甲醇合成工艺及其催化剂
甲醇合成原理方法与工艺
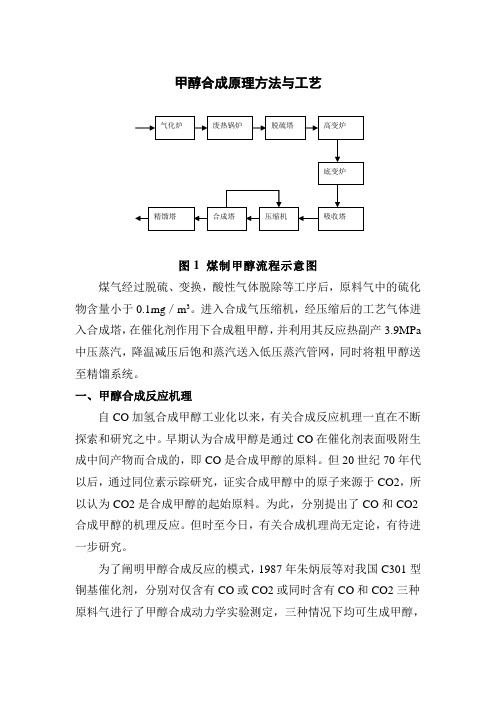
甲醇合成原理方法与工艺图1 煤制甲醇流程示意图煤气经过脱硫、变换,酸性气体脱除等工序后,原料气中的硫化物含量小于0.1mg/m3。
进入合成气压缩机,经压缩后的工艺气体进入合成塔,在催化剂作用下合成粗甲醇,并利用其反应热副产3.9MPa 中压蒸汽,降温减压后饱和蒸汽送入低压蒸汽管网,同时将粗甲醇送至精馏系统。
一、甲醇合成反应机理自CO加氢合成甲醇工业化以来,有关合成反应机理一直在不断探索和研究之中。
早期认为合成甲醇是通过CO在催化剂表面吸附生成中间产物而合成的,即CO是合成甲醇的原料。
但20世纪70年代以后,通过同位素示踪研究,证实合成甲醇中的原子来源于CO2,所以认为CO2是合成甲醇的起始原料。
为此,分别提出了CO和CO2合成甲醇的机理反应。
但时至今日,有关合成机理尚无定论,有待进一步研究。
为了阐明甲醇合成反应的模式,1987年朱炳辰等对我国C301型铜基催化剂,分别对仅含有CO或CO2或同时含有CO和CO2三种原料气进行了甲醇合成动力学实验测定,三种情况下均可生成甲醇,试验说明:在一定条件下,CO和CO2均可在铜基催化剂表面加氢生成甲醇。
因此基于化学吸附的CO连续加氢而生成甲醇的反应机理被人们普遍接受。
对甲醇合成而言,无论是锌铬催化剂还是铜基催化剂,其多相(非匀相)催化过程均按下列过程进行:①扩散——气体自气相扩散到气体一催化剂界面;②吸附——各种气体组分在催化剂活性表面上进行化学吸附;③表面吸附——化学吸附的气体,按照不同的动力学假说进行反应形成产物;④解析——反应产物的脱附;⑤扩散——反应产物自气体一催化剂界面扩散到气相中去。
甲醇合成反应的速率,是上述五个过程中的每一个过程进行速率的总和,但全过程的速率取决于最慢步骤的完成速率。
研究证实,过程①与⑤进行得非常迅速,过程②与④的进行速率较快,而过程③分子在催化剂活性界面的反应速率最慢,因此,整个反应过程的速率取决于表面反应的进行速率。
提高压力、升高温度均可使甲醇合成反应速率加快,但从热力学角度分析,由于CO、C02和H2合成甲醇的反应是强放热的体积缩小反应,提高压力、降低温度有利于化学平衡向生成甲醇的方向移动,同时也有利于抑制副反应的进行。
甲醇合成催化剂生产工艺

甲醇合成催化剂生产工艺甲醇合成催化剂分两期进行生产,甲醇合成催化剂每批生产周期(从物料加入到得到产品)为24小时,每批产品为500kg,一期年生产批数为2000批,总计为1000吨。
一期甲醇合成催化剂以电解铜、电解锌、碱式碳酸铜、碱式碳酸锌、碳酸氢钠、硝酸、氧化铝、石墨为原料,经备料、反应、过滤、烘干、焙烧、成型得到产品。
(1)备料①化铜先将电解铜和水加入5m3化铜罐中,再加入95%硝酸,化铜罐内设有冷却水盘管,用冷却水控制反应温度为60~70℃,铜和硝酸反应生成硝酸铜。
该工序涉及反应方程式如下:3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+4H2O②化锌先将电解锌和水加入5m3化锌罐中,再加入95%硝酸,化锌罐内设有冷却水盘管,用冷却水控制反应温度为60~70℃,锌和硝酸反应生成硝酸锌。
该工序涉及反应方程式如下:3Zn + 8HNO3 = 3Zn(NO3)2 + 2NO↑+4H2O将上述制备好的硝酸铜和硝酸锌溶液打入15m3混合液罐中进行混合,混合均匀后打入计量罐用作反应工序原料。
备料过程会有含氮氧化物废气产生,送二级低温水+二级尿素水溶液吸收系统处理。
(2)反应先向12m3反应罐加入一定量水,再夹套内通入蒸汽升温至60~65℃,开启搅拌器,然后加入碳酸氢钠。
保持罐内温度为60℃~65℃,将制备的硝酸铜、硝酸锌混合液经过计量后匀速加入反应罐中,硝酸铜、硝酸锌与碳酸氢钠发生反应生成碱式碳酸铜、碱式碳酸锌沉淀,碱式碳酸铜、碱式碳酸锌为难溶性物质,溶解度均小于0.01g/100g 水。
该工序涉及反应方程式如下:2Cu(NO3)2 + 4NaHCO3 = Cu2(OH)2CO3↓+4NaNO3 + H2O + 3CO2↑2Zn(NO3)2 + 4NaHCO3 = Zn2(OH)2CO3↓+4NaNO3 + H2O + 3CO2↑反应结束后,将称量好的碱式碳酸铜、碱式碳酸锌、氧化铝依次放入反应罐中,继续搅拌20~30分钟,然后静止沉降得到反应浆液。
甲醇合成的工艺流程

甲醇合成的工艺流程:水煤浆经新型气化炉加压气化制取的水煤气,经净化处理制得总硫含量小于0.1 ppm,氢碳比(H2-CO2)/(CO+CO2) =2.05~2.15的合格合成气。
经透平压缩机压缩段5级叶轮加压后,在缸内与甲醇分离器来的循环气(40℃,4.6Mpa)按一定比例混合,经过循环段1级叶轮加压至5.20Mpa后,送入缓冲槽中,获得压力为5.15MPa,温度约为60℃的入塔气。
入塔气以每小时528903Nm3的流量进入入塔预热器的壳程,被来自合成塔反应后的出塔热气体加热到225℃后,进入合成塔顶部。
合成塔为立式绝热管壳型反应器。
管内装有NC306型低压合成甲醇催化剂。
当合成气进入催化剂床层后,在5.10MPa,220~260℃下CO、CO2与H2反应生成甲醇和水,同时还有微量的其它有机杂质生成。
合成甲醇的两个反应都是强放热反应,反应释放出的热大部分由合成塔壳侧的沸腾水带走。
通过控制汽包压力来控制催化剂层温度及合成塔出口温度。
从合成塔出来的热反应气体进入入塔预热器的管程与入塔合成气逆流换热,被冷却到90℃左右,此时有一部分甲醇被冷凝成液体。
该气液混合物再经水冷器进一步冷凝,冷却到≤40℃,再进入甲醇分离器分离出粗甲醇。
分离出粗甲醇后的气体,压力约为4.60MPa,温度约为40℃,返回循环段,经加压后循环使用系统。
为了防止合成系统中惰性的积累,要连续从系统中排放少量的循环气体:一部分直接排放至精馏工段,另一部分经水洗塔洗涤甲醇后作为弛放气体送往燃气发电管网,整个合成系统的压力由弛放气排放调节阀来控制。
分离出的粗甲醇和水洗塔塔底排出粗甲醇液体,减压至0.4MPa后,进入甲醇膨胀槽,以除去溶解在粗甲醇中大部分气体,然后直接送往甲醇工段或粗甲醇贮槽。
汽包与甲醇合成塔壳侧由二根下水管和六根汽液上升管连接形成一自然循环锅炉,付产4.0MPa中压蒸汽减压至1.3MPa后送入蒸汽管网。
汽包用的锅炉给水来自锅炉给水总管,温度为104℃,压力为5.0MPa。
甲醇工艺流程介绍

甲醇工艺流程介绍甲醇是一种重要的有机化工产品,广泛应用于化工、医药、农药、塑料、合成纤维等领域。
甲醇的生产工艺主要有四种,包括合成气法、天然气重整法、甲烷水蒸气重整法和木质素液化法。
本文将详细介绍甲醇的生产工艺流程。
一、合成气法合成气法是最常用的甲醇生产工艺,其主要原料是天然气或煤炭。
该工艺流程包括气化、合成气净化、气体转化、甲醇合成和甲醇精制等环节。
首先,将天然气或煤炭进行气化,生成合成气。
气化反应需要高温高压环境下进行,主要反应为C+H2O=CO+H2、气化产物中含有一定量的一氧化碳和氢气。
接下来,对合成气进行净化。
合成气中的杂质如硫化物、氨、氯化物等需要被去除,以保证后续反应的顺利进行。
净化工艺主要包括酸性气体的吸收、氢气和一氧化碳的选择性吸附等。
然后,将净化后的合成气进行转化。
转化主要是通过催化剂的作用,将一氧化碳和二氧化碳转化为甲醇。
转化反应的主要反应为CO+2H2=CH3OH。
该反应需要适宜的温度和压力条件,并且需要选择合适的催化剂。
最后,将合成气中生成的甲醇进行精制。
精制工艺主要包括蒸馏、吸附和冷凝等过程,以去除甲醇中的杂质,得到高纯度的甲醇产品。
二、天然气重整法天然气重整法是一种以天然气为原料生产甲醇的工艺。
该工艺流程包括重整、甲醇合成和甲醇精制等环节。
首先,将天然气进行重整反应,生成合成气。
重整反应主要是将天然气中的甲烷和水蒸气在催化剂的作用下进行反应,生成氢气和一氧化碳。
重整反应的主要反应为CH4+H2O=CO+3H2接下来,将重整反应生成的合成气进行甲醇合成。
甲醇合成反应的条件和催化剂与合成气法相似。
最后,对甲醇进行精制,得到高纯度的甲醇产品。
三、甲烷水蒸气重整法甲烷水蒸气重整法是一种以天然气为原料生产甲醇的工艺。
该工艺流程包括甲烷水蒸气重整、甲醇合成和甲醇精制等环节。
首先,将甲烷进行水蒸气重整反应,生成合成气。
重整反应的主要反应为CH4+H2O=CO+3H2接下来,将重整反应生成的合成气进行甲醇合成。
合成甲醇铜基催化剂及制备工艺研究进展

2015年8月第23卷第8期 工业催化INDUSTRIALCATALYSIS Aug.2015Vol.23 No.8综述与展望收稿日期:2015-01-27;修回日期:2015-03-27作者简介:程金燮,1989年生,男,四川省成都市人,硕士研究生,研究方向为工业催化。
通讯联系人:程金燮。
合成甲醇铜基催化剂及制备工艺研究进展程金燮 ,胡志彪,王 科,凌华招,邹 鑫,徐晓峰,李 倩,黄 宏(西南化工研究设计院有限公司国家碳一化学工程技术研究中心,四川成都610225)摘 要:合成甲醇大型化装置主要使用铜基催化剂,并且铜基催化剂类型、助催化剂和制备工艺等对甲醇收率影响较大。
合成甲醇铜基催化剂主要分为Cu-Zn、Cu-Zn-Cr、Cu-Zn-Al、Cu-Zr以及其他类,Cu-Zn-Al催化剂性能优异,是当代甲醇生产技术主要采用的催化剂。
碱金属、碱土金属、过渡金属、稀土金属和非金属元素对合成甲醇催化剂的活性、选择性和稳定性表现出不同作用。
沉淀法、溶胶-凝胶法、燃烧法、机械混合法和骨架合成法等是制备铜基催化剂的有效方法,工业上制备合成甲醇催化剂主要采用沉淀法。
针对合成甲醇大型化装置催化剂的开发,提升催化剂的选择性与稳定性是下一步的研究重点。
关键词:催化剂工程;铜基催化剂;甲醇;助催化剂doi:10.3969/j.issn.1008 1143.2015.08.002中图分类号:TQ426.6;O643.36 文献标识码:A 文章编号:1008 1143(2015)08 0585 10ResearchprogressinCu basedcatalystsformethanolsynthesisandtheirpreparationtechnologyChengJinxie,HuZhibiao,WangKe,LingHuazhao,ZouXin,XuXiaofeng,LiQian,HuangHong(NationalEngineeringResearchCenterforC1Chemistry,SouthwestResearch&DesignInstituteCo.,Ltd.ofChemicalIndustry,Chengdu610225,Sichuan,China)Abstract:Cu basedcatalystswerecommonlyusedinlarge scalemethanolsynthesisdevice,andthecat alysttypes,promotersandpreparationprocesshavesignificantinfluenceontheyieldofmethanol.Cu basedcatalystformethanolsynthesiscouldbemainlydividedintoCu Zn,Cu Zn Cr,Cu Zn Al,Cu Zrandsoon.Cu Zn Alcatalystspossessedexcellentperformance,andwereusedforthemaincatalystincontemporarymethanolproductiontechnology.Alkalimetal,alkalineearthmetal,transitionmetal,rareearthmetalandnonmetalelementsshoweddifferenteffectsontheactivity,selectivityandstabilityofthecatalystsformethanolsynthesis.TheeffectivepreparationmethodsofCu basedcatalystswereprecipitationmethod,sol gelmethod,combustionmethod,mechanicalmixingmethodandskeletonsynthesismethod,andprecipitationmethodwasmainlyusedforthepreparationofmethanolsynthesiscatalystinindustry.Asforthedevelopmentofthecatalystsforlarge scalemethanolsynthesisdevice,theimprovementofselectivityandstabilityofthecatalystswerethenextresearchkey.Keywords:catalystengineering;Cu basedcatalyst;methanol;additivedoi:10.3969/j.issn.1008 1143.2015.08.002CLCnumber:TQ426.6;O643.36 Documentcode:A ArticleID:1008 1143(2015)08 0585 10Copyright ©博看网. All Rights Reserved. 586 工业催化 2015年第8期 在世界能源快速消耗的情况下,C1化学发挥的作用日益重要[1],甲醇作为C1化学的基石倍受关注。
甲醇的合成

甲醇的合成甲醇的合成目录:1. 介绍甲醇2. 甲醇的合成方法3. 重要的反应路径4. 常见的合成催化剂5. 甲醇合成的条件和工艺6. 甲醇合成的应用和前景7. 结论1. 介绍甲醇甲醇,也被称为木精或甲醇酒精,是一种无色、具有特殊气味的化学物质。
它是一种普遍使用的化工原料和溶剂,并且在能源领域也有广泛的应用。
甲醇的化学式为CH3OH,是由一个碳原子、三个氢原子和一个羟基组成。
它是最简单的醇类化合物,也是一个重要的有机合成原料。
2. 甲醇的合成方法甲醇可以通过多种方法合成,其中最常用的方法是通过一氧化碳和氢气的反应,即加氢合成方法。
具体的反应方程式为:CO + 2H2 -> CH3OH甲醇合成还可以通过其他反应途径,如甲烷水合物的解离、天然气重整和生物质气化等。
3. 重要的反应路径甲醇的合成反应是一个复杂的过程,涉及多个反应路径。
在加氢合成法中,主要的反应路径包括气相和液相反应。
在气相反应中,一氧化碳首先与氢气进行反应生成甲醛,然后再通过一系列连续的加氢反应步骤转化为甲醇。
在液相反应中,催化剂通常会被溶解在金属盐中,一氧化碳和氢气在此种环境中发生反应生成甲醛和甲醇。
4. 常见的合成催化剂甲醇的合成需要使用催化剂来促进反应的进行。
常见的甲醇合成催化剂包括铜基催化剂、铁基催化剂和锌基催化剂等。
铜基催化剂是最常用的甲醇合成催化剂,它通常与锌和铝等辅助金属一起使用,以提高催化活性和选择性。
5. 甲醇合成的条件和工艺甲醇合成的条件和工艺对于实现高效、高选择性的合成过程至关重要。
一般来说,甲醇合成需要较高的压力(通常在几十到数百个大气压之间)和适当的温度(通常在180-280°C之间)。
反应过程中还需要适量的催化剂和反应物的比例,以及合适的反应时间。
6. 甲醇合成的应用和前景甲醇是一种重要的化工原料和燃料,具有广泛的应用前景。
它可以作为溶剂、反应试剂和合成化学品的原料,并可用于气体和液体燃料的制备。
催化剂甲醇合成

催化剂甲醇合成催化剂甲醇合成是一种重要的工业生产技术,可以用来合成甲醇,还可以制造其他有机化合物。
本文将介绍甲醇合成的催化剂及其原理、工业生产过程和新技术发展趋势。
一、催化剂及其原理甲醇合成的催化剂主要分为金属氧化物催化剂和配合物催化剂两类。
1、金属氧化物催化剂常见的金属氧化物催化剂有氧化铜、氧化铬、氧化钴等。
这些催化剂的原理是,催化剂中的金属离子可以与一氧化碳和氢气发生反应,生成一种中间体(如甲酸、甲酸甲酯等),然后再经过一系列反应,生成甲醇。
2、配合物催化剂配合物催化剂包括贵金属催化剂和非贵金属催化剂。
其中,铑和铱是最常见的贵金属催化剂,非贵金属催化剂主要包括钼、铌、钒等。
这些催化剂的原理是,经过氢气活化后,催化剂能够与一氧化碳和二氧化碳反应,生成甲酸,然后再生成甲醇。
此外,配合物催化剂还可以用于一些特殊反应,比如催化碳氢键的切割。
二、工业生产过程甲醇的工业生产过程主要有两种方法:一是合成气法,即将氢气和一氧化碳反应生成甲醇;二是天然气法,即从天然气中提取甲烷,然后通过一系列化学反应生成甲醇。
合成气法合成气法是目前最常用的甲醇生产方法。
生产过程主要包括合成气的制备、催化剂的选择和反应的控制。
1、合成气制备合成气制备方法包括煤气、重油和天然气重整、重油催化裂解和煤气化等。
其中,天然气煤气化是最常用的方法。
通过高温高压反应,将天然气转化成含有一氧化碳和氢气的合成气。
2、催化剂选择甲醇合成的催化剂主要是氧化物和配合物催化剂。
目前工业生产中,氧化铜和氧化锌是最常用的催化剂,伴有一些助剂。
3、反应控制甲醇合成的反应控制十分关键。
在反应过程中,必须控制反应温度、压力和催化剂用量等参数,才能获得高质量的甲醇。
天然气法天然气法是一种新兴的甲醇生产方法。
与合成气法相比,天然气法具有取之不尽、用之不竭的优势,并且生产过程更加环保。
1、天然气的处理天然气中的甲烷需要经过催化裂解,生成含有一氧化碳和氢气的合成气。
2、合成气的制备和处理生产过程与合成气法一致。
关于甲醇合成过程中催化剂的研究

司也随后研制了同类催化剂,其代表产品为CuO/ZnO/Al 2O 3。
在催化合成过程中操作压力为5~10MPa ;温度为200~300℃。
比最初甲醇合成工艺所需的压力和温度要低很多,属于低温低压操作条件的范畴。
这类催化剂的特点是:耐热性能较差、活性较高、选择性也高;但对杂质较为敏感;而这种低压法生产设备的体积大,从而占地面积大、投资也较大。
1.2.3 贵金属负载类催化剂贵金属负载类催化剂是由MgO 、SiO 2、ZrO 2等氧化物作为载体,将某些贵金属负载,通常贵金属选择Pd 、Pt 、Au 等。
其代表产品为PtCr/Si SiO 2、PtW/SiO 2等,这类催化剂的优点主要在于对甲醇的选择性很高,有的催化剂即使在合成过程中其他杂质较多情况下仍然可以保持高选择性以及高转化率。
2 反应条件对甲醇合成催化剂的影响在反应过程中催化剂催化效果的好坏不仅和自身的性质、结构有关,而且反应条件也对催化剂有很大的影响作用。
适宜的反应条件会让催化剂的活性达到最佳状态。
所以在甲醇合成过程中,研究不同反应条件对于催化剂活性的影响很有必要。
2.1 压力对催化剂的影响甲醇合成反应为:CO+2H 2=CH 3OH,该反应的正方向是分子数减少,根据化学平衡相关知识可以知道,当压力增大时反应会向生成反应物方向移动,即有利于甲醇产品的合成。
,所以,当压力增大时,甲醇转化率会随着压力的增加而升高。
除此以外,催化剂上反应物的吸附以及生成物的脱附也和压力有关。
实验研究表明,当压力增加10%,甲醇的转化率亦增加10%。
但并非压力一直增加转化率会一直随之增加,和其他对压力有要求的反应一样,压力增加虽然会提高产物转化率,但有一个限值。
对于甲醇生产来讲,当压力超过8MPa ,甲醇转化率反而呈开始下降趋势。
2.2 温度对催化剂的影响温度作为化学反应过程中至关重要的反应条件之一,对于化学反应速率、反应方向都有着很重要的影响作用。
对于使用催化剂的化学反应中,温度更是不能忽视的因素之一。
