高考化学复习高中总复习:专题2第1讲氧化还原反应的基本概念和规律
高一氧化还原反应知识点归纳

氧化还原反应知识点归纳氧化还原反应中的概念与规律:一、五对概念在氧化还原反应中,有五对既相对立又相联系的概念。
它们的名称和相互关系是:二、五条规律1、表现性质规律同种元素具有多种价态时,一般处于最高价态时只具有氧化性、处于最低价态时只具有还原性、处于中间可变价时既具有氧化性又具有还原性。
2、性质强弱规律3、反应先后规律在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中最强的还原剂作用;同理,在浓度相差不大的溶液中,同时含有几种氧化剂时,若加入还原剂,则它首先与溶液中最强的氧化剂作用。
例如,向含有FeBr2溶液中通入Cl2,首先被氧化的是Fe2+4、价态归中规律含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。
5、电子守恒规律在任何氧化-还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
三.物质氧化性或还原性强弱的比较:(1)由元素的金属性或非金属性比较<1>金属阳离子的氧化性随其单质还原性的增强而减弱非金属阴离子的还原性随其单质的氧化性增强而减弱(2)由反应条件的难易比较不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强.如:前者比后者容易发生反应,可判断氧化性:。
同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
(3)根据被氧化或被还原的程度不同进行比较当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。
如,根据铁被氧化程度的不同 ,可判断氧化性: .同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。
(4)根据反应方程式进行比较氧化剂+还原剂=还原产物+氧化产物氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物(5)根据元素周期律进行比较一般地,氧化性:上>下,右>左;还原性:下〉上,左>右。
2015届高考化学大一轮复习课件:专题2 第1讲氧化还原反应的基本概念和规律(苏教版)

知识梳理
I
考点二 电子转移数目的分析方法
关键是明确反应中元素的化合价变化,找出氧化剂或还 原剂的物质的量,以及 1 mol 氧化剂得电子的物质的量 或者 1 mol 还原剂失电子的物质的量。例如:
2 mol 1 mol 3 mol 2 mol
1.有关电子转移数目的计算
知识梳理
2.氧化还原反应中电子转移的表示方法 (1)单线桥法 表示氧化剂与还原剂之间电子转移的方向和总数。
N -3
CuH Si3N4
Cu +1 Si +4
Fe +(8-n)
N -3
知识梳理
I
考点三 氧化性、还原性强弱规律
(1)氧化性是指 得电子 的性质(或能力);还原性是指
1.氧化性、还原性的判断
失电子 的性质(或能力)。
(2)氧化性、还原性的强弱取决于得、失电子的 难易 程 度,与得、失电子数目的 多少 无关。如:Na-e-=== Na+,Al-3e-===Al3+,但根据金属活动性顺序表,Na 比 Al 活泼, 更易失去电子, 所以 Na 比 Al 的还原性强。
由(3)中的化学方程式可知,当生成 4 mol H2O 时,转移 6 mol 电子,所以当转移 0.3 mol 电子时,生成 0.2 mol H2O,质量为 3.6 g。
递进题组
题组一 1
题组二
2
3
答案
(1)H2S
(2)NO
(4)3.6 g
递进题组
题组一 1
题组二
2
3
题组二 复杂氧化还原反应中电子转移数目的分析 2.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4
题组训练
1 2
解析 首先分析四种元素价态的变化:Na 的价态反 应前后都是+1 价,B 反应前后都是+3 价,O 反应 前后都是-2 价,变价元素只有 H,NaBH4 中-1 价 氢被 H2O 中+1 价氢氧化,发生归中反应生成 H2。
高考化学专题复习之氧化还原反应知识点总结
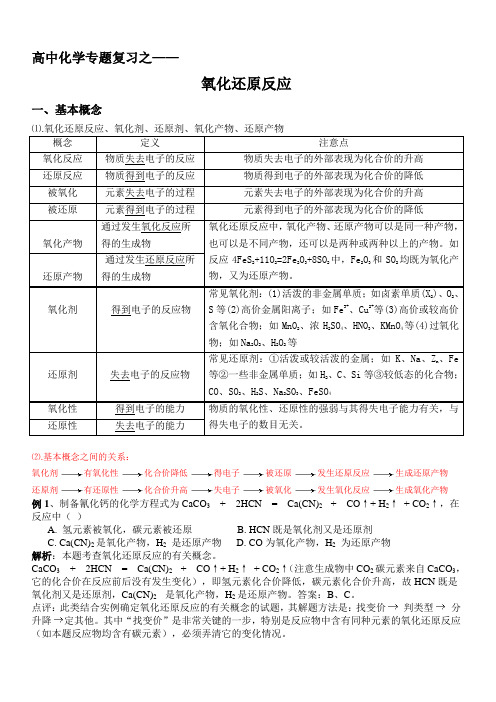
高中化学专题复习之——氧化还原反应一、基本概念⑴.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物通过发生还原反应所得的生成物氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Zn、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力⑵.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物例1、制备氰化钙的化学方程式为CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑,在反应中()A. 氢元素被氧化,碳元素被还原B. HCN既是氧化剂又是还原剂C. Ca(CN)2是氧化产物,H2是还原产物D. CO为氧化产物,H2为还原产物解析:本题考查氧化还原反应的有关概念。
CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑(注意生成物中CO2碳元素来自CaCO3,它的化合价在反应前后没有发生变化),即氢元素化合价降低,碳元素化合价升高,故HCN既是氧化剂又是还原剂,Ca(CN)2 是氧化产物,H2是还原产物。
高考化学氧化还原反应知识

高考化学氧化还原反应知识高考化学氧化还原反应知识氧化还原反应是化学反应中最基本的类型之一,包括氧化、还原、氧化还原反应等。
在高考化学中,氧化还原反应是非常重要的知识点,它涉及到了很多基础理论和实际应用,具有非常重要的指导意义。
下面我们就来详细了解一下高考化学氧化还原反应知识。
一、氧化还原反应的基本概念及分类氧化还原反应是一种电子转移反应。
它是指在化学反应中,一个物种失去或得到电子,从而产生正电荷和负电荷的化学变化。
在氧化还原反应中,氧化是指物质失去电子,还原是指物质得到电子。
根据反应的特征,氧化还原反应可分为以下几类:(1)加氧反应:物质与氧气反应,物质的氧化状态增加。
(2)脱氧反应:物质与还原剂反应,物质的氧化状态减少。
(3)还原反应:还原剂与氧化剂反应,还原剂被氧化剂氧化,自身被还原。
(4)氧化反应:氧化剂与还原剂反应,氧化剂被还原剂还原,自身被氧化。
二、氧化还原反应的基本原理氧化还原反应基本原理是电子转移,即电子从一个物质转移到另一个物质。
在氧化还原反应中,还原剂能够给予电子,而氧化剂能够接受电子,反映了物质电子的转移过程。
这个转移过程实际上反映了反应过程中能量和物质的转化。
氧化还原反应中,一般情况下,氧化剂能够得到电子,从而将自身还原,而还原剂失去电子,从而将自身氧化。
这种电子转移过程,可以通过配位化学、红外光谱等方式进一步证实。
三、氧化还原反应的应用氧化还原反应在实际应用中具有广泛的应用。
在生产过程中,氧化还原反应被广泛用于物质的合成、催化、分离、提纯等方面。
例如,氧化剂可以用于合成某些酸、碱、氧化物等物质,还原剂可以用于某些金属的提纯。
在生活中,氧化还原反应也经常用于除臭、净水、消毒等方面。
例如,用氯等氧化剂消毒、汲取井水可以用还原剂使铁水离子还原等等。
在高考中,氧化还原反应作为非常重要的一个知识点,涉及到了许多方面的知识,例如反应平衡、化学动力学和热力学等方面,需要我们掌握相应的知识点,才能从容应对考试。
氧化还原规律知识点总结

氧化还原规律知识点总结一、氧化还原反应的基本概念1. 氧化还原反应的定义氧化还原反应是指在化学变化过程中,物质中原子的氧化态发生改变的化学反应。
通常情况下,沦为氧化剂的物质被氧化为更高的氧化态,而还原剂则被还原为更低的氧化态。
氧化还原反应是一种电子转移过程。
2. 氧化还原反应的特征氧化还原反应有许多的特征,其中最主要的包括:(1)原子的氧化态发生改变;(2)伴随着电子的转移;(3)发生氧化还原反应的物质中,必须至少含有一个氧化剂和一个还原剂。
二、氧化还原反应的判定1. 氧化还原反应的氧化数法氧化数法也称氧化态法或氧化数法,是化学中常用的一种方法,凭借着氧化数的变化来判断化学物质在氧化还原反应中的角色。
2. 氧化还原反应的电子转移法氧化还原反应涉及到电子的转移,因此可以通过电子转移的方式来判断氧化还原反应的发生。
三、氧化还原反应的动力学1. 氧化还原反应的速率氧化还原反应的速率与其反应物的浓度、温度和催化剂等因素有关。
通常情况下,高温、高浓度和催化剂都能够提高氧化还原反应的速率。
2. 氧化还原反应的平衡氧化还原反应在一定条件下也会达到平衡状态。
在平衡状态下,氧化剂和还原剂的浓度不再发生变化,反应速率也趋于稳定。
四、氧化还原反应的应用1. 电化学氧化还原反应是电化学中的重要反应类型,电池、电解等都是基于氧化还原反应进行的。
2. 工业生产在工业生产中,氧化还原反应也是一种重要的反应类型,例如金属冶炼、有机合成等过程中都涉及到氧化还原反应。
3. 生活应用在生活中,氧化还原反应也有诸多应用,比如燃烧、腐蚀和食品加工等都是基于氧化还原反应进行的。
总之,氧化还原反应是化学中一种重要的反应类型,其规律性和应用广泛。
深入理解氧化还原反应的规律对于学习化学和应用化学都具有重要意义。
高三化学复习优质课件1:氧化还原反应的基本概念和规律

H2、C等
想一想 一个氧化还原反应的反应物一定是氧化
剂或还原剂吗?
不一定!!
一个氧化还原反应的生成物一定是氧化 产物或还原产物吗?
不一定!!
三、特殊的氧化还原反应
1.部分氧化还原反应
——在氧化还原反应中,如果还原剂只有部 分被氧化、或者氧化剂只有部分被还原,这就是 部分氧化还原反应 。
例1、MnO2+4HCl(浓)===MnCl2+Cl2 ↑+2H2O 问: (1).氧化剂与还原剂的物质的量之比:__1_:__2_ (2).若有4×36.5gHCl参加反应,则做还原剂的HCl_7_3_ g, 被氧 化的HCl_7_3__g,生成标况下的Cl2 2_2_._4_L (3)反应中HCl表现_还__原__性__、__酸__性__性.
得到2e-化合价降低,被还原,还原反应
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得到6e-化合价降低,被还原,还原反应
+3
+2
0
+4
Fe2O3 + 3CO == 2Fe + 3CO2
失去6e-化合价升高,被氧化,氧化反应
氧化剂 + 还原剂 = 还原产物 + 氧化产物
二、氧化还原反应的基本概念的相互关系
夯实基础
氧 一、几组概念
化
还
原
反
应 二、氧化还原反应的基本概念的相互关系
的
基
本
概 念
三、特殊的氧化还原反应
一、基本概念
氧化剂 ——反应物中得到电子(或电子对偏
1.
向)的物质
还原剂 ——反应物中失去电子(或电子对偏 离)的物质
高考化学复习:氧化还原反应的基本概念和规律

(3)依据产物中元素价态的高低来判断 ①相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧 化性强。例如:
②相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原 性强。例如:
返回
3.先后规律
在浓度相差不大的溶液中: (1)同时含有几种还原剂时――加―入―氧―化―剂―→ 将按照还原性由强到弱的顺序依
返回
解析:在反应4Li+2SOCl2===4LiCl+S+SO2↑中,只有Li元素的化合价 升高,Li作还原剂,SOCl2中一部分S元素的化合价降低,SOCl2作氧化剂, A项正确,B项错误;Li元素的化合价升高,被氧化,LiCl是氧化产物,S元 素的化合价降低,被还原,单质S是还原产物,C项错误;因题目中未说明 二氧化硫是否处于标准状况,所以无法计算转移电子的数目,D项错误。
返回
【正误辨析】 (1)有单质参加或有单质生成的化学反应一定是氧化还原反应( × ) (2)金属阳离子一定只具有氧化性( × ) (3)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原( × ) (4)氧化还原反应中的反应物,不是氧化剂就是还原剂( × ) (5)氧化还原反应一定属于四种基本反应类型( × )
返回
6.硼氢化钠(NaBH4)中的氢元素为-1价,具有很强的还原性,被称为“万 能还原剂”,NaBH4在催化剂钌(Ru)表面与水反应的历程如图所示:
下列说法错误的是 A.过程②反应为BH3+H2O===H2↑+H2B(OH)
√B.反应过程中硼元素的化合价发生了变化
C.若过程③和过程④均产生1 mol H2,则转移电子数目不相等 D.Ru可使上述反应活化分子的百分数提高,加快反应速率
还原剂+氧化剂===氧化失去ne-产物+还原得到ne-产物 用双线桥法标出铜和浓硝酸反应电子转移的方向和数目:
2024高考化学专题复习—氧化还原反应的概念和规律(新高考)

2024高考化学专题复习—氧化还原反应的概念和规律(新高考)[复习目标] 1.了解氧化还原反应的概念。
2.会用“单、双线桥”分析电子转移的方向和数目。
3.掌握氧化性、还原性强弱的比较及价态规律的应用。
考点一氧化还原反应及相关概念1.氧化还原反应(1)判断依据:反应前后有元素的化合价发生变化。
(2)本质:电子转移(得失或偏移)。
2.相关概念概括为“升失氧、降得还,剂性一致、其他相反”。
(1)氧化性是指得电子的性质(或能力);还原性是指失电子的性质(或能力)。
(2)氧化性、还原性的强弱取决于得、失电子的难易程度,与得、失电子数目的多少无关。
如:Na-e-===Na+,Al-3e-===Al3+,但根据金属活动性顺序可知,Na比Al活泼,更易失去电子,所以Na的还原性比Al强。
应用举例2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
上述反应中,氧化剂是______,还原剂是________,氧化产物是__________,还原产物是________,KMnO4发生__________反应,HCl发生________反应,盐酸表现的性质是________性和________性;生成1mol Cl2时转移电子数目为________,被氧化的HCl的物质的量是________mol。
答案KMnO4HCl Cl2MnCl2还原氧化还原酸2×6.02×1023(或1.204×1024)23.氧化还原反应电子转移的表示方法(1)双线桥法:①标变价,②画箭头(反应物指向生成物),③算数目,④说变化。
用双线桥法标出MnO2与浓盐酸加热反应的电子转移的方向和数目:+2H2O。
归纳。
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”“失”字样。
用单线桥法标出铜和浓硝酸反应的电子转移的方向和数目:+2NO2↑+2H2O。
归纳。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1讲 氧化还原反应的基本概念和规律[考纲要求] 1.了解氧化还原反应的本质是电子转移。
2.了解常见的氧化还原反应。
考点一 用分类思想理解氧化还原反应1.根据反应中有无________转移或元素____________是否发生变化,可以把化学反应划分为____________反应和____________反应。
判断氧化还原反应的最佳判据是______________________。
2.四种基本反应类型和氧化还原反应的关系可用下图表示:1. 下列反应属于氧化还原反应的是____________,属于化合反应的是______________,属于分解反应的是____________________________________________________________, 属于置换反应的是____________,属于复分解反应的是______________。
A .Cu 2S +O 2===2Cu +SO 2 B .3O 2===2O 3C .Fe 2O 3+3CO=====△2Fe +3CO 2 D .2Na +2H 2O===2NaOH +H 2↑E .CaCO 3=====△CaO +CO 2↑ F .2H 2O 2===2H 2O +O 2↑ G .SO 3+H 2O===H 2SO 4H .2Fe +3Cl 2=====△2FeCl 3 I .H 2SO 4+2NaOH===Na 2SO 4+2H 2O考点二 结合实例理解氧化还原反应的相关概念实例:在Fe 2O 3+3CO=====高温2Fe +3CO 2的反应中________是氧化剂,________是还原剂;________元素被氧化,________元素被还原;Fe 2O 3具有氧化性,CO 具有还原性;________是氧化产物,________是还原产物。
1.相关概念还原剂在反应中表现为所含元素的化合价________,实质上____电子。
还原剂具有________,反应时本身被_____________________________________________________, 发生________反应,得到________产物。
氧化剂在反应中表现为所含元素的化合价__________,实质上______电子。
氧化剂具有________性,反应时本身被________,发生________反应,得到________产物。
2.常见氧化剂和还原剂 (1)常见氧化剂①某些活泼的非金属单质:如Cl 2,一般被还原为________。
②元素处于高价态的物质:如浓硫酸,一般被还原为________。
③过氧化物:如H 2O 2,一般被还原为________。
(2)常见还原剂①活泼的金属单质:如Zn ,一般被氧化为________。
②某些活泼的非金属单质:如H 2,一般被氧化为________。
③元素处于低价态的物质:如CO ,一般被氧化为________。
(3)具有中间价态的物质既有氧化性,又有还原性。
还原产物 中间价态 氧化产物____ Fe 2+―→____ SO 2-3―→ ______ ______ H 2O 2―→ ,,2.下列氧化还原反应中,水作为氧化剂的是( )A.CO +H 2O=====高温CO 2+H 2 B .3NO 2+H 2O===2HNO 3+NO C .2Na 2O 2+2H 2O===4NaOH +O 2↑ D .2F 2+2H 2O===4HF +O 23.被称为万能还原剂的NaBH 4溶于水并和水反应:NaBH 4+2H 2O===NaBO 2+4H 2↑,下列说法中正确的是(NaBH 4中H 为-1价)( )A .NaBH 4既不是氧化剂又不是还原剂B .NaBH 4是氧化剂,H 2O 是还原剂C .硼元素被氧化,氢元素被还原D .被氧化的元素与被还原的元素质量之比为1∶1 4.下列推断合理的是( )A .Fe 3+、O 2、H 2O 2三种微粒只具有氧化性,没有还原性 B .木炭与浓硝酸反应可能生成CO 和NH 4NO 3C .因为SO 2具有还原性,所以不能用浓H 2SO 4干燥SO 2D .Cl 2转变为HClO 时一定需要加入氧化剂才能实现5.ClO 2是一种杀菌消毒效率高、二次污染小的水处理剂。
实验室中可通过以下反应制得:2KClO 3+H 2C 2O 4+H 2SO 4=====△2ClO 2↑+K 2SO 4+2CO 2↑+2H 2O 。
下列说法不正确的是( )A .CO 2是氧化产物B .H 2C 2O 4在反应中被氧化C .H 2C 2O 4的氧化性强于ClO 2的氧化性D .ClO 2作水处理剂时,利用了其强氧化性灵活应用氧化还原反应的相关概念(1)在复习氧化还原反应的有关概念时,要紧紧抓住“反应前后元素化合价起变化”这一特征,沿着“化合价升高——失去电子——还原剂——氧化反应——氧化产物(或化合价降低——得到电子——氧化剂——还原反应——还原产物)”这一线索进行分析。
(2)不能正确标出反应前后元素的化合价变化,是解此类题常出错的原因。
(3)统一规律:氧化反应和还原反应在同一反应中同时发生,有化合价升高的元素,必有化合价降低的元素。
(4)在氧化还原反应中可能有的物质既是氧化剂又是还原剂,也有的物质既不是氧化剂也不是还原剂。
考点三 电子转移表示法及氧化还原反应类型下列标明电子转移的方向和数目的化学方程式中正确的是________;其中属于歧化反应的是________,属于归中反应的是________,属于部分氧化还原反应的是__________。
常考的氧化性、还原性强弱的判断 方法1.根据化学方程式判断氧化剂(氧化性)+还原剂(还原性)===还原产物+氧化产物; 氧化性:氧化剂>氧化产物; 还原性:还原剂>还原产物。
2.根据反应条件和反应剧烈程度进行判断(1)与同一物质反应,一般越易进行,则其氧化性或还原性就越强。
如Na 与冷水剧烈反应,Mg 与热水反应,Al 与水加热反应也不明显,所以还原性:Na>Mg>Al ;非金属单质F 2、Cl 2、Br 2、I 2与H 2反应,F 2与H 2暗处剧烈反应并爆炸,Cl 2与H 2光照剧烈反应并爆炸,Br 2与H 2加热到500 ℃才能发生反应,I 2与H 2在不断加热的条件下才缓慢发生反应,且为可逆反应,故氧化性:F 2>Cl 2>Br 2>I 2。
(2)当不同的氧化剂作用于同一还原剂时,如果氧化产物价态相同,可根据反应条件的高低进行判断:一般条件越低,氧化剂的氧化性越强;同种还原剂作用于不同氧化剂时,反应越剧烈,其还原性越强。
如:2Fe +3Cl 2=====点燃2FeCl 3,Fe +S=====△FeS ,氧化性:Cl 2>S ;MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O,2KMnO 4+16HCl(浓)===2KCl +2MnCl 2+5Cl 2↑+8H 2O ,由上述反应条件的不同,可判断氧化性:KMnO 4>MnO 2。
3.其他因素(1)浓度:同一种物质浓度越大,氧化性(或还原性)越强。
如氧化性:浓H 2SO 4>稀H 2SO 4,浓HNO 3>稀HNO 3,还原性:浓HCl>稀HCl 。
(2)温度:同一种物质,温度越高其氧化性越强。
如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
(3)酸碱性:同一种物质,所处环境酸(碱)性越强其氧化性(还原性)越强。
如KMnO 4溶液的氧化性随溶液酸性的增强而增强。
【例1】 下列说法正确的是( )A .强氧化剂与强还原剂不一定能发生氧化还原反应B .含最高价元素的化合物一定只表现强氧化性C .阳离子只有氧化性,阴离子只有还原性D .发生化学反应时,失电子越多的金属原子,还原能力越强 【例2】 已知常温下在溶液中可发生如下两个离子反应 Ce 4++Fe 2+===Fe 3++Ce 3+Sn 2++2Fe 3+===2Fe 2++Sn 4+由此可以确定Fe 2+、Ce 3+、Sn 2+三种离子的还原性由强到弱的顺序是 ( )A .Sn 2+、Fe 2+、Ce 3+B .Sn 2+、Ce 3+、Fe 2+C .Ce 3+、Fe 2+、Sn2+D .Fe 2+、Sn 2+、Ce 3+【例3】 已知Co 2O 3在酸性溶液中易被还原成Co 2+,Co 2O 3、Cl 2、FeCl 3、I 2的氧化性依次减弱。
下列反应在水溶液中不可能发生的是( )A.3Cl2+6FeI2===2FeCl3+4FeI3B.Cl2+FeI2===FeCl2+I2C.Co2O3+6HCl===2CoCl2+Cl2↑+3H2OD.2Fe3++2I-===2Fe2++I2【例4】(1)100 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,生成的氯气的物质的量小于0.3 mol,为什么?(2)将一Cu片投入稀H2SO4溶液中,没观察到反应现象,然后向其中加入少量的KNO3晶体,看到溶液由无色逐渐变蓝并有少量气泡产生,为什么?反思感悟(1)判断氧化性或还原性的强弱,依据的是得失电子的难易程度,而不是得失电子数目的多少。
(2)元素的高价态氧化性不一定比低价态强,如HClO的氧化性大于HClO4,另外最高价态的物质也不一定都表现氧化性,如H3PO4。
(3)强弱规律及应用氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。
应用:①在适宜条件下,用氧化性强的物质制备还原性弱的物质;用还原性强的物质制备氧化性弱的物质;②比较物质间氧化性(或还原性)的强弱或判断氧化剂和还原剂在一定条件下是否发生反应。
关于氧化还原反应的三条规律模型1.反应先后规律的思维模型同一氧化剂与含多种还原剂(物质的量浓度相同)的溶液反应时,首先被氧化的是还原性最强的物质;同一还原剂与含多种氧化剂(物质的量浓度相同)的溶液反应时,首先被还原的是氧化性最强的物质。
2.价态归中规律思维模型含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价―→中间价”,而不会出现交叉现象。
例如,不同价态硫之间可以发生的氧化还原反应是如反应KClO 3+6HCl===KCl +3Cl 2↑+3H 2O 中,转移的电子数为5,而非6。
3.歧化反应规律思维模型 “中间价→高价+低价”。
具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl 2+2NaOH===NaCl +NaClO +H 2O 。
