避孕药具使用不良反应事件报告表
避孕药具宣传简报

避孕药具宣传简报避孕药具不良反应/不良事件监测报告分析摘要目的:了解避孕药具的不良反应/不良事件。
方法:收集计划生育服务站避孕药具不良反应监测试点的避孕药具不良反应/不良事件报告,并进行统计分析。
结果:全区避孕药具不良反应/不良事件监测报告1036例,均为可疑器械(宫内节育器)不良事件报告。
可疑医疗器械不良事件分列前5位的主要表现为:位置与形态改变(宫内节育器下移)、月经问题(月经间期出血/点滴出血、月经过多、闭经)、非意愿妊娠(带器妊娠、不带器妊娠)、腰腹疼痛和宫内节育器完全脱落。
按照所使用的宫内节育器的不同其不良事件前5位分别为:1活性金属环型165IUD。
2元宫铜300宫内节育器。
3母体乐375宫内节育器。
4芙蓉宫内节育器。
5TCu380A宫内节育器。
5种宫内节育器发生不良事件的时间比较差异有显著性。
结论:避孕药具中,以使用宫内节育器发生不良事件为绝大多数,在使用宫内节育器前,对育龄妇女进行完善的健康宣教,置器后对其进行定期随访,发现异常情况及时处理,都是有效避免宫内节育器不良事件发生的重要措施。
关键词避孕药具宫内节育器不良反应/不良事件应对措施随着经济的发展,人们的生育观有了较大改变,避孕药具在育龄妇女的应用越来越多。
本研究通过对10000例婚后育龄妇女使用避孕药具情况进行调查了解,对避孕药具不良反应/不良事件进行监测,总结其不良反应/不良事件发生情况,现报告如下。
资料与方法2008年9月~2011年12月随访使用避孕药具的产后育龄妇女10000例,年龄22~50岁,平均36.75±8.17岁,其中22~29岁2692例(26.92%),30~39岁4545例(45.45%),≥40岁1763例(17.63%)。
使用宫内节育器7521例,安全套避孕1804例,药物避孕675例。
随访的所有妇女均无严重疾病。
对于上述女性由于避孕药具的使用而发生的不良反应/不良事件进行统计和分析。
结果有1036例妇女出现不良反应/不良事件,均为使用宫内节育器。
避孕药具不良反应监测

医疗器械不良事件监测是指对医疗器械不良事件的发现、报
告、评价和控制的过程。
2019/11/12
国家人口计生委计划生育药具不良反应监测中心
1
国外药品不良反应监测进展
历史上曾发生过无数例因药品引起器官功能损害、致残致死事件: 1950年 女婴的外生殖器男性化畸形(600多例)与母亲孕期服 用孕激素有关; 1961年 “反应停” (沙利度安)-海豹儿(1万多例); 1966年 己烯雌酚-阴道腺癌(8例)等。
人工心脏瓣膜,512例死亡,300例伤害事件 心脏起搏器,89例死亡,186例伤害事件 宫内节育器,10例死亡,8000例伤害事件 欧美、日本、澳大利亚和新西兰都将宫内节育器作为第Ⅲ类医 疗器械(植入人体,必须监测)列入全国性国家人口计生委计划生育药具不良反应监测中心
在美国Alexandria Virginia(10个国家)
2019/11/12
国家人口计生委计划生育药具不良反应监测中心
4
黄卡系统在避孕药监测中的作用
在1968—1984年间,英国的药品安全委员会(CSM)为了 评价甾体类口服避孕药(OC)与抗惊厥药或抗生素之间的 交互作用时,运用了“黄卡系统”:结果发现 监测对象中有43例妇女使用OC同时服用抗癫痫药而怀孕 63例妇女使用OC同时服用抗生素的妇女而怀孕 提出抗癫痫药或抗生素与OC同时使用将影响避孕效果
我国曾报告2例在埋植左炔诺孕酮硅胶棒埋植剂后发生颅内压增
高。
埋植左炔诺孕酮硅胶棒后26小时突然持续性剧烈头痛,视物 不清,呕吐,颈抵抗(+),眼底检查双侧乳头水肿,临床诊断 为特发性颅内压增高。
常用避孕药具的不良反应及处理

常用避孕药具的不良反应及处理随着我国人口不断增加,计划生育越来越重要了,避孕是计划生育中的主要内容。
现将常用避孕药具的不良反应及处理列举如下:1口服避孕药口服避孕药的不良反应是指在正常用量和用法时,出现与避孕目的无关的反应1.1类早孕反应少数妇女在服药初期,有轻度的恶心、食欲不振、头晕、乏力、嗜睡、呕吐等类早孕反应,多数由雌激素引起。
常在开始服药后1~2周期发生,继续服药以后即可自行改善。
1.1.1症状轻者,无需处理,随着服药时间延长,可自行缓解。
1.1.2症状较重者,可加服维生素B610㎎,每日3次,共3~5日。
1.1.3经上述处理效果不明显者,可于每次服药时加服抗副反应片,每日1片,共3日。
1.2点滴或突破性出血出血常见的原因为漏服、不定时服药、服药方法错误或药品质量受埙;个别妇女体内激素平衡受到避孕药的影响,不能维持子宫内膜的完整性而导致出血。
出血发生在月经周期的前半周期,提示雌激素剂量不足,加服炔雌醇1~2片,与避孕药同时服到该服药周期结束。
出血发生在月经周期的后半周期,表示孕激素剂量不够,加服孕激素或短效避孕药1片,直到该服药周期结束。
如果连续2个周期发生异常出血,出血时间较固定,可于每次出血前2日开始,每日加服炔雌醇1片,直到该服药周期结束,预防出血。
出血时间不固定,每天加服炔雌醇1片连服22日。
一般连续加服3个周期后停药,如恢复正常剂量又有出血者,则以后均需每天加服炔雌醇1片。
1.3月经量减少或停经一般停服避孕药后能自行恢复正常。
月经过少或闭经,是因子宫内膜受抑制所致。
月经量减少一般不处理。
如月经量过少,可每天加服炔雌醇1片连服22日,与避孕药同时服到该服药周期结束。
停药后7日内月经未来潮为停经,应先排除早孕,然后在次日晚开始服下1周期避孕药。
如果连续2个周期发生停经,排除妊娠,停药观察,通常由于雌激素不足,内膜萎缩所致。
大多数停药后内膜可以自然恢复,而且月经复潮。
闭经3个月以上,应停药排除妊娠,等月经恢复;如在停药后1个月仍未行经,可肌注黄体酮20㎎,每日1次,连续3日,一般停药后1周内月经来潮。
启东市2017-2018年避孕药具不良反应监测结果

岁;其EMS 的病程为2~10年,平均病程为(6.06±2.14)年。
GST 组患者的年龄为24~39岁,平均年龄为(31.86±6.14)岁;其EMS 的病程为3~9年,平均病程为(6.09±2.11)年。
两组患者的基线资料相比,P >0.05。
1.2 方法用孕三烯酮胶囊对GST 组患者进行治疗。
孕三烯酮胶囊(由北京紫竹药业有限公司生产)的用法是:口服,每次服2.5 mg,每周服2次,共用药3个月。
用孕三烯酮胶囊(用法同上)联合米非司酮片对GAM 组患者进行治疗。
米非司酮片(由上海新华联制药有限公司生产)的用法是:口服,每次服12.5 mg,每天服1次,共用药3个月。
1.3 疗效判定标准与观察指标显效:经治疗,患者的月经周期异常、痛经、性交痛、慢性盆腔痛等症状基本消失,其美国生殖医学协会子宫内膜异位症分期(R-AFS 分期,共分4期,分期越高表示患者的病情越严重)为Ⅰ期。
有效:经治疗,患者的月经周期异常、痛经、性交痛、慢性盆腔痛等症状明显减轻,其R-AFS 分期为Ⅱ期。
无效:经治疗,患者的月经周期异常、痛经、性交痛、慢性盆腔痛等症状未减轻,其R-AFS 分期为Ⅲ期或Ⅳ期。
总有效率=(显效例数+有效例数)/总例数×100%。
比较两组患者的临床疗效及治疗前后其血清雌二醇(E 2)和促卵泡生成激素(FSH)的水平。
治疗后,对两组患者进行12个月的随访,比较其受孕的情况。
1.4 统计学方法用SPSS 26.0软件处理本研究中的数据,计数资料用%表示,用χ²检验,计量资料用均数±标准差(s ±)表示,用t 检验,P <0.05表示差异有统计学意义。
2 结果2.1 两组患者的临床疗效GAM 组患者治疗的总有效率高于GST 组患者,P <0.05。
详见表1。
表1 两组患者的临床疗效组别例数显效[n (%)]有效[n(%)]无效[n (%)]总有效率[%(n )]GAM 组4920(40.82)27(55.1)2(4.08)95.92(47)GST 组4910(20.41)26(53.06)13(26.53)73.47(36)χ²值9.5245P 值0.00202.2 治疗后两组患者血清E 2及FSH 的水平治疗后,GAM 组患者血清E 2和FSH 的水平均低于GST 组患者,P <0.05。
药品不良反应登记表格模板

关联性评价
报告人:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
省级药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
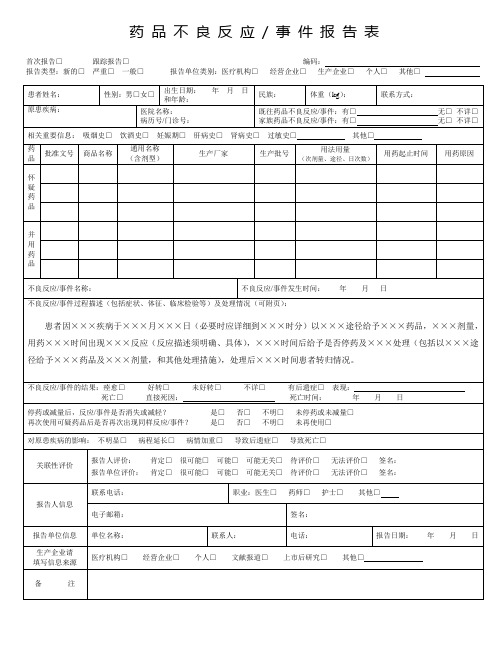
药品不良反应/事件报告表
新的□严重□一般□医疗卫生机构□生产企业□经营企业□个人□编码
单位名称:部门:电话:报告日期:年月日
患者姓名:
性别:
男□女□
出生日期:
年月日
民族:
体重(㎏)
联系方式:
家庭药品不良反应/事件:有□无□不详□
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名称:
不良反应/事件发生时间:
国家药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告人职业(医疗机构):医生□药师□护士□报告人职务职称(企业):报告人签名:
病历号/门诊号
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
商品名称
通用名称(含剂型,监用药起
止时间
用药原因
怀疑
药品
并用
药品
不良反应/事件的结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日
原患疾病:
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现:
药品不良反应事件报告表及填写说明
药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□《药品不良反应/事件报告表》填写说明1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□严重□一般□(1)新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。
新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。
有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。
如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
11. 家族药品不良反应/事件及既往药品不良反应/事件情况:请选择正确选项。
如果选择“有”,则在报告的空白处清晰叙述。
药品不良反应事件报告表

药品不良反应 / 事件报告表
患者姓名性别:男
□女□
出生日期:年月
日
或年龄
民族联系方式:
体重
(kg)
病历号/门
诊号
家族药品不良反
应/事件:有□无□不详□既往药品不良反应/事件情况:有□无□ 不详□
既往病史:(如高血压、糖尿病、肝肾疾病等)相关重要情况:怀孕□ 吸烟□ 饮酒□ 药物滥用□ 放射治疗□ 其他□
不良反应/事件名称:不良反应/事件发生时间:年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):不良反应/事件的结果:治愈□ 好转□ 未好转□ 不详□ 有后遗症□ 表现:
死亡□ 直接死因:死亡时间:年月日
1.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
2.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
商品名称通用名称(含剂型,监
测期内品种用*注明)
生产
厂家
批号
用法用
量
用药起止时间
用药原
因
怀疑药品
关联性评价报告人:肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能无关□待评价□无法
除非得到允许,报告表中的个人信息将予以保密。
计划生育药具管理报表说明

2、避孕药具发放、随访登记表(村级) 附表二
(2)随访情况一栏村级发放员发放药具时对上次药具使 用情况进行询问,如有不良反应和不适症状的要填写清楚, 使用正常填写“使用正常”。领药人签名一定要本人签名。 如果此人不再使用药具应在备注栏内注明原因。首次使用 不记录随访情况。 A、短效口服避孕药(如:21+7)随访用语: 未见异常; 漏服(准事件); 漏服后出血(不良反应事件); 经间期点滴出血(副反应); 类早孕反应等(副反应)。
7、_____年度全国计划生育药具需求计划 表
b、年标准使用量与人份(参考要素之二) 年标准使用量:是根据育龄妇女的月经周期及各类药具的 用法和用量来确定,各大类药具新规定中年标准使用量如 下: 长效针 13(支)/人.年 短效药 13(板)/人.年 速效药 2(板)/人.年 外用药 100(张、粒、支)/人.年 (最多不超过120张、粒) 避孕套 100(只)/人.年 (最多不超过120只)
7、_____年度全国计划生育药具需求计划 表
乡级应于7月底前将编制好的下一年度药具需求计划上报 到县级药具管理部门。 按照《计划生育药具业务管理规范》编制年度药具需求计 划。 编制年度需求计划要考虑:品种结构、库存适宜、保障供 应、杜绝浪费、满足需求等因素综合考虑,做好需求分析。 按照自下而上,上下结合的原则编制。 需求计划表按要求填写规范,按规定时间上报(每年7月5 日前上报县、区)。一式两份,一份存档。
1、《避孕药具使用情况报表》(市、县、 乡、村级)附表一
(3)凡是放置的宫内节育器和皮下埋植剂是由县(区)或乡 (镇)计划生育服务机构免费提供的,都应统计在内。 (4) “序号”为使用单位序号。 (5) “使用单位”包括所辖下级单位和本单位零星发 放的 部分。 (6) “长期”系指连续使用该药具避孕时间超过12个月者, 为时点数;“临时”系指在一个统计年度内使用该药具避 孕时间不超过11个月者,为时期数。 城市供应方式改革可统计为长期使用人数,计算方式为品 种的标签使用量除标准人份量,不得有小数。宣传或零星 发放的全归入临时用药人数内,人数统计按发放量除以3 计算。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
避孕药具使用不良反应/事件报告表
新的□严重□一般□
单位名称:部门:电话:报告日期:年月日
◇不良反应/事件分析
1.用药与不良反应/事件的出现有无合理的时间关系?有□无□
2.反应是否符合该药已知的不良反应类型?是□否□不明□
3.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
4.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
5.反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否□
不明□
◇严重药品不良反应/事件是指有下列情形之一者:
①引起死亡□
②致畸、致癌或出生缺陷□
③对生命有危险并能够导致人体永久的或显著的伤残□
④对器官功能产生永久损伤□
⑤导致住院或住院时间延长□。
