氟啶虫酰胺的合成
氟啶虫酰胺的合成

氟啶虫酰胺的合成1.氟啶虫酰胺简介氟啶虫酰胺的通用名称为flonicamid或flunicotamid,CAS号:158062-67-0,化学名称为N-氰甲基-4-(三氟甲基)烟酰胺,英文名称:N-(cyanomethyl)-4-(trifluoromethyl)nicotinamide,化学结构式:本品外观为白色无味固体粉末,熔点:157.5℃,蒸汽压(20℃):9.43×10-7p a,溶解度(g/L,20℃):水5.2,丙酮157,甲醇89,该品热稳定性较好。
氟啶虫酰胺是日本石原产业开发的吡啶酰胺类杀虫剂。
2000年,Morita M等人在布赖顿会议上首次报道了石原产业株式会社发现的吡啶酰胺类杀虫剂氟啶虫酰胺,石原产业与美国富美实公司、韩国韩农株式会社、比利时Belchim作物保护公司、印度联合磷化公司签署合作协议,共同开发全球市场,该产品主要有日本石原产业和印度联合磷化公司生产。
氟啶虫酰胺通过阻碍害虫吮吸作用而发挥效果,害虫摄入药剂后很快停止吮吸,最后饥饿而死。
氟啶虫酰胺主要用于非农作物、棉花、水果和蔬菜,对各种刺吸式口器害虫有效,具有良好的内吸和渗透作用,可从根部向茎部、叶部渗透。
2003年,氟啶虫酰胺首次在美国取得登记,用于温室观赏植物。
2005年,氟啶虫酰胺在法国登记,用于马铃薯、小麦、苹果、梨树、桃树,商品名为Teppeki;同年,其在英国和荷兰登记,用于马铃薯和小麦,商品名为Teppeki。
2005年,氟啶虫酰胺在美国登记,用于棉花,商品名为Carbine;同年,在美国登记,用于果树、蔬菜、商品名为Turbine;2005年在美国上市,用于温室观赏植物和苗圃,商品名为Aria。
2005年,氟啶虫酰胺在韩国取得登记,用于防治苹果、辣椒蚜虫,商品名为Setis,2006年开始在韩国销售。
2005年,氟啶虫酰胺在巴西和哥伦比亚登记并上市,用于防治棉花蚜虫,商品名为Turbine。
15%联苯菊酯·氟啶虫酰胺可分散油悬浮剂的配方研制

h—4*a象泠农药研究5°/。
联苯菊酯•氟啶虫酰胺可分散油悬浮剂的配方研制欄I李登辉,赵强,聂运魏,耿彪(河南瀚斯作物保护有限公司)联苯菊酯是70-80年代迅速发展起来的新型 拟除虫菊类农用杀虫剂品种之一,具有击倒作用 强、广谱、高效、快速、长残效等特点,以触杀 和胃毒作用为主,无内吸作用。
可用于防治棉铃 虫、红铃虫、茶尺蠖、茶毛虫、苹果或山楂红蜘蛛、桃小食心虫、菜蚜、菜青虫、菜小蛾、柑橘潜叶蛾等。
氟啶虫酰胺是一种低毒吡啶酰胺类昆虫生长 调节剂类杀虫剂,2007年获得中国农药产品临时 登记证,制剂为10%水分散粒剂,氟啶虫酰胺具 有触杀和胃毒作用,还具有很好的神经毒剂和快 速拒食作用,对蚜虫等刺吸式口器害虫有效,并 具有良好的渗透作用。
农药活性成分在油相中悬浮的液体制剂称为 可分散油悬浮剂,通常以植物油、甲酯化植物油 或矿物油为分散介质,用水稀释后使用。
其具有 绿色环保、安全高效、使用方便等特点,此外以 油为分散介质,提高了制剂的渗透性、延展性、耐雨水冲刷性能,可分散油悬浮剂制备通常采用 湿法研磨工艺,平均粒径在3〜5微米左右,本 文通过大量的试验成功研制了 15%联苯菊酯•氟 啶虫酰胺可分散油悬浮剂。
1材料与方法1. 1原药与助剂联苯菊酯原药97% (广东立威)氟啶虫酰胺原药98% (中农立华)乳化剂:蓖麻油聚氧乙烯醚(BY-125),十二 烷基苯磺酸钙苯盐(500#)苯乙基苯酚聚氧乙烯醚(601,602#),烷基^,^2021.3酚聚氧乙烯醚(NP-10),烷基芳基聚氧丙烯聚氧 乙烯醚(33#),酚醚磷酸酯,吐温80;分散剂:500LQ (阿克苏),V0-01 (索尔维)增稠剂:白炭黑、有机膨润土分散介质:大豆油、甲酯油、玉米油1.2主要设备砂磨机、剪切机、恒温箱、磁力搅拌器、电热恒温水浴锅、冰箱、气相色谱仪、高效液相色 谱仪、p H计、电子称量天平等。
1. 3试验方法采用湿法研磨工艺:准确称取所需助剂及分 散介质,用磁力搅拌器搅拌均匀,再称取所需原药, 用剪切机剪切均匀,将剪切均匀的浆料转入立式 砂磨机中加入1.5倍浆料质量的氧化锆珠(直径 0.8-1. 2毫米),研磨时间约2-3小时,砂磨机转 速1400r/min,砂磨完成后,取样进行粒径、分散、乳化等指标的检测,合格后过滤进行灌装,工艺 流程图如图1:图1可分散油悬浮剂加工工艺2助剂筛选农药研究-h 十* a彖泠2.1分散介质筛选 米油,根据原药的性质、理化指标及性价比要求,可分散油悬浮剂对分散介质的要求是被悬浮 我们采用甲酯油+大豆油为分散介质,具体筛选的有效成分至少在50摄氏度以下是不溶的,在试 结果如表1:验过程中所用的分散介质为大豆油、甲酯油、玉表1分散介质的筛选编号分散介质用量分散性流动性悬浮率结论1大豆油68差差91.5不合格2甲酯油68良良94.7不合格3甲酯油+大豆油48+20优优98.3合格4甲酯油+玉米油48+20良优97.0不合格试验结果表明,在15%联苯菊酯•氟啶虫酰 胺油悬浮剂配方中,分散介质采用甲酯油48%+大 豆油20%混合,有较好的分散性及流动性,并且 悬浮率也优于其他对照组。
氟啶虫酰胺 原药 标准

令人难忘的细节高二作文3篇令人难忘的细节高二作文3篇在平日的学习、工作和生活里,大家都接触过作文吧,借助作文人们可以实现文化交流的目的。
那么,怎么去写作文呢?以下是小编精心整理的令人难忘的细节高二作文,供大家参考借鉴,希望可以帮助到有需要的朋友。
令人难忘的细节高二作文1淡忘了,记忆里的深刻;模糊了,画面里的清晰;消散了,泥土里的芬芳。
夏雨的汹涌冲刷这红泥土的山头,响彻的惊雷震动着,闪烁着。
噢!那是一个晴天!时间呀,时间,竟如此不留情,往日的深情在时间里如此惨淡,年轮的旋转帅去了哪些至为重要的记忆。
那个夏天,那是个晴空,那是个新生的早晨,鸟语花香,袅袅炊烟,乡间的清晨如此的祥和,天空的行云来去匆匆,乡村的天气千变万化。
一切还是原来的样子,一切没有变化,记忆里的细节如此的深刻。
爷爷起床了,伴随着咳嗽声与浓浓的旱烟味,起床了。
爷爷依旧烧起了炉火,依旧坐在火炉旁静静的烧着茶水,烤着馒头。
火焰的声音,水沸的声音,干柴噼啪之声叫醒了那时还在酣睡的我。
在一切完毕后,我跨上了书包,步行在崎岖的上学之路上,夏天的早晨确实很温暖,阳光若隐若现,此刻乡村的天气开始变化了。
脚下的步子越走越快,渐渐的学校已近在眼前。
一切确实来得很突然,校园里的几棵柏树的叶子已开始奏乐,屋檐下的乐师也毫不逊色。
雨,突如其来,雨,倾盆而下,雨,滂沱也不见停止,校园外干涸的小溪此时也在沸腾。
眼见正午已到,雨愈下愈大,没有停止的意思。
早晨出门并未准备好相关器具,正午的回家只能是落汤鸡了,泥泞的路面很不好走,再加上大多修在山沟边沿,危险性就更高了。
那个深深的记忆在那时便永久的深埋在我的心里,那个难忘的细节在那时被定格。
雨还在下着,正午的放学铃声响了,比起晴天的`铃声,此时更让人厌恶。
烟雨蒙蒙,那个熟悉的声音透过雨幕钻进了我的耳里。
那个每日清晨叫我起床的咳嗽的声音。
在烟雨里,那个熟悉的黑色背影,那把比我年龄还大的黑色帆布伞,沮丧的心暂时得以平复,爷爷来来了,来接我了。
一种氟啶虫酰胺及其中间体4-三氟甲基烟酸的制备方法

一种氟啶虫酰胺及其中间体4-三氟甲基烟酸的制备
方法
氟啶虫酰胺是一种杀虫剂,其制备方法可以通过以下步骤实现:
1. 制备4-三氟甲基烟酸:将氯甲酸与三氟化氮反应,生成氟氯甲酰胺,然后再通过氯化亚铜氧化,得到4-三氟甲基烟酸。
2. 制备氟啶虫酰胺中间体:将4-三氟甲基烟酸与二甲基甲硅烷反应,生成4-三氟甲基烟酰亚胺。
3. 制备氟啶虫酰胺:将4-三氟甲基烟酰亚胺与胺类化合物(如丁胺、己胺等)反应,通过缩合反应,生成氟啶虫酰胺。
以上是一种常见的氟啶虫酰胺及其中间体4-三氟甲基烟酸的制备方法。
当然,制备过程中可能存在某些细节,需要在实验室进行具体的操作。
同时,注意在制备过程中遵守相关安全操作规定,避免对环境和人身造成伤害。
氟啶虫酰胺的新工艺

氟啶虫酰胺的新工艺
氟啶虫酰胺是一种重要的农药原料,其新工艺主要包括以下几个步骤:
1. 氧化反应:将氟啶通过氧化反应转化为氟啶酮。
2. 羧化反应:将氟啶酮通过羧化反应转化为氟啶酰氯。
3. 氨解反应:将氟啶酰氯与氨气在催化剂的作用下发生氨解反应,生成氟啶虫酰胺。
在新工艺中,可以采用高效催化剂和环保溶剂,减少原料消耗和废弃物产生,提高生产效率和产品质量,同时减少对环境的影响,实现绿色制造。
这些新工艺的发展将有助于促进氟啶虫酰胺的生产和应用,并为农业生产提供更加安全和高效的农药原料。
氟啶虫酰胺组成结构、作用功能详解

氟啶虫酰胺(flonicamid) 是由日本石原产业株式会社发现的吡啶酰胺(或烟酰胺) 类杀虫剂,它可以有效防治广泛作物上的刺吸式口器害虫,对蚜虫尤其高效。
其作用机理新颖,与目前市售其他杀虫剂无交互抗性,对蜜蜂低毒。
多家公司参与开发,其中包括美国富美实、韩国东部韩农株作用机理氟啶虫酰胺作用机理新颖,对蚜虫等刺吸式口器害虫具有快速拒食活性和很好的神经毒性。
氟啶虫酰胺通过抑制蚜虫口针穿透植物组织来抑制取食。
刺吸式口器害虫取食带有氟啶虫酰胺的植物汁液后,30 min内迅速停止取食,1 h内完全没有排泄物出现,且这种拒食作用具有不可恢复性,被阻止吸汁的害虫最终因饥饿而死亡。
似乎氟啶虫酰胺的杀虫作用类似于吡蚜酮,但两者的作用机理还是存在差异。
研究人员认为,氟啶虫酰胺具有新颖的作用机理。
国际杀虫剂抗性行动委员会(IRAC)因此将氟啶虫酰胺划分为:9C类,选择性同翅目拒食剂。
目前,氟啶虫酰胺是该组产品中的唯一成员。
靶标害虫氟啶虫酰胺为高效、选择性杀虫剂,具有较好的内吸性,渗透作用强,持效期长,可用于果树、谷物、马铃薯、水稻、棉花、蔬菜、豆类、瓜类、茄子、茶树、核果、向日葵、番茄和温室观赏植物等,防治刺吸式口器害虫,如棉蚜、马铃薯蚜、粉虱、车前圆尾蚜、假眼小绿叶蝉、桃蚜、褐飞虱、小黄蓟马、麦长管蚜、蓟马和温室粉虱等,其中对蚜虫防效优异。
叶面喷雾的有效成分用量为50~100g/hm2。
氟啶虫酰胺对螨、双翅目、鞘翅目和鳞翅目害虫没有活性。
氟啶虫酰胺在推荐剂量下使用,对作物、人畜和环境安全。
其对有益节肢动物如家蚕、意大利蜜蜂、异色瓢虫、智利小植绥螨等无不良影响。
与有机磷类、氨基甲酸酯类和拟除虫菊酯类杀虫剂无交互抗性,可用于对这些杀虫剂及新烟碱类杀虫剂产生抗性的害虫防治。
氟啶虫酰胺杰出的作用机理和对益虫的安全性使其成为抗性治理以及有害生物综合防治体系(IPM)的重要产品。
毒性哺乳动物毒性雄大鼠急性经口LD50为884 mg/kg,雌大鼠为1 768 mg/kg。
新型杀虫剂氟啶虫胺腈的合成研究

有 机 氟 工 业
・
6・
Ogn —Fu r eIds y rao lo n ut i n r
2 1 第 3期 0 2年
1 实验 部 分
1 1 仪 器与试 剂 .
在装 有温度计 和搅 拌器 回流冷 凝器 的 四 口反应
瓶 中加入 1 . ( . o)1一四氢 吡咯 一3一甲硫 7 1g 0 1t 1 o
oo e y)一3一pr i 1 e y ]一h rm t 1 h yi n ] t 1 dy h 4一sl nl ee u ayi n ] f d
一
在查 阅文献 _ 的基 础 上 设 计 了 如 下合 成 工 艺 , 2 并 对其 合 成工艺 进行 了详 细研究 。
O O
八 。
1 6 甲基 [ . 1一( 2一三 氟 甲基吡 啶 一 5一基 ) 乙基 一 N一氰基 硫亚胺 的合成 在装 有温 度计 和搅 拌器 的干 燥 2 0mL三 口反 5 应 瓶 中加 入 2 . ( . o) 2 1g 0 1t 1 3_[ o 1一( 甲硫 基 ) 乙 基 ] 6 三氟 甲基 ) 啶 , .4 g 0 1 o) 单腈 一 ( 吡 5 0 ( .2 t 1 的 o
基 丁烯 一1和 5 L乙腈 , 却 至 0c 0m 冷 C以下 , 加 滴
1 . ( .1m 1 , , 8 5g o 1 o)1 1 1一三 氟 甲基 一 2一氧 代 一 4
一
三氟 乙酸 酐 , 工业 品 , 江 永创 化 工 有 限公 司 ; 浙 乙烯基 乙醚 , 业 品 , 河 口荆 烘 化 工 有 限 责 任 公 工 老 司; 巴豆醛 , 学纯 , 化 国药 集 团化 学试 剂有 限公 司 ; 单
关键词 : 氟啶虫胺腈 ; 杀虫剂 ; 成 合
有关氟啶虫酰胺原药产品情况介绍
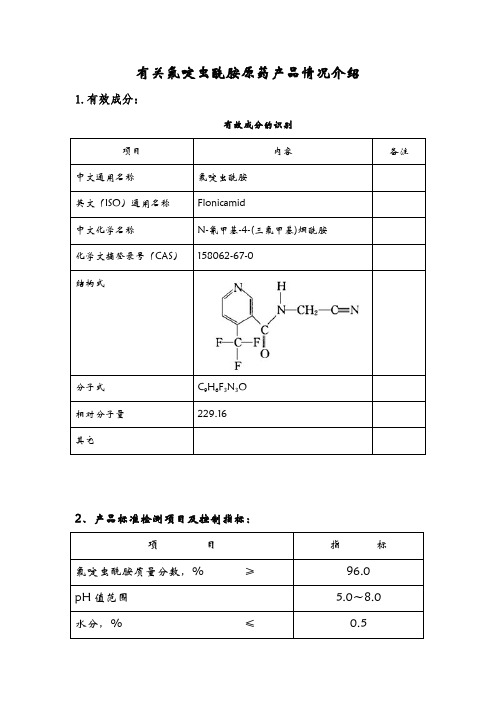
有关氟啶虫酰胺原药产品情况介绍1.有效成分:有效成分的识别项目内容备注中文通用名称 氟啶虫酰胺 英文(ISO)通用名称 Flonicamid中文化学名称N-氰甲基-4-(三氟甲基)烟酰胺 化学文摘登录号(CAS) 158062-67-0结构式分子式 C 9H 6F 3N 3O 相对分子量 229.16 其它2、产品标准检测项目及控制指标:项 目指 标 氟啶虫酰胺质量分数,% ≥ 96.0 pH 值范围5.0~8.0 水分,% ≤0.5丙酮不溶物质量分数,%≤ 0.5 a正常生产时,丙酮不溶物每3个月至少测定1次。
3.生产工艺摘要:生产工艺摘要原材料名称 CAS号纯度 供应商 备注乙基乙烯醚 109-92-299%三氟乙酸酐 407-25-099%吡啶 110-86-1 99% 氨水 1336-21-6 28% 甲氧基丙烯酸甲酯 5788-17-099%甲醇钠 124-41-4 99% 甲醇 67-56-1 99% 氯化亚砜 7719-9-7 99% DMF 1968-12-2 99% 三乙胺 121-44-8 99% 氨基乙腈硫酸盐 5466-22-899%四氢呋喃 109-99-999%甲苯108-88-399%主反应方程式(包括主产物和副产物)反应过程简述以乙基乙烯醚为起始原料,三氟乙酸酐酰基化,经氨解,酸性条件下缩合,合环,水解得到4-三氟甲基烟酸;以4-三氟甲基烟酸为起始原料,经氯化与氨基乙腈硫酸盐反应得到氟啶虫酰胺产品。
工艺控制点1、酰基化反应要低温加入乙基乙烯醚,温度在0℃以下;2、用氨水代替氯气,氨水配比4-5,收率高10%个点左右;3、缩合温度控制在回流温度,反应24小时效果最佳;4、酰氯与氨基乙腈硫酸盐反应体系要加入一定质量的水,效果较好。
工艺流程图其他4.毒理学资料摘要:急性毒理学试验数据项目 毒性结果 毒性级别雄:>2000mg/kg;雌:>2000mg/kg 低毒 大鼠急性经口 LD50雄:>2000mg/kg;雌:>2000mg/kg 低毒 大鼠急性经皮 LD50大鼠急性吸入 LC0雄:>2000mg/m3;雌:>2000mg/m3低毒5兔皮肤刺激 无刺激性兔眼睛刺激 轻度刺激性豚鼠皮肤致敏 弱致敏物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氟啶虫酰胺的合成
1.氟啶虫酰胺简介
氟啶虫酰胺的通用名称为flonicamid或flunicotamid,CAS号:158062-67-0,化学名称为N-氰甲基-4-(三氟甲基)烟酰胺,英文名称:N-(cyanomethyl)-4-(trifluoromethyl)nicotinamide,化学结构式:
本品外观为白色无味固体粉末,熔点:157.5℃,蒸汽压(20℃):9.43×10-7p a,溶解度(g/L,20℃):水5.2,丙酮157,甲醇89,该品热稳定性较好。
氟啶虫酰胺是日本石原产业开发的吡啶酰胺类杀虫剂。
2000年,Morita M等人在布赖顿会议上首次报道了石原产业株式会社发现的吡啶酰胺类杀虫剂氟啶虫酰胺,石原产业与美国富美实公司、韩国韩农株式会社、比利时Belchim作物保护公司、印度联合磷化公司签署合作协议,共同开发全球市场,该产品主要有日本石原产业和印度联合磷化公司生产。
氟啶虫酰胺通过阻碍害虫吮吸作用而发挥效果,害虫摄入药剂后很快停止吮吸,最后饥饿而死。
氟啶虫酰胺主要用于非农作物、棉花、水果和蔬菜,对各种刺吸式口器害虫有效,具有良好的内吸和渗透作用,可从根部向茎部、叶部渗透。
2003年,氟啶虫酰胺首次在美国取得登记,用于温室观赏植物。
2005年,氟啶虫酰胺在法国登记,用于马铃薯、小麦、苹果、梨树、桃树,商品名为Teppeki;同年,其在英国和荷兰登记,用于马铃薯和小麦,商品名为Teppeki。
2005年,氟啶虫酰胺在美国登记,用于棉花,商品名为Carbine;同年,在美国登记,用于果树、蔬菜、商品名为Turbine;2005年在美国上市,用于温室观赏植物和苗圃,商品名为Aria。
2005年,氟啶虫酰胺在韩国取得登记,用于防治苹果、辣椒蚜虫,商品名为Setis,2006年开始在韩国销售。
2005年,氟啶虫酰胺在巴西和哥伦比亚登记并上市,用于防治棉花蚜虫,商品名为Turbine。
2006年氟啶虫酰胺新制剂产品在日本登记,用于苹果、梨、桃、草莓、黄瓜、茶叶、马铃薯等作物。
2007年,氟啶虫酰胺在中国取得原药临时登记,用于黄瓜、苹果、马铃薯,商品名为铁壁;2007年,氟啶虫酰胺在意大利登记,用于苹果、葫芦和桃、商品名为Teppeki;同年,在日本登记,用于苹果和黄瓜。
2008年,氟啶虫酰胺在巴西登记,用于蔬菜、棉花和柑橘,商品名为Turbine。
2010年,氟啶虫酰胺被列入欧盟农药登记条例,有效期至2020年8月31日。
2011年,
氟啶虫酰胺在韩国获准登记,用于苹果、梨和辣椒,2012年上市;同年,氟啶虫酰胺在印度上市,用于棉花、水稻、马铃薯和玉米,商品名为Ulala。
2004~2011年,氟啶虫酰胺销售额年平均增长率接近30%,其中2011年全球市场销售额约为4000万美元。
2.氟啶虫酰胺的合成
氟啶虫酰胺有2种合成方法:直接法和间接法。
2.1直接法
以4-三氟甲基烟酸为起始原料,酰氯与胺反应直接制备氟啶虫酰胺(收率:43.5%)。
2.2间接法
以4-三氟甲基烟酰氯及亚甲氨基乙氰为起始原料,制备相应的酰胺,经2步水解制得氟啶虫酰胺(4步总收率:55.7%)。
2.3 4-三氟甲基烟酸的制备
无论直接法还是间接法,起始原料均为重要的含氟中间体4-三氟甲基烟酸,其主要有以下几种合成方法。
路线1:以4,4,4-三氟乙酰乙酸乙酯为起始原料,与氰基乙酰胺在碱性条件下合环,三氯氧磷将羟基氯代,再钯催化脱卤素,碱性条件下水解得到4-三氟甲基烟酸。
路线2:与路线1相似,在得到2,6-二氯-3-氰基-4-三氟甲基吡啶后,先进行水解,在催化脱除卤素,得到4-三氟甲基烟酸。
路线3:以3-甲氧基丙烯酸甲酯及4-氨基-1,1,1-三氟-3-丁烯-2-酮为起始原料,在碱性条件下,依次经过缩合、环化、水解反应,制备4-三氟甲基烟酸。
路线4:以乙基乙烯醚为起始原料,与三氟乙酰氯进行酰基化、经氨解、碱性条件下缩合、合环、水解得到4-三氟甲基烟酸。
路线5:以乙基乙烯醚为起始原料,与三氟乙酸酐进行酰基化、经氨解、碱性条件下缩合、合环、水解得到4-三氟甲基烟酸。
路线6:以4-三氟甲基吡啶或3-碘-4-三氟甲基吡啶为原料,在低温下与强碱反应,生成的碳负离子与二氧化碳反应,经酸化制备4-三氟甲基烟酸。
路线7:以2-氯-4-甲基吡啶为原料,低温与强碱反应,生成的碳负离子与二氧化碳反应,经酸化、钯碳催化脱卤素制备4-三氟甲基烟酸。
路线8:以2,6-二氯三氟甲基吡啶为原料,低温下与强碱反应,生成的碳负离子与二氧化碳进行羟基化,经酰氯制备酯、钯碳催化脱卤素、水解制备4-三氟甲基烟酸。
3.开发建议
3.1 专利概况
日本石原产业株式会社对氟啶虫酰胺的生产工艺在世界范围内均申请专利保护,主要申请情况如下:
PCT/欧洲专利:制备专利有效期至2013年7月16日,美国专利:制备专利有效期至2013年7月23日,中国专利:制备专利有效期至2013年7月22日。
由此可见,2013年7月氟啶虫酰胺在全球众多市场失去专利保护,成为非专利生产商又一好的选择。
目前,国内的沈阳化工研究院(隶属于中国中化集团)、南京理工大学、西华大学等科院院所及高校已开展相关课题的研究。
3.2 开发路线
比较氟啶虫酰胺制备的直接法和间接法,直接法虽然步骤短,但收率偏低(收率:43.5%),且产品需要利用柱层析的方法提纯,不利于工业化。
间接法虽然步骤较长(4步),但总收率
相比直接法略高(4步总收率:55.7%),产品后处理工艺相对简单,有利于工业化,采用间接法更利于氟啶虫酰胺的生产。
关键中间体4-三氟甲基烟酸的合成方法中,路线1、2原料便宜易得,但需要钯碳催化脱卤素,催化剂价格高,如果不能很好解决钯碳的回收套用问题,路线1、2不值得推荐。
路线3、4、5采用的路线相似。
路线3在制备过程中采用了一锅法制备,且收率高。
避免了在缩合后的酸处理,合环过程中再次加入碱就可以进行合环反应,值得推荐。
路线4增加了制备3-甲氧基丙烯酸甲酯的工艺,原料有保障,总产率虽不及路线3,但也值得推荐。
路线5中,以液体的三氟乙酸酐代替了气体三氟乙酰氯,且反应收率更高,值得借鉴。
除此之外,以氨水代替氨气进行氨化,收率与路线4相近,这在合成中也很值得借鉴。
路线6、7、8均采用低温条件、丁基锂(或类似丁基锂的强碱)为原料制备,不适合工业化生产。
总体来说,在合成中间体4-三氟甲基烟酸时,借鉴路线5来合成4-氨基-1,1,1-三氟-3-丁烯-2-酮,再采用路线3制备4-三氟甲基烟酸是一个好的选择。
参考文献:
1.张亦冰.新颖杀虫剂—氟啶虫酰胺[J].世界农药, 2010, 32(1):54-56
2.刘鹏飞,孙克,张敏恒.氟啶虫酰胺合成方法述评[J].农药, 2013, 52(8):615-619
3.程志明.几个重要杀虫剂的合成[J].今日农药, 2011(9):17-21
4.张梅凤,马新刚.2011年—2015年专利到期的农药品种之氟啶虫酰胺[J].今日农药, 2012, 41(6): 34-36
5.TOKI T, KOYANAGI T, MORITA M, et al. Amide Compounds and Their Salts and Pesticidal Compositions Containtng Them:US,5360806[P]. 1994-11-01
6.TOKI T, KOYANAGI T, MORITA M, et al. Pyridine Amides and Their Salts, Processes for Their Production and Pesticidal Compositions Containing Them: EP0580374A1[P]. 1994-01-26.
7.马梦林.一种4-三氟甲基烟酸的制备方法: CN 200910167945.1[P].2010-10-06
8.姜迪.4-三氟甲基烟酸及其衍生物的合成研究(硕士论文)[D].南京:南京理工大学,2010
9.上田学史, 若林徹. Method for Producing 4-Trifluoromethylnicotinic Acid or Its Salt: JP, 2007210923A[P]. 2007-08-23
10.KOYANAGI TORU,YONEDA TETSUO,KANAMORI FUMIO, et al . Process for Producing
4-Trifluoromethylnicotinic Acid: EP0744400A2[P].1996-11-27
11. SCHLOSSER M, MARULL M. The Direct Metalation and Subsequent Functionalization of
Trifluoromethyl-substituted Pyridines and Quinolines[J]. Eur J Org Chem,2003,8:1569-1575 12. COTTET F, MARULL M, LEFEBVRE O, et al . Recommendable Routes to Trifluoromthyl-
substituted Pyridine and Quinolinecarboxylic Acids[J]. Eur J Org Chem,2003,8:1559-1568。
