二硫键检测方法
fib试剂检测原理

fib试剂检测原理
fib试剂是一种用于检测蛋白质含量的试剂。
其原理是利用亚硫酸盐还原蛋白质中的二硫键,使之断裂,从而将蛋白质分解为各种氨基酸。
接着,试剂中的酚与这些氨基酸结合,产生一种紫色的化合物,即“fib紫”。
该化合物的光吸收峰波长为562nm。
根据所产生的紫色化合物的吸光度,可以计算出蛋白质的含量。
fib试剂是一种经典的蛋白质含量测定方法,具有灵敏度高、操作简便等优点。
同时,该方法也存在着一些限制,如对于一些特殊的蛋白质不适用,以及与其他化合物的干扰等问题。
因此,在使用该方法时需要根据具体情况进行优化和改进,以保证检测结果的准确性和可靠性。
- 1 -。
ELLMAN试剂法测定自由巯基和二硫键

E L L M A N试剂法测定自由巯基和二硫键This manuscript was revised by the office on December 22, 2012E L L M A N试剂测定自由巯基试验基于的原理:5,5’-dithiobis-2-nitrobenzoicacid(DTNB)5,5-二硫基-双(2-硝基苯甲酸)5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB)[1]。
TNB2-在412nm有很强的吸收,可以用于对肽段的自由巯基进行定量分析[2]。
DTNBTNB2-根据文献记载,TNB的吸光系数在13.6*103M-cm-~14.25*103M-cm-之间[3,4]。
吸光度测量的最灵敏范围在0.2-0.7之间。
A=εbc,其中A为吸光度,ε是摩尔吸收光系数或消光系数,ε单位为升/(摩尔·厘米)[L/(mol·cm)]。
以吸光度下限0.2来计算(吸光系数取14.15*103M-cm-),需要TNB的浓度为c=0.2/(14.15*103LM-cm-*1cm)=1.4*10-5mol/L(1.4*10-8mol/ml),需要蛋白浓度为1.4*10-5mol/L*18790g/mol=0.2631g/L=0.2631mg/ml.我们的条件可以达到这个检测限度。
ELLMAN试剂法测定自由巯基主要的影响因素有:1.EDTA的适量加入有助于TNB显色的稳定和成梯度线性关系[5]。
2.在不同缓冲液中,TNB的最大吸收波长略微不同,所以它们在412nm的吸收也不3.同,要根据选择的缓冲液来确定[5]。
另外,TNB的分光光度法分析对SDS很敏感[6]。
4.DTNB随着pH的升高,降解速度加快。
在pH7.0,其降解速度为0.02%/h,在5.pH值8.0,其降解速度为0.2%/h,随着pH值得升高,降解速度加快,在pH12时,15min之内会完全降解[7,8]。
ELLM试剂法测定自由巯基和二硫键

E L L M试剂法测定自由巯基和二硫键Prepared on 22 November 2020ELLMAN试剂测定自由巯基试验基于的原理:5,5’-dithiobis-2-nitrobenzoicacid(DTNB)5,5-二硫基-双(2-硝基苯甲酸)5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB)[1]。
TNB2-在412nm有很强的吸收,可以用于对肽段的自由巯基进行定量分析[2]。
DTNBTNB2-根据文献记载,TNB的吸光系数在*103M-cm-~*103M-cm-之间[3,4]。
吸光度测量的最灵敏范围在之间。
A=εbc,其中A为吸光度,ε是摩尔吸收光系数或消光系数,ε单位为升/(摩尔·厘米)[L/(mol·cm)]。
以吸光度下限来计算(吸光系数取*103M-cm-),需要TNB的浓度为c=(*103LM-cm-*1cm)=*10-5mol/L*10-8mol/ml),需要蛋白浓度为*10-5mol/L*18790g/mol=L=ml.我们的条件可以达到这个检测限度。
ELLMAN试剂法测定自由巯基主要的影响因素有:1.EDTA的适量加入有助于TNB显色的稳定和成梯度线性关系[5]。
2.在不同缓冲液中,TNB的最大吸收波长略微不同,所以它们在412nm的吸收也不3.同,要根据选择的缓冲液来确定[5]。
另外,TNB的分光光度法分析对SDS很敏感[6]。
4.DTNB随着pH的升高,降解速度加快。
在,其降解速度为%/h,在5.pH值,其降解速度为%/h,随着pH值得升高,降解速度加快,在pH12时,15min之内会完全降解[7,8]。
6.摩尔吸收光系数在不同的温度下不同,随温度的升高而下降[4].试验方案主要材料:1.材料PEG-G-CSF批号:080229浓度mlG-CSF批号:080126浓度ml10k超滤膜PALL2.试剂SequencingGradeModifiedTrypsin,Promega,lot#237826。
探究双缩脲试剂检测蛋白质的原理

探究双缩脲试剂检测蛋白质的原理双缩脲试剂(DTT)是一种常用的还原剂,它可以将蛋白质中的二硫键断裂,从而使其变得可测定,并且可以促使蛋白质的还原性复原。
双缩脲试剂检测蛋白质的原理主要是利用其还原性,使得蛋白质的构象变化,从而可进行后续的分析和检测。
在细胞中,蛋白质的三维构象决定了其功能,而二硫键是维持蛋白质结构的关键。
二硫键是一种共价键,它连接两个半胱氨酸残基,可以在蛋白质的折叠过程中形成。
在还原环境下,二硫键会被还原剂断裂,蛋白质的构象发生改变,这就是双缩脲试剂检测蛋白质的原理之一。
具体来说,当双缩脲试剂与蛋白质反应后,蛋白质的二级结构和三级结构都会发生改变。
在二级结构方面,对具有二硫键交联的α-螺旋蛋白,双缩脲试剂的还原可以导致α-螺旋蛋白的解旋,使其变得不规则。
而对于β-折叠蛋白来说,双缩脲试剂的还原则可以导致其β-折叠结构的解开,使其变得呈直链状。
在三级结构方面,双缩脲试剂的还原可以导致蛋白质的立体构象变得更加松弛。
这些结构的改变使得蛋白质在还原条件下变得容易溶解,从而可以用于后续的分析和检测。
双缩脲试剂检测蛋白质的原理还可以从分子水平上进行解释。
在正常情况下,蛋白质的二硫键起到维持其稳定性和功能性的作用。
而当双缩脲试剂作用于蛋白质时,它可以与蛋白质中的半胱氨酸残基形成二硫键,从而破坏原有的二硫键连接。
这种作用使得蛋白质的二级结构和三级结构发生改变,从而使蛋白质变得可测定。
双缩脲试剂检测蛋白质的原理在分子水平上主要是通过破坏蛋白质的二硫键连接,使蛋白质的结构发生改变,从而使其变得可测定。
双缩脲试剂检测蛋白质的原理也可以通过一些实验来加以验证。
可以通过电泳、免疫印迹等实验手段来观察双缩脲试剂检测后蛋白质的变化。
实验结果将显示,在双缩脲试剂的作用下,蛋白质的构象发生改变,使得蛋白质在还原条件下变得可溶解,从而为后续实验提供了条件。
双缩脲试剂检测蛋白质的原理主要是通过破坏蛋白质中的二硫键连接,使得蛋白质的构象发生改变,从而使其变得可测定。
测定蛋白质中二硫键位置的经典方法

测定蛋白质中二硫键位置的经典方法1. 二硫键还原方法:通过还原蛋白质中的二硫键,使其断裂并形成巯基,然后通过化学反应或质谱分析等方法定位巯基的位置。
常用的还原剂包括二巯基丙醇、巴巴锡、二硫化碳等。
2. 红细胞凝集试验:利用二硫键的存在可以促使红细胞间的凝集反应。
该方法可以快速筛查蛋白质中的二硫键位置,但只能给出大致的结果,不能确定具体的二硫键位置。
3. 巯基标记方法:通过使用巯基化合物(如巯基乙基硫酸酯)标记蛋白质中的巯基,然后通过质谱分析等方法确定巯基的位置。
这种方法可以较准确地确定蛋白质中二硫键的位置,但需要进行复杂的实验操作和分析过程。
4. 立体化学分析:通过测定蛋白质中二硫键的立体结构,可以确定二硫键的位置。
常用的方法包括核磁共振(NMR)和X射线晶体学等。
5. 蛋白质结构预测:利用蛋白质的序列信息和结构模型,通过计算方法预测蛋白质中的二硫键位置。
这种方法可以快速预测二硫键的位置,但需要对蛋白质结构预测方法有一定的了解。
6. 蛋白质质谱分析:通过质谱分析蛋白质中的二硫键,可以确定二硫键的位置。
常用的质谱方法包括质子转移反应质谱(PTR-MS)、质谱成像等。
7. 单分子力谱:通过单分子力谱技术,可以直接测量蛋白质中二硫键的断裂力,从而确定二硫键的位置。
这种方法具有高分辨率和高灵敏度,但需要复杂的实验操作和数据处理。
8. 蛋白质电泳:通过蛋白质电泳分离和检测,可以确定蛋白质中二硫键的位置。
常用的电泳方法包括SDS-PAGE、非变性电泳等。
9. 硫醇还原法:通过使用硫醇还原剂如巴巴锡等,可以将蛋白质中的二硫键还原为巯基,然后通过化学反应或质谱分析等方法确定巯基的位置。
10. 蛋白质交联方法:通过使用交联试剂如二硫化亚砜等,可以将蛋白质中的巯基交联形成二硫键,然后通过质谱分析等方法确定二硫键的位置。
这种方法在研究蛋白质的亚单位组装和结构中起到重要作用。
细菌bca蛋白检测方法

细菌bca蛋白检测方法
细菌是一种微生物,生活在各种环境中,包括人体内。
有些细菌可以引起感染和疾病,因此对于细菌的检测非常重要。
其中一种常用的检测方法是bca蛋白检测。
BCA蛋白检测是一种常用的蛋白质浓度检测方法,它可以用于检测细菌中的蛋白质含量。
这种方法基于一种化学反应,可以将蛋白质转化为紫色化合物,然后通过测量紫色化合物的吸光度来确定蛋白质的浓度。
BCA蛋白检测的原理是利用一种叫做“双硫键还原剂”的物质将蛋白质中的二硫键还原,使其转化为可与铜离子形成紫色化合物的还原型离子。
这种化合物可以通过紫外-可见光谱仪来测量其吸光度,从而得出蛋白质的浓度。
BCA蛋白检测方法具有以下优点:
1. 灵敏度高:这种方法可以检测非常低浓度的蛋白质,甚至可以检测到纳克级别的蛋白质。
2. 精确度高:BCA蛋白检测方法对于不同种类的蛋白质都有很好的适应性,可以准确地测量各种不同类型的蛋白质。
3. 操作简单:这种方法操作简单,不需要复杂的仪器和试剂,只需要一些基本的实验室设备即可。
4. 可靠性强:BCA蛋白检测方法的结果稳定可靠,不会受到
其他因素的影响。
在细菌病原体检测中,BCA蛋白检测方法被广泛应用。
通过
检测细菌中的蛋白质含量,可以快速、准确地确定细菌的存在和数量。
这对于临床诊断和治疗非常重要。
总之,BCA蛋白检测方法是一种非常有效的细菌检测方法,
具有高灵敏度、高精确度、操作简单、可靠性强等优点。
在细菌病原体检测中应用广泛,对于临床诊断和治疗具有重要意义。
重组抗体药物的质量控制

抗体药物是生物工程关键技术的前沿成果,在肿瘤、自身免疫、器官移植和感染性疾病的治疗中均取得了显著疗效,在生物技术药物市场中的比重也在迅速攀升。
作为生物技术产业化领域最成功的产品之一,如何通过质量控制确保抗体药物的安全有效一直是本领域的关注热点。
文中就重组抗体药物质量控制的关键环节、进展及未来需要进一步开展的工作作一简要综述。
药品的质量源于设计,而非依赖终产品的检测,重组抗体药物也不例外。
广义的质量控制包括生产过程控制、终产品质量控制等环节。
抗体由两条重链和轻链以链间二硫键形成连接,结构复杂、相对分子质量大,采用哺乳动物细胞表达体系制备通常含有翻译后修饰,与原核体系制备的生物技术产品相比,其质量控制难度相对较大。
重组抗体药物的生产过程包括工程细胞的构建及传代扩增、细胞培养、抗体的纯化、产品分装保存等。
因此生产单位需遵循药品生产质量管理规范(GMP)的总体要求建立质量体系,并通过质量保证部门对生产过程实施全程监控才能确保终产品的安全有效。
鉴于抗体药物生产过程与其他生物技术药物类似,本文未对抗体药物生产的过程控制进行阐述(相关内容可参见国家食品药品监督法规与ICH指导原则等),而主要侧重于介绍重组抗体药物生产细胞、质控用标准物质、产品质量控制方面的研究进展。
Part1、生产细胞的质量控制重组单抗的生产细胞应来自于共同的原始细胞,具有相同的遗传和生物学特征,经全面检测无病源微生物污染,在特定的培养条件下,可以稳定持续地表达结构正确并具有生物学活性的抗体。
1工程细胞的构首先应清楚所采用细胞系的来源及培养历史等有关背景资料,包括细胞种属及地域来源、病原体检测结果、最初分离培养和建系信息、采用的方法与原材料等。
在构建中应说明构建和筛选的手段与步骤、克隆基因的序列、插入载体目的基因编码区和相关侧翼序列,说明载体引入细胞的方法及载体在细胞内的状态与拷贝数,并应提供宿主和载体结合后的遗传稳定性资料。
同时还应明确细胞的生长特征、培养条件、培养液组成、导入目的基因的表达水平等。
ELLMAN试剂法测定自由巯基和二硫键
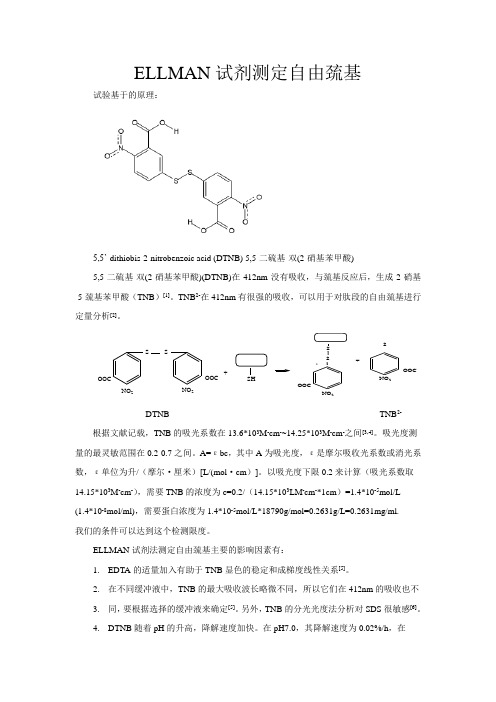
ELLMAN 试剂测定自由巯基试验基于的原理:5,5’-dithiobis-2-nitrobenzoic acid (DTNB) 5,5-二硫基-双(2-硝基苯甲酸)5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm 没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB )[1]。
TNB 2-在412nm 有很强的吸收,可以用于对肽段的自由巯基进行定量分析[2]。
SS NO 2NO 2-OOC-OOC+SH S -SNO 2NO 2-OOC-OOC+SDTNB TNB 2- 根据文献记载,TNB 的吸光系数在13.6*103M -cm -~14.25*103M -cm -之间[3,4]。
吸光度测量的最灵敏范围在0.2-0.7之间。
A=εbc ,其中A 为吸光度,ε是摩尔吸收光系数或消光系数,ε单位为升/(摩尔·厘米)[L/(mol ·cm )]。
以吸光度下限0.2来计算(吸光系数取14.15*103M -cm -),需要TNB 的浓度为c=0.2/(14.15*103LM -cm -*1cm )=1.4*10-5mol/L (1.4*10-8mol/ml),需要蛋白浓度为1.4*10-5mol/L*18790g/mol=0.2631g/L=0.2631mg/ml. 我们的条件可以达到这个检测限度。
ELLMAN 试剂法测定自由巯基主要的影响因素有:1. EDTA 的适量加入有助于TNB 显色的稳定和成梯度线性关系[5]。
2. 在不同缓冲液中,TNB 的最大吸收波长略微不同,所以它们在412nm 的吸收也不3. 同,要根据选择的缓冲液来确定[5]。
另外,TNB 的分光光度法分析对SDS 很敏感[6]。
4. DTNB 随着pH 的升高,降解速度加快。
在pH7.0,其降解速度为0.02%/h ,在5.pH值8.0,其降解速度为0.2%/h,随着pH值得升高,降解速度加快,在pH 12时,15min之内会完全降解[7,8]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.3.1.4 MBP-Permatin蛋白中半胱氨酸残基及二硫键数目的测定
L半胱氨酸可于5,5-二巯基双-2硝基甲苯(DTNB)发生硫醇-二硫化物交换反应,在碱性条件下反应显黄色,在412 nm处有强烈吸收峰。
该反应可特异地检测-SH,从而定量检测L半胱氨酸含量。
分析MBP标签氨基酸序列可知,该标签蛋白中不含有半胱氨酸,故不影响原核表达的Permatin中半胱氨酸残基的数目。
采用DTNB 方法测定样品的巯基数,其方法的主要步骤为:
1)样品先用8 M尿素37℃处理4 h;
2)游离巯基数的测定: 向未经尿素处理的1.0 ml样品(0.38 mg/ml)中加入2 ml Tris-Gly(0.086 M Tris, 0.09 M Gly, pH 8.0),加入50μl DTNB(10 mM DTNB, 200 mM Tris-HCl, pH 8.0),5 min后测定412 nm 处的吸光值;
3) 总的巯基数的测定: 向经尿素处理的0.5 ml样品中加入2 ml Tris-Gly,加入50μl β-巯基乙醇(β-ME),37℃温浴1h,加入10 ml 12%三氯乙酸(TCA),37℃温浴1 h,11000 rpm离心30 min,用5 ml 12% TCA重悬沉淀两次,以彻底去除β-ME,最后用2ml Tris-Gly重溶沉淀,加入50μl DTNB溶液,5 min后测定412 nm处的吸光值。
利用公式:μmol SH/g=73.53×A412×D/C进行计算。
其中A412是412 nm处的吸光值, D为稀释倍数,C为蛋白浓度, 73.53是一个系数,由106/1.36 x 104得到。
