四种类型的晶体概述
07 第七章 晶体的类型

根据晶格结点上的粒子的种类不同,晶体可 以分成四种类型: (1)离子晶体:晶格结点上交替排列的是正、 负离子。 (2)原子晶体: 晶格结点上排列的是中性原子。 (3)分子晶体: 晶格结点上排列的是中性分子。
(4)金属晶体: 晶格结点上排列的是金属原子 或金属离子
§1 离子晶体
1.1 离子晶体的特征
相应的电子构型变化: 2s 2 2p 6 3s 1 —— 2s 2 2p 6 ,3s 2 3p 5 —— 3s 2 3p 6 形成稀有气体原子结构的稳定离子。
第二步 靠静电吸引, 形成化学键 。 体系的势能与核间距之间的关系如图所示:
V
0 Vr0 r0 r
纵坐标的零点 当 r 无穷大时,即两核之间 无限远时的势能。
+
+
Cl ( g )
-
NaCl ( g )
H 1 = S = 108.8 kJ· mol-1 , Na ( s ) 的升华热 S ;
H 2 = I1 = 496kJ· mol-1 , Na 的第一电离能 I 1 ; H 3 = 1/2 D = 121.5kJ· mol-1 , Cl 2 ( g ) 的离解能 D 的一半;
d ) 阳离子半径小于它的原子半径;阴离子半径大 于它的原子半径。
如: Na + (97pm) < Na (157pm) ; Cl (99pm) < Cl - (181pm) 。
e ) 负离子半径一般较大;正离子半径一般较小 。
第二周期
第四周期
F- 136 pm ;
Br- 195 pm ;
Li + 60 pm 。
考察 Na+ 和 Cl - 彼此接近的过程中,势能 V 的变化。 图中可见: r > r0 ,当 r 减小时,正负离
晶体的四种基本类型和特点

晶体的四种基本类型和特点晶体是由于原子、分子或离子排列有序而形成的固态物质。
根据晶体的结构特点,晶体可以分为四种基本类型:离子晶体、共价晶体、金属晶体和分子晶体。
1. 离子晶体离子晶体由正离子和负离子通过离子键结合而成。
正负离子之间的电荷吸引力使得离子晶体具有高熔点和脆性。
离子晶体的晶格结构稳定,形成高度有序的排列。
常见的离子晶体有氯化钠(NaCl)、氧化镁(MgO)等。
离子晶体在溶液中能够导电,但在固态下通常是绝缘体。
2. 共价晶体共价晶体由共价键连接的原子或分子组成。
共价键是由原子间的电子共享形成的,因此共价晶体具有很高的熔点和硬度。
共价晶体的晶格结构复杂多样,具有很高的化学稳定性。
典型的共价晶体包括金刚石(C)和硅(Si)。
共价晶体通常是绝缘体或半导体,由于共价键的稳定性,其导电性较弱。
3. 金属晶体金属晶体由金属原子通过金属键结合而成。
金属键是由金属原子间的电子云形成的,因此金属晶体具有良好的导电性和热传导性。
金属晶体的晶格结构常为紧密堆积或面心立方等紧密排列。
金属晶体的熔点通常较低,而且具有良好的延展性和韧性。
典型的金属晶体有铁(Fe)、铜(Cu)等。
4. 分子晶体分子晶体由分子通过弱相互作用力(如范德华力)结合而成。
分子晶体的晶格结构不规则,分子间的距离和角度较大。
由于分子间的相互作用力较弱,分子晶体通常具有较低的熔点和软硬度。
典型的分子晶体有水(H2O)、冰、石英(SiO2)等。
分子晶体在固态下通常是绝缘体,但某些分子晶体在溶液中能够导电。
总结起来,离子晶体由正负离子通过离子键结合,具有高熔点和脆性;共价晶体由共价键连接,具有高熔点和硬度;金属晶体由金属原子通过金属键结合,具有良好的导电性和热传导性;分子晶体由分子通过弱相互作用力结合,具有较低的熔点和软硬度。
这四种基本类型的晶体在结构、性质和应用上都有明显的差异。
研究晶体的类型和特点对于理解物质的性质和应用具有重要意义。
斜方晶系和正交晶系

斜方晶系和正交晶系晶系是晶格类型的重要分类,即晶体晶格的静态表现,晶系更多地在宏观上反映了晶体之间某种程度的结构相似性。
现代晶体结构理论认为,根据晶格类型的不同,可以将晶体晶格分为斜方晶系和正交晶系。
一、斜方晶系斜方晶系是指由两个或多个斜方体相互连接在一起构成的晶体晶格。
斜方晶系可以分为四种类型:普通的斜方体结构(如NaCl结构),改进的斜方体结构(如CaF2结构),双斜方结构(如CdI2结构)和混合斜方晶系(如CuCl结构)。
斜方晶体相对于正交晶体,晶粒大小较小,晶格灵活可塑性强,因此斜方晶体中的原子层状障碍易受到打破,因而容易产生类似极性强的共价键,使斜方晶体中的物质更好地团结在一起,更易于在晶格内扩散,常见如离子晶体,有机晶体等。
二、正交晶系正交晶系是指由三种不同正交单位晶格构成的晶体晶格。
它由晶格系数a,b,c和晶体角α,β,γ组成,其中a,b,c是晶胞各轴的长度,α,β,γ是晶胞各轴之间的夹角。
正交晶系有六种基本类型,分别是四面体正交晶系(如Cu),六面体正交晶系(如GaAs),八面体正交晶系(如CuCl),十二面体正交晶系(如HgTe),十六面体正交晶系(如CdS),二十四面体正交晶系(如LiF)。
正交晶体生长得比较整齐,其中的原子层状障碍会比较强,因此正交晶体的物质分子之间的键比较稳定,构建出更紧密的晶体结构,常见如金属晶体,半导体晶体等,同时,由于紧密的晶格会使原子的移动比较困难,因此正交晶体的扩散能力不如斜方晶体。
总结斜方晶系和正交晶系是现代晶体结构理论中晶格类型的两个主要分类,它们具有一定的特点。
斜方晶系相对于正交晶系来说,晶粒较小,晶格灵活可塑性强,因此斜方晶体中的物质更好地团结在一起,更易于在晶格内扩散。
而正交晶系生长较整齐,因此正交晶体的物质分子之间的键比较稳定,构建出更紧密的晶体结构,但扩散能力不如斜方晶体。
四种晶体比较表
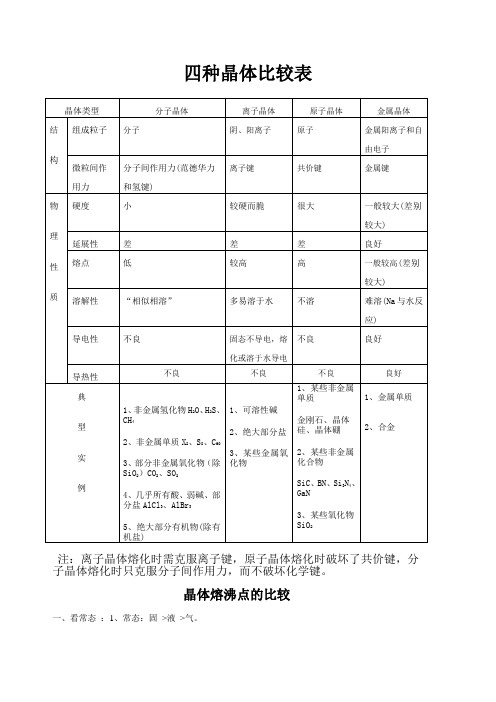
四种晶体比较表注:离子晶体熔化时需克服离子键,原子晶体熔化时破坏了共价键,分子晶体熔化时只克服分子间作用力,而不破坏化学键。
晶体熔沸点的比较一、看常态:1、常态:固>液>气。
2、一般情况下,原子晶体>离子晶体(金属晶体)>分子晶体。
3、原子晶体:共价键(取决于原子半径)。
4、离子晶体:离子键(取决于离子半径和离子电荷)5、金属晶体:金属键(取决于金属原子半径和价电子数)6、分子晶体:①结构相似,分子量越大,熔沸点越高。
②分子量相等,正>异>新。
③氢键反常二、看类型三、分类比较18.请完成下列各题:(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有种。
(2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。
Ga原子的电子排布式为。
在GaN晶体中,每个Ga原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为。
在四大晶体类型中,GaN属于晶体。
(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是(填化学式)。
19.生物质能是一种洁净、可再生的能源。
生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。
写出基态Zn原子的核外电子排布式。
(2)根据等电子原理,写出CO分子结构式。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子中碳原子轨道的杂化类型为。
②甲醛分子的空间构型是;1mol甲醛分子中σ键的数目为。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为。
晶体结构的类型分类

晶体结构的类型分类晶体是由原子、离子或分子按照一定的规律排列而成的固体物质,其结构具有高度的有序性和周期性。
根据晶体内部原子、离子或分子的排列方式和结构特征,可以将晶体结构分为几种不同的类型。
下面将介绍几种常见的晶体结构类型分类。
1. 根据晶体的周期性分为:- 长程有序晶体:具有长程有序性,即晶体中原子、离子或分子的排列呈现出明显的周期性,如立方晶系、四方晶系、六方晶系等。
- 短程有序晶体:具有短程有序性,即晶体中只有一部分原子、离子或分子的排列呈现出周期性,而整体结构并不呈现规则的周期性。
2. 根据晶体的原子、离子或分子排列方式分为:- 离子晶体:由正负离子按照一定比例排列而成,如氯化钠晶体。
- 共价晶体:由共价键连接的原子或分子构成,如金刚石晶体。
- 金属晶体:由金属原子通过金属键连接而成,如铜晶体。
- 分子晶体:由分子之间通过范德华力或氢键等相互作用力连接而成,如冰晶体。
3. 根据晶体的结构特征分为:- 离子晶体:具有高度的电荷平衡,通常硬度较大,熔点较高,易溶于水。
- 共价晶体:具有坚硬的结构,通常硬度很大,熔点也很高。
- 金属晶体:具有电子云海结构,通常具有良好的导电性和热导性。
- 分子晶体:分子之间的相互作用力较弱,通常易溶于有机溶剂,熔点较低。
4. 根据晶体的晶体系统分类:- 立方晶系:包括立方晶体、体心立方晶体、面心立方晶体。
- 四方晶系:包括四方晶体。
- 六方晶系:包括六方晶体。
- 斜方晶系:包括斜方晶体。
- 单斜晶系:包括单斜晶体。
- 单轴晶系:包括单轴晶体。
总的来说,晶体结构的类型分类是根据晶体内部原子、离子或分子的排列方式、结构特征以及晶体系统等因素进行划分的。
不同类型的晶体结构具有不同的性质和特点,对于研究物质的性质和应用具有重要意义。
通过对晶体结构的分类和研究,可以更深入地了解物质的结构和性质,为材料科学和化学领域的发展提供重要参考。
四种晶体类型

晶体,一般包括离子晶体、分子晶体、原子晶体、金属晶体四种类型。
一、依据构成晶体的微粒和微粒间的作用判断(1)离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。
(2)原子晶体的构成微粒是原子,微粒间的作用是共价键。
(3)分子晶体的构成微粒是分子,微粒间的作用为分子间作用力。
(4)金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用是金属键。
二、依据物质的分类判断(1)金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合类原子晶体有碳化硅、二氧化硅等。
(4)金属单质是金属晶体。
三、依据晶体的熔点判断。
(1)离子晶体的熔点较高。
(2)原子晶体的熔点很高。
(3)分子晶体的熔点低。
(4)金属晶体多数熔点较高,但有少数熔点相当低。
四、依据导电性判断。
(1)离子晶体溶于水及熔融状态时能导电。
(2)原子晶体一般为非导体。
(3)分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。
(4)金属晶体是电的良导体。
五、依据硬度和机械性能判断。
(1)离子晶体硬度较大、硬而脆。
(2)原子晶体硬度大。
(3)分子晶体硬度小且较脆。
(4)金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
晶体的类型和结构
30 26
4.2003年3月,学国家发现首例带 2003年 下呈现超导性。 结晶水的晶体在 5K 下呈现超导性。报 报道, 报道,该晶体中含有最简式为 CoO2 的 层状结构,结构如右图(小球表示Co Co原 层状结构,结构如右图(小球表示Co原 大球表示O原子)。 )。下列用粗线画 子,大球表示O原子)。下列用粗线画 出的CoO 层状结构的晶胞( 出的CoO2层状结构的晶胞(晶胞是在 晶体中具有代表性的最小重复单元) 晶体中具有代表性的最小重复单元)示 D 意图不符合化学式的是
30
一个氯化钠晶胞中 有多少个钠离子? 有多少个钠离子? Na+=(12/4+1) ( ) =4个 个
30
19
NaCl晶体结构示意图: NaCl晶体结构示意图: 晶体结构示意图 (4)每 个晶胞含 钠离子、 钠离子、 氯离子的 个数? 个数?
1 氯离子: 氯离子: × 8 + 1 × 6 = 4
30
Cl-
Na+
Na
Cl+
12
1、NaCl晶体结构示意图: NaCl晶体结构示意图 晶体结构示意图:
晶胞是在晶体中具有代表性的最小重复单元 晶胞是在晶体中具有代表性的最小重复单元 是在晶体中具有代表性 (1)钠 离子和氯 离子在晶 胞中的位 置:
Cl-
Na+
钠离子:体心和棱中点;氯离子:面心和顶点, 钠离子:体心和棱中点;氯离子:面心和顶点, 30 13 或者反之。 或者反之。
1、NaCl晶体结构示意图: NaCl晶体结构示意图 晶体结构示意图:
(3)、在氯 )、在氯 化钠晶体中, 化钠晶体中, 每个Na 每个Na+周围 与之最接近且 距离相等的Cl 距离相等的Cl共有6 共有6个;这6 个Cl-在空间构 成的几何构型 成的几何构型 为 正八面体 。
四种常见晶体

主讲 汪毅
一、四种晶体类型对比
晶体类型 离子晶体 晶体粒子 阴、阳离子
粒子间作 离子键 用力
原子晶体 分子晶体 金属晶体
原子
分子
金属阳离子、自 由电子
共价键 分子间作 金属键 用力
熔沸点 硬度
较高 较硬
很高 很硬
较低
一般较高,少部
一般较软 分低 ,一般较硬 少部分软
溶解性
易溶于水,难 难溶解 相似相溶 难溶 溶于有机溶剂
存在共价键 B.分子中含两个氢原子的酸一定是二元酸 C.含有金属离子的晶体一定是离子晶体 D.元素的非金属型越强,其单质的活泼性一定
越强
晶体熔沸点高低的判断方法 1、不同晶体类型的熔沸点比较
一般:原子晶体>离子晶体>分子晶体(有例外)
金刚石熔点3350℃ 碳化硅熔点2600℃ 氧化镁熔点2852℃ 二氧化硅熔点1723℃ 氧化铝熔点2050℃ 氯化铝熔点190℃
氯化钠熔点801℃ 氯化镁熔点714℃
离子晶体的晶格能的大小
不能简单用
离子间的库仑力
衡量
晶体熔沸点高低的判断方法
2、同种晶体类型物质的熔沸点比较
组成和结构相似
①离子晶体:再次强调组成和结构相似 阴、阳离子电荷数越大,半径越小
②原子晶体: 原子半径越小→键长越短→键能越大
熔沸点越高 熔沸点越高
③分子晶体: 分子的极性、氢键的因素和支链的多少等
组成,键角是 60o ,共含有 30 个 B—B键。
四、典型的离子晶体举例
<一>NaCl
1、照本宣科可不行喽
有一种由钛原子和碳原 子构成的气态团簇分子, 如右图所示,顶角和面 心的原子是钛原子,棱 的中心和体心的原子是 碳原子,它的化学式是 _T_i1_4_C_1_3 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
思考3:用电子式表示NaCl和HCl的形成过程, 比较两者形成过程的差异
讨论:Na+只与1个Cl-形成离子键吗? H原子只与1个Cl原子形成共价键吗?
一、离子键的成键特点 无饱和性和方向性
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
[问题解决2] 从结构和能量两个角度比较并解释下 列物质的熔点高低
原子核外特征电子排布 原子半径/pm 原子化热/kJ·mol-1 熔点/℃
Li 2s1 152 147.2 180.5
Na 3s1 186 108.4 97.5
K 4s1 255 90.0 63.4
结论:同主族金属元素的单质,从上到下,金属原子 半径增大,原子化热减小,金属的熔点降低
二、离子晶体中离子键强弱的量度——晶格能
1、晶格能(符号U):指拆开1mol离子晶体使之 成为气态阴离子和气态阳离子时所吸收的能量
思考:从表中数据分析影响晶格能大小的因素有哪些?
AB型离子晶体 NaCl NaBr NaI MgO CaO
离子电荷数
11 1 2 2
核间距/pm
282 298 311 210 239
[问题解决2] 从结构和能量两个角度比较并解释下 列物质的熔点高低
原子核外特征电子排布 原子半径/pm 原子化热/kJ·mol-1 熔点/℃
Na 3s1 186 108.4 97.5
Mg 3s2 160 146.4 650
Al 3s23p1 143.1 326.4
660
结论:同周期金属元素的单质,从左到右,金属原子 半径减小,且单位体积的自由电子数增加,原子化热 增大,金属的熔点升高。
+
+
+
+
+
思考:Na+周围最近的Cl-有几个, Cl-周围最近的Na+有几个?
思考:在NaCl晶胞中真正拥有 的离子数分别有几个?
CsCl的晶体结构 Cl-
Cs+
思讨考论:12345:①C在 假 解都s设 释C+是周s阳 为CA围离 什lB晶最型子么胞近离周固离中子围态子 的真化晶正合带离体Cl有拥物负子-有较有 , 电 化几高的 为 合个的离 什 阴 物,硬子 么 离 不C度数 阳 子 导l-周和分离的电围熔别子体而点周积? 最有围小熔并的得融近几猜阴可状的个测离以态?CNas子 忽 导+C有数 略 电l和几不 ?C个同 计sC??,l熔你点觉 ②得的它由高与此低什你?么如晶何体理类解似离呢子?键 没有饱和性和方向性这一 观点?
(3)从原子化热的定义思考固态的金属熔融后, 液态的金属中还有没有金属键?
三、金属晶体模型及化学式计算
金属Li
金属Mg
金属Cu
81 1 2 8
81 1 2 8 1 6 1 4
8
82
体心立方
六方最密堆积 面心立方最密堆积
思考1:由Na、H、Cl三种元素组成的化合物 有哪些?依据所学的化学键的知识,写出它们 的电子式
+
+
能量
E0为两个远离的氢 原子的能量之和
E0
r=74pm
E1=-436kJ/mol
核间距
能量
E0为两个远离的氢 原子的能量之和
E0
r=74pm
E1=-436kJ/mol
核间距
思讨考论1234::如从 由 你 当下两 此 认原个 可 为子模知可自轨拟共把旋道动价图相式画键中反,中形的表可成氢r=述7以的原4Hp得本子Fm中出质的和共什是1Es价1轨么什=4键道结么36是最论?kJ如/大?m何重o形l 叠定 义 成为键的什后?么 ,比 能较 否恰 再当与?另一个氢原子成键,为什么?
结论:晶格能越大,离子晶体的熔沸点越高,硬度越大
2、影响晶格能的主要因素:
(1)离子半径(离子半径越大,晶格能越小)
(2)离子所带的电荷数(离子所带电荷数越大,
晶格能越大)
即:晶格能
q1 q2 r2
思考1:判断Na原子失去一个电 子至很远处的过程中的能量变化 (Na - e- =Na+)
+11
晶格能/kJ·mol-1 786 747 686 3721 3401
熔点/℃
801 747 662 2852 2030
摩氏硬度
2.5 <2.5 <2.5 6.5 4.5
二、离子晶体中离子键强弱的量度——晶格能
1、晶格能(符号U):指拆开1mol离子晶体使之 成为气态阴离子和气态阳离子时所吸收的能量
思考2:判断Cl原子从很远处得 到一个电子的过程中的能量变化 (Cl +e- = Cl-)
+17
结论:克服引力做功,需吸收热量,体系能量增大, 引力做正功,向环境释放热量,体系能量降低。
两个核外电子自旋方向相同的氢原子靠近的模拟动画
+
能量
E0为两个远离的氢 原子的能量之和
E0
+
核间距
两个核外电子自旋方向相反的氢原子靠近的模拟动画
[问题解决2] 从结构和能量两个角度比较并解释下 列物质的熔点高低
原子核外特征电子排布 原子半径/pm 原子化热/kJ·mol-1 熔点/℃
Na 3s1 186 108.4 97.5
Ca 4s2 197 150.0 842
结论:金属原子半径相近,单位体积内价电子数越的角度解释下列现象 (1)1mol干冰气化成CO2气体,需吸收16kJ热量 (2)将1mol NaCl固体气化为自由离子,需吸收 786kJ热量 (3)将1mol 金刚石固体气化为自由原子,需吸收 308kJ的热量
思考2:(1)将1mol金属钠固体完全气化成相互 远离的气态原子需要吸收108.4 kJ的热量(即原子 化热为108.4kJ/mol),由此可以得出什么结论?
(2)金属固体能导电的原因是什么?
从中你能猜测构成金属的微粒和存在的作用力分别 是什么吗?
一、金属键与金属的通性
1、概念:化学上把这种金属 离子与自由电子之间强烈的 相互作用力称为金属键,由 此形成的晶体称为金属晶体
2、构成微粒
金属阳离子 自由电子
3、微粒间作用力
[问题解决1] 运用金属键理论解释金属为什么具备 导电性、导热性和延展性等通性
二、金属键强弱的量度及其影响因素
1、金属键强弱的量度指标——原子化热
2、影响金属键强弱的因素
(1)金属原子半径
(2)单位体积内的自由电子数(价电子数) 思考:(1)从书本p33表格数据分析为什么钠和 铬的最外层电子数相同,但钠质地柔软,而铬是 最硬的金属 思考:(2)为什么过渡元素一般都具有较高的 熔点和硬度?
