2020届高三工艺流程题专项训练
2020年高考化学真题-工艺流程题(习题版)

2020年高考真题工艺流程题1.(2020年山东新高考)以菱镁矿(主要成分为MgCO 3,含少量SiO 2,Fe 2O 3和A12O 3)为原料制备高纯镁砂的工艺流程如下:已知浸出时产生的废渣中有SO 2,Fe(OH)3和Al(OH)3。
下列说法错误的是A .浸出镁的反应为4232MgO+2NH Cl=MgCl +2NH +H O ↑B .浸出和沉镁的操作均应在较高温度下进行C .流程中可循环使用的物质有NH 3、NH 4ClD .分离Mg 2+与Al 3+、Fe 3+是利用了它们氢氧化物K sp 的不同2.(2020年新课标Ⅰ)钒具有广泛用途。
黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO 2、Fe 3O 4。
采用以下工艺流程可由黏土钒矿制备NH 4VO 3。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH 如下表所示: 金属离子Fe 3+ Fe 2+ Al 3+ Mn 2+ 开始沉淀pH1.9 7.0 3.0 8.1 完全沉淀pH3.2 9.04.7 10.1回答下列问题:(1)“酸浸氧化”需要加热,其原因是___________。
(2)“酸浸氧化”中,VO +和VO 2+被氧化成2VO +,同时还有___________离子被氧化。
写出VO +转化为2VO +反应的离子方程式___________。
(3)“中和沉淀”中,钒水解并沉淀为252V O xH O ⋅,随滤液②可除去金属离子K +、Mg 2+、Na +、___________,以及部分的___________。
(4)“沉淀转溶”中,252V O xH O ⋅转化为钒酸盐溶解。
滤渣③的主要成分是___________。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________。
(6)“沉钒”中析出NH 4VO 3晶体时,需要加入过量NH 4Cl ,其原因是___________。
2020年高考专题训练-工艺流程题(七)

工艺流程题(七)15.钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。
广泛应用于钢铁、航空航天、能源、化工等领域。
工业上常用钒炉渣(主要含FeO?V2O3,还有少量SiO 2、P2O5等杂质)提取V2O 5的流程如图:(1)焙烧的目的是将FeO?V2O3 转化为可溶性NaVO 3,其中铁元素全部转化为+3 价,写出该反应的化学方程式___________________________________(2)加MgSO 4溶液的步骤中,滤渣的主要成分是__________ (用化学式表示)。
(3)沉钒过程中的发生反应的离子方程式为________________ ,得到的固体物质往往需要洗涤,写出实验室洗涤NH 4VO 3沉淀的操作方法______________ 。
(4)元素钒在溶液中还可以以V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(黄色)等形式存在.某利用钒元素微粒间的反应来设计的可充电电池的工作原理如图示,已知溶液中还含有 1 mol硫酸,请回答下列问题:①充电时,左槽电极上发生的电极反应式为_________________②放电过程中,右槽溶液颜色变化为_______________________ ,若此时外电路转移了3.01 ×1022个电子,则左槽溶液中H+的变化量Δn(H+)=_______ 。
【答案】4FeO?V2O5+4Na2CO3+5O2 8NaVO3+2Fe2O3+4CO2 MgSiO3 Mg(3 PO4) 3 NH4++VO3-=NH4VO3↓ 往漏斗中加水至浸没沉淀,让水自然流下,重复2-3 次VO2++H2O-e=VO2++2H 紫色变为绿色0.05mol【解析】【分析】钒炉渣加入碳酸钠在空气中焙烧,生成NaVO3、氧化铁、硅酸钠、磷酸钠,水浸后得到滤渣中含有氧化铁,滤液为NaVO3、硅酸钠、磷酸钠的水溶液,滤液中加入硫酸镁生成生成难溶的硅酸镁、磷酸镁沉淀,过滤后向溶液中再加入硫酸铵生成NH4VO3 沉淀,NH4VO3灼烧生成V2O5。
2020年高考专题训练-工艺流程题(一)

工艺流程练习题(一)1.锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。
以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:已知25℃,部分物质的溶度积常数如下:物质Mn(OH)2Co(OH)2Ni(OH)2MnS CoS NiSK sp 2.1×10-13 3.0×10-16 5.0×10-16 1.0×10-11 5.0×10-22 1.0×10-22(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是_______________________;(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③________________;(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是__________________;加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有_________;滤渣2的主要成分是_________;(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10-5mol•L-1,则应保持溶液中c(S2-)≥ _____ mol•L-1。
【答案】(1)MnCO3+H2SO4=MnSO4+CO2↑+H2O;(2)抑制Mn2+的水解;(3)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(4)烧杯;CoS和NiS;(5)1.0×10﹣6.【解析】试题分析:(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水;(2)Mn2+离子易水解;(3)据得失电子守恒有MnO2+2Fe2+﹣﹣Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+﹣﹣Mn2++2Fe3+,最后据原子守恒得MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(4)根据操作方法判断缺少的仪器;由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;(5)由于将一级沉降根据MnS的Ksp=c(Mn2+)•c(S2﹣)进行计算即可.解:向碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)中加入硫酸,可以发生反应生成硫酸盐,向其中就如具有氧化性的二氧化锰,可以将亚铁离子氧化为铁离子,调节pH可以将氢氧化铁沉淀下来,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的含有锰离子的盐电解,可以得到金属锰.(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水,步骤Ⅰ中,MnCO3与硫酸反应的化学方程式为:MnCO3+H2SO4=MnSO4+CO2↑+H2O,故答案为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;(2)Mn2+离子易水解.加入过量硫酸,还可以抑制Mn2+的水解,故答案为:抑制Mn2+的水解;(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+﹣Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+﹣Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(4)步骤Ⅲ为过滤操作,需要用到的玻璃仪器除玻璃棒、漏斗外,还需要烧杯;由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成,故答案为:烧杯;CoS和NiS;(5)MnS的Ksp=c(Mn2+)•c(S2﹣)=1.0×10﹣11,为了将Mn2+降到1.0×10﹣5mol/L,则c(S2﹣)===1.0×10﹣6mol/L,即硫化钠的浓度是1.0×10﹣6mol/L,故答案为:1.0×10﹣6.2.高铁酸盐在能源、环保等方面有着广泛的用途。
2020届高三考前冲刺工艺流程题专项训练(含答案)

(6)从废旧碱性锌锰电池中可以回收利用的物质有 _____________________(写两种)。 7.亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、 印染和食品工业.它在碱性环境中稳定存在。某同学查阅资料后 设计生产 NaClO2 主要流程如下:
(1)Ⅰ中发生反应的还原剂是___________,气体 a 的名称是 ___________ (2) Ⅱ 中 反 应 的 离 子 方 程 式 是 _________________________________________ (3)A 的化学式是___________ (4)Ⅲ中电极 X 是___________,(填“阴极”“阳极”),其上 发生的电极反应为 ____________________________。离子交换膜 N 是____(填“阴” “阳”)离子交换膜。(5)ClO2 是一种高效水处理剂,可用亚氯 酸钠和稀盐酸为原料制备: 5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,该反应中氧化剂和还原剂
(1)反应①的尾气可以再利用,写出应用该尾气制得的两种重 要化学试剂:____________。(2)如果在实验室模拟操作 1 和 操作 2,则需要使用的主要玻璃仪器有:_______________。 (3)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶 液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式 为_______________。 (4)工业上制备还原性气体 CO 和 H 2 的反应原理为 CO 2+CH 42CO +2H 2,CH 4+H 2O CO +3H 2。含甲烷体积分数为 80%的 a L(标准状况)天然气与足 量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为 90%,用产生的还原性气体(CO 和 H 2)还原 MoO 3 制钼,理论上 能生产钼的质量为____________。 5.二氟磷酸锂(LiPO 2F 2)作为电解液添加剂能够有效提升锂电 池的循环性能。在氮气气氛下,在 PFA(全氟烷氧基树脂)烧瓶中 加入高纯 LiPF 6 和 Li 2CO 3 固体,以碳酸二甲酯作溶剂制备 LiPO 2F 2,其流程如下:
2020届高三化学大题练——化学工艺流程题
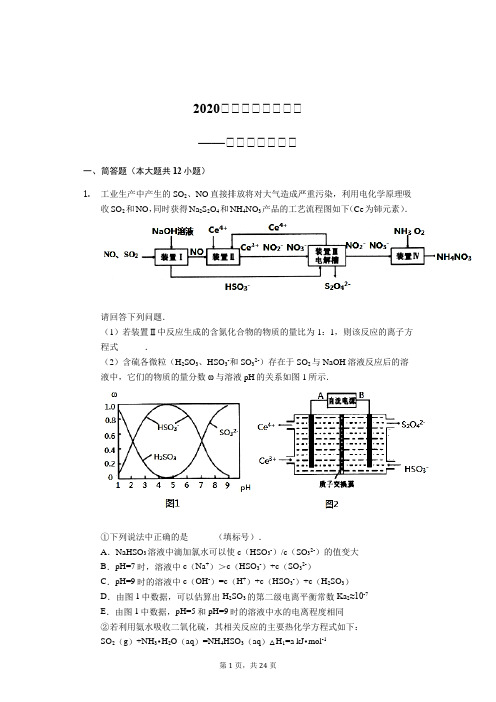
2020届届届届届届届届——届届届届届届届一、简答题(本大题共12小题)1.工业生产中产生的SO2、NO直接排放将对大气造成严重污染,利用电化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素).请回答下列问题.(1)若装置Ⅱ中反应生成的含氮化合物的物质的量比为1:1,则该反应的离子方程式______.(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.①下列说法中正确的是______(填标号).A.NaHSO3溶液中滴加氯水可以使c(HSO3-)/c(SO32-)的值变大B.pH=7时,溶液中c(Na+)>c(HSO3-)+c(SO32-)C.pH=9时的溶液中c(OH-)=c(H+)+c(HSO3-)+c(H2SO3)D.由图1中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7E.由图1中数据,pH=5和pH=9时的溶液中水的电离程度相同②若利用氨水吸收二氧化硫,其相关反应的主要热化学方程式如下:SO2(g)+NH3•H2O(aq)=NH4HSO3(aq)△H1=a kJ•mol-1NH3•H2O (aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=b kJ•mol-1 2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=c kJ•mol-1反应2SO2(g)+4NH3•H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)△H=______kJ•mol-1.③取装置Ⅰ中的吸收液VmL,用cmol/L的酸性高锰酸钾溶液滴定.吸收液溶液应装在______(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法______.(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.图中B为电源的______(填“正”或“负”)极.左侧反应室中发生的主要电极反应式为______.(4)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,该过程中转移电子数目为______.2.2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛.(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为______;(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:①操作Ⅰ的名称是______;操作Ⅱ为洗涤,洗涤操作的具体方法为______;②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式:______;(3)如果煅烧不充分,产品中将有FeO存在,称取3.0g氧化铁产品,溶解,在250mL 容量瓶中定容;量取25.00mL待测溶液于锥形瓶中,用酸化的0.01000mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00mL,①该实验中的KMnO4溶液需要酸化,用于酸化的酸是______(填字母序号).a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸②计算上述产品中Fe2O3的质量分数为______.3.某学习小组利用废旧电池拆解后的碳包滤渣(含MnO2、C、Hg2+等)制取硫酸锰晶体( MnSO4•H2O ),实验流程如下:已知:(1)25℃时,几种硫化物的溶度积常数如下:物质 FeS MnS HgS 溶度积 5×10-18 4.6×10-14 2×10-54(2)25℃时,几种金属氢氧化物沉淀时的PH 如下:Fe (OH )2 Fe (OH )3Mn (OH )2 开始沉淀时的PH 6.3 2.78.3 沉淀完全时的PH 8.43.7 9.8 请回答下列问题:(1)“浸取”时加热的作用是______;写出“浸取”时生成MnSO 4、Fe 2(SO 4)3 反应的离子方程式:______.(2)若“浸取”在25℃时进行,加入足量FeS ,则FeS (s )+Hg 2+(aq )⇌HgS (s )+Fe 2+ (aq )的平衡常数K 为______.(3)过滤I 过程中,需要使用的玻璃仪器有烧杯、______,滤渣I 的主要成分为FeS 、S 和______(化学式).(4)“氧化”时加入MnO 2 的作用是______,也可用H 2O 2 代替MnO 2 ,H 2O 2 的电子式为______.(5)“中和”过程,应该调节溶液PH 为______,写出该过程产生滤渣II 的离子方程式:______(6)获得MnSO 4•H 2O 的“一系列操作”是______、过滤、洗涤、干燥.(7)1150℃时,MnSO 4•H 2O 在氩气氛围中进行焙烧的分解产物是Mn 3O 4、硫的氧化物等,分解反应的化学方程式是:______,在MnSO 4•H 2O 进行焙烧时,除加热仪器外,还需要的仪器中主要成分属硅酸盐的有______.4. 草酸钴用途广泛,可用于指示剂和催化剂制备.一种利用水钴矿[主要成分为Co 2O 3,含少量Fe 2O 3、Al 2O 3、MnO 、MgO 、CaO 等]制取CoC 2O 4•2H 2O 工艺流程如图1:已知:①浸出液含有的阳离子主要有H +、Co 2+、Fe 2+、Mn 2+、Ca 2+、Mg 2+、Al 3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH 见表:沉淀物 Fe (OH )3 Fe (OH )2 Co (OH )2 Al (OH )3 Mn (OH )2完全沉淀的pH3.79.69.2 5.29.8(1)浸出过程中加入Na2SO3的目的是将______还原(填离子符号).(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为______.(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:______.(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是______;使用萃取剂适宜的pH是______.A.接近2.0 B.接近3.0 C.接近4.0(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知K sp(MgF2)=______.=7.35×10-11、K sp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)c(Ca2+)(6)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用cmol/L高锰酸钾溶液去滴定,当溶液由______(填颜色变化),共用去高锰酸钾溶液VmL(CoC2O4的摩尔质量147g/mol),计算草酸钴样品的纯度为______.5.图l表示“侯氏制碱法”工业流程,图2表示各物质的溶解度曲线.回答下列问题:(1)图中X的化学式为______ .(2)沉淀池中发生反应的化学方程式为______ ,该反应先向饱和食盐水中通入______ (填化学式)至饱和,再通入另一种气体,若顺序颠倒,后果是______ .(3)沉淀池的反应温度控制在30~35℃,原因是______ .(4)母液中加入CaO后生成Y的化学方程式为______ .(5)氯碱工业是指电解饱和食盐水,这里的碱是指______ (填化学式),其另外两种气体产物可以用于工业上制取纯硅,流程如图3:①整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应,写出该反应的化学方程式______ .②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%.则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是______ .6.Ⅰ.工业上常利用电解含有铁、钯、铜等金属的粗银棒精炼银,示意图如下:(1)阴极反应式为______。
2020年高考专题训练-工艺流程题(八)

工艺流程题(八)22.硫酸铜是一种常见的无机化合物,可形成CuSO4 .5H2O、CuSO4 .H2O等多种结晶水合物,它可用作杀菌剂,还可用于电镀和电解精炼铜。
冋答下列问题:(1)CuSO4 .5H2O的俗名是________ 。
(2)工业利用“冶炼硫酸铜”(主要成分CuSO4含少量Fe2+、AsO2-、Ca2+等杂质)提纯制备“电镀硫酸铜”(CuSO4 .H2O)的生产流程如下:溶解所用的酸最适宜的是_____ ,氧化的产物中有比H3AsO4和______,调节pH时生成固体的主要成分除FeAsO4、Fe((OH)) 3外还有______,生成FeAsO4反应的离子方程是________,操作a需经过蒸发浓缩、____、过滤、洗涤、干燥等步骤,其中洗涤的过程中常用无水乙醇,其作用是______________________。
(3)用CuSO4溶液电解精炼铜的装置如图所示,粗铜中含锌、银、铂杂质,阳极发生的电极反应式_______:目前世界正在大力开展用Cu+的络合物作电解质溶液制备纯铜的研究,电解Cu+的络合物与电解CuSO4溶液相比较,优点是________________,【答案】胆矾或蓝矾硫酸Fe2(SO4)3CaCO32H3AsO4+2Fe3++3CO32-=2FeAsO4↓+3H2O+3CO2↑冷却结晶迅速除去晶体表面的水,防止与表面的水的形成CuSO4•5H2O Zn-2e-=Zn2+Cu-2e-=Cu2+理论上制备相同质量的铜时,可以节省一半的电能【解析】【详解】(1)CuSO4•5H2O的俗名为胆矾或蓝矾;(2)因为最后制取的为电镀硫酸铜CuSO4•H2O,所以加入的酸最好为硫酸;亚铁离子能被过氧化氢氧化,所以产物中含有硫酸铁。
调节pH时加入的试剂为碳酸钠,所以溶液中的钙离子与碳酸钠反应生成碳酸钙。
调节pH时生成固体的主要成分除FeAsO4,说明铁离子和H3AsO4在碳酸根离子存在反应生成FeAsO4,同时产生二氧化碳,离子方程式为:2H3AsO4+2Fe3++3CO32-=2FeAsO4↓+3H2O+3CO2↑。
高考专项练习:工艺流程题

高考专项练习:工艺流程题1.(2020届江西省重点中学盟校高三联考)高纯MnCO 3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO 2,还含有Fe 2O 3、CaCO 3、CuO 等杂质)制取碳酸锰的流程如图所示:已知:还原焙烧主反应为2MnO 2+C2MnO +CO 2↑。
可能用到的数据如下:根据要求回答下列问题:(1)在实验室进行步骤A ,混合物应放在__________中加热;步骤C 中的滤渣为__________。
(2)步骤D 中氧化剂与还原剂的物质的量之比为__________。
(3)步骤E 中调节pH 的范围为____________,其目的是______________________________。
(4)步骤G ,温度控制在35℃以下的原因是____________________________________,若Mn 2+恰好沉淀完全时测得溶液中CO 32-的浓度为2.2×10-6mol/L ,则K sp (MnCO 3)=____________。
(5)生成的MnCO 3沉淀需经充分洗涤,检验洗涤是否干净的方法是_____________________。
(6)现用滴定法测定产品中锰元素的含量。
实验步骤:称取3.300 g 试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO 3完全转化为[Mn(PO 4)2]3-(其中NO 3-完全转化为NO 2-);加入稍过量的硫酸铵,发生反应NO 2-+NH 4+=N 2↑+2H 2O 以除去NO 2-;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L -1硫酸亚铁铵溶液,发生的反应为[Mn(PO 4)2]3-+Fe 2+=Mn 2++Fe 3++2PO 43-;用5.00 mL 0.500 mol·L -1酸性K 2Cr 2O 7溶液恰好除去过量的Fe 2+。
℃酸性K 2Cr 2O 7溶液与Fe 2+反应的离子方程式为_____________________________________。
2020届高三化学一轮复习 工艺流程题专项训练

2020届高三化学一轮复习工艺流程题专项训练1、(2019年北京顺义)以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。
已知:多数金属硫酸盐的分解温度都高于600 ℃硫去除率=(1—)×100%①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。
Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
【答案】(1)SO 2+OH−HSO3−(2)①FeS2②硫元素转化为CaSO4而留在矿粉中(3)NaAlO2 Al(OH)3(4)1∶162.(2019·河南师范大学附属中学高三月考,27)铁的化合物有广泛用途,如碳酸亚铁(FeCO 3)可作为补血剂,铁红(Fe 2O 3)可作为颜料。
利用某硫酸厂产生的烧渣(主要含Fe 2O 3、FeO ,还有一定量的SiO 2)制备FeCO 3的流程如下:(1)“酸溶”时加快反应速率的方法有________(写出一种)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020届高三工艺流程题专项训练1.立德粉ZnS·BaSO 4(也称锌钡白),是一种常用白色颜料。
回答下列问题:(1).利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。
灼烧立德粉样品时,钡的焰色为_________(填标号)。
A .黄色 B .红色 C .紫色 D .绿色(2).以重晶石(BaSO 4)为原料,可按如下工艺生产立德粉:①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。
回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO 2和一种清洁能源气体,该反应的化学方程式为______________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。
其原因是“还原料”表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为______________________。
(3).成品中S 2−的含量可以用“碘量法”测得。
称取m g 样品,置于碘量瓶中,移取25.00mL 0.1000mol·L −1的I 2−KI 溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min ,有单质硫析出。
以淀粉溶液为指示剂,过量的I 2用0.1000mol·L −1 Na 2S 2O 3溶液滴定,反应式为I 2+2223S O-=2I −+246S O -。
测定时消耗Na 2S 2O 3溶液体积V mL 。
终点颜色变化为_________________,样品中S 2−的含量为______________(写出表达式)。
2.硼酸(33H BO )是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。
一种以硼镁矿(含2252Mg B O H O ⋅、2SiO 及少量23Fe O 、23Al O )为原料生产硼酸及轻质氧化镁的工艺流程如下:回答下列问题:(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。
为检验“过滤1”后的滤液中是否含有3Fe +离子,可选用的化学试剂是_________。
(3)根据33H BO 的解离反应:332H BO +H O()-+4H +B OH ,-10a K =5.81?10,可判断33H BO 是_______酸;在“过滤2”前,将溶液pH 调节至3.5,目的是_______________。
(4)在“沉镁”中生成()32Mg OH MgCO ⋅沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。
由碱式碳酸镁制备轻质氧化镁的方法是_________。
3.磷精矿湿法制备磷酸的一种工艺流程如下:已知:磷精矿主要成分为Ca 5(PO 4)3(OH),还含有Ca 5(PO 4)3F 和有机碳等。
溶解度:Ca 5(PO 4)3(OH)<CaSO 4·0.5H 2O(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:2Ca 5(PO 4)3(OH)+3H 2O+10H 2SO 410CaSO 4·0.5H 2O+6H 3PO 4①该反应体现出酸性关系:H 3PO 4__________H 2SO 4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。
写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。
相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。
80℃后脱除率变化的原因:__________。
SO残留,原因是__________;加入BaCO3可进一步提(5)脱硫时,CaCO3稍过量,充分反应后仍有2-4高硫的脱除率,其离子方程式是__________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L−1 NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是__________。
(已知:H3PO4摩尔质量为98g·mol−1)4.以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为__________(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
已知:多数金属硫酸盐的分解温度都高于600℃硫去除率=(1-)×100%①不添加CaO 的矿粉在低于500℃焙烧时,去除的硫元素主要来源于__________。
②700℃焙烧时,添加1%CaO 的矿粉硫去除率比不添加CaO 的矿粉硫去除率低,其主要原因是__________(3)向“过滤”得到的滤液中通入过量CO 2,铝元素存在的形式由__________(填化学式)转化为__________(填化学式)(4)“过滤”得到的滤渣中含大量的Fe 2O 3。
Fe 2O 3与FeS 2混合后在缺氧条件下焙烧生成Fe 3O 4和SO 2,理论上完全反应消耗的n(FeS 2):n(Fe 2O 3)=__________5.焦亚硫酸钠(225Na S O )在医药、橡胶、印染、食品等方面应用广泛,回答下列问题: (1)生产225Na S O ,通常是由3NaHSO 过饱和溶液经结晶脱水制得,写出该过程的化学方程式_________________________________。
(2)利用烟道气中的2SO 生产225Na S O 的工艺为:①pH=4.1时,1中为__________溶液(写化学式)。
②工艺中加入23Na CO 固体,并再次充入2SO 的目的是________________________。
(3)制备225Na S O ,也可采用三室膜电解技术,装置如图所示,其中2SO 碱吸收液中含有3NaHSO 和23Na SO 。
阳极的电极反应式为__________,电解后,__________室的3NaHSO 浓度增加,将该室溶液进行结晶脱水,可得到225Na S O 。
(4)225Na S O 可用作食品的抗氧化剂。
在测定某葡萄酒中225Na S O 残留量时,取50.00mL 葡萄酒样品,用0.01000-1mol L ⋅的碘标准液滴定至终点,消耗10.00mL,滴定反应的离子方程式为__________,该样品中225Na S O 的残留量为__________-1g L ⋅ (以2SO 计)。
6.重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为23FeO Cr O ⋅,还含有硅、铝等杂质。
制备流程如图所示:回答下列问题:(1)步骤①的主要反应为:23233242322FeO Cr O +Na CO +NaNO Na CrO +Fe O +CO +NaNO −−−→⋅高温上述反应配平后23FeO Cr O ⋅与3NaNO 的系数比为___________。
该步骤不能使用陶瓷容器,原因是_______________________________________。
(2)滤渣1中含量最多的金属元素是__________,滤渣2的主要成分是__________及含硅杂质。
(3)步骤④调滤液2的pH 使之变__________(填“大”或“小”),原因是_________________________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到227K Cr O 固体。
冷却到__________(填标号)得到的227K Cr O 固体产品最多。
a.80℃b.60℃c.40℃d.10℃步骤⑤的反应类型是____________。
(5)某工厂用1m kg 铬铁矿粉(含23Cr O 40%)制备227K Cr O ,最终得到产品2m kg,产率为_____________________________。
7.Li 4Ti 5O 12和LiFePO 4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO 3,还含有少量MgO 、SiO 2等杂质)来制备,工艺流程如下:回答下列问题:(1)“酸浸”实验中,铁的浸出率结果如下图所示。
由图可知,当铁的浸出率为70%时,所采用的实验条件为_________。
(2)“酸浸”后,钛主要以24TiOCl -形式存在,写出相应反应的离子方程式___________。
(3)22TiO H O x ⋅沉淀与双氧水、氨水反应40min 所得实验结果如下表所示:分析40℃时22TiO H O x ⋅转化率最高的原因___________。
(4)2515Li Ti O 中Ti 的化合价为4+,其中过氧键的数目为___________。
(5)若“滤液②”中21(Mg )0.02mol L c +-=⋅,加入双氧水和磷酸(设溶液体积增加1倍),使3Fe +恰好沉淀完全即溶液中351(Fe ) 1.010mol L c +--=⨯⋅,此时是否有342Mg (PO )沉淀生成______________(列式计算)。
4FePO 、342Mg (PO )的sp K 分别为221.310-⨯、-241.010⨯。
(6)写出“高温煅烧②”中由4FePO 制备4LiFePO 的化学方程式____________。
8.铝是应用广泛的金属。
以铝土矿(主要成分为23Al O ,含2SiO 和23Fe O 等杂质)为原料制备铝的一种工艺流程如下:注:2SiO 在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_________________________________。
(2)向“过滤Ⅰ”所得滤液中加入3NaHCO 溶液,溶液的pH__________(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融23Al O ,电解过程中作阳极的石墨易消耗,原因是_________________________________。
(4)“电解Ⅱ”是电解23Na CO 溶液,原理如图所示。
阳极的电极反应式为__________,阴极产生的物质A 的化学式为__________。
