物理化学 2013
湖南师范大学2013年物理化学考研真题及答案

D.Δ[k2/(k1+k3)]_____0
) 1.单原子理想气体等容过程,温度从 T1 升高到 T2,则ΔH 应为( A.0 B.Cv(T2-T1) C.Cp(T2-T1) D.其他值 2.理想气体与温度为 T 的大热源接触作等温膨胀吸热 Q,所做的功是变到相同终态的最大 功的 25%,则系统的熵变为( ) A.Q/T B.0 C.-Q/T D.4Q/T 3.蔗糖可以顺利地溶解在水中,这说明固体糖与溶液中糖的化学势比较,高低如何? A.低 B.高 C.相等 D.不可比较 4.物质 A 和 B 的系统在蒸馏时可按比例形成最高恒沸混合物 E。已知纯 A 和纯 B 的沸点 之间的关系为 Tb(B)>Tb(A)。若将任意比例的 A+B 系统放入一个精馏塔中蒸馏,则在塔 釜中应得到什么物质?( ) A.纯 A B.纯 B C.恒沸混合物 E D.不一定 5.用配分函数计算热力学函数值时,若分子运动的基态能级的能量值选取不同,下列描述 中正确的是( ) A.U、H、G、A 和 Cv 的计算值都改变 B.U、H、G、A 和 S 的计算值都不变 C.只有 U、H、G、A 的计算值不变 D.只有 S 和 Cv 的计算值不变 6.蓄电池在充电和放电时的反应正好相反,则其充电和放电时电极的极性:正极和负极、 阴极和阳极的关系为( ) A.正极和负极不变,阴极和阳极不变 B.正极和负极不变,阴极和阳极相反 C.正极和负极相反,阴极和阳极不变 D.正极和负极相反,阴极和阳极相反
第 2 页 共 6 页
五、(20 分) 乙烯加氢反应的方程式为 C2H4(g)+H2(g)══C2H6(g),设反应的ΔrCp=0。 已知在 298K 时各物质的热力学数据如下表: 物质 ΔfHm /kJ·mol Smθ/J·K-1·mol-1
物理化学期末试卷A卷

1昆 明 理 工 大 学 试 卷 (A )考试科目: 物理化学 考试日期:2013. 1. 08 命题教师:物化命题小组 一、选择题 (每小题2分,共30分)1、一定量的某理想气体等容下由T 1升温到T 2,相同量的该气体等压下也由T 1升温到T 2,两个过程热量的关系和热力学能变化的关系:( ) ( A ) Q V = Q p ,∆U V = ∆U p ; ( B ) Q V < Q p ,∆U V = ∆U p ; ( C ) Q V > Q p ,∆U V < ∆U p ; ( D ) Q V < Q p ,∆U V < ∆U p 。
2、物质的量为n 的理想气体等温压缩,当压力由p 1变到p 2时,其∆G 是: ( )(A) nRT p p ln 12; (B) nRTp p p p d 12⎰; (C) Vp p ()21-; (D) nRT p p ln 213、CH 4(g)在298 K 且反应物及产物均在标准压力下完全燃烧,反应进度ξ=1 mol ,ν[CH 4(g)] =-1,放出的热为890.7 kJ ,其热化学方程式写法正确的是: ( )(A )CH 4(g)+ 2O 2(g) == CO 2(g)+ 2H 2O(l),∆r H (298 K) = -890.7 kJ ·mol -1; (B )CH 4(g)+ 2O 2(g) == CO 2(g)+ 2H 2O(g),∆r H (298 K) = -890.7 kJ ·mol -1; (C )CH 4(g)+ 2O 2(g) == CO 2(g)+ 2H 2O(l),∆r H (298 K) = 890.7 kJ ·mol -1; (D )CH 4(g)+ 2O 2(g) == CO 2(g)+ 2H 2O(g),∆r H (g) = 890.7 kJ ·mol -14、一封闭系统,当状态从A 到B 发生变化时,经历了两条任意不同的途径,则下列四式正确的是: ( ) ( A ) Q 1 = Q 2; ( B ) W 1 = W 2; ( C ) Q 1 +W 1 = W 2 +Q 2; ( D ) Q 1 -W 1 = W 2 -Q 2。
2013年华南理工物化二考研试题及参考答案(工科)-完整

(5 分)
/ RT 代入得 将 ln K r Gm
ln K {r H m (298K) r C p ,m (T 298K) T [r Sm (298K) r C p ,m ln(T / 298K)]} / RT
将数值代入有:
(298K) +4.0*ln(457.4/298)]}/(8.315*457.4) ln0.36=-{61500+4.0*(457.4-298)-457.4*[ r Sm
3. 固态和液态 UF4 的蒸气压与温度的关系分别为: ln[p(s)/Pa]=41.67-(10.017× 103 K)/T ln[p( l ) /Pa]=29.43-(5.900× 103 K)/T (1) 试计算 UF4 三相点的温度和压力; (2) 求 UF4 的正常沸点; (3) 计算 UF4 三相点的摩尔熔化热及摩尔熔化熵; (4) 计算由 UF4 三相点温度增加 0.012 K 时,其压力变化多少? 假设 1 mol 液态 UF4 的体积比固体大 0.0091dm3。 3. [解]:(1) 41.67-10.017 10 K/T=29.43-5.900 10 K/T
5. 将氯苯用水蒸气蒸馏提纯,在 100kPa 压力下进行,冷凝后的水和氯苯完全不互溶,已知该 系统的共沸点为 92℃,氯苯在共沸点下的蒸气压为 29 kPa。试解决下列问题: (1) 气相中氯苯的组成; (2) 欲蒸出 100 kg 纯氯苯,需要消耗多少水蒸气?氯苯的摩尔质量为 112.5 g·mol 1。(10 分)
(4 分) (2 分)
=RT2[dln(p(l)/Pa)]/dT=49.05 kJ· mol-1 kJ· mol-1 (6 分)
subHm fusHm fusSm
2013年初三练兵物理化学

2013年学业水平阶段性调研测试物理、化学试题本试题分第1卷(选择题)和第II卷(非选择题)两部分。
第Ⅰ卷共6页,满分为56分;第Ⅱ卷共8页,满分为94分。
本试题共14页,满分为150分,考试时间为120分钟。
答卷前,请考生务必将自己的姓名、准考证号、座号、考试科目涂写在答题卡上,并同时将考点、姓名、准考证号、座号填写在试卷规定的位置。
第Ⅰ卷(选择题共56分)注意事项:1. 第1卷为选择题,每小题选出答案后,用2B铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号,答案写在试卷上无效。
2. 本考试不允许使用计算器。
一、单项选择题(本大题共22个小题,每小题2分,共44分。
每小题给出的四个选项中,只有一个选项最符合题目的要求)【化学部分】可能用到的相对原子质量:H:1 C:12 Ca:40 O:16 Na:23 S:32 Cl:35.5 Cu:64 1.下列常见的变化属于物理变化的是2.日常生活安全问题一直得到人们的关注,用你所学的化学知识判断下列做法合理的是A.生病禽类加工后食用 B.蔬菜浸泡甲醛溶液来保鲜C.燃气泄漏后可以用火机检验泄露点D.油锅着火可以用锅盖盖灭3.保护环境,创造美丽家园,是我们每个人的责任,下列做法中,与倡导不相符的是A.工业废水处理达标后再排放B.推广使用一次性木筷和纸杯C.提倡使用无磷洗衣粉D.使用节能灯泡,提倡节约用电4.右图1是某粒子的结构示意图,下列说法中不.正确..的是A.该元素的原子核外有2个电子层B.该粒子是阳离子C.该元素是一种金属元素D.该粒子具有稳定结构5. 化学实验操作过程中我们必须要具备安全意识,注意安全,下列实验操作正确的是A.实验室里可以随意品尝药品的味道B.点燃氢气前先检验其纯度C.将水直接加入浓硫酸中进行稀释D.酒精灯倾翻着火要立刻用水扑灭6.某一化学反应的微观示意图如下,请根据所学的知识判断以下说法错误的是A. 该反应中A和B元素都有两种化合价B. 该反应一定遵守质量守恒定律C. 丙的化学式中A和B原子之比为1:3D. 该反应中电子总数没有变化7.某同学在探究金属活泼性比较试验时,实验过程和现象如下图所示,据此该同学得到如下结论,正确的是A.滤渣A中一定含有铜 B.滤渣A中含有铜和银C.滤液B中只含有硝酸锌D.白色沉淀C是氯化银8.请通过对化学知识的认识,判断下列说法中正确的是A.酸中都含有氢元素,所以含有氢元素的化合物一定是酸B.草木灰和铵态氮肥混合使用肥效更高C.测定溶液的pH,先用水润湿pH试纸,然后将试纸插入待测液中D.长期露置于空气中的固体氢氧化钠,其成分会发生变化9.物质的鉴别有时候不止一种办法,下表是某同学采用不同的办法进行物质鉴别,其中有错误的是10.除去下列物质中混有的少量杂质(括号内为杂质),合理的是A.NaCl溶液(Na2CO3):加入稀硫酸至不再产生气泡B.H2(CO2、H2O):先通过氢氧化钠溶液再通过浓硫酸C.FeSO4溶液(CuSO4):加入过量锌粉、过滤D.H2SO4溶液(HCl):加入AgNO3溶液,过滤11.现有8.9gCuO和Cu (OH)2组成的固体混合物,加入100g 9.8%的稀H2SO4充分反应后,所得溶液的pH=7,形成不饱和溶液。
物理化学实验复习题20131215

物理化学实验复习题考试要求:(闭卷考试时间120分钟,成绩占30%)每位同学需准备:钢笔、铅笔、直尺、固体胶及大于12×12格的坐标纸。
以下复习内容涵盖的知识点,你认为已用到的会考的加强记忆,没用到的帮助你了解,将来会用到。
没有百分之百的正确,应有百分之百的努力,一起加油!1.实验室常用的气体钢瓶颜色分别是:N2瓶黑色, H2瓶绿色, O2瓶蓝色。
2.开启气体钢瓶的操作顺序是:反时针旋松减压旋杆、开启高压气阀、观测高压表读数、顺时针旋紧减压器旋杆、观测低压表读数。
3.用热分析法测绘锡—铋二组分合金相图。
为了测定系统的温度随时间变化,可选用的温度计是:热电偶。
4.在二元合金相图绘制的实验中,选择了具有低共熔点的铅锡物系,已知纯铅和纯锡的熔点分别为327℃及232℃,则比较合适的测温元件为:镍铬-镍硅热电偶。
5.为测定物质在600~100℃间的高温热容,首先要精确测量物系的温度。
此时测温元件宜选用:铂-铑热电偶。
某体系的温度约为1500℃,欲测量该体系的温度,需选用:铂-铂铑热电偶温度计。
6.用热电偶温度计测温时,热电偶的冷端要求放臵在:只要温度恒定的任一方便的温度即可。
为保证温度测定的可靠性,措施之一是热电偶的冷端应臵于:冰和水共存的杜瓦瓶中。
7.饱和标准电池在20℃时电动势为:1.01845 V 。
8.用一支规格为0─5°变化范围的Beckman温度计,来测定18℃附近的温度,为了使18℃时Beckman温度计的水银柱指示刻度为4℃左右,则用来调节此Beckman温度计的水的温度最好是:22 ℃。
9.为测定大分子溶液中大分子化合物的平均摩尔质量,方法有:渗透压法、光散射法、粘度法。
常利用稀溶液的依数性来测定溶质的摩尔质量,其中最常用来测定高分子溶质摩尔质量的是:渗透压。
10.研究不溶性表面膜的最有用的工具是:兰缪尔膜天平。
11.实验时应尽量少与有致癌变性能的化学物质(苯、四氯化碳、氯仿等溶剂)接触,所以实验时通常用甲苯代替苯,用二氯甲烷代替四氯化碳和氯仿。
物理化学之化学热力学(2013初赛)

50 10
1280Pa
假设亨利定律适用于血液中的乙醇溶液,我们得到: 104=k×4.5×10-3 所以,人的血液中乙醇的重量百分含量是:
4 .5 1 0 10
4 3
1 2 8 0 1 0 0= 0 .0 5 8
因此此人是法定的酒醉。
亨利定律应用
3.当潜水员上升到水面时,氮的溶解度降低,血液 中形成氮气泡,使潜水员发生“潜函病”。假设氮 在血液中的溶解度同水中的相同,一个人体内含有3 公斤血,问:当他从20℃约60米深的淡水中急速地 上升时,在他的血液中形成的氮气泡的体积有多大? 血液的温度约为40℃;在40℃下,总压力(N2+H2O) 为1大气压时,N 2 的溶解度为每公斤水1.39×10 -5 公 斤N2。在计算中我们把水蒸汽压(≈0.07大气压)的 影响忽略不计,20℃时60米水柱所施加的压力是:
13
m
= 8 .5 7 1 0
dm
3
理想气体状态方程和道尔顿定律应用
1升气体含有的分子数为
N 10
5
1 0
3
8 .3 1 4 2 9 3
6 .0 2 3 1 0
23
= 2 .4 7 1 0
22
另一个人每吸入的 一口气中含有的分 子数为
N1
2 .4 7 1 0 8 .5 7 1 0
$ 用符号 c H m (物质、相态、温度)表示。
•下标“c”表示combustion。 •上标“”表示各物均处于标准压力下。 •下标“m”表示反应进度为1 mol时。
基本定律——热力学第一定律
化学反应的焓变值等于各反应物燃烧焓的总和 减去各产物燃烧焓的总和。 用通式表示为:
中科院大学 2013硕士研究生物理化学乙真题

(B) 2
(C) 3
(D)4
11. 对相图中的“结线”理解不正确的是:
(A) 在二元体系中结线一定是一条平行于横轴的水平线
(B) 从物系点到结线两端的长度比,代表了该条件下两平衡相所含物质的数 量比
(C) 结线的长度代表了某一平衡相的质量或物质的量分数
(D) 在定压相图中,温度不同时其结线的长度一般也就不同
5. 对于理想液体混合物:
(A) ΔmixH = 0,ΔmixS = 0
(B) ΔmixH = 0,ΔmixG = 0
(C) ΔmixV = 0,ΔmixH = 0
(D) ΔmixV = 0,ΔmixS = 0
6. 97.11℃时,x(乙醇)=0.012 时的乙醇水溶液,总蒸气压 P 为 101325 Pa,该 温度下纯水饱和蒸气压为 91293.8 Pa,当温度不变,x(乙醇)=0.02 时,下列 各式错误的是:
的 ΔGr
θ m
为
:
(A) 14.39 kJ
(B) 15.92 kJ (C) -15.92 kJ (D) -31.83 kJ
10.FeCl3 和 H2O 形成四种水合物:FeCl3·6 H2O,2FeCl3·3 H2O,2FeCl3·5 H2O, FeCl3·2H2O,这个系统的组分数(独立)是:
(A) 1
16. 在 Hittorf 法测迁移数的实验中,用 Ag 电极电解 AgNO3 溶液,测出在阳极
区 AgNO3 的浓度增加了 x mol,而串联在电路中的 Ag 库仑计上有 y mol 的 Ag 析出,则 Ag+离子迁移数为:
(A) x/y
(B) y/x
(C) (x-y)/x
(D) (y-x)/y
《物理化学》2012-2013学年2学期考试卷答案
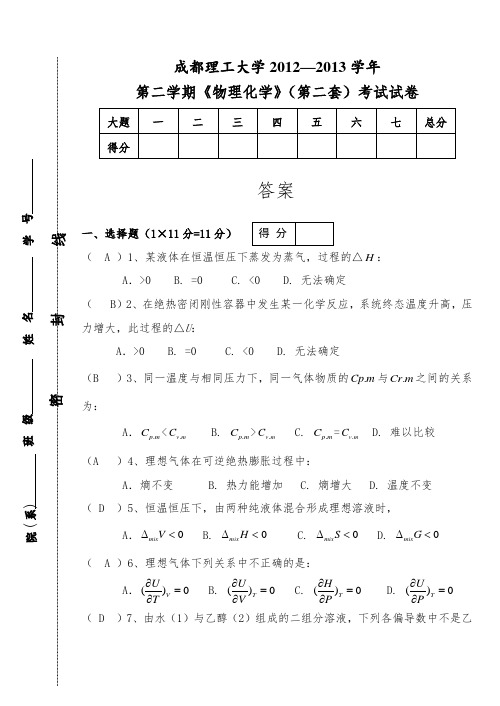
成都理工大学2012—2013学年 第二学期《物理化学》(第二套)考试试卷答案一、选择题(1×11分=11分)( A )1、某液体在恒温恒压下蒸发为蒸气,过程的△H :A .>0 B. =0 C. <0 D. 无法确定( B )2、在绝热密闭刚性容器中发生某一化学反应,系统终态温度升高,压力增大,此过程的△U :A .>0 B. =0 C. <0 D. 无法确定(B )3、同一温度与相同压力下,同一气体物质的.Cp m 与.Cr m 之间的关系为:A ..p m C <.v m C B. .p m C >.v m C C. .p m C =.v m C D. 难以比较(A )4、理想气体在可逆绝热膨胀过程中:A .熵不变B. 热力能增加C.熵增大 D. 温度不变(D )5、恒温恒压下,由两种纯液体混合形成理想溶液时,A.0mix V∆<B. 0mix H ∆<C. 0mix S ∆<D. 0mix G ∆<( A )6、理想气体下列关系中不正确的是:A .()0V U T ∂=∂ B. ()0T U V ∂=∂ C. ()0T H P ∂=∂ D. ()0T UP∂=∂ ( D )7、由水(1)与乙醇(2)组成的二组分溶液,下列各偏导数中不是乙得 分醇化学势的有:A .1,,2()S P n H n ∂∂ B. 1,,2()T P n G n ∂∂ C. 1,,2()T V n A n ∂∂ D. 1,,2()T P n U n ∂∂ ( A )8、在某一温度下,由纯A 与纯B 形成理想态混合物。
已知**AB P P <,当气液两相平衡时,气相组成B y 与该相组成B x 关系为:A .B y >B x B. B y <B x C. B y =B x D. 无法判断( C )9、将固体42()NH HCO s 放入真空容器中,恒温到400k ,43NH HCO 按下式分解并达平衡:43()NH HCO s 322()()NH H O g CO g +(g )+,体系的组分数C 和自由度F 为:A .C=2,F=1 B. C=2,F=2 C. C=1,F=0 D. C=3,F=2( C )10、某连串反应A →B →C ,实验测得B 非常活泼,当反应稳定后,则B 的生成速率与B 的消耗速率关系为:A .> B. < C. = D. 无法确定( D )11、对行反应A 11k k - B ;当温度一定时由A 开始,下列说法中是不对的:A .开始时A 的消耗速率最快 B. 反应的净速率是正逆二向反应速率之差 C. 11/k k -的值是恒定的D. 平衡时正逆二向速率常数相等二、填空题(20×0.5=10分)1、封闭系统由一始态出发,经历一循环过程,过程的U ∆ =0 ;H ∆得 分=0 ;Q 与W 的关系是 Q=-W ,但Q 与W 的具体数值 无法确定 ,因为 不知具体途径 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京科技大学2013年硕士学位研究生入学考试试题============================================================================================================= 试题编号: 627 试题名称:物理化学B (共 5 页)适用专业:化学说明: 1.所有答案必须写在答题纸上,做在试题或草稿纸上无效。
2.符号$在右上角表示标准态, 例如p$表示一个标准压力100kPa. E$表示标准电动势等。
=============================================================================================================一、选择题( 共15题,每题2分共30分)1. 下述体系中的组分B,选择假想标准态的是:( )(A)理想溶液中的组分B; (B)理想混合气体中的组分B(C)非理想溶液中的溶剂; (D)稀溶液中的溶质B2. 将某理想气体从温度T1加热到T2。
若此变化为非恒压过程,则其焓变ΔH应为何值? ( )(A) ΔH=0 (B) ΔH=C p(T2-T1)(C) ΔH不存在(D) ΔH等于其它值3. 已知在373 K时,液体A的饱和蒸气压为66 662 Pa,液体B的饱和蒸气压为1.01 325×105 Pa,设A和B构成理想液体混合物,则当A在溶液中的物质的量分数为0.5 时,气相中A的物质的量分数应为:( )(A) 0.200;(B) 0.300;(C) 0.397;(D) 0.6034. 在温度T时,纯液体A 的饱和蒸气压为p A*,化学势为μA*,并且已知在p$压力下的凝固点为T f*,当 A 中溶入少量与 A 不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为p A,μ A,T f ,则( )(A) p A*< p A, μA*<μA,T f* < T f;(B) p A*> p A, μA*<μA,T f* < T f(C) p A*< p A, μA*<μA,T f* > T f;(D) p A*> p A, μA*>μA,T f* > T f5. 有下述陈述(1) 溶液的化学势等于溶液中各组分的化学势之和(2) 对于纯组分,则化学势等于其摩尔Gibbs自由能(3) 理想溶液各组分在其全部浓度范围内服从Henry定律(4) 理想溶液各组分在其全部浓度范围内服从Raoult定律上述诸说法正确的是:( )(A) (1),(2);(B) (2),(3);(C) (2),(4);(D) (3),(4)6. 如图,在绝热盛水容器中,浸有电阻丝,通以电流一段时间,如以电阻丝为体系,则上述过程的Q 、W 和体系的ΔU 值的符号为: ( )(A) W = 0, Q < 0, ΔU < 0; (B) W < 0, Q < 0, ΔU > 0(C) W = 0, Q > 0, ΔU > 0; (D )W < 0, Q = 0, ΔU > 07. 节流过程中,下述说法正确的是 ( )(A )内能不变,压力减少; (B )焓不变,压力减少;(C )吉布斯自由能不变,压力不变;(D )焓不变,压力增加。
8. 当把金属铅插入下列四组溶液中,有可能置换出金属锡的是: ( )(A) 2+Sn a = 1.0, 2+Pb a = 0.1;(B) 2+Sn a = 1.0, 2+Pb a = 1.0;(C) 2+Sn a = 0.1, 2+Pb a = 1.0 ;(D) 2+Sn a = 0.5, 2+Pb a = 0.59. CuSO 4与水可生成CuSO 4ּH 2O,CuSO 4ּ3H 2O,CuSO 4 5H 2O 三种水合物,则在一定温度下与水蒸气平衡的含水盐最多为: ( )(A) 3种; (B) 2种; (C) 1种; (D) 不可能有共存的含水盐10. 对于 E $=[RT /(zF )] ln K $ 一式,正确理解是 : ( )(A) 表示电池内各物都处于标准态; (B) 表示电池反应已达平衡;(C) 表示电池内部各物都处于标准态且反应已达平衡;(D) E $与K $仅在数值上满足上述关系,两者所处状态并不相同。
11. 恒沸混合物在气、液两相平衡共存时的自由度为: ( )(A)0 (B)1 (C)2 (D)312. CaCO 3(s),CaO(s),BaCO 3(s),BaO(s)及CO 2(g)构成的一个平衡物系,其组分为: ( )(A) 2; (B) 3; (C) 4; (D) 5。
13. 水与苯胺的最高临界溶点温度为T 。
在某工艺中需用水萃取苯胺中的某物质时,操作的最佳温度应该是: ( )(A)T > T 0; (B)T < T 0; (C)T = T 0; (D)视具体情况而定。
14. 在其它条件不变时,电解质溶液的摩尔电导率随溶液浓度的增加而 ( )(A) 增大; (B) 减小; (C) 先增后减; (D) 不变15. 碘的三相点处在115℃和12 kPa上,这意味着液态碘:( )(A) 比固态碘密度大;(B) 在115℃以上不能存在;(C) 在p$压力下不能存在;(D) 不能有低于12 kPa的蒸气压。
二、填空题(14题,除第1和5题3分外,其余每题2分共30分)$(298 K)<0。
若此反应在恒容绝热器中1. 反应C(s)+O2(g) −−→CO2(g)的Δr Hm进行,则该体系的ΔT 零,ΔU零,ΔH零。
(填:大于,等于,小于)2. 对实际气体,由于分子间存在吸引力,当温度不变时,气体的体积增加,则其内能。
(填:增加,不变,减少)3. 当液体A溶解在液体B中时,发现液体A的偏摩尔体积比纯液体A的摩尔体积要大,则增加压力时,液体A在液体B中的溶解度。
(填:增加,不变,减少)4. 将A,B两种气体以1:2的比例封入一真空容器,反应A(g)+2B(g)=C(g) 为吸热反应,300℃下平衡时系统的总压力为p1,在500℃下平衡时总压力为p2,则p1____ p2 (填:大于,小于,等于)。
5. 采用32P标记的五氯化磷t1/2为14.3 天, 经___________天后, 放射性衰变到起始值的1/1000。
O2(g)设计成电池的表示式为:______________ 6. 将反应Ag2O(s) = 2Ag(s) + 12____________________________________________________________。
7. 平行反应的总速率是所有平行发生的反应速率的____________________。
其决速步是平行反应中反应速率最(填:快,慢)的一个。
8. 在101 325 Pa压力下,I2在液态水和CCl4中溶解分配达平衡。
该平衡体系的自由度为,其可变量是。
9. 经验规则“温度每增加10 K, 反应速率增加2 倍”。
在T1=298 K 和T2=308K 时,符合这规则的活化能值E a=___________________。
10. 电池: Pt│H2(p$)‖HCl(γ±, m)│Hg2Cl2│Hg│Pt根据能斯特公式其电动势E = _______________,得到lgγ±=_____________ 。
11. 指出下列平衡体系的独立组分数:(1);(2)(1)NaCl(s)、HCl(l)、H2O(l)的饱和水溶液。
(2)H2、石墨,催化剂,生成n种碳氢化合物所组成的化学平衡体系。
12. 一级相变特点:(1)物质在二相中的化学势;(2)物质在二相中的化学势对温度或压力的一级偏微商。
(填“相等”或“不等”)13. 分别用反应物和生成物表示反应A+3B=2C 的反应速率, 并写出它们间关系为:。
14. 298 K 时,电池反应Ag(s)+12Hg2Cl2(s)=AgCl(s)+Hg(l) 所对应的∆r S m=32.9 J·K-1·mol-1,电池电动势为0.0193 V,则相同反应进度时∆r H m=,(∂E/∂T)p=______________。
三、计算题(7题,每题10分共70分)1. 某物质有α和β两种晶型。
25℃时α和β型的标准摩尔生成热分别为-200.0和-1980 kJ⋅mol-1。
标准摩尔熵分别为70.0和71.5 J⋅K-1⋅mol-1。
它们都能溶于CS2中,α在CS2中溶解度为10.0 mol⋅kg-1。
假定α,β溶解后活度系数皆为1。
(1) 求25℃,由α型转化为β型的ΔGm$;(2) 求25℃,β型在CS2中的溶解度(mol⋅kg-1)。
2. 一定量的H2O(l) 置一钢瓶中(V= 5 dm3),用O2气加压至 2.53×108 Pa。
已知293 K 时O2在水中溶解的亨利常数为3.93×109 Pa。
(1) 计算O2在水中的物质的量分数;(2) 293 K时,水的正常蒸气压为2.67×103 Pa,计算溶液上方水的蒸气压;(3) 如果实测得液面上水的蒸气压为2.45×103 Pa,计算溶液中水的活度系数。
(以纯水为标准态)3. 在温度为298 K 的恒温浴中,一理想气体发生不可逆膨胀过程。
过程中环境对体系做功为 3.5 kJ,到达终态时体积为始态的10倍。
求此过程的Q,W及气体的ΔU,ΔH,ΔS,ΔG,ΔA。
4. 1 mol O2克服101.325 kPa 的恒定外压下作绝热膨胀,直到达到平衡为止,初始温度为200℃,初始体积为20 dm3,假定氧气为理想气体,C V, m= (5/2)R。
试计算氧气膨胀过程中的Q, W, ΔU,ΔH,ΔS。
5. 气相反应2NO2+ F2→ 2NO2F,当2 mol NO2和 3 mol F2在400 dm3的反应釜中混合,已知300 K 时,k = 38 dm3·mol-1·s-1,反应速率方程为:r = k[NO2][F2]。
试计算反应10 s 后,NO2 ,F2,NO2F 在反应釜中物质的量。
6. 将正丁醇蒸气在298.15 K时慢慢加压,当开始形成半径为1×10-9 m的微小液滴时,蒸气压力为多大?已知正丁醇的正常沸点为390 K,Δvap H m=43.822 kJ·mol-1,298.15 K时正丁醇的密度ρ=806 kg·m-3,表面张力γ=0.0261 N·m-1。
