浓硫酸讲义工业制法
硫酸的工业制法PPT课件

照片
.
9
吸收塔
吸
收
塔
.
10
沸腾炉照片
沸 腾 炉
.
11
接触室照片
接
触
室
.
12
• 一、造气 1.原料 接触法制硫酸可以用硫黄、黄铁矿、石膏、有色金属
冶炼厂的烟气(含有一定量的SO2)等作原料。
从原料成本、环境保护等角度考虑,硫黄是制硫酸的 首选材料。我国由于硫黄矿产资源较少,主要用黄铁矿作 原料。
②二氧化硫的催化氧化
S+O2 点燃 SO2
4FeS2+11O2 高温 2Fe2O3+8SO2
催化剂
2SO2+O2
2SO3
③三氧化硫的吸收
SO3 +H2O → H2SO4
.
3
.
4
.
5
硫酸的工业生产 硫酸工业生产流程动画
沸腾炉
接触室
吸收塔
净 化
冷却
.
6
.
7
沸腾炉
沸 腾 炉
照片
.
8
接触室
接
触
室
.
34
.
35
• 进入接触室的SO2和O2需要加热,而接触 氧化生成SO3时放出热量,反应环境温度 会不断升高,用热交换器将这些热量来 预热SO2和O2反应。
.
36
为什么要换热?
• 由于接触氧化是一个放热反应,要想 增大SO2的转化率、提高SO3的产率,平 衡要向正反应方向移动,根据平衡移动 理论,高温不利于SO3的生成,所以装一 个热交换器可用来把反应生成的热传给 需预热的炉气。
生产设备 沸腾炉
.
16
黄铁矿 空气
SO2、O2、 N2
硫酸的工业制法
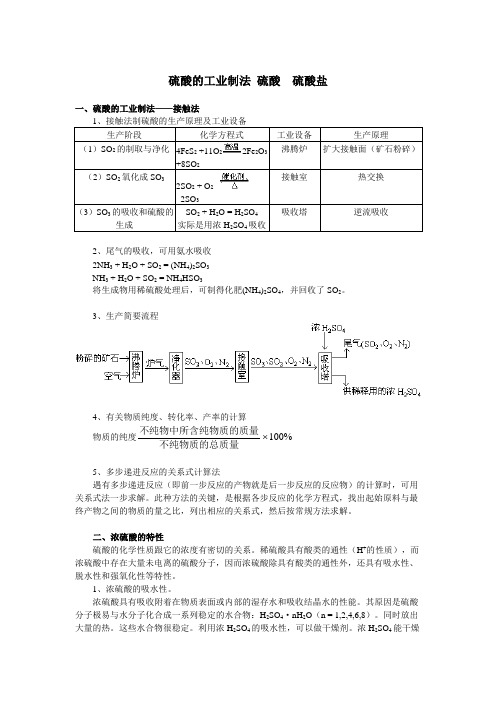
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
硫酸的工业制法
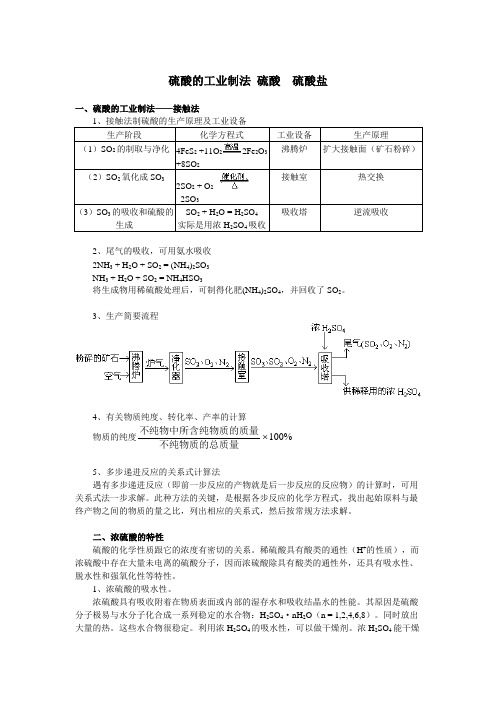
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
【高中化学】硫酸的工业制法PPT课件

原理一、提高原料转化率原理
1、增大反应物的浓度。根据勒夏特列原理,对于达到平衡后的可逆
反应,在其他条件不变时,增大一种反应物的浓度,可使平衡向正反 应方向移动,从而可以提高另一种反应物的转化率。在实际生产中,
常使反应中原料较易得到、价钱比较便宜的反应物的浓度超过反应所
需要的量,从而能提高较贵重原料的利用率。如煅烧黄铁矿制硫酸时, 采用通入过量空气的方法使黄铁矿充分燃烧。 2、逆流吸收原理。用98.3%的浓硫酸吸收时,液体和气体的流向是 相反的,液体自上而下,气体自下而上,使吸收更完全。在热交换中, 冷的和热的气体(或液体),都是采用逆流的方法进行热量交换的。
原理四、经济效益最高原理
LOGO
1、热能充分利用原理。硫酸生产过程中三个主要反应都是放
热的,可在制硫酸的工厂设置锅炉来加热水,用生成的水蒸气
发电。在接触氧化时用放出的热量来预热未起反应的空气。
2、循环原理。许多化学反应是可逆的,为了提高原料的利用
率,化学工业上一般把未起反应的原料分离出来再循环使用,
1、脱水性:可被浓硫酸脱水的物质一般为含 氢、氧元素的有机物,其中蔗糖、木屑、纸 屑和棉花等物质中的有机物,被脱水后生成 了黑色的炭(炭化)。 如C12H22O11===12C + 11H2O
2.吸水性: 就硫酸而言,吸水性有很多用处,比如 很多的气体都可以用浓硫酸来干燥。它是 良好的干燥剂。 这个与脱水性有很大的不 同:脱水性一般反应前没有水,而是H、O 元素以个数比2:1的形式形成水,从有机 物中出来。 除此之外浓硫酸还具有难挥发性(高沸点 )、酸性和稳定性。
如用接触法制取中把未反应的(不能排放到空气中)加以回收
再通入接触室中继续参加反应,以保证原料的充分利用。
硫酸的工业制备 浓硫酸的性质课件

净
化 冷却
工业接触法制硫酸小结
S
硫化物如
SO2
SO3
FeS2 SO2的制取和 净化
SO2转化成SO3
H2SO4
吸收SO3生成 硫酸
4FeS2+沸11腾O2炉=高=温 2Fe2O3+8SO2
接触室
吸收塔
2SO2+O2 催化△剂2SO3 SO3+H2O==H2SO4
问题解决
阅读课本并思考:化工产业中为什么用硫铁矿制 浓硫酸,而不用硫黄制酸法?化工生产中需要考虑那 些实际问题?
酸性、脱水性
d 把木屑放入浓硫酸中,变黑,__脱__水__性__
e 铜与浓硫酸反应
酸性__、___氧__化__性
C + 2H2SO4(浓)△=CO2↑+2SO2↑+2H2O
结论: 浓硫酸具有_脱___水__性__
问题解决 吸水性和脱水性有何区别 ? 吸水性
是指浓硫酸吸收水、水蒸气或结晶水的性质。 脱水性
是指浓硫酸把有机物中的氢氧元素按原子个数 比2:1脱去水的性质。
关键看:是否有“现成”的水。
(三)浓硫酸的特性
【思考】稀释浓硫酸应特别注意: ① 将浓硫酸加入水中 ;② 边加边搅拌 。
(三)浓硫酸的特性
实验1:向表面皿中加入少量胆 矾,再加入约3ml的浓硫酸,搅 拌,观察实验现象。
现象:由蓝色晶体变为白色粉末
原因: 浓硫酸中存在的主要是硫酸分子, CuSO因4·5而H浓2O硫浓酸硫酸具有Cu一SO些4 独特的性质。
3、浓硫酸的作用: _体__现_ 酸性和氧化性 4、C + 2H2SO4(浓△)=CO2↑+2SO2↑+2H2O 浓硫酸的 作用: 只体现氧化性
高三研讨会课件:硫酸及工业制法PPT

实验室制 乙烯
实验室制 乙酸乙酯
【问题探究】
三位同学设计了下述三个实验方案,并都认为 如果观察到的现象和自己的设计方案一致,
即可证明试液中存在SO42:
方案甲 :试液 BaCl2溶液 白色沉淀 足量稀HCl
沉淀不溶解
方案乙 :试液 足量稀HCl
无沉淀
BaCl2溶液
白色沉淀
方案丙 :试液 足量稀HNO3
A、小试管内液体分成两层, 上层蓝色,下层无色
B、U型管内左边液面下降, 右边液面升高
C、有少量白色固体析出 D、以上现象都没有,无明显现象
( ABC)
一.硫酸
1.纯净的硫酸是一种 无 色 油 状液 体, 密度比水 大 。硫酸是一种难挥发 的强酸,
易 溶于水,能以任意 比与水混溶。浓硫酸
溶于水放出大量的热,稀
HCOOH 浓H2SO4 CO+H2O
下列哪些气体可以用浓硫酸干燥,哪些不可以,为什么?
NH3、H2S、HBr、HI 、 O2、H2、CO、Cl2、HCl、SO2、CO2、CH4
1 脱水性
浓硫酸
C6H12O6
6C+6H2O
浓硫酸
HCOOH
CO+H2O
2 吸水性
3
强氧化 性
C+2H2SO4(浓)△==
思考:
酸性和不挥发性 用于实验室制HCl 、HNO3
通常配制酸性KMnO4溶液,用什么酸酸化? 实验室如何配制FeSO4、Fe2(SO4)3溶液? 铅蓄电池的工作介质?
硫酸酸性介质
8 催化剂
淀粉水解
制葡萄糖
9 催化剂 脱水性
10 催化剂 吸水性
浓硫酸
C2H5OH 170℃ C2H4+H2O
硫酸的制备和性质课件

硫 酸 亚 铁
FeSO4·7H2O 绿矾
(1)医疗上用于生产防治缺铁性贫血的药剂; (2)工业上用于生成铁系列净水剂和铁红颜 料。
四、硫酸的用途
硫酸在下列用途或反应中各表现的性质是:
A.酸性 B.吸水性C.脱水性D.强氧化性
(1)实验室制取氢气; A (2)可用作H2、SO2、Cl2等气体的干燥剂; B (3)铝制容器可盛放浓硫酸; D (4)浓硫酸能使湿润的蓝色石蕊试纸变红,后 来又变黑; AC (5)浓硫酸与金属铜加热反应; AD
参考答案:
1.(1)冷的浓硫酸能使铁钝化,所以可将浓 硫酸密闭在铁罐中。铁罐出口处腐蚀严重,说 明浓硫酸具有吸水性。 (2)稀硫酸与铁反应生成氢气,有火源可能引 起爆炸。 (3)浓硫酸的强腐蚀性。 (4)洒石灰。
2、不慎将浓硫酸洒在皮肤上,正确的处理方 法是( C )
A、立即用大量水冲洗
B、立即用适量碱中和 C、立即用干布擦拭,再用大量水冲洗,再涂抹碳 酸氢钠
问:怎样鉴别浓硫酸和稀硫酸? 观察状态,油状粘稠的液体是浓硫酸 根据密度,等体积的液体较重的是浓硫酸 溶于水,放出大量热的是浓硫酸。
各取少许加入蔗糖中,能使蔗糖脱水碳化的是浓硫酸 加铜片并加热,产生气体的是浓硫酸;无现象的是稀硫酸 加铁钉,使之钝化的是浓硫酸;有气体生成的是稀硫酸 蓝色石蕊试纸先变红后变黑的是浓硫酸;只变红是稀硫酸
三、硫酸盐
俗称
用途
硫 酸 钙
CaSO4·2H2O 生石膏 2CaSO4·H2O 熟石膏
(1)制做各种模型 (2)医疗上用作石膏绷带 (3)加在水泥中调节凝结时间
硫 酸 钡
BaSO4 重晶 石
(1)是制造其他钡盐的原料 (2)医疗上用硫酸钡作“钡餐”的原因 :
浓硫酸工业制法19页PPT

END
浓硫酸工业制法
26、机遇对于有准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 量泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
16、业余生活要有意义,ቤተ መጻሕፍቲ ባይዱ要越轨。——华盛顿 17、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云 19、自己活着,就是为了使别人过得更美好。——雷锋 20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃
