(2010-2019)十年高考化学真题分类汇编专题09 化学能与热能(学生版)
2010-2019十年高考题汇编(2)热学2

2010-2019十年高考题汇编(二)——热学1.2018·新课标I卷·T13)如图,一定质量的理想气体从状态a开始,经历过程①、②、③、④到达状态e,对此气体,下列说法正确的是( )A.过程①中气体的压强逐渐减小B.过程②中气体对外界做正功C.过程④中气体从外界吸收了热量D.状态c、d的内能相等E.状态d的压强比状态b的压强小2.(2019•海南卷•T15)一定量的理想气体从状态M出发,经状态N、P、Q回到状态M,完成一个循环。
从M到N、从P到Q是等温过程;从N到P、从Q到M是等容过程;其体积-温度图像(V-T图)如图所示。
下列说法正确的是()A.从M到N是吸热过程B.从N到P是吸热过程C.从P到Q气体对外界做功D.从Q到M是气体对外界做功E.从Q到M气体的内能减少3.(2019•江苏卷•T17)如图所示,一定质量理想气体经历A→B的等压过程,B→C的绝热过程(气体与外界无热量交换),其中B→C过程中内能减少900J.求A→B→C过程中气体对外界做的总功。
.4.(2014·广东卷)用密封性好、充满气体的塑料袋包裹易碎品,如图所示。
充气袋四周被挤压时,假设袋内气体与外界无热交换,则袋内气体A.体积减小,内能增大B.体积减小,压强减小C.对外界做负功,内能增大D.对外界做正功,压强减小5.(2014·上海卷·T10)如图,竖直放置、开口向下的试管内用水银封闭一段气体,若试管自由下落,管内气体()A.压强增大,体积增大B.压强增大,体积减小C.压强减小,体积增大D.压强减小,体积减小6.(2015·上海卷·T9)如图,长为h的水银柱将上端封闭的玻璃管内气体分割成两部分,A处管内外水银面相平。
将玻璃管缓慢向上提升H高度(管下端未离开水银面),上下两部分气体的压强发生变化分别为△p1和△p2,体积变化分别为△V1和△V2。
已知水银密度为ρ,玻璃管截面积为S,则( )A.△p2一定等于△p1B.△V2一定等于△V1C.△p2与△p1之差为ghD.△V2与△V1之和为HS7.(2015·海南卷·T15(1))已知地球大气层的厚度h远小于地球半径R,空气平均摩尔质量为M,阿伏伽德罗常数为,N A地面大气压强为P0,重力加速度大小为g。
2010-2019十年高考题汇编(1)热学1

2010-2019十年高考题汇编(一)——热学1.(2016·全国新课标Ⅲ卷)关于气体的内能,下列说法正确的是( )A.质量和温度都相同的气体,内能一定相同B.气体温度不变,整体运动速度越大,其内能越大C.气体被压缩时,内能可能不变D.一定量的某种理想气体的内能只与温度有关E.一定量的某种理想气体在等压膨胀过程中,内能一定增加2.(2018·新课标II卷·T13)对于实际的气体,下列说法正确的是()A.气体的内能包括气体分子的重力势能B.气体的内能包括分子之间相互作用的势能C.气体的内能包括气体整体运动的动能D.气体体积变化时,其内能可能不变E.气体的内能包括气体分子热运动的动能3.(2015·重庆卷·T10(1))某驾驶员发现中午时车胎内的气压高于清晨时的,且车胎体积增大.若这段时间胎内气体质量不变且可视为理想气体,那么( )A.外界对胎内气体做功,气体内能减小B.外界对胎内气体做功,气体内能增大C.胎内气体对外界做功,内能减小D.胎内气体对外界做功,内能增大4.(2016·全国新课标Ⅲ卷·T33(1))关于热力学定律,下列说法正确的是( )A.气体吸热后温度一定升高B.对气体做功可以改变其内能C.理想气体等压膨胀过程一定放热D.热量不可能自发地从低温物体传到高温物体E.如果两个系统分别与状态确定的第三个系统达到热平衡,那么这两个系统彼此之间也必定达到热平衡5.(2013·海南卷)下列说法正确的是( )A.把一枚针轻放在水面上,它会浮在水面,这是由于水表面存在表面张力的缘故B.水在涂有油脂的玻璃板上能形成水珠,而在干净的玻璃板上却不能,为是因为油脂使水的表面张力增大的缘故C.在围绕地球飞行的宇宙飞船中,自由飘浮的水滴呈球形,这是表面张力作用的结果D.毛细现象中,毛细管中的液面有的升高,有的降低,这与液体的种类和毛细管的材质有关E.当两薄玻璃板间夹有一层水膜时,在垂直于玻璃板的方向很难将玻璃板拉开,这是由于水膜具有表面张力的缘故6.(2016·全国新课标Ⅲ卷·T33(1))一定量的理想气体从状态a开始,经历等温或等压过程ab、bc、cd、da 回到原状态,其p–T图像如图所示,其中对角线ac的延长线过原点O。
十年高考真题分类汇编(2010-2019)化学 专题09 化学能与热能 试卷含解析
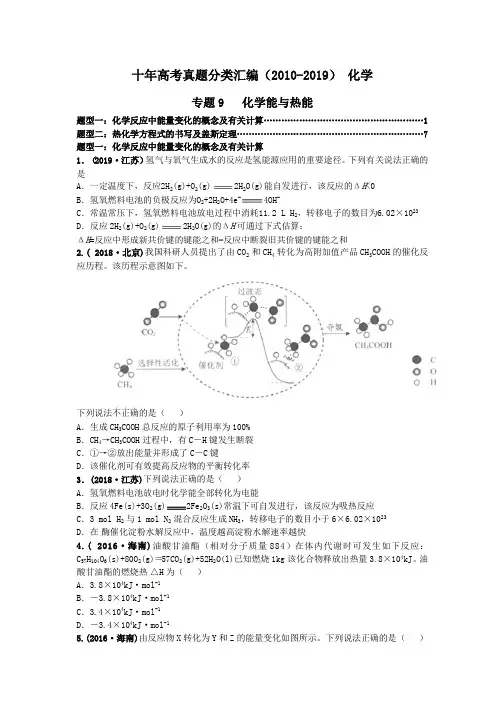
610
413
436
则可以计算出反应
的ΔH 为-384 kJ·mol-1
D.常温下,在 0.10 mol·L-1 的 NH3·H2O 溶液中加入少量 NH4Cl 晶体,能使 NH3·H2O 的电 离度降低,溶液的 pH 减小
25.(2012·重庆)已知断裂 1mol 化学键所需的能量(kJ):N≡N 为 942、O=O 为 500、N-
B.220 kJ C. 550 kJ D.1108 kJ
13.(2014·全国 II)室温下,将 1mol 的 CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应 为ΔH1,将 1mol 的 CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O 受热分解
的化学方程式为:CuSO4·5H2O(s)
ΔH=-220kJ·mol-1
H-H、O=O 和 O-H 键的键能分别为 436、496 和 462kJ·mol-1,则 a 为( )
A.-332 B.-118 C.+350 D.+130
16.(2014·上海)1,3-丁二烯和 2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH—CH=CH2(g) + 2H2(g) → CH3CH2CH2CH3(g) + 236.6 kJ CH3-C≡C-CH3(g) + 2H2(g) → CH3CH2CH2CH3(g) + 272.7 kJ 由此不能判断
关于此 反应说法错误的是( ) A.一定属于吸热反应 B.一定属于可逆反应 C.一定属 于氧化还原反应 D.一定属于分解反应 8.(2015·全国 I)(3)已知反应 2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收 436kJ、151kJ 的能量,则 1molHI(g)分 子中化学键断裂时需吸收的能量为__________kJ。 9.( 2015·北京)最新报道:科学家首次用 X 射线激光技术观察到 CO 与 O 在催化剂表面形 成化学键的过程。反应过程的示意图如下:
十年(2010年—2019年)高考化学真题汇编附答案:物质结构(选考大题)

量)P4O6>SO2
(4) 2 a 4
3a 4
8 × 24 +16 × 64 NA a3 ×10−30
【解析】(1)A.[Ne]3s1 属于基态的 Mg+,由于 Mg 的第二电离能高于其第一电离能,故其 再失去一个电子所需能量较高; B. [Ne] 3s2 属于基态 Mg 原子,其失去一个电子变为基态 Mg+; C. [Ne] 3s13p1 属于激发态 Mg 原子,其失去一个电子所需能量低于基态 Mg 原子; D.[Ne] 3p1 属于激发态 Mg+,其失去一个电子所需能量低于基态 Mg+,综上所述,电离最外 层一个电子所需能量最大的是[Ne]3s1,答案选 A; (2)乙二胺中 N 形成 3 个单键,含有 1 对孤对电子,属于 sp3 杂化;C 形成 4 个单键,不 存在孤对电子,也是 sp3 杂化;由于乙二胺的两个 N 可提供孤对电子给金属离子形成配位键, 因此乙二胺能与 Mg2+、Cu2+等金属离子形成稳定环状离子;由于铜离子的半径较大且含有 的空轨道多于镁离子,因此与乙二胺形成的化合物稳定性相对较高的是 Cu2+;
2
(4)一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图 2所示。
图1
图2
图 中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合
物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值, 完成它们关系表达式:ρ=________g· cm−3。
(3)由于 Li2O、MgO 为离子晶体,P4O6、SO2 为分子晶体。晶格能 MgO>Li2O,分子间
力(分子量)P4O6>SO2,所以熔点大小顺序是 MgO>Li2O>P4O6>SO2;
高考化学十年(2010-2019_真题分类解析19---有机化学基础

式为 HOCH2CH(OH)CH2OH;D 在浓硫酸、加热时消去 2 个“H2O”生成 E;根据 F →G→J 和 E+J→K,结合 F、G、J 的分子式以及 K 的结构简式,E+J→K 为加成反
应,则 E 的结构简式为 CH2=CHCHO,F 的结构简式为 、G 的结构简式为
、J 的结构简式为
【答案】(1)丙酮 (2)
2 6:1 (3)取代反应
(4) (5)碳碳双键酯基氰基 (6)8
11 / 236
(5)根据题给结构简式,氰基丙烯酸酯为 CH2=C(CN)COOR,根据流程图提供的信 息可知,G 的结构简式为 CH2=C(CN)COOCH3,则 G 中的官能团有碳碳双键、酯基、 氰基。 (6)G 的同分异构体中,与 G 具有相同官能团且能发生银镜反应的有机物为甲 酸 酯 , 将 氰 基 看 成 氢 原 子 , 有 三 种 结 构 : HCOOCH2CH=CH2 、 HCOOCH=CHCH3 、 HCOOC(CH3)=CH2,然后将氰基取代右面的碳原子上,共有 8 种。 8.(2015·安徽·26)四苯基乙烯(TFE)及其衍生物具有诱导发光特性,在光 电材料等领域应用前景广泛。以下是 TFE 的两条合成路线(部分试剂及反应条件 省略):
(3) (4)取代反应
(5)C18H31NO4
(6)6 【解析】A 的化学式为 C2H4O,其核磁共振氢谱为单峰,则 A 为 ;B 的化学式 为 C3H8O,核 磁共振氢谱为三组峰,峰面积比为 6∶1∶1,则 B 的结构简式为 CH3CH(OH)CH3;D 的化学式为 C7H8O2,其苯环上仅有两种不同化学环境的氢,1 mol D 可与 1 mol NaOH 或 2 mol Na 反应,则苯环上有酚羟基和—CH2OH,且为对位结
2010-2019十年高考题汇编(3)热学3

2010-2019十年高考题汇编(三)——热学1.(2012·新课标卷)关于热力学定律,下列说法正确的是( )A.为了增加物体的内能,必须对物体做功或向它传递热量B.对某物体做功,必定会使该物体的内能增加C.可以从单一热源吸收热量,使之完全变为功D.不可能使热量从低温物体传向高温物体E.功转变为热的实际宏观过程是不可逆过程2.(2017·新课标Ⅱ卷·T33(1))(5分)如图,用隔板将一绝热气缸分成两部分,隔板左侧充有理想气体,隔板右侧与绝热活塞之间是真空。
现将隔板抽开,气体会自发扩散至整个气缸。
待气体达到稳定后,缓慢推压活塞,将气体压回到原来的体积。
假设整个系统不漏气。
下列说法正确的是()A.气体自发扩散前后内能相同B.气体在被压缩的过程中内能增大C.在自发扩散过程中,气体对外界做功D.气体在被压缩的过程中,外界对气体做功E.气体在被压缩的过程中,气体分子的平均动能不变3.(2016·江苏卷)在高原地区烧水需要使用高压锅,水烧开后,锅内水面上方充满饱和汽,停止加热,高压锅在密封状态下缓慢冷却,在冷却过程中,锅内水蒸汽的变化情况为( )A.压强变小B.压强不变C.一直是饱和汽D.变为未饱和汽4.(2014·海南卷)下列说法正确的是( )A.液面表面张力的方向与液面垂直并指向液体内部B.单晶体有固定的熔点,多晶体没有固定的熔点C.单晶体中原子(或分子、离子)的排列具有空间周期性D.通常金属在各个方向的物理性质都相同,所以金属是非晶体E.液晶具有液体的流动性,同时具有晶体的各向异性特征5.(2014·新课标全国卷Ⅱ·T33(1))下列说法正确的是。
A.悬浮在水中的花粉的布朗运动反映了花粉分子的热运动B.空气的小雨滴呈球形是水的表面张力作用的结果C .彩色液晶显示器利用了液晶的光学性质具有各向异性的特点D .高原地区水的沸点较低,这是高原地区温度较低的缘故E .干湿泡温度计的湿泡显示的温度低于干泡显示的温度,是湿泡外纱布中水蒸发吸热的结果6 .(2013·福建卷)下列四幅图中,能正确反映分子间作用力f 和分子势能E p 随分子间距离r 变化关系的图线是( )A B C D7.(选做)(2016·上海卷)如图,粗细均匀的玻璃管A 和B 由一橡皮管连接,一定质量的空气被水银柱封闭在A 管内,初始时两管水银面等高,B 管上方与大气相通。
化学反应与能量的高考题
化学反应中的能量变化1.(2010山东卷)下列与化学反应能量变化相关的叙述正确的是 A 生成物能量一定低于反应物总能量B 放热反应的反应速率总是大于吸热反应的反应速率C 盖斯定律,可计算某些难以直接测量的反应焓变D 同温同压下,22()()2()H g Cl g HCl g +=在光照和点燃条件的H ∆不同 (2010广东理综卷)2.(09全国卷Ⅱ11) 已知:2H 2(g )+ O 2(g)=2H 2O(l) ΔH= -571.6kJ · mol -1CH 4(g )+ 2O 2(g)=CO 2(g)+2H 2O(l) ΔH= -890 kJ · mol -1现有H 2与CH 4的混合气体112L (标准状况),使其完全燃烧生成CO 2和H 2O(l),若实验测得反应放热3695KJ ,则原混合气体中H 2与CH 4的物质的量之比是A .1∶1B .1∶3C .1∶4D .2∶33.(2010崇文一模卷)下列过程都与能量变化有关,其中表述不正确的是( )A.CO(g)的燃烧热是283.0 kJ· mol-1,则表示CO(g)燃烧反应的热化学方程式为CO(g)+ 1/2 O2(g)= CO2(g)ΔH= -283kJ· mol-1B.稀盐酸与稀氢氧化钠溶液反应的中和热为57.3 kJ· mol-1 ,则表示稀硫酸和稀氢氧化钾溶液发生反应的热化学方程式为1/2 H2SO4 (l) + KOH (l) =1/2 K2SO4 (l) + H2O(l) ΔH= -57.3 kJ· mol-1C.铝热反应是放热反应,但需要足够的的热量才能使反应发生D. HCl和NaOH反映的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反映的中和热△H=2×(-57.3)kJ/mol4.(09海南卷12)已知:Fe2O3(s) + 3/2 C(s) = 3/2 CO2(g) + 2Fe(s) △H=-234.1kJ/molC(s) + O2(g)= CO2(g) △H=-393.5kJ/mol则2Fe (s) + 3/2 O2 (g) = Fe2O3 (s) 的△H是()A.-824.4 kJ/mol B.-627.2 kJ/mol C.-744.7kJ/mol D.-169.4kJ/mol5.(09宁夏卷28)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。
十年(2013-2022)高考化学真题分项汇编(全国通用):化学与能源、环境(学生版)
13.【2016 年高考新课标Ⅱ卷】下列有关燃料的说法错误的是( )
A.燃料燃烧产物 CO2 是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的 CO 是大气污染物之一
14.【2015 江苏化学】“保护环境”是我国的基本国策。下列做法不应该提倡的是( )
A.风力发电,让能源更清洁 B.合成光纤,让通讯更快捷
C.合成药物,让人类更健康 D.环保涂料,让环境更宜居
18.(2012·上海高考真题)2012 年 3 月修订的《环境空气质量标准》中新纳入的强制监测指标是 A.PM2.5 B.NOx C.SO2 D.可吸入颗粒物
19.(2012·江苏高考真题)化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。 下列做法与社会可持续发展理念相违背的是 A.改进汽车尾气净化技术,减少大气污染物的排放 B.开发利用可再生能源,减少化石燃料的使用 C.研发可降解高分子材料,减少“白色污染” D.过度开采矿物资源,促进地方经济发展
D.大气中 CO2 含量的增加会导致温室效应加剧
16.(2015·江苏高考真题)“保护环境”是我国的基本国策。下列做法不应该提倡的是( )
A.采取低碳、节俭的生活方式 B.按照规定对生活废弃物进行分类放置
C.深入农村和社区宣传环保知识 D.经常使用一次性筷子、纸杯、塑料袋等
17.(2011·重庆高考真题)“化学,让生活更美好”,下列叙述不能直接体现这一主旨的是
A.采取低碳、节俭的生活方式
B.按照规定对生活废弃物进行分类放置
C.深入农村和社区宣传环保知识
D.经常使用一次性筷子、纸杯、塑料袋等
15.(2012·海南高考真题)化学与环境密切相关,下列有关说法正确的是
十年(2010年—2019年)高考化学真题汇编附答案:元素及其化合物(选择题)
A
B
C
NaOH 溶液滴入
实验 FeSO4 溶液中
石蕊溶液滴入氯 水中
Na2S 溶液滴入 AgCl 浊液中
D 热铜丝插入稀硝 酸中
产生白色沉淀,随后 溶液变红,随后迅 沉淀由白色逐渐 产生无色气体,
现象
变为红褐色
速褪色
变为黑色
随后变为红棕色
பைடு நூலகம்
14.[2017 海南]下列叙述正确的是(双选) A.稀硫酸和铜粉反应可制备硫酸铜
B.碘化钾与浓硫酸反应可制备碘化氢
C.过氧化钠与二氧化碳反应可制备氧气
D.铝箔在氯气中燃烧可制备无水三氯化铝
15.[2017 海南]分别将足量下列气体通入稀 Na2S 溶液中,可以使溶液变浑浊的是
A.CO
B.SO2
C.HCl
9.[2018 海南卷]絮凝剂有助于去除工业和生活废水中的悬浮物。下列物质可作为絮凝剂的是
A.NaFe(SO4)2· 6H2O
B.CaSO4· 2H2O
C.Pb(CH3COO)2· 3H2O
D.KAl(SO4)2· 12H2O
10.[2018·江苏]下列有关物质性质的叙述一定不正确的是
A.向 FeCl2 溶液中滴加 NH4SCN 溶液,溶液显红色 B.KAl(SO4) 2·12H2O 溶于水可形成 Al(OH)3 胶体
C.冰表面第三层中,冰的氢键网络结构保持不变 D.冰表面各层之间,均存在可逆反应 HCl H++Cl−
2.[2019江苏]下列有关物质的性质与用途具有对应关系的是
A.NH4HCO3受热易分解,可用作化肥
B.稀硫酸具有酸性,可用于除去铁锈
2022_2022十年高考化学真题分类汇编专题09化学能与热能含解斩20222211186
专题9 化学能与热能1.〔2022·江苏〕氢气与氧气生成水的反响是氢能源应用的重要途径。
以下有关说法正确的选项是A.一定温度下,反响2H2(g)+O2(g)2H2O(g)能自发进行,该反响的ΔH<0B.氢氧燃料电池的负极反响为O2+2H2O+4e−4OH−C.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023 D.反响2H2(g)+O2(g)2H2O(g)的ΔH可通过下式估算:ΔH=反响中形成新共价键的键能之和−反响中断裂旧共价键的键能之和【答案】A【解析】体系能量降低和混乱度增大都有促使反响自发进行的倾向,该反响属于混乱度减小的反响,能自发说明该反响为放热反响,即∆H<0,故A正确;B.氢氧燃料电池,氢气作负极,失电子发生氧化反响,中性条件的电极反响式为:2H2 − 4e− =4H+,故B错误;C.常温常压下,V m≠22.L/mol,无法根据气体体积进行微粒数目的计算,故C错误;D.反响中,应该如下估算:∆H=反响中断裂旧化学键的键能之和−反响中形成新共价键的键能之和,故D错误;应选A。
2.( 2022·北京)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反响历程。
该历程示意图如下。
以下说法不正确的选项是.......〔〕A.生成CH3COOH总反响的原子利用率为100%B.CH4→CH3COOH过程中,有C―H键发生断裂C.①→②放出能量并形成了C―C键D.该催化剂可有效提高反响物的平衡转化率【答案】D【解析】【名师点睛】此题考查原子利用率、化学反响的实质、化学反响中的能量变化、催化剂对化学反响的影响,解题的关键是准确分析示意图中的信息。
注意催化剂能降低反响的活化能,加快反响速率,催化剂不能改变ΔH、不能使化学平衡发生移动。
3.(2022·江苏)以下说法正确的选项是〔〕A.氢氧燃料电池放电时化学能全部转化为电能B.反响4Fe(s)+3O2(g)2Fe2O3(s)常温下可自发进行,该反响为吸热反响C.3 mol H2与1 mol N2混合反响生成NH3,转移电子的数目小于6×6.02×1023D.在酶催化淀粉水解反响中,温度越高淀粉水解速率越快【答案】C【解析】【名师点睛】此题考查燃料电池中能量的转化、化学反响自发性的判断、可逆的氧化复原反响中转移电子数的计算、蛋白质的变性和酶的催化特点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
十年高考真题分类汇编(2010-2019)化学专题9 化学能与热能题型一:化学反应中能量变化的概念及有关计算 (1)题型二:热化学方程式的书写及盖斯定理 (7)题型一:化学反应中能量变化的概念及有关计算1.(2019·江苏)氢气与氧气生成水的反应是氢能源应用的重要途径。
下列有关说法正确的是A.一定温度下,反应2H2(g)+O2(g)2H2O(g)能自发进行,该反应的ΔH<0B.氢氧燃料电池的负极反应为O2+2H2O+4e−4OH−C.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023 D.反应2H2(g)+O2(g)2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和−反应中断裂旧共价键的键能之和2.( 2018·北京)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如下。
下列说法不正确...的是()A.生成CH3COOH总反应的原子利用率为100%B.CH4→CH3COOH过程中,有C―H键发生断裂C.①→②放出能量并形成了C―C键D.该催化剂可有效提高反应物的平衡转化率3.(2018·江苏)下列说法正确的是()A.氢氧燃料电池放电时化学能全部转化为电能B.反应4Fe(s)+3O 2(g)2Fe2O3(s)常温下可自发进行,该反应为吸热反应C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快4.( 2016·海南)油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)已知燃烧1kg该化合物释放出热量3.8×104kJ。
油酸甘油酯的燃烧热△H为()A.3.8×104kJ·mol-1B.-3.8×104kJ·mol-1C.3.4×104kJ·mol-1D.-3.4×104kJ·mol-15.(2016·海南)由反应物X转化为Y和Z的能量变化如图所示。
下列说法正确的是()A.由反应的ΔH=E5−E2B.由反应的ΔH<0C.降低压强有利于提高Y的产率D.升高温度有利于提高Z的产率6.( 2016·天津)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。
回答下列问题:(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
7.(2016·上海)一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中和代表不同元素的原子。
关于此反应说法错误的是()A.一定属于吸热反应B.一定属于可逆反应C.一定属于氧化还原反应D.一定属于分解反应8.(2015·全国I)(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为__________kJ。
9.( 2015·北京)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。
反应过程的示意图如下:下列说法中正确的是()A.CO和O生成CO2是吸热反应B.在该过程中,CO断键形成C和OC.CO和O生成了具有极性共价键的CO2D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程10.( 2015·上海)已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。
下列说法正确的是()A.加入催化剂,减小了反应的热效应B.加入催化剂,可提高H2O2的平衡转化率C.H2O2分解的热化学方程式:H2O2 → H2O + O2 + QD.反应物的总能量高于生成物的总能量11.( 2015·江苏)下列说法正确的是()A.分子式为C2H6O的有机化合物性质相同B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能途径a:C CO+H2CO2+H2O途径b:C CO2C.在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数D.通过化学变化可以直接将水转变为汽油12.( 2015·海南)己知丙烷的燃烧热△H=-2215kJ·mol-1,若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为()A.55 kJ B.220 kJ C. 550 kJ D.1108 kJ13.(2014·全国II)室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s) +5H2O(),热效应为ΔH3。
则下列判断正确的是A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3 14.(2014·全国I)已知分解1mol H2O2放出热量98KJ。
在含有少量I的溶液中,H2O2分解的机理为:H2O2+ I H2O+IO H2O2+ IO H2O+O2+ I下列有关该反应的说法正确的是()A.反应速率与I浓度有关 B.IO也是该反应的催化剂C.反应活化能等于98KJ mol-1 D.15.(2014·重庆)已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-12C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( )A.-332 B.-118 C.+350 D.+13016.(2014·上海)1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:CH2=CH—CH=CH2(g) + 2H2(g) → CH3CH2CH2CH3(g) + 236.6 kJCH3-C≡C-CH3(g) + 2H2(g) → CH3CH2CH2CH3(g) + 272.7 kJ由此不能判断A.1,3-丁二烯和2-丁炔稳定性的相对大小B.1,3-丁二烯和2-丁炔分子储存能量的相对高低C.1,3-丁二烯和2-丁炔相互转化的热效应D.一个碳碳叁键的键能与两个碳碳双键键能之和的大小17.(2014·海南)某反应过程能量变化如图所示,下列说法正确的是A、反应过程a有催化剂参与B、该反应为放热反应,热效应等于△HC、改变催化剂,可改变该反应的活化能D、有催化剂的条件下,反应的活化能等于E1+E218.(2014·海南)标准状况下,气态分子断开1mol化学键的焓变称为键焓。
已知H—H,H —O,和O==O键的键焓△H分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是()A、H2O(g)==H2(g)+1/2O2(g) △H =—485KJ/molB、H2O(g)==H2(g)+1/2O2(g) △H = + 485KJ/molC、2 H2(g) + O2(g)==2 H2O(g) △H = + 485KJ/molD、2 H2(g) + O2(g)==2 H2O(g) △H =—485KJ/mol19.(2014·北京)NH3经一系列反应可以得到HNO3,如下图所示。
(3)III中,将NO2()转化为N2O4(),再制备浓硝酸。
①已知:2NO 2() N2O4()△H12NO 2() N2O4()△H2下列能量变化示意图中,正确的是(选填字母)_______________。
A B C②N2O4与O2、H2O化合的化学方程式是_________________。
20.(2014·浙江)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。
采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。
但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。
相关反应的热化学方程式如下:CaSO 4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ) CaSO 4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)请回答下列问题:⑴反应Ⅰ能自发进行的条件是。
⑶假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是。
A B C D21.(2012·全国I)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(△H)分别为—890.3 KJ·mol-1、—285.8 KJ·mol-1、—283.0 KJ·mol-1,则生成1 m3(标准状况)CO所需热量为;22.(2012·全国I)反应 A+B →C(△H <0)分两步进行① A+B→X (△H >0)② X →C(△H <0)下列示意图中,能正确表示总反应过程中能量变化的是23.(2012·江苏)某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。
下列有关叙述正确的是A.该反应为放热反应B.催化剂能改变反应的焓变C.催化剂能降低反应的活化能D.逆反应的活化能大于正反应的活化能24.(2012·浙江)下列说法正确的是:A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H 2O(g)H2O(l) 的ΔH = 40.69 kJ·mol-1B.已知MgCO3的K sp= 6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+) · c(CO32-) = 6.82 × 10-6C.已知:键能/ kJ·mol348 610 413 436则可以计算出反应的ΔH为-384 kJ·mol-1D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小25.(2012·重庆)已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N 为154,则断裂1molN-H键所需的能量(KJ)是A.194B.391C.516.D.65826.(2012·浙江)(3)实验测得该反应的ΔH= 50.5 kJ·mol-1,活化能E a= 90.4 kJ·mol-1。
