实验一 总糖和还原糖的测定
总糖和还原糖的测定

三、实验器材
1、材料:山芋粉 2、仪器:电子分析天平、水浴锅、V-1100 可见分光光度计、移液器 3、其他:试管、容量瓶、三角烧瓶、量筒、 吸管(移液管)、洗耳球、玻棒、洗瓶、 漏斗、离心管、六凹反应盘、pH试纸(1 ~14)
四、实验试剂
1、标准葡萄糖溶液(1.0mg/ml) 2、DNS试剂 3、6mol/L HCl 4、6mol/L NaOH 5、I2-KI溶液
六、计算
C1V1 ω(还原糖)=——×100% m1
C2V2
ω(总糖)=——×0.9×100% m2
附:相关仪器使用 1、移液管的使用
2、移液器的使用
3、离心机的使用 注意配平,对称放 4、V-1100可见分光光度计的使用 比色皿
V-1100可见分光光度计
开机预热30min 测吸光度 选择波长(540nm) MODE键切换到T,将黑体放入光路中
2、样品中总糖的水解、提取
准确称取0.2g山芋粉置于100ml三角烧瓶中
加3ml蒸馏水,调成糊状
取1~2滴于六凹 反应盘中,加1滴 I2-KI溶液,如果 完全不显蓝色, 即可进行下面的 操作。
再加12ml蒸馏水,5ml 6mol/L HCl
沸水浴,30min (不时搅拌) 冷却至室温 用6mol/L NaOH调pH7.0( pH试纸) 蒸馏水定容至100ml,混匀
合上盖,0键校零MODE键切换到A,参比 Nhomakorabea放入到光路中
合上盖,100键调零
将待测液依次放入到光路中,即可得出 待测液的吸光度。
比色皿的使用
管号
试剂
标准葡萄糖溶液 /ml
0
1
2
3
4
5
6
7
生 化 实 验

(3) 0.10mo1/L醋酸溶液100mL
(4) 0.01mo1/L醋酸溶液50mL
(5)0.5%酪蛋白溶液(以0.01M NaOH作溶剂)100ml
(6)0.01%溴甲酚绿指示剂
(7)0.02mo1/L氢氧化钠溶液100ml
(8)0.02mo1/L盐酸溶液100ml
1.00N醋酸溶液(ml)2.4————
0.1N醋酸溶液(ml)—4.01.0——
0.01N醋酸溶液(ml)———2.50.62
酪蛋白醋酸钠溶液(ml)1.01.01.01.01.0
溶液的最终pH3.24.14.75.35.9
沉淀出现的情况
(2)静置约20分钟,观察每支试管内溶液的混浊度,以“—、+、++、+++、++++”符号表示沉淀的多少。根据观察结果,指出哪一个是酪蛋白的等电点。
茚三酮反应分为两步,第一步是氨基酸被氧化形成CO2。
NH2和醛,水合茚三酮被还原成还原型茚三酮;第二步是所
形成的还原型茚三酮同另一个水合茚三酮分子和氨缩合生成
有色物质。此反应的适宜pH为5—7,同一浓度的蛋白质或氨基酸
在不同pH条件下的颜色深浅不同,酸度过大时甚至不显色。
(13) 2%氯化钡溶液150mL
四、实验操作
1、蛋白质的盐析
中性无机盐(硫酸铵、硫酸钠、氯化钠等)的浓溶液能析出蛋白质。盐的浓度不同,析出的蛋白质也不同。如球蛋白可在半饱和硫酸铵溶液中析出,而清蛋白则在饱和硫酸铵溶液中才能析出。由盐析获得的蛋白质沉淀,当降低其盐类浓度时,又能再溶解,故蛋白质的盐析作用是可逆过程。
4、有机溶剂沉淀蛋白质
取1支试管,加入2mL蛋白质溶液,再加入2mL 95%乙醇,混匀,观察沉淀的生成。
实验一35二硝基水杨酸比色法还原糖和总糖的测定

实验一还原糖和总糖的测定——3,5-二硝基水杨酸比色法一、实验目的掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计的使用。
二、实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
三、实验材料、主要仪器和试剂1.实验材料小麦面粉;广范pH试纸。
2.主要仪器(1)大试管:2×20cm×14(2)烧杯:100mL×3(3)三角瓶:100mL×1(4)容量瓶:100mL×3(5)移液管:1mL×3;2mL×2;10mL×4(6)吸耳球、玻璃棒(7)恒温水浴锅(8)漏斗、滤纸(9)白瓷缸、电炉(10)精度天平(11)分光光度计3.试剂(已制备)(1)1mg/mL葡萄糖标准液准确称取90℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。
(2)3,5-二硝基水杨酸(DNS)试剂将6.3g 3,5-二硝基水杨酸(DNS)和2mol\L NaOH溶液262mL,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g重蒸酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中,7-10天后才能使用。
还原糖和总糖的测定实验报告

还原糖和总糖的测定实验报告还原糖和总糖的测定实验报告导言:糖是我们日常生活中常见的食品成分之一,它不仅为我们提供能量,还赋予食物甜味。
然而,不同类型的糖对人体的影响是不同的。
为了更好地了解糖的含量和类型,我们进行了还原糖和总糖的测定实验。
实验目的:1. 学习使用化学方法测定食品中的还原糖和总糖含量;2. 了解不同类型糖的含量及其对人体的影响。
实验原理:还原糖是指能够还原氧化剂的糖类物质,如葡萄糖、果糖等。
总糖则包括还原糖和非还原糖,如蔗糖、乳糖等。
在实验中,我们将使用菲林试剂对还原糖进行定量分析,使用硫酸对总糖进行水解,然后再用菲林试剂进行测定。
实验步骤:1. 准备食品样品:我们选择了三种常见的食品作为样品,分别是苹果、饼干和牛奶;2. 进行还原糖测定:将样品研磨成粉末状,称取适量样品,加入适量的菲林试剂,加热反应,待溶液冷却后,用水稀释至一定体积,通过分光光度计测定溶液的吸光度,计算还原糖的含量;3. 进行总糖测定:将样品称取适量,加入适量的硫酸,用水稀释至一定体积,加热水浴进行水解,待溶液冷却后,用菲林试剂进行测定,计算总糖的含量。
实验结果:经过实验测定,我们得到了三种食品样品中还原糖和总糖的含量数据。
苹果中还原糖含量为X%,总糖含量为X%;饼干中还原糖含量为X%,总糖含量为X%;牛奶中还原糖含量为X%,总糖含量为X%。
讨论与分析:通过对实验结果的分析,我们可以得出以下结论:1. 不同食品中的糖含量差异较大,苹果中的糖含量较高,而饼干和牛奶中的糖含量较低;2. 还原糖和总糖的含量也存在差异,苹果中的还原糖含量较高,而饼干和牛奶中的还原糖含量较低;3. 总糖的含量比还原糖的含量高,这是因为总糖包括了还原糖和非还原糖的含量。
结论:通过本次实验,我们成功测定了苹果、饼干和牛奶中的还原糖和总糖的含量。
实验结果表明,不同食品中的糖含量存在差异,而总糖的含量比还原糖的含量更高。
这些数据对我们了解食品的营养成分和糖的类型具有重要意义。
总糖和还原糖的测定实验报告

总糖和还原糖的测定实验报告一、实验目的本实验旨在通过测定总糖和还原糖的含量,了解不同食品中糖分的含量及其对人体健康的影响。
二、实验原理总糖是指食品中所有可溶性糖类的总和,包括单糖、双糖和多糖。
还原糖是指具有还原性的单糖和部分双糖。
测定总糖和还原糖的方法主要有蒸发法、显色法、高效液相色谱法等,本实验采用显色法测定。
三、实验步骤1.样品制备:将待测样品粉碎并过筛,取2g样品加入100ml锥形瓶中,加入40ml去离子水,振荡混合均匀。
2.制备还原剂:称取0.5g氢氧化钠加入50ml去离子水中,加温搅拌至完全溶解。
3.蒸发:将步骤1中制备好的样品放入沸水浴中加温蒸发至干固。
4.水解:将步骤3中得到的干固样品加入10ml 0.5mol/L盐酸中,加温水解30min。
5.冷却:将步骤4中的样品冷却至室温,加入50ml去离子水稀释。
6.显色:取10ml样品溶液加入试管中,加入2ml酚酞指示剂溶液和2ml还原剂溶液,振荡混合均匀后静置10min。
7.测定:用1mol/L氢氧化钠滴定至颜色变为淡粉色,记录滴定体积V1。
同时进行空白试验并记录滴定体积V0。
8.计算:总糖含量=(V1-V0)×0.01×1000/2g(mg/g),还原糖含量=(V1-V0)×0.01×1000/2g(mg/g)。
四、实验结果本次实验测得样品A的总糖含量为24.5mg/g,还原糖含量为8.7mg/g;样品B的总糖含量为18.3mg/g,还原糖含量为6.9mg/g;样品C的总糖含量为31.7mg/g,还原糖含量为12.4mg/g。
五、实验分析通过本次实验可以发现不同食品中的总糖和还原糖含量存在较大差异。
其中,样品C的总糖和还原糖含量均较高,而样品B的含量最低。
这提示我们在饮食中应该注意控制糖分的摄入,避免过多摄入对身体健康造成影响。
六、实验感想本次实验通过测定总糖和还原糖含量,让我对不同食品中糖分的含量有了更深入的了解。
总糖和还原糖的测定──费林试剂比色法
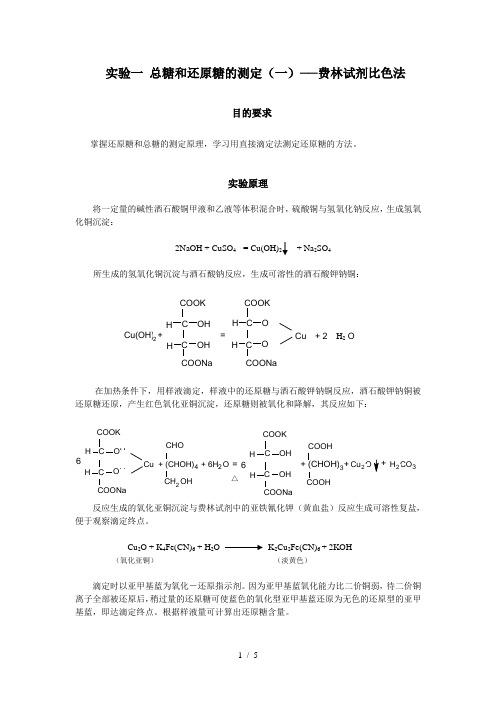
实验一 总糖和还原糖的测定(一)──费林试剂比色法目的要求掌握还原糖和总糖的测定原理,学习用直接滴定法测定还原糖的方法。
实验原理将一定量的碱性酒石酸铜甲液和乙液等体积混合时,硫酸铜与氢氧化钠反应,生成氢氧化铜沉淀:2NaOH + CuSO 4 = Cu(OH)2+ Na 2SO4所生成的氢氧化铜沉淀与酒石酸钠反应,生成可溶性的酒石酸钾钠铜:在加热条件下,用样液滴定,样液中的还原糖与酒石酸钾钠铜反应,酒石酸钾钠铜被还原糖还原,产生红色氧化亚铜沉淀,还原糖则被氧化和降解,其反应如下:反应生成的氧化亚铜沉淀与费林试剂中的亚铁氰化钾(黄血盐)反应生成可溶性复盐,便于观察滴定终点。
Cu 2O + K 4Fe(CN)6 + H 2O K 2Cu 2Fe(CN)6 + 2KOH(氧化亚铜) (淡黄色)滴定时以亚甲基蓝为氧化-还原指示剂。
因为亚甲基蓝氧化能力比二价铜弱,待二价铜离子全部被还原后,稍过量的还原糖可使蓝色的氧化型亚甲基蓝还原为无色的还原型的亚甲基蓝,即达滴定终点。
根据样液量可计算出还原糖含量。
2 O试剂和器材一、试剂碱性酒石酸铜甲液:称取15g硫酸铜(CuSO4·5H2O)及0.05g亚甲基蓝,溶于蒸馏水中并稀释到1000ml。
碱性酒石酸铜乙液:称取50g酒石酸钾钠及75g NaOH,溶于蒸馏水中,再加入4g亚铁氰化钾[K4Fe(CN)6],完全溶解后,用蒸馏水稀释到1000ml,贮存于具橡皮塞玻璃瓶中。
0.1%葡萄糖标准溶液:准确称取1.000g经98~100℃干燥至恒重的无水葡萄糖,加蒸馏水溶解后移入1000ml容量瓶中,加入5ml浓HCl(防止微生物生长),用蒸馏水稀释到1000ml。
6mol/LHCl:取250ml浓HCl(35%~38%)用蒸馏水稀释到500ml。
碘-碘化钾溶液:称取5g碘,10g碘化钾溶于100ml蒸馏水中。
6N NaOH:称取120gNaOH溶于500ml蒸馏水中。
总糖和还原糖的测定实验报告

总糖和还原糖的测定实验报告一、实验目的1、掌握总糖和还原糖含量测定的基本原理和方法。
2、熟练使用分光光度计进行比色分析。
3、培养实验操作技能和数据分析能力。
二、实验原理1、总糖的测定总糖是指样品中所有能够还原斐林试剂的糖类物质的总和,包括还原糖(如葡萄糖、果糖、麦芽糖等)和非还原糖(如蔗糖)。
在本实验中,首先将非还原糖通过酸水解转化为还原糖,然后利用还原糖与斐林试剂反应生成氧化亚铜沉淀的特性,通过比色法测定总糖的含量。
2、还原糖的测定还原糖能够直接与斐林试剂反应,生成氧化亚铜沉淀。
在碱性条件下,氧化亚铜沉淀与酒石酸钾钠反应,形成蓝色的络合物。
通过分光光度计测量溶液在特定波长下的吸光度,与标准曲线对比,即可计算出还原糖的含量。
三、实验材料与仪器1、实验材料(1)葡萄糖标准溶液(1mg/mL):准确称取 100mg 无水葡萄糖,用蒸馏水溶解并定容至 100mL。
(2)3,5-二硝基水杨酸(DNS)试剂:称取 63g DNS 和 262mL2mol/L NaOH 溶液,加到500mL 含有185g 酒石酸钾钠的热水溶液中,再加 5g 结晶酚和 5g 亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中备用。
(3)6mol/L HCl 溶液。
(4)10% NaOH 溶液。
(5)待测样品:如水果汁、蔬菜汁等。
2、实验仪器(1)分光光度计。
(2)恒温水浴锅。
(3)电子天平。
(4)移液器。
(5)容量瓶(100mL、500mL)。
(6)具塞刻度试管(25mL)。
四、实验步骤1、葡萄糖标准曲线的绘制(1)分别吸取 00、02、04、06、08、10、12mL 葡萄糖标准溶液(1mg/mL)于 25mL 具塞刻度试管中,用蒸馏水补足至 20mL。
(2)向各试管中加入 20mL DNS 试剂,摇匀后在沸水浴中加热5min,取出后立即用冷水冷却至室温。
(3)用蒸馏水定容至 25mL,摇匀。
(4)以空白管(00mL 葡萄糖标准溶液)为参比,在 540nm 波长下测定各管溶液的吸光度。
实验一 还原糖和总糖含量的测定

实验一还原糖和总糖含量的测定一、实验目的1、了解还原糖和总糖含量的测定原理,熟悉实验步骤。
2、掌握还原糖和总糖含量的测定方法。
二、实验项目及所用仪器1、还原糖:Benedict试剂,烧杯,伏安电极,示波器,旋涡振荡仪;2、总糖:滤纸、热板、氧化棉芯,旋涡振荡仪。
三、实验原理1、还原糖:Benedict试剂由碳酸锰盐溶液、碳酸铵溶液、氯化钠溶液和抗上皮染料橙Ⅲ组成。
当还原糖作用于Benedict试剂时,会与其中的锰离子发生反应,生成蓝色配体,从而使抗上皮染料橙Ⅲ发生变色;2、总糖:将样品与氧化棉芯一起置于热板中,加热到900℃时,碳水化合物在此温度条件下完全分解为糖和水,糖与热板表面发生热反应而分解,引起氧化棉芯之上有显著黑色浓缩形成,即糖皿现象,根据糖皿质量来推算样品中碳水化合物的质量。
四、实验步骤1、还原糖测定:(1)将1ml Benedict溶液放至烧杯中;(2)向烧杯中加入1ml样品液体,根据不同液体不同加入2-3滴 (液体较稠时) 或1-2滴 (液体较洁时) 酸碱度调节液;(3)将伏安电极组件放入烧杯中,并选取示波器连接;(4)加热26℃下水浴加热,取示波器时加热过程中的电势;(5)检测峰面上的电势,来比较是否有变色;(6)如果有变色,就用旋涡振荡仪对发生变色的液体测定样品含有的还原糖含量。
(1)将样品5ml液体流入滤纸中,滤取液体;(2)将滤取的液体均匀的淋洒在氧化棉芯之上,并将其置于热板之上;(3)将热板加热,观察过程中糖皿现象的变化,双环现象表示反应完成;五、结果计算还原糖:检测变色后用旋涡振荡仪测定吸光度值,用标准曲线求出浓度;总糖:使用朱诺重量比法称取峰面上的焦灰,根据标准曲线求出浓度,以重量比计算样品中碳水合物的含量。
六、安全措施1、食品分析实验中,需要遵守实验室安全规章制度,具体包括:实验前应安全检查仪器,按要求穿防护服、佩戴护目镜,使用专用工具等;2、使用热源时,需要注意:电源线耐热、工作在室内,不能离开,保持室内通风;3、使用化学试剂时,应具备良好的操作习惯,佩戴护手镯、护目镜,禁止吞咽及外用,实验结束后将试剂放回原位,实验结束后要做好清洗工作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验一总糖和还原糖的测定(3,5-二硝基水杨酸法)
171850044钱诗晨
一、实验目的
掌握还原糖和总糖的测定原理,学习用3,5-二硝基水杨酸法测定还原糖的方法。
二、实验原理
单糖和某些寡糖含有游离的醛基或酮基,有还原性,属于还原糖;而多糖和蔗糖等属于非还原性糖。
利用多糖能被酸水解为单糖的性质可以通过测定水解后的单糖含量对总糖进行测定。
还原糖在碱性条件下被氧化成糖酸及其他产物,3,5-二硝基水杨酸(DNS)则被还原为红棕色的3-氨基-5-硝基水杨酸。
在过量的NaOH碱性溶液中此化合物呈橘红色,在540nm处一定浓度范围内还原糖的量与光吸收值呈线性关系,利用比色法可测定样品中的含糖量和总糖的含量。
三、实验器材
1.面粉
2.试管
3.吸管
4.水浴锅
5.电炉
6.紫外可见分光光度计
7.PH试纸
8.容量瓶
9.量筒、研体、三角烧瓶、玻璃漏斗
10.电子分析天平
面粉里含多糖淀粉,遇碘变蓝
四、实验试剂
1.标准葡萄糖溶液(1.0mg/ml):准确称取干燥恒重的葡萄糖100mg,溶于蒸馏水并定容至100ml,混匀,4℃冰箱中保存备用。
2.3,5-二硝基水杨酸(DNS)试剂:将6.3gDNS和262ml2mol/L NaOH溶液,加到500ml含有185g酒石酸甲钠的热水溶液中,再加5g结晶酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000ml贮于棕色瓶中备用。
3.6mol/L HCl:取250ml浓HCl(35%~38%),用蒸馏水稀释到500ml。
4.6mol/L NaOH:称取24g NaOH溶于蒸馏水并稀释至100ml。
5.碘—碘化钾溶液:称取5g碘,10g碘化钾溶于100ml蒸馏水中。
五、实验操作
1.葡萄糖标准溶液曲线的制作
取干净试管6支,按表7进行操作。
以吸光度为纵坐标,各标准液浓度(mg/ml)为横坐标作图得标准曲线
2.样品中还原糖的提取和测定
准确称取1.0g红薯粉,加蒸馏水约10ml,在研体中磨成匀浆,转入三角烧瓶中,
并用约30ml的蒸馏水冲洗研体2~3次,洗出液也转入三角烧瓶中。
与50℃水浴
中保温0.5h,不时搅拌,是还原糖浸出。
将浸出液(含沉淀)转移到100ml离心
管中,于4000r/minx下离心5min,沉淀用20ml蒸馏水洗一次,搅一搅再离心,
将两次离心的上清液合并,用蒸馏水定容至100ml,混匀,作为还原糖待测液。
取1ml进行还原糖的测定。
0123456789
葡萄糖00.10.20.30.40.510.50.250.05水 1.00.90.80.70.60.500.50.750.95 DNS 2.0
水 4.0
A(520nm)0.0000.0580.1360.2530.3350.436 1.0330.4710.4200.049有色数据是红薯粉中浸出来的还原糖制备的样品,绿色数据被舍弃了
根据标准曲线,当A=1.033时,对应浓度为1.0,根据公式求得ω=;
七、计算
1.计算还原糖的百分含量
当A=0.471时,对应浓度为0.560,ω=11,2%;
当A=0.420时,对应浓度为0.490,ω=16.8%;
当A=0.049时,对应浓度为0.068,ω=13.6%
八、注意事项
1.使用离心机,一定要注意相对两个离心管的平衡。
2.稀释液倍数,可根据具体情况决定,浓度在线性范围中,有时候可超过标示倍数。
3.未知样品的条件应该与标准溶液一致。
