常见阴离子的分析与鉴定
常见阴离子的分析与鉴定

常见阴离子的分析与鉴定阴离子的分析与鉴定是化学分析的重要内容之一、常见阴离子的分析与鉴定有很多方法,包括沉淀法、气体分析法、离子交换法、红外光谱法等。
这些方法可以用于分析和鉴定各种常见的阴离子,包括硫酸根离子、氯离子、硝酸根离子、碳酸根离子等。
下面将就一些常见阴离子的分析与鉴定方法进行详细介绍。
首先是硫酸根离子的分析与鉴定。
硫酸根离子具有很强的酸性,可以与金属离子形成不溶性的沉淀物。
常用的分析方法是沉淀法。
首先,将待测溶液与钡盐溶液反应生成硫酸钡沉淀。
如果有沉淀生成,则可以判断原溶液中含有硫酸根离子。
此外,还可以使用离子交换法或者红外光谱法对硫酸根离子进行分析与鉴定。
其次是氯离子的分析与鉴定。
氯离子在水中呈现酸性,可以和银离子形成不溶性的氯化银沉淀。
常用的分析方法是沉淀法。
将待测溶液与银盐溶液反应,如果有沉淀生成,则可以判断原溶液中含有氯离子。
此外,还可以使用气体分析法或者离子交换法对氯离子进行分析与鉴定。
再次是硝酸根离子的分析与鉴定。
硝酸根离子在水中呈现酸性,可以和铁离子形成不溶性的铁氰化物沉淀。
常用的分析方法是沉淀法。
将待测溶液与铁盐溶液反应,如果有沉淀生成,则可以判断原溶液中含有硝酸根离子。
此外,还可以使用离子交换法或者红外光谱法对硝酸根离子进行分析与鉴定。
最后是碳酸根离子的分析与鉴定。
碳酸根离子在水中呈现中性,可以用酸酐酸进行分析与鉴定。
将待测溶液与酸酐酸反应,观察是否有气体产生。
如果有气体产生,则可以判断原溶液中含有碳酸根离子。
此外,还可以使用离子交换法或者红外光谱法对碳酸根离子进行分析与鉴定。
除了以上所述的常见阴离子,还有许多其他阴离子的分析与鉴定方法。
保持实验室良好的实验室环境和实验室环境是实施分析与鉴定工作的前提条件。
实施分析与鉴定工作时,要严格按照实验方法操作,准确测量和记录实验数据。
同时,还需要根据不同阴离子的特点,选择合适的实验方法和实验条件,确保分析与鉴定结果的准确性和可靠性。
常见阴离子的分离与鉴定实验报告

常见阴离子的分离与鉴定实验报告实验报告:常见阴离子的分离与鉴定摘要:通过本实验能够掌握离子交换法分离阴离子、荧光试剂法鉴定阴离子和近红外光谱法鉴定阴离子的方法,成功分离和鉴定了常见的硫酸根、硝酸根和氯根离子。
一、实验目的:1.掌握离子交换法分离阴离子的方法,并分离出常见的硫酸根、硝酸根和氯根离子。
2.掌握荧光试剂法鉴定阴离子的方法,并鉴定分离得到的硫酸根、硝酸根和氯根离子。
3.掌握近红外光谱法鉴定阴离子的方法,并鉴定分离得到的硫酸根、硝酸根和氯根离子。
二、实验原理:1.离子交换法分离阴离子:通过阳离子交换树脂,将不同离子与树脂中的Na+交换,使阴离子被树脂吸附并分离出来。
2.荧光试剂法鉴定阴离子:荧光试剂与阴离子反应产生荧光物质,根据荧光的强度或颜色判断阴离子种类。
3.近红外光谱法鉴定阴离子:近红外光谱区域中阴离子所产生的吸收峰可用于鉴定阴离子种类。
三、实验步骤:1.离子交换法分离阴离子:分别取三个含阴离子的样品,加入少量0.005mol/L NaCl溶液。
将三个样品分别加入三个干燥的阳离子交换树脂柱中,收集通过的溶液,收集得到三个样品的阴离子分离物。
2.荧光试剂法鉴定阴离子:将阴离子分离物溶于少量水中,并加入不同的荧光试剂,观察荧光变化并判断阴离子种类。
3.近红外光谱法鉴定阴离子:将不同的阴离子样品固定在固体基底上,并进行近红外光谱扫描,根据吸收峰判断阴离子种类。
四、实验结果:通过离子交换法成功分离得到三个样品的阴离子分离物,经荧光试剂鉴定与近红外光谱鉴定,确定分离得到的三种阴离子分别为硫酸根、硝酸根和氯根离子。
五、结论:离子交换法分离阴离子是一种可行的方法,能够分离常见的阴离子;荧光试剂法与近红外光谱法鉴定阴离子的方法也能够准确判断阴离子种类,三种方法结合使用,能够充分确认阴离子的种类。
常见阴离子的鉴定报告

常见阴离子的鉴定报告报告编号:2021-CL-001样品信息:样品名称:未知液体样品编号:2021-SN-001取样时间:2021年1月1日样品来源:实验室实验室处理后的液体样品,取自实验室原料库中的混合液体。
样品保存在常温下,避免光照和氧化。
鉴定方法:样品的阴离子类型鉴定采用离子色谱仪进行分析。
实验过程中采用离子交换柱,采用高压梯度洗选法和电导检测法,对样品中的阴离子进行了全面鉴定。
鉴定结果:样品中共检测出7种常见阴离子,具体鉴定结果如下:1. 氢氧根离子(OH-):未检测到。
2. 碳酸根离子(CO32-):未检测到。
3. 氯离子(Cl-):1.0 mg/L。
4. 硝酸根离子(NO3-):3.5 mg/L。
5. 硫酸根离子(SO42-):未检测到。
6. 磷酸根离子(PO43-):未检测到。
7. 氟离子(F-):0.5 mg/L。
结论:样品中检测出氯离子、硝酸根离子和氟离子等3种阴离子,其中氯离子、硝酸根离子浓度较高。
据分析,该样品可能是一种水溶液用于清洗装备的清洁剂。
备注:1. 该鉴定报告是根据实验室分析结果编写而成,并且仅适用于此样品。
对于其他样品,请重新进行分析。
2. 本报告仅对实验室所提供的样品进行阴离子鉴定,不代表该样品中不含有其他化学物质。
3. 实验室在样品提取、保存以及测试过程中都尽可能地保证样品不受污染,但是我们无法保证样品的绝对纯度,并且我们不对损失或任何直接或间接损害承担任何责任。
报告人:XXX 实验室资深分析师2021年6月1日。
常见阴离子的分离、鉴定
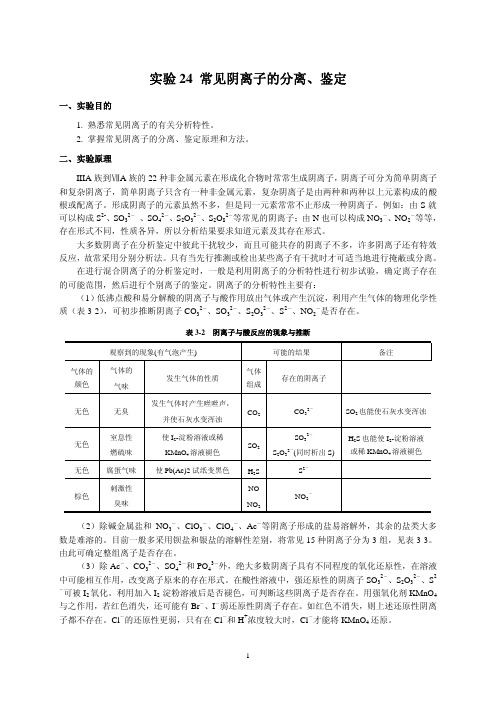
浓)、HNO3 (2.0mol·L-1,6.0mol·L-1,浓)、NaOH (2.0mol·L-1,6.0mol·L-1)、NH3·H2O (2.0mol·L-1,6.0mol·L-1,浓)。 盐溶液: NaNO2 (0.1 mol·L-1)、NaNO3 (0.1 mol·L-1)、KI (0.1 mol·L-1)、NaCl (0.1 mol·L-1)、 KBr (0.1 mol·L-1)、Na2SO3 (0.1 mol·L-1)、Na2S2O3 (0.1 mol·L-1)、Na2CO3 (0.1 mol· L-1)、Na2S (0.1 mol·L-1)、Na2SO4 (0.1 mol·L-1)、AgNO3 (0.1 mol·L-1)、(NH4)2MoO4 (0.1 mol·L-1)、KMnO4 (0.01 mol·L-1)、BaCl2 (0.1 mol·L-1)、K4[Fe(CN)6] (0.1 mol·L-1)、 ZnSO4 (饱和)。 其他试剂:Na2[Fe(CN)5NO]溶液(5%)、氯水(新配制)、I2-淀粉溶液、CCl4、对氨基苯磺酸(1 %)、α-萘胺(0.4%)。
+
+
+
+
(+)
+
+
+
+
(+)
+ (+)
+
+
+
+
+
+
+
分离与鉴定常见非金属阴离子的实验报告

分离与鉴定常见非金属阴离子的实验报告实验目的:通过实验分离和鉴定常见的非金属阴离子,并研究它们在不同试剂下的化学反应特性。
实验原理:阴离子是电荷为负的离子,而非金属阴离子是在化合物中没有金属阳离子的阴离子。
常见的非金属阴离子包括:氯离子(Cl-)、溴离子(Br-)、碘离子(I-)、硝酸根离子(NO3-)、硫酸根离子(SO42-)、碳酸根离子(CO32-)、氢碳酸根离子(HCO3-)和硫代硫酸根离子(S2O32-)等。
在实验中,我们将使用一些常见的化学试剂来鉴定这些非金属阴离子的存在。
实验步骤:1. 溴苯试剂鉴定溴离子:- 取少量待鉴定溴离子的溶液,加入溴苯试剂。
- 若反应产生橙红色的沉淀,则表明溴离子存在。
2. 银镜反应鉴定碘离子:- 取少量待鉴定碘离子的溶液,加入碘化钾试剂。
- 加入稀硝酸,再滴加少量银氨溶液。
- 若出现镜面反应(镜面变黑),则表明碘离子存在。
3. 巴特利特试剂鉴定硝酸根离子:- 取少量待鉴定硝酸根离子的溶液,加入巴特利特试剂。
- 若反应产生红色的沉淀,则表明硝酸根离子存在。
4. 钡盐鉴定硫酸根离子:- 取少量待鉴定硫酸根离子的溶液,加入硝酸钡试剂。
- 若反应产生白色的沉淀,则表明硫酸根离子存在。
5. 盐酸鉴定碳酸根离子:- 取少量待鉴定碳酸根离子的溶液,加入盐酸。
- 若反应产生气泡,并放置数分钟后仍有气泡释放,则表明碳酸根离子存在。
6. 碳酸氢钠鉴定氢碳酸根离子:- 取少量待鉴定氢碳酸根离子的溶液,加入碳酸氢钠试剂。
- 若反应产生气泡,并用湿润的红色石蕊试纸测试,变蓝色或紫色,则表明氢碳酸根离子存在。
7. 亚铁离子鉴定硫代硫酸根离子:- 取少量待鉴定硫代硫酸根离子的溶液,加入氨水和一滴亚铁离子溶液。
- 若反应产生深红色或棕褐色的沉淀,则表明硫代硫酸根离子存在。
实验结果与讨论:根据实验步骤所描述的反应过程,我们可以鉴定出待测溶液中是否存在特定的非金属阴离子。
通过溴苯试剂鉴定,若反应产生橙红色沉淀,我们可以确认溴离子的存在。
常见阴离子的分离与鉴定

常见阴离子的分离与鉴定实验05常见阴离子的分离与鉴定一、教学要求1、使学生掌握常见阴离子的分离和鉴定方法;2、离子检出的基本操作。
二、注意事项根据材料性质的不同特点和溶液中离子的共存情况,应首先进行初步试验或分组试验,以消除不可能的离子,然后确定可能的离子。
初步性质检验一般包括:(一)、试液的酸碱性试验;(二)、是否产生气体的试验;(三)、氧化性阴离子的试验;(四)、还原性阴离子的试验;(五)、难溶盐阴离子试验;试剂酸Ba2+Ag+h2so4h2so4h2so4离子H2SO4+HNO3+ki+I2+kmno4so42白色沉淀*SO32酸性气体沉淀可溶性酸反应沉淀至灰色气体+浊度*S2O32反应酸性气体S2黑色沉淀反应(臭鸡蛋味)CO32酸性气体沉淀可溶性酸沉淀可溶性酸PO43沉淀可溶性酸aso43——反应sio32白色沉淀白色沉淀CL白色沉淀br浅黄色沉淀反应I黄色沉淀反应CN酸性气体*反应NO2酸性气体反应NO3-*表明浓度较高时可能发生反应。
经过初步试验后,可以对试液中可能存在的阴离子作出判断,然后根据阴离子特性反应作出鉴定。
三、实验仪器和药物离心机、点滴盘、试管、试管夹、酒精灯、蒸发皿、浓硝酸,6mol L-1hno3,浓盐酸,2mol L-1hcl,浓H2SO4,2mol L-1h2so4,浓H3PO4,6mol L-1hac,2mnaoh,6mol。
L-1naoh、NH3(6mol.L-1)、pH试纸、碘化钾试纸、醋酸铅试纸、对氨基苯磺酸、α-萘胺、K4[Fe(CN)6]、ZnSO4、AgNO3、Na2[Fe(CN)5No]、澄清BA(OH)2、CdCl(或CD(NO3)(NH4)2Mo422)Na2CO3、NaCl、KBr、Ki、Na3PO4、BaCl2、naso4、naso4、NaSO3、NaSO3、Na2O3、NaNO3、NaNO2c12水、i2水、cc14、0.1mol.l-1kmno4、四、实验现象及相关化学反应式(一),常见阴离子的鉴定1。
常见阴离子的分离与鉴定

常见阴离子得分离与鉴定一、实验目得①掌握一些常见阴离子得性质与鉴定反应;②了解阴离子分离与鉴定得一般原则,掌握常见阴离子分离与鉴定得原理与方法。
二、实验原理许多非金属元素可以形成简单得或复杂得阴离子,例如S2=、Cl=、Br=、NO3=与SO42—等,许多金属元素也可以以复杂阴离子得形式存在,例如VO3=、CrO42-、Al(OH)4-等。
所以,阴离子得总数很多。
常见得重要阴离子有Cl=、Br=、I=、S2-、SO32-、S2O32-、SO42-、NO3-、NO2—、PO43-、CO32—等十几种,这里主要介绍它们得分离与鉴定得一般方法。
许多阴离子只在碱性溶液中存在或共存,一旦溶液被酸化,它们就会分解或相互间发生反应、酸性条件下易分解得有NO2-、SO32-、S2O32-、S2-、CO32-;酸性条件下氧化性离子(如NO3-、NO2-、SO32—)可与还原性离子(如I-、SO32-、S2O32-、S2-)发生氧化还原反应、还有一些离子容易被空气氧化,例如NO2-、SO32-、S2-分别被空气氧化成NO3-、SO42—与S等,分析不当很容易造成错误。
由于阴离子间得相互干扰较少,实际上许多离子共存得机会也较少,因此大多数阴离子分析一般都采用分别分析得方法,只有少数相互有干扰得离子才采用系统分析法,如S2-、SO32-、S2O32-;Cl-、Br-、I—等。
三、器材与药品①仪器:试管,离心试管,点滴板,滴管,酒精灯,水浴烧杯,离心机等。
②药品:HCl(6mol⋅L-1);HNO3(6mol⋅L—1);H2SO4(3mol⋅L—1);H2SO4(浓);BaCl(0、1mol⋅L-1);AgNO3(0。
1mol⋅L—1);KI(0、1mol·L—1);KMn2O4(0.01mol·L-1);FeSO4(固体);CCl4;pH试纸浓度均为0.1mol·L-1得阴离子混合液:CO32-,SO42-,NO3-,PO43-一组;Cl-,Br-,I-一组;S2—,SO32—,S2O32—,CO32-一组;未知阴离子混合液可配5-6个离子一组。
常见11非金属阴离子的分离与鉴定

实验:常见11种非金属阴离子的分离与鉴定[实验目的] 学习和掌握常见11种非金属阴离子的分离与鉴定方法11种常见非金属阴离子:CO32-、SO42-、SO32-、S2O32-、S2-、PO43-、Cl-、Br-、I-、NO2-、NO3-一、初步试验(或消去试验)——完成教材P155表10-41.酸碱性试验——测定阴离子钠盐溶液的pH值阴离子试液一般呈中性或碱性。
若阴离子试液呈酸性,则S2O32-不存在,NO2-和I-、S2-不能共存。
2.挥发性试验——CO32-、SO32-、S2O32-、S2-、NO2-在适当较大浓度的阴离子溶液中加入稀硫酸或盐酸,CO32-、SO32-、S2O32-、S2-、NO2-均有气泡现象。
其中:S2O32- + 2H+→ SO2↑ + S↓ + H2O ,溶液变乳白色浑浊,放置变黄,这是S2O32-的一个重要特征。
但S x2-存在干扰。
3.氧化性阴离子试验——NO2-2I- + 2 NO2- + 4H+(HAc酸化) → 2NO↑ + I2 + 2H2OCCl4层呈紫红色,这是NO2-存在的特征。
4.还原性阴离子试验——S2-、SO32-、S2O32-、I-、NO2-、Br-,Cl-(∆)①试样用硫酸酸化,滴加1~2D KMnO4(aq),褪色,则上述6种阴离子存在,Cl-需加热。
②试样用硫酸酸化,滴加I2+淀粉溶液,褪色,则S2-、SO32-、S2O32-离子存在。
③试样用硫酸酸化,滴加氯水和CCl4,CCl4层呈紫红色,则I-存在。
5.分组试验——难溶盐分组①BaCl2分组——CO32-、SO42-、SO32-、S2O32-、PO43-在中性或弱碱性条件下,于阴离子试液中加入BaCl2溶液,有沉淀生成,则CO32-、SO42-、SO32-、S2O32-、PO43-可能存在。
在盐酸酸化条件下,于阴离子试液中加入BaCl2溶液,仅SO42-、S2O32-有沉淀生成,但S2O32-产生的是乳白色浑浊,而SO42-为细晶。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
还原性试验(KMnO4褪色试验):
2MnO4-+ 5SO32- + 6H+ =2Mn2++ 5SO42- +3H2O 4MnO4-+ 5S2O32-+ 9H+= 10SO42-+4Mn2++18H2O
2MnO4-+ 10Br-+ 16H+ =2Br2+2Mn2++8H2O
2MnO4-+ 10 I-+ 16H+ =2I2+2Mn2++8H2O 2MnO4-+ 5NO2-+ 16H+= 5NO3-+2Mn2++8H2O
(1) Fe3+、Na+ 、 SO42-、 NO2(2) K+ 、I- 、SO42-、 NO2(3) Na+ 、Zn2+ 、SO42-、NO3- 、Cl(4) Ba2+、Al3+ 、Cu2+、NO3- 、CO32试判断哪些分析结果的报告合理? (1)和(3)的结果合理, 在(2) 中NO2-可以
氧化I-,在(4)中CO32-不能与Al3+ 、Cu2+离子
Ag++ Cl-=AgCl↓(白) AgCl+ HNO3= 不反应
Ag++ Br-=AgBr↓(黄)
AgBr+ HNO3= 不反应
Ag++ I-=AgI ↓(黄) AgI+ HNO3= 不反应
其它离子如NO3-、NO2- 无明显现象
3. 氧化还原性试验
氧化性试验(淀粉KI试验):
2I-+ 4H++ 2NO2-= 2NO↑+ 2H2O+I2 其余离子无明显现象。
实验六 常见无机阴离子的分离与鉴别
一、实验目的 1、熟悉常见阴离子的有关性质并掌握它 们的鉴别反应。 2、进一步培养观察实验和分析现象中所 遇到的问题的能力
二、实验原理 常见阴离子有以下13种:SO42-、SiO32-、 PO43-、CO32-、SO32-、S2O32-、S2-、Cl-、Br-、 I-、NO3-、NO2-、Ac- 在阴离子中,有的遇酸易分解,有的彼此氧化还 原而不能共存。故阴离子的分析有以下两个特点: (1) 阴离子在分析过程中容易起变化,不易于进行 手续繁多的系统分析。 (2)阴离子彼此共存的机会很少,且可利用的特效 反应较多,有可能进行分别分析。
B、钡组阴离子的检验
在离心试管中加入几滴未知液,加入1~2滴
1mol· L-1BaCl2溶液,观察有无沉淀产生。如果有白
色沉淀产生,可能有SO42-、SO32-、PO43-、CO32-等
离子(S2O32-的浓度大时才会产生BaS2O3沉淀)。离
心分离,在沉淀中加入数滴6mol· L-1HCl,根据沉淀
并不是要针对所研究的全部离子逐一进行检验,而是
先通过初步实验,用消去法排除肯定不存在的阴离子,
然后对可能存在的阴离子逐个加以确定。
初步试验包括挥发性试验、沉淀试验、氧化还原 试验等,具体为: 1. 挥发性实验(利用PH试纸及稀硫酸加之闻味)
待检离子:SO32-、 CO32-、 S2O32-、S2-、NO2反应方程式: 2H++ CO32-= H2O+CO2↑ 2H++ SO32-= H2O+SO2↑ 2H++ S2O32-= H2O+SO2↑+S↓(黄)
的用量较大时,氧化剂的颜色变化是不容易看到的。
五、思考题 1、在氧化性,还原性实验中,稀HNO3, 稀HCl 和 浓H2SO4是否可以代替稀H2SO4酸化试液, 为什么?
答:不可以, HNO3和 浓H2SO4,具有氧化 性,而稀HCl具有还原性。
混合离子的分离与鉴定
Cl-,Br-,IAg+ HNO3
(2) 确证性试验
根据初步试验结果,对可能存在的阴离子进行确证性
试验。
四、 注意事项
1、在观察BaS2O3沉淀时,如果没有沉淀, 应用玻璃棒摩
擦试管壁, 加速沉淀生成。 2、注意观察Ag2S2O3在空气中氧化分解的颜色变化。 3、在还原性试验时一定要注意, 加的氧化剂KMnO4和I2淀粉的量一定要少, 因为阴离子的浓度很低。如果氧化剂
共存。
液呈碱性或中性,可取试液数滴,用3mol· L-1H2SO4
酸化并水浴加热。若无气体产生,表示CO32-、NO2-、
S2-、SO32-、S2O32-等离子不存在;如果有气体产生,
则可根据气体的颜色、臭味和性质初步判断哪些阴离 子可能存在。(一般为避免气体逸出,发生氧化还原 反应、价态的变化,通常将试样制成碱性溶液)
BaSO4↓+HCl= 不反应
3Ba2++2 PO43-=Ba3(PO4)2↓(白)
Ba3(PO4)2+3 HCl= BaCl2+H3PO4 Ba2++ CO32-=BaCO3↓(白) BaCO3+2 HCl= BaCl2+H2O+CO2↑ Ba2++ SO32-=BaSO3↓(白)
BaSO3+2HCl= BaCl2+H2O+SO2↑
离心分离,在沉淀中加入6mol· L-1HNO3,必要时加热。若
沉淀不溶或只发生部分溶解,则表示有可能Cl-、Br-、I-存在。
D、 氧化性阴离子检验
取几滴未知液,用稀H2SO4酸化,加淀粉 2~3滴,再加
入几滴0.1mol· L-1KI溶液。振荡后,溶液呈蓝色,说明有 NO2-存在(若溶液中有SO32-等,酸化后NO2-先与它们反应
2H++ S2-= H2S↑
2H++ NO2-=NO↑+ H2O
2. 沉淀实验
(1) 与 BaCl2的反应(钡组阴离子的检验 ) SO42-、SiO32-、PO43-、CO32-、SO32-、S2O32-、S2-、 Br-、I-、NO3-、NO2-、Ac- 反应方程式:
Ba2++ SO42-=BaSO4↓(白)
在阴离子的分析中,由于阴离子间的相互干扰较少, 实际上许多离子共存的机会也较少,因此大多数阴离 子分析一般都采用分别分析法,如体系SO42-、NO3-、
Cl-、CO32-。只有在鉴定时,当某些阴离子发生相互
干扰的情况下,才适当采取分离手段,即系统分析法,
如S2-、SO32-、S2O32-;Cl-、Br-、I-等。分别分析方法
是否溶解,进一步判断哪些离子可能存在。
C、银盐组阴离子的检验
取几滴未知液,滴加0.1mol· L-1AgNO3溶液。如果立即
生成黑色沉淀,表示有S2-存在;如果生成白色沉淀,迅速变 黄变棕变黑,则有S2O32-。但S2O32-浓度大时,也可能生成 Ag(S2O3)23-不析出沉淀。Cl-、Br-、I-、CO32-、PO43-都 与Ag+形成浅色沉淀,如有黑色沉淀,则它们有可能被掩盖。
而不一定氧化I-,溶液呈蓝色不能说明无NO2-)。
E、还原性阴离子检验
取几滴未知液,用稀H2SO4酸化,然后加入1~2滴 0.01mol· L-1 KMnO4溶液。若KMnO4的紫红色褪去,表示可
能存在哪些离子?
取几滴未知液,然后加入1~2滴I2淀粉溶液。若褪色,表 示可能存在哪些离子? 根据(A)~(E)实验结果,判断有哪些离子可能存在。
三、实验具体方法
某混合离子试液可能含有SO42-、PO43-、CO32-、 SO32-、S2O32-、S2-、Cl-、Br-、I-、NO3-、NO2-、 Ac按下列步骤进行分析,确定试液中含有哪些离子。
(1) 初步检验 A 、用pH试纸测试未知试液的酸碱性
如果溶液呈酸性,哪些离子不可能存在?如果试
AgCl AgBr AgI
12%(NH4)2CO3
Ag(NH3)2+ Cl-
AgBr AgI H2O,Zn粉,加热
Ag Zn
白色沉淀,示有Cl-
Br-,I饱和氯水,CCl4
CCl4层紫色示有I-
水层 I2 Br- Cl饱和氯水
CCl4层橙黄色示有Br- 水层无色 IO3-,Cl-
3、有酸性未知液,定性分析报告如下
Ba2++ S2O32-=BaS2O3 ↓(白)
BaS2O3+2HCl= BaCl2+H2O+SO2↑+S↓
而S2-、、Br-、I-、NO3-、NO2-、Ac-中加入 BaCl2后无现象。
(2)
与AgNO3的反应 (银盐组阴离子的检验 )
反应方程式: 2Ag++ SO42-=Ag2SO4 ↓(白) Ag2SO4+HNO3= 不反应 3Ag++ PO43-=Ag3PO4 ↓(黄) Ag3PO4+3 HNO3= AgNO3+ H3PO4 2Ag++ CO32-=AgCO3 ↓(白) AgCO3+2HNO3=2AgNO3+H2O+CO2↑ 2Ag++ SO32-=Ag2SO3 ↓(黄) Ag2SO3+2HNO3=2AgNO3+H2O+ SO2↑ 2Ag++ 2S2-=Ag2S↓(黑)
2MnO4-+ 10Cl-+ 16H+=5Cl2+2Mn2++8H2O
2 MnO4-+ 5S2-+ 16H+ = 5S↓(黄) + 2Mn2++8H2O 其余离子无明显现象
I2淀粉褪色试验
I2 + S2- = 2I- + S↓ I2 + 2S2O32- = 2I- + S4O62H2O + I2 + 2SO32- = 2H+ + 2I- + SO42-
