2不饱和脂肪烃——炔烃
合集下载
炔烃的物理性质,化学 性质

(2)化学性质:能发生氧化反应、加成 反应、加聚反应。
4、乙炔
(1)乙炔的分子结构:
电子式:
H C
● ×
●● ●● ●●
C H
● ×
结构式: H—C≡C—H 结构简式: CH≡CH 或 HC≡CH 空间结构: 直线型,键角1800
PS:乙炔结构
1、C≡C的键能和键长并不是C-C的三倍,也 不是C=C和C—C之和。说明叁键中有二个键不 稳定,容易断裂,有一个键较稳定。
原 油 的 分 馏 及 裂 化 的 产 品 和 用 途
石油炼制 的方法
分馏
裂化
裂解
在一定条件下, 利用各成分沸点 在高温下,把 的不同,用蒸发和 把相对分子质 石油分馏产品 量大、沸点高 冷凝的方法把石 中长链烃断裂 原理 油分成不同沸点 的烃断裂为相 为短链气态小 范围的分馏产物 对分子质量小、 分子烃。 沸点较低的烃。 化学变化 物理变化 化学变化 变化 重油 原油 石油分馏产品 主要原料 提高轻质油, 制得由短链气 得到各种不同 特别是汽油的 态不饱和烃组 目的 沸点范围的烃。 产量和质量 成得裂解气 乙烯、丙烯、 石油气,汽油,煤油, 主要产品 柴油,润滑油,重油等 汽油 1,3-丁二烯等
5、描述CH3—CH = CH—C≡C—CF3分子结构的下列 叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
习题1. 鉴别甲烷、乙烯、乙炔三种气体可采用 的方法是:
A. 通入溴水中,观察溴水是否褪色。 B. 通入酸化的高锰酸钾溶液中,观察颜色是否 变化。 C. 点燃,检验燃烧产物。 D. 点燃,观察火焰明亮程度及产生黑烟量的多 少。
4、乙炔
(1)乙炔的分子结构:
电子式:
H C
● ×
●● ●● ●●
C H
● ×
结构式: H—C≡C—H 结构简式: CH≡CH 或 HC≡CH 空间结构: 直线型,键角1800
PS:乙炔结构
1、C≡C的键能和键长并不是C-C的三倍,也 不是C=C和C—C之和。说明叁键中有二个键不 稳定,容易断裂,有一个键较稳定。
原 油 的 分 馏 及 裂 化 的 产 品 和 用 途
石油炼制 的方法
分馏
裂化
裂解
在一定条件下, 利用各成分沸点 在高温下,把 的不同,用蒸发和 把相对分子质 石油分馏产品 量大、沸点高 冷凝的方法把石 中长链烃断裂 原理 油分成不同沸点 的烃断裂为相 为短链气态小 范围的分馏产物 对分子质量小、 分子烃。 沸点较低的烃。 化学变化 物理变化 化学变化 变化 重油 原油 石油分馏产品 主要原料 提高轻质油, 制得由短链气 得到各种不同 特别是汽油的 态不饱和烃组 目的 沸点范围的烃。 产量和质量 成得裂解气 乙烯、丙烯、 石油气,汽油,煤油, 主要产品 柴油,润滑油,重油等 汽油 1,3-丁二烯等
5、描述CH3—CH = CH—C≡C—CF3分子结构的下列 叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
习题1. 鉴别甲烷、乙烯、乙炔三种气体可采用 的方法是:
A. 通入溴水中,观察溴水是否褪色。 B. 通入酸化的高锰酸钾溶液中,观察颜色是否 变化。 C. 点燃,检验燃烧产物。 D. 点燃,观察火焰明亮程度及产生黑烟量的多 少。
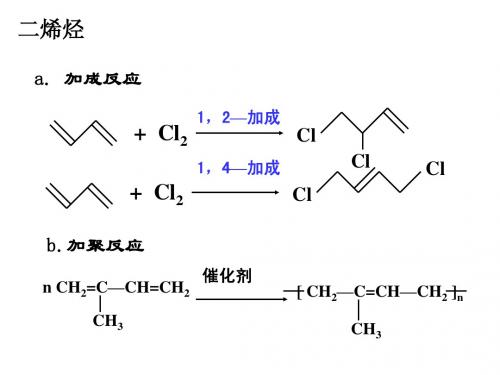
不饱和脂肪烃

HH Cl Cl C=C CH C = C H3C 3 C = C H H
√
CH3–CH2–C–CH– ‖ 3 4 2 CH3 1CH2 命名原则与烷烃相同, 3-甲基-2-乙基-1-丁烯 只是在选母体和编号时要以官能团C=C为准。 2.烯烃的系统命名 选择含有双键的最长碳链为主链 (1)选主链 (母体) 选择含双键最多的最长碳链作主连。 (2)编号 使双键的位次最小,
Z/E命名法:IUPAC系统命名(适用于所有结构) a b C=C c d ②若a>c、b>d 或者a<c、b<d,为Z——构型; 否则,为E ——构型。 ①根据“次序规则”比较基团的大小
大的基团在同侧者为Z型,
大基团不在同侧者为E型。
大
பைடு நூலகம்
Br C=C H3C
Cl H
大
大
Br H3C
C=C
H Cl
跃迁 2s 2p
(以乙烯为例来说明)
H 1210 C H 杂化 C H sp2 2p H
1180
C-基态
2s 激发态
2p
杂化态
杂 化
原子轨道:s
p
C
1200
杂化态
C-H键 (sp2–s) 头碰头重叠形成C—Cσ键 H 键特点——肩并肩 式交叠,重叠小、不 牢固、不能沿键轴自 由旋转。 H
+ - + -
四、烯烃的化学性质 官能团 C=C
官能团分析 + - R C C= C H ① 键 ②-H 反应 位置 键 -H 原因 反应 类型
加成、氧 化、聚合
电子云密度 高、易极化 电负性 sp2>sp3
取代
-C α-氢受双键 的影响,有特 殊的活泼性。
1.加成反应 2.氧化反应 3.聚合反应 4.α-氢的卤代反应
炔烃
②煤的气化
煤的气化是在一定条件下将其转化为可燃性气 体的过程。 C(s)+H2O(g)
高温
CO(g)+H2(g)
③煤的液化
2. 石油
主要成分:烷烃、环烷烃、芳香烃 ①石油的分馏 定义:石油分馏是利用原油中各组分沸点的不 同,将复杂的混合物分离成较简单和更有用的混合 物的过程。
分为常压分馏和减压分馏
CaS + 2H2O = Ca(OH)2 + H2S ↑
H2S +CuSO4 =CuS ↓+ H2SO4 用硫酸铜溶液除去H2S、PH3等杂质气体。
思考:能否用启普发生器制取乙炔? 1.因为碳化钙吸水性强,与水反 应剧烈,启普发生器难以控制 反应速率,不能随用、随停。 2.反应放出的热量较多,易使启普 发生器炸裂。 启普发生器 3. 生成的Ca(OH)2呈糊状,易堵塞球型漏斗。
二、烯烃的顺反异构
定义:由于碳碳双键不能旋转而导致分子中原子或 原子团在空间的排列方式不同所产生的异构现象, 称为顺反异构。
两个相同的原子或原子团排列在双键的同一侧的 称为顺式结构。 两个相同的原子或原子团排列在双键的两侧的称 为反式结构。
产生顺反异构体的条件:
1.具有碳碳双键。
2.组成双键的每个碳原子必须连接两个不同的原子 或原子团。即a’ b’ 且a b 。
随堂练习
2. 在标准状况下将11.2升乙烯和乙炔的混合气通入到 溴水中充分反应,测得有128克溴参加了反应,测乙 烯、乙炔的物质的量之比为( B )
A.1∶2
B.2∶3
C.3∶4
D.4∶5
随堂练习
3. CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子 型碳化物,请通过对CaC2制C2H2的反应进行思考,从 中得到必要的启示,写出下列反应的产物:
三章节不饱和脂肪烃

并不影响电子云的重叠,因此碳碳双键不象碳
碳单键能具有旋转性。这就导致了烯烃中的几
何异构体,这在上面已经提到过。
在碳碳双键中,一个是σ 键,一个是π 键,两 种键是不等同的。σ 键重叠大,比较稳定,这 在 烷烃中已经介绍过。而π 键因是肩并肩重叠,
重叠比σ 键小,因此比较不稳定,当受到试剂 进攻时容易断开而发生反应,所以π 键是烯烃 的官能团。π 键的不稳定也可以从键能数据方 面来说明:C=C的键能为610,C-C的键能为345, 前者减去后者等于265即为π 键的键能,可以看 出π 键的键以能比σ 键的键能要来得小。
返回
1.2. 烯烃的命名
烯烃的命名与烷烃的命名基本相同,只 是在选择最长碳链时要选择那条含有双键 的最长碳链,编号的原则是使双键的位次 最小,双键的位次要标在母体命称的前面:
CH2=CH2 乙烯
CH2=CH-CH3 1-丙烯
CH2=CH-CH2-CH3 1-丁烯
CH2-CH=CH-CH3 2-丁烯
1.4.1.3 加卤化氢HX(HCl、HBr、HI)——马氏规律
烯烃可以同HX进行加成反应: CH2=CH2 + HX → CH3CH2X
反应历程和加卤素相同,即亲电加成。首先HX先离解:
HX → H⊕ + X-
H⊕是亲电的,它首先向烯烃电子云 多的π 键进攻:
CH2=CH2 + H⊕ → {CH3-CH2⊕} → CH3CH2X
(Ⅰ)
(Ⅱ)
CCC C
(Ⅲ)
(Ⅰ)和(Ⅲ),(Ⅱ)和(Ⅲ)的碳链结构不同,是碳链异构 (与丁烷的情况类似),我们在烷烃中已经接触过了。但 是(Ⅰ)和(Ⅱ)的碳链是不同的,它们的不同仅在于碳碳双 键的位置不同,即碳碳双键这一官能团的位置不同,象这 促异构现象叫官能团位置异构。(Ⅰ)和(Ⅱ)之间互称为位 置异构体。
碳单键能具有旋转性。这就导致了烯烃中的几
何异构体,这在上面已经提到过。
在碳碳双键中,一个是σ 键,一个是π 键,两 种键是不等同的。σ 键重叠大,比较稳定,这 在 烷烃中已经介绍过。而π 键因是肩并肩重叠,
重叠比σ 键小,因此比较不稳定,当受到试剂 进攻时容易断开而发生反应,所以π 键是烯烃 的官能团。π 键的不稳定也可以从键能数据方 面来说明:C=C的键能为610,C-C的键能为345, 前者减去后者等于265即为π 键的键能,可以看 出π 键的键以能比σ 键的键能要来得小。
返回
1.2. 烯烃的命名
烯烃的命名与烷烃的命名基本相同,只 是在选择最长碳链时要选择那条含有双键 的最长碳链,编号的原则是使双键的位次 最小,双键的位次要标在母体命称的前面:
CH2=CH2 乙烯
CH2=CH-CH3 1-丙烯
CH2=CH-CH2-CH3 1-丁烯
CH2-CH=CH-CH3 2-丁烯
1.4.1.3 加卤化氢HX(HCl、HBr、HI)——马氏规律
烯烃可以同HX进行加成反应: CH2=CH2 + HX → CH3CH2X
反应历程和加卤素相同,即亲电加成。首先HX先离解:
HX → H⊕ + X-
H⊕是亲电的,它首先向烯烃电子云 多的π 键进攻:
CH2=CH2 + H⊕ → {CH3-CH2⊕} → CH3CH2X
(Ⅰ)
(Ⅱ)
CCC C
(Ⅲ)
(Ⅰ)和(Ⅲ),(Ⅱ)和(Ⅲ)的碳链结构不同,是碳链异构 (与丁烷的情况类似),我们在烷烃中已经接触过了。但 是(Ⅰ)和(Ⅱ)的碳链是不同的,它们的不同仅在于碳碳双 键的位置不同,即碳碳双键这一官能团的位置不同,象这 促异构现象叫官能团位置异构。(Ⅰ)和(Ⅱ)之间互称为位 置异构体。
有机化学-第三章不饱和烃:烯烃和炔烃

a
18
分子的结构包括分子的构造、构型和构象。
同分异构
构造异构
碳架异构 官能团位次异构 官能团异构
互变异构
立体异构
构型异构
顺反异构 对映异构
构象异构
a
19
当两个双键碳原子均连接不同的原子或基团时,即产 生顺反异构现象。如下列三种形式的烯烃都有顺反异构 体,而其它形式的烯烃则没有顺反异构体。
a
20
3.3 烯烃和炔烃的命名
构 型 异 构 体 : ( I) 和 ( Ⅱ ) 是 由 于 构 型 不 同 而 产 生 的 异 构 体 , 称 为 构 型 异 构 体 (configurational isomers)。构型异构体具有不同的物理性质。
a
17
顺反异构体:像(I)和(Ⅱ)这种构型异构体通常用顺、反 来区别,称为顺反异构体(cis and trans ismers),也称几 何异构体(geometric ismers)。
对于碳原子数相同的烯烃顺反异构体,顺式异构 体的沸点比反式异构体略高,而熔点则是反式异构体 比顺式异构体略高。
a
44
与烷烃相似,折射率也可用于液态烯烃和炔烃的鉴 定和纯度的检验。在分子体系中,由于电子越容易极化, 折射率越高,因此,烯烃和炔烃的折射率一般比烷烃大。
a
45
3.5 烯烃和炔烃的化学性质
不饱和链烃分子中同时含有碳碳双键和三键的化合物 称为烯炔。在系统命名法中,选择含有双键和三键在内的 最长碳链作为主链,一般称为“某烯炔”(“烯”在前、 “炔”在后),碳链的编号遵循“最低系列”原则,使双 键、三键具有尽可能低的位次号,其它与烯烃和炔烃命名 法相似。
a
37
但主链编号若双键、三键处于相同的位次供选择时,优 先给双键以最低编号。例如:
有机化学第三章不饱和烃

4 H +C
+
C
H
H
C
C
H H
H
+
H
C
.C
H H
• 键两部分电子云,象两块面包夹住圆柱型 键。
第三章 不饱和脂肪烃
学问如清泉,越掘越甘甜
(二)炔烃的结构
• 1、叁键上的碳原子以sp杂化。
2 S
2 P
2 Py 2 Pz SP
18O0
+
一个杂化
轨道
第三章 不饱和脂肪烃
学问如清泉,越掘越甘甜
2、乙炔分子中三个 键,2个π键的形成。
1)原子序数大的优先。
• Cl > F > O>N >C >B >H >孤电子对
2) 从离烯碳最近的原子
第二
(第一道弧线上)开始比
较, 如果都相同,依次比 较第二道弧线上的原子; H 3 C
如果还相同, 就比较第三道弧线上的 原子……
C l 第一
弧线
直到有一个优先。
弧线
H
H
H
HH
H
第三
H
弧线
H OH 第三章H不饱和脂肪烃
H+
C
+
C
+ H 三个 键
H
C
C
H
的形成
二个π键
+
的形成
HC
CH
三键的筒 状电 子云
第三章 不饱和脂肪烃
学问如清泉,越掘越甘甜
• 三.烯烃和炔烃的性质
• (一)烯烃和炔烃的物理性质
• 烯烃、炔烃物理性质与烷烃的相似。 ➢均不溶于水。 ➢2~4个碳原子的烯烃、炔烃在室温下为气体,
5~19个碳原子的烯烃在室温下为液体。
第3章不饱和脂肪烃
1.4.1.1 加氢反应(又称之为催化氢化)
催化剂:Pd、Pt、Ni(需高温) 产物:烷烃
RCH=CHR'
催化剂
H2
RCH2CH2R'
反应可以定量进行,因此可以根据所用的H2气的体积 来定量地分析烯烃。
无Cat. E活 E CH2 CH2 E活 H CH3CH3
一个反应能否进行,并不取决于
加Cat. 反应是放热还是吸热,而是取决于
两个甲基在双 键的不同侧, 叫反式异构体
H CH3
H C C
(Ⅳ)
H CH3
CH3 C
(Ⅴ)
CH3
C
H
这种异构现象叫顺反异构或叫几何异构
产生几何异构体的条件:
I.分子中必须具有限制旋转的因素;
II.满足条件I的两个碳原子必须和两个不 同的原子或基团相连。
H2C=CH-CH2-CH3
H2C C CH3 CH 3
C C + A-B C A C B
象这样的反应叫亲电加成反应。
1.4.1 1.4.2 1.4.3
加成反应 氧化反应 聚合反应
1.4.4
a-H的卤代反应
1.4.1 加成反应
1 . 加氢反应 2 . 加卤素(Cl2、Br2、I2)
3 . 加卤化氢HX (HCl、HBr、HI)
4 . 加水 5 . 加硫酸 6 . 加次卤酸 7. 加烯烃 8. 硼氢化反应
子与水加成,最后脱质子。
CH2=CH2 + Cl2 + H2O HOCl
CH3CH=CH2 + Br-OH
ClCH2CH2OH
CH3CHCH2Br OH
1.4.1.7 加烯烃 * 需要酸催化
脂肪烃
(2)化学性质
A、 在炔烃分子中是否也存在顺反异构? B 、乙炔是否属于饱和烃?你能否预测乙炔可 能具有什么化学性质?
实验
将纯净的乙炔通入盛有酸 性KMnO4溶液的试管中 将纯净的乙炔通入盛有溴 的四氯化碳溶液的试管中 点燃验纯后的乙炔
现象 溶液紫色逐渐褪去 溴的颜色逐渐褪去,生成无 色易溶于四氯化碳的物质。 火焰明亮,并伴有浓烟。
化学反 应特点
3、有机物和无机物的区别
性质和 反应
溶解性
有机化合物
大多数不溶于水,易溶于有 机溶剂。如油脂溶于汽油,煤 油溶于苯。 多数不耐热,熔点较低 (400 ℃以下 )。如淀粉、蔗糖、 蛋白质、脂肪受热易分解; C20H42熔点36.4℃,尿素132℃。 多数可以燃烧。如棉花、汽 油、天然气都可以燃烧。 多数是非电解质。如酒精、 乙醚、苯都是非电解质、溶液 不电离、不导电。 一般较复杂,副反应多,较 慢,属于可逆反应。如生成乙 酸乙酯的酯化反应在常温下要 16年才达到平衡。
注意: CH2=CH2 + Br2 → BrCH2-CH2Br A、逐一取代,产物为混合物,不宜制备。 CH2=CH2 + HCl → CH3-CH2Cl B、甲烷的四种产物均不溶于水。常温下 注意: CH3Cl是气体,其余均为液体;
3、高温裂解
A、常用的加成试剂 : H2、X2、HX、 H2O、HCN等 B、加成反应是烯烃等不饱和烃的特征反
+
碳原子的化合价达饱和 稳定 卤代 — 不能发生 + KMnO4 溶液(H )不褪 色 燃烧火焰较明亮 溴水不褪色或 KMnO4 + 溶液(H )不褪色
碳原子的化合价未达饱 和,直线形分子 活泼 — 能与 H2、X2、HX、H2O 等发生加成反应 能发生 KMnO4 溶液(H )褪色 燃烧火焰很明亮,带浓烟 溴水褪色或 KMnO4 溶液 + (H )褪色
A、 在炔烃分子中是否也存在顺反异构? B 、乙炔是否属于饱和烃?你能否预测乙炔可 能具有什么化学性质?
实验
将纯净的乙炔通入盛有酸 性KMnO4溶液的试管中 将纯净的乙炔通入盛有溴 的四氯化碳溶液的试管中 点燃验纯后的乙炔
现象 溶液紫色逐渐褪去 溴的颜色逐渐褪去,生成无 色易溶于四氯化碳的物质。 火焰明亮,并伴有浓烟。
化学反 应特点
3、有机物和无机物的区别
性质和 反应
溶解性
有机化合物
大多数不溶于水,易溶于有 机溶剂。如油脂溶于汽油,煤 油溶于苯。 多数不耐热,熔点较低 (400 ℃以下 )。如淀粉、蔗糖、 蛋白质、脂肪受热易分解; C20H42熔点36.4℃,尿素132℃。 多数可以燃烧。如棉花、汽 油、天然气都可以燃烧。 多数是非电解质。如酒精、 乙醚、苯都是非电解质、溶液 不电离、不导电。 一般较复杂,副反应多,较 慢,属于可逆反应。如生成乙 酸乙酯的酯化反应在常温下要 16年才达到平衡。
注意: CH2=CH2 + Br2 → BrCH2-CH2Br A、逐一取代,产物为混合物,不宜制备。 CH2=CH2 + HCl → CH3-CH2Cl B、甲烷的四种产物均不溶于水。常温下 注意: CH3Cl是气体,其余均为液体;
3、高温裂解
A、常用的加成试剂 : H2、X2、HX、 H2O、HCN等 B、加成反应是烯烃等不饱和烃的特征反
+
碳原子的化合价达饱和 稳定 卤代 — 不能发生 + KMnO4 溶液(H )不褪 色 燃烧火焰较明亮 溴水不褪色或 KMnO4 + 溶液(H )不褪色
碳原子的化合价未达饱 和,直线形分子 活泼 — 能与 H2、X2、HX、H2O 等发生加成反应 能发生 KMnO4 溶液(H )褪色 燃烧火焰很明亮,带浓烟 溴水褪色或 KMnO4 溶液 + (H )褪色
炔烃
1
炔烃
4、乙炔
1)乙炔的分子结构:
电子式: 结构式:
H C
● ×
●● ●● ●●
C H
● ×
H—C≡C—H
结构简式: CH≡CH 或 HC≡CH
直线型,键角1800 空间结构:
2
炔烃
乙炔结构 (1)C≡C的键能和键长并不是C-C的三倍,也 不是C=C和C—C之和。说明叁键中有二个键不 稳定,容易断裂,有一个键较稳定。
脂肪烃---------炔烃
三、炔烃
1、概念: 分子里含有碳碳三键的一类不饱 和脂肪烃称为炔烃。 2、炔烃的通式:CnH2n-2 (n≥2) 3、炔烃的通性: (1)物理性质:随着碳原子数的增多,沸点 逐渐升高,液态时的密度逐渐增加。 C小于等于4时为气态,难溶于水。
(2)化学性质:能发生氧化反应,加成反应。
24
脂肪烃的来源及其应用
原 油 的 分 馏 及 裂 化 的 产 品 和 用 途
25
脂肪烃的来源及其应用
26
脂肪烃的来源及其应用
27
脂肪烃的来源及其应用
28
脂肪烃的来源及其应用
学与问 P35
石油分馏是利用石油中各组分的沸点 不同而加以分离的技术。分为常压分馏和 减压分馏,常压分馏可以得到石油气、汽 油、煤油、柴油和重油;重油再进行减压 分馏可以得到润滑油、凡士林、石蜡等。 减压分馏是利用低压时液体的沸点降低的 原理,使重油中各成分的沸点降低而进行 分馏,避免高温下有机物的炭化。
33
脂肪烃的来源及其应用
烷烃 CnH2n+2 (n≥1) 结构特点 碳碳之间仅 含单键 代表物 甲烷 主 与溴 不 褪色 要 (CCl4) 化 与高锰 不褪色 学 酸钾 性 (H SO ) 通式 烯烃 炔烃 CnH2n CnH2n-2(n (n≥2) ≥2) 有碳碳 有碳碳三键 双键 乙烯 乙炔 褪色 褪色 褪色 褪色
炔烃
4、乙炔
1)乙炔的分子结构:
电子式: 结构式:
H C
● ×
●● ●● ●●
C H
● ×
H—C≡C—H
结构简式: CH≡CH 或 HC≡CH
直线型,键角1800 空间结构:
2
炔烃
乙炔结构 (1)C≡C的键能和键长并不是C-C的三倍,也 不是C=C和C—C之和。说明叁键中有二个键不 稳定,容易断裂,有一个键较稳定。
脂肪烃---------炔烃
三、炔烃
1、概念: 分子里含有碳碳三键的一类不饱 和脂肪烃称为炔烃。 2、炔烃的通式:CnH2n-2 (n≥2) 3、炔烃的通性: (1)物理性质:随着碳原子数的增多,沸点 逐渐升高,液态时的密度逐渐增加。 C小于等于4时为气态,难溶于水。
(2)化学性质:能发生氧化反应,加成反应。
24
脂肪烃的来源及其应用
原 油 的 分 馏 及 裂 化 的 产 品 和 用 途
25
脂肪烃的来源及其应用
26
脂肪烃的来源及其应用
27
脂肪烃的来源及其应用
28
脂肪烃的来源及其应用
学与问 P35
石油分馏是利用石油中各组分的沸点 不同而加以分离的技术。分为常压分馏和 减压分馏,常压分馏可以得到石油气、汽 油、煤油、柴油和重油;重油再进行减压 分馏可以得到润滑油、凡士林、石蜡等。 减压分馏是利用低压时液体的沸点降低的 原理,使重油中各成分的沸点降低而进行 分馏,避免高温下有机物的炭化。
33
脂肪烃的来源及其应用
烷烃 CnH2n+2 (n≥1) 结构特点 碳碳之间仅 含单键 代表物 甲烷 主 与溴 不 褪色 要 (CCl4) 化 与高锰 不褪色 学 酸钾 性 (H SO ) 通式 烯烃 炔烃 CnH2n CnH2n-2(n (n≥2) ≥2) 有碳碳 有碳碳三键 双键 乙烯 乙炔 褪色 褪色 褪色 褪色
炔烃 课件 高中化学课件
二、脂肪烃的来源及其应用 1.脂肪烃的来源及其应用 脂肪烃的来源有石油、天然气、煤等。石油中含有 1 ~ 50个碳原子的烷烃及环烷烃。石油通过常压分馏可以得到石 油气、汽油、煤油、柴油等;而减压分馏可以得到润滑油、 石蜡等分子量较大的烷烃;通过石油的催化裂化及裂解可以 得到较多的轻质油和气态烯烃,气态烯烃是最基本的化工原 料;而催化重整是获得芳香烃的主要途径。 天然气的化学组成主要是烃类气体,以甲烷为主(按体积 分数计约占80%~90%)。天然气是高效清洁燃料,也是重要 的化工原料。 煤也是获得有机化合物的源泉。通过煤焦油的分馏可以 获得各种芳香烃;通过煤的直接或间接液化,可以获得燃料 油及多种化工原料。
⑧乙炔制备的反应原理虽是“固+液→气”类型,但制
取乙炔不能用启普发生器或具有启普发生器原理的实验装 置,原因是: a .碳化钙吸水性强,与水反应剧烈,不能随 用、随停。 b .反应过程中放出大量的热,易使启普发生器 炸裂。c.生成的Ca(OH)2呈糊状,易堵塞球形漏斗。
⑨工业上用生石灰和焦炭在高压电弧作用下反应制备电
思维激活
我们常见到大货车在刚发动或爬坡的时候,排出的尾气 都是黑烟,而小汽车却没有这种现象,为什么?用来切割或 焊接金属的氧炔焰是利用了什么原理来切割或焊接金属的?
自学导引
一、炔烃 1.乙炔的组成和结构 乙炔的分子式:C2H2,电子式: , 结构式:H—C≡C—H,结构简式:CH≡CH。 注意:①从乙炔分子的电子式、结构式、结构简式可看 出,乙炔分子中含有—C≡C—结构,通常称它为碳碳三键。 ②从乙炔分子的两种模型可看出,乙炔分子里 4 个原子 均在同一条直线上。 ③从乙炔的分子组成与结构情况看,乙炔属于不饱和 烃。 ④常见的直线形分子有:所有双原子分子、CO2、 CS2、HC≡CH等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不饱和脂肪烃——炔烃
1、制备
(1)邻二卤代物,偕二卤代物两次E2消去
试剂:NaNH2(+氢氧化钾)
(2)四卤代烃锌镁作用下反应
2、三键上的亲电加成
(1)与卤化氢加成——在CuCl/HCl作用下双键三键共存下先和三键反应
(2)过氧化物效应
(3)与卤素发生反式加成(常用于炔基的保护,生成四卤代烃再用Zn反应回复成为炔键) (4)与水加成生成酮式结构——马氏规则——在二价汞离子催化下,三键比双键更易水合(5)在和1MOL氢反映的时候首先生成共轭二烯
3、三键上的亲核加成
(1)与氢氰酸的加成
(2)与含有活泼氢的有机物加成——优先生成稳定碳负离子
应用——引入乙烯基
4、炔烃的还原反应
(1)催化氢化:对于双键、三键共存的分子中,若它们是孤立的,则双键易还原,若它们是共轭的则三键先还原。
特殊催化剂Lindlar-Cat只加氢至双键
(2)硼氢化还原:顺式加成,反马氏
(3)碱金属还原——Na/NH3(不同于NaNH3)——反式烯烃
5、炔烃的氧化反应
高锰酸钾+碱——若为端炔则是羧酸和二氧化碳
臭氧+水——若为端炔则成羧酸和甲酸
6、端炔的性质
(1)叁键氢的弱酸性及炔基负离子——炔基钠
(2)炔基负离子的反应及在合成上的应用
(3)和银氨络离子生成炔银沉淀
7、炔烃的聚合
三聚成苯环
Ps:苯在五氧化二钒,和氧气条件下生成马来酸酐。
