高中化学竞赛辅导-第04章 化学平衡 课件
合集下载
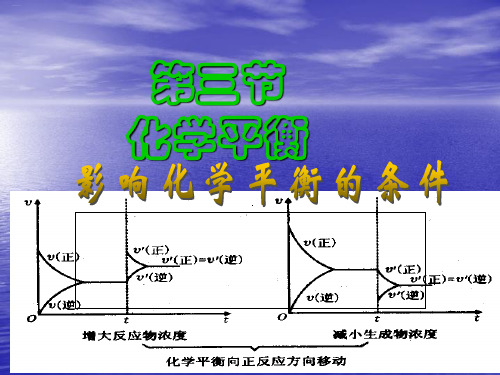
高中化学竞赛辅导课件 化学平衡

2BrCl (g)+ I2(g) 2IBr(g)+ Cl2(g) K 3 = K 1 ·K 2 = 0.45×0.051=0.023
4.1.3 平衡常数与 反应速率系数的关系
Kc
k正
k逆
expEa(正R) -TEa(逆)
exprHm RT
Van’t Hoff 方程式:
ln K 2 r H m
的K =3.2。 (1)当c(Ag+)=1.00 ×10-2mol·L-1, c(Fe2+)=0.100 mol·L-1, c(Fe3+)= 1.00 ×10-3mol·L-1时反应向哪 一方向进行?
(2)平衡时, Ag+ ,Fe2+,Fe3+的浓度各为多少?
(3) Ag+ 的转化率为多少?
(4)如果保持Ag+ ,Fe3+的初始浓度不变,使c(Fe2+)
解:
CO(g)+Cl2 (g) COCl 2(g)
开始cB/(mol·L-1)
开始pB/kPa 假设Cl2全部转化 又设COCl 2转化x 平衡pB/kPa
0.0350 108.5 108.5-83.7
x 24.8+x
0.0270 83.7 0
x x
0 0 83.7 -x 83.7-x
KpCpO /(pCO p(2)C /C2p)l/lp
4.2.1 判断反应的程度
K 愈大,反应进行得愈完全; K 愈小,反应进行得愈不完全; K 不太大也不太小(如 10-3< K <103),
反应物部分地转化为生成物。
4.2.2 预测反应的方向
反应商:
对于一般的化学反应:
4.1.3 平衡常数与 反应速率系数的关系
Kc
k正
k逆
expEa(正R) -TEa(逆)
exprHm RT
Van’t Hoff 方程式:
ln K 2 r H m
的K =3.2。 (1)当c(Ag+)=1.00 ×10-2mol·L-1, c(Fe2+)=0.100 mol·L-1, c(Fe3+)= 1.00 ×10-3mol·L-1时反应向哪 一方向进行?
(2)平衡时, Ag+ ,Fe2+,Fe3+的浓度各为多少?
(3) Ag+ 的转化率为多少?
(4)如果保持Ag+ ,Fe3+的初始浓度不变,使c(Fe2+)
解:
CO(g)+Cl2 (g) COCl 2(g)
开始cB/(mol·L-1)
开始pB/kPa 假设Cl2全部转化 又设COCl 2转化x 平衡pB/kPa
0.0350 108.5 108.5-83.7
x 24.8+x
0.0270 83.7 0
x x
0 0 83.7 -x 83.7-x
KpCpO /(pCO p(2)C /C2p)l/lp
4.2.1 判断反应的程度
K 愈大,反应进行得愈完全; K 愈小,反应进行得愈不完全; K 不太大也不太小(如 10-3< K <103),
反应物部分地转化为生成物。
4.2.2 预测反应的方向
反应商:
对于一般的化学反应:
化学平衡第一课时选修四赛课课件课件

(物质的量、XX分数、转化率等也是不变的)
3.化学平衡的特征:
逆:可逆反应 等: V正= V逆 动: 动态平衡 V正= V逆 ≠ 0 定: 各组分含量(物质的量、 质量 、质量分数 、
体积分数、转化率等)一定
变: 当条件(温度、浓度、压强 等)改变时,
化学平衡可能改变
分析下面两个图像,分别在什么时间达 到了化学平衡状态?
化学平衡第一课时选修四赛课课件 课件
教学目标
1、通过对生活中的平衡及溶解平衡的理解 和迁移,使学生建立起化学平衡的概念,并 理解可逆反应。 2、通过对化学平衡概念的理解,归纳出一 个可逆反应达到平衡状态时的特征。 3、能用平衡状态的特征来判断可逆反应是 否达到平衡。
思考1:一定温度下,在100克水里加入 大量的蔗糖,蔗糖开始溶解,固体质量 会减少,等到一定程度时,固体的质量 再也不改变了,得到的溶液是什么溶液?
N2 +
消耗0.5nmol
3H2
2NH3
生成nmol
生成nmol
思考:单位时间内生成nmolN2同时生成(?) molNH3才表明达到平衡状态
二、化学平衡状态
在一定温度下,密闭容器中,发生反应
CO+H2O
CO2+H2,数据记录如下:
谢谢
某一物理量不变是否可作为 平衡已达到的标志,取决于该物 理量在平衡到达前是否发生变化。 若是(“变量”)则可;否则不行
三、化学反应平衡状态的判定
(二) “变量 ” 不变
该物理量在平衡到达 前是不断在变化的
三、化学反应平衡状态的判定
下面这些物理量到底哪些是“变量”呢?) 方法:未达平衡 (如在正向进行),这些量是否发生改变?
例2:在一定温度下容积一定的容器中,下列物
3.化学平衡的特征:
逆:可逆反应 等: V正= V逆 动: 动态平衡 V正= V逆 ≠ 0 定: 各组分含量(物质的量、 质量 、质量分数 、
体积分数、转化率等)一定
变: 当条件(温度、浓度、压强 等)改变时,
化学平衡可能改变
分析下面两个图像,分别在什么时间达 到了化学平衡状态?
化学平衡第一课时选修四赛课课件 课件
教学目标
1、通过对生活中的平衡及溶解平衡的理解 和迁移,使学生建立起化学平衡的概念,并 理解可逆反应。 2、通过对化学平衡概念的理解,归纳出一 个可逆反应达到平衡状态时的特征。 3、能用平衡状态的特征来判断可逆反应是 否达到平衡。
思考1:一定温度下,在100克水里加入 大量的蔗糖,蔗糖开始溶解,固体质量 会减少,等到一定程度时,固体的质量 再也不改变了,得到的溶液是什么溶液?
N2 +
消耗0.5nmol
3H2
2NH3
生成nmol
生成nmol
思考:单位时间内生成nmolN2同时生成(?) molNH3才表明达到平衡状态
二、化学平衡状态
在一定温度下,密闭容器中,发生反应
CO+H2O
CO2+H2,数据记录如下:
谢谢
某一物理量不变是否可作为 平衡已达到的标志,取决于该物 理量在平衡到达前是否发生变化。 若是(“变量”)则可;否则不行
三、化学反应平衡状态的判定
(二) “变量 ” 不变
该物理量在平衡到达 前是不断在变化的
三、化学反应平衡状态的判定
下面这些物理量到底哪些是“变量”呢?) 方法:未达平衡 (如在正向进行),这些量是否发生改变?
例2:在一定温度下容积一定的容器中,下列物
化学人教版高中选修4化学平衡优秀课件

v v正’ v正’= v逆’ v 平衡状态2
逆’
v正 v正= v逆 v逆 平衡状态1
t1
t2
t3
t4
t2:增大压强 t4:减小压强
t
mA(g) + nB(g) pC(g) + qD(g)
(1)m+n > p+q时 (2)m+n < p+q时 (3)m+n = p+q时
增大压强或减小压强时 平衡如何移动?新旧平 衡的速率大小比较。
下表中压强变化和NH3含量的关系,分析
压强对化学平衡的影响:
5 10 30
60
100
9.2 16.4 35.5 53.6 69.4
总结: mA(g) + nB(g)
pC(g) + qD(g)
若 m+n > p+q P↑ 平衡正向移动 新旧平衡比较:
CA ↑ 、 CB↑ 、 C↑C 、 ↑CD A的转化率↑ B的转化率 ↑ A% ↓ 、B%↓ 、C%↑ 、D↑%
讨论: 起始
N2 + 3H2 1 mol 3 mol
2NH3 (恒T、V) 达平衡状态1
③加入B,A的转化率减小 ④加入催化剂,气体总的物质的量不变
⑤加压使容器体积减小,A或B的浓度一定增大 ⑥若A的反应速率为vA,则B的反应速率vB=(n/m)vA A、①②④⑤ B、①②③⑤ C、①②③⑥ D、③④⑤⑥
压强
1
(MPa)
NH3 % 2.0
体积分数
N2(g)+3H2(g)
2NH3(g) ,试根据
故对化学平衡移动没有影响,只是能改变反应达平衡所需时间。
v
v正’= v逆’
高二上学期化学选修四《化学平衡》PPT(80页)

增大 N2 浓度(投入量)或及时分离出 N H3 (2)应用
①增大低成本反应物的浓度(投入量),提高高成 本原料的转化率,以降低生产成本;
②及时分离产物,提高原料的转化率。
一、化学平衡的移动 2.压强对化学平衡的影响
一、化学平衡的移动 2.压强对化学平衡的影响
450℃时, N2 与 H2 反应生成 N H3 的实验数据 压强
二、什么是饱和溶液? 在一定温度下,在一定量的溶剂里,不能再溶解 某种溶质的溶液,叫做这种溶质的饱和溶液。
饱和溶液中溶质的溶解过程完全停止了吗?
高二上学期化学选修四《化学平衡》P PT(80 页)
高二上学期化学选修四《化学平衡》P PT(80 页)
思考与交流
一天过去了……
不规则 Na Cl 晶体 Na Cl 饱和溶液
三、化学平衡状态定义
化学平衡状态,就是指在一定条件下的可 逆反应里,正反应速率和逆反应速率相等,反 应混合物中各组分的浓度保持不变的状态。
☆强调三点☆
☆强调三点☆
1.前提条件:可逆反应。
☆强调三点☆
1.前提条件:可逆反应。 2.实质:正反应速率=逆反应速率。
☆强调三点☆
1.前提条件:可逆反应。 2.实质:正反应速率=逆反应速率。 3.标志:反应混合物中各组分的浓度保持不变的状态
是反应物与生成物的混合物
一、什么是可逆反应?
在同一条件下,既能向正反应方向进行,同时 又能向逆反应方向进行的反应,叫做可逆反应。
NH3+H2O
NH3·H2O
注意:可逆反应总是不能进行到底,得到的总
是反应物与生成物的混合物
一般把正反应方向进行的程度占绝对优势的反 应,看做不可逆反应。
高二上学期化学选修四《化学平衡》P PT(80 页)
①增大低成本反应物的浓度(投入量),提高高成 本原料的转化率,以降低生产成本;
②及时分离产物,提高原料的转化率。
一、化学平衡的移动 2.压强对化学平衡的影响
一、化学平衡的移动 2.压强对化学平衡的影响
450℃时, N2 与 H2 反应生成 N H3 的实验数据 压强
二、什么是饱和溶液? 在一定温度下,在一定量的溶剂里,不能再溶解 某种溶质的溶液,叫做这种溶质的饱和溶液。
饱和溶液中溶质的溶解过程完全停止了吗?
高二上学期化学选修四《化学平衡》P PT(80 页)
高二上学期化学选修四《化学平衡》P PT(80 页)
思考与交流
一天过去了……
不规则 Na Cl 晶体 Na Cl 饱和溶液
三、化学平衡状态定义
化学平衡状态,就是指在一定条件下的可 逆反应里,正反应速率和逆反应速率相等,反 应混合物中各组分的浓度保持不变的状态。
☆强调三点☆
☆强调三点☆
1.前提条件:可逆反应。
☆强调三点☆
1.前提条件:可逆反应。 2.实质:正反应速率=逆反应速率。
☆强调三点☆
1.前提条件:可逆反应。 2.实质:正反应速率=逆反应速率。 3.标志:反应混合物中各组分的浓度保持不变的状态
是反应物与生成物的混合物
一、什么是可逆反应?
在同一条件下,既能向正反应方向进行,同时 又能向逆反应方向进行的反应,叫做可逆反应。
NH3+H2O
NH3·H2O
注意:可逆反应总是不能进行到底,得到的总
是反应物与生成物的混合物
一般把正反应方向进行的程度占绝对优势的反 应,看做不可逆反应。
高二上学期化学选修四《化学平衡》P PT(80 页)
人教版化学选修四《化学平衡》教学课件
1L T2
1L T0
等效平衡
相同条件下,同一可逆
反应体系,不管从正反应开 始,还是从逆反应开始,达 到平衡时,任何相同物质的 含量(体积分数、质量分数或 物质的量分数)都相同的化学 平衡互称等效平衡。
化学平衡状态的建立
T、V不变 2SO2+O2
SO2 2mol O2 1mol SO3 0mol
意义:增大成本较低的反应物的浓度,
提高成本较高的原料的转化率。
人教版化学选修四《化学平衡》
人教版化学选修四《化学平衡》
练习
已知在氨水中存在下列平衡:
NH3 + H2O
NH3·H2O
NH4+ + OH-
(1)、向氨水中加入MgCl2固体,平衡向正反应方向移动,
OH-浓度 减小
,NH4+浓度 增大
。
(2)、向氨水中加入浓盐酸,平衡向 正反应方向 移动, 此时溶液中浓度减小的粒子有OH-、NH3·H2O、。NH3
A.加压混和气体颜色先深后浅;
B.减压混和气体颜色先浅后深。
压强对化学平衡的影响
[讨论]
2NO2(气)
(2体积,红棕色)
N2O4(气)
(1体积,无色)
A:当加压气体体积缩小时,混和气体颜 色先变深是由于① NO2浓度增大 ,后又
逐渐变浅是由于 ②平衡向正反应方向移动;
B:当减压气体体积增大时,混和气体颜
色先变浅是由于① NO2浓度减小
,
后又逐渐变深是由于平衡向逆反应方向移动。
aA(g)+bB(g)
图象观察
cC(g)
[结论]在其它条件不变的情况下: A:增大压强,会使化学平衡向着气体
体积缩小的方向移动; B:减小压强,会使化学平衡向着气体
1L T0
等效平衡
相同条件下,同一可逆
反应体系,不管从正反应开 始,还是从逆反应开始,达 到平衡时,任何相同物质的 含量(体积分数、质量分数或 物质的量分数)都相同的化学 平衡互称等效平衡。
化学平衡状态的建立
T、V不变 2SO2+O2
SO2 2mol O2 1mol SO3 0mol
意义:增大成本较低的反应物的浓度,
提高成本较高的原料的转化率。
人教版化学选修四《化学平衡》
人教版化学选修四《化学平衡》
练习
已知在氨水中存在下列平衡:
NH3 + H2O
NH3·H2O
NH4+ + OH-
(1)、向氨水中加入MgCl2固体,平衡向正反应方向移动,
OH-浓度 减小
,NH4+浓度 增大
。
(2)、向氨水中加入浓盐酸,平衡向 正反应方向 移动, 此时溶液中浓度减小的粒子有OH-、NH3·H2O、。NH3
A.加压混和气体颜色先深后浅;
B.减压混和气体颜色先浅后深。
压强对化学平衡的影响
[讨论]
2NO2(气)
(2体积,红棕色)
N2O4(气)
(1体积,无色)
A:当加压气体体积缩小时,混和气体颜 色先变深是由于① NO2浓度增大 ,后又
逐渐变浅是由于 ②平衡向正反应方向移动;
B:当减压气体体积增大时,混和气体颜
色先变浅是由于① NO2浓度减小
,
后又逐渐变深是由于平衡向逆反应方向移动。
aA(g)+bB(g)
图象观察
cC(g)
[结论]在其它条件不变的情况下: A:增大压强,会使化学平衡向着气体
体积缩小的方向移动; B:减小压强,会使化学平衡向着气体
人教化学选修4化学平衡PPT(19页)

平衡常数的数学表达式 K c p (C) • cq (D)
cm ( A) • cn (B)
【思考】平衡浓度的单位是mol·L-1,请问平衡常数K有 没有单位?
3.平衡常数的单位 ∵浓度的单位为mol·L-1 ∴K的单位为(mol·L-1)n;n=p+q-m-n
人教化学选修4化学平衡PPT(19页)
Ag+( aq)+Cl-(aq)
⑥ Cr2072-(aq)+H20 Cr042-(aq)+2H+(aq)
人教化学选修4化学平衡PPT(19页)
人教化学选修4化学平衡PPT(19页)
【思考与交流】
(1)比较①和②,分析平衡常数表达式的 书写与哪些因素有关?
(2)比较②和③,分析正、逆反应的平衡 常数之间的关系
起始时浓度mol/L
c (H2)
c(I2) c (HI)
0.0119 0.00694 0 74
平衡时浓度mol/L
c[H2]
c[I2]
c[HI]
0.00561 0.000593 0.0127
7
6
0
平衡时
c2 (HI)
c(H2) ·c(I2)
48.38
0.0122 0.00996 84
0 0.00384 0.001524 0.0168 48.61
人教化学选修4化学平衡PPT(19页)
【练习】请写出下表中各反应的平衡常数表达式并
回答问题
反应
Kc 单位
① 1/2N2(g)+3/2H2(g)
NH3(g)
② N2(g)+3H2(g)
2NH3(g)
③ 2NH3(g)
N2(g)+3H2(g)
cm ( A) • cn (B)
【思考】平衡浓度的单位是mol·L-1,请问平衡常数K有 没有单位?
3.平衡常数的单位 ∵浓度的单位为mol·L-1 ∴K的单位为(mol·L-1)n;n=p+q-m-n
人教化学选修4化学平衡PPT(19页)
Ag+( aq)+Cl-(aq)
⑥ Cr2072-(aq)+H20 Cr042-(aq)+2H+(aq)
人教化学选修4化学平衡PPT(19页)
人教化学选修4化学平衡PPT(19页)
【思考与交流】
(1)比较①和②,分析平衡常数表达式的 书写与哪些因素有关?
(2)比较②和③,分析正、逆反应的平衡 常数之间的关系
起始时浓度mol/L
c (H2)
c(I2) c (HI)
0.0119 0.00694 0 74
平衡时浓度mol/L
c[H2]
c[I2]
c[HI]
0.00561 0.000593 0.0127
7
6
0
平衡时
c2 (HI)
c(H2) ·c(I2)
48.38
0.0122 0.00996 84
0 0.00384 0.001524 0.0168 48.61
人教化学选修4化学平衡PPT(19页)
【练习】请写出下表中各反应的平衡常数表达式并
回答问题
反应
Kc 单位
① 1/2N2(g)+3/2H2(g)
NH3(g)
② N2(g)+3H2(g)
2NH3(g)
③ 2NH3(g)
N2(g)+3H2(g)
《化学平衡》PPT全文课件【人教版】
b.当m+n=p+q时增大压 强(即△n=0的体系)。
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
三、某物质的转化率(或百分含量)-时间-温度(或 《化学平衡》PPT全文课件【人教版】优秀课件(实用教材) 压强)图(先拐先平,温度、压强均更高)
对于反应mA(g)+nB(g) pC(g)+qD(g)
对于反应mA(g)+nB(g) pC(g)+qD(g)
B%
T2P2 T1P2 T1P1
t •首先判断压强高低:P1<P2 则:m+n<应吸热
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
AB3%
温度
A.
1×105Pa
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
1×106Pa
时间 C.
时间 B.
AB3% 100℃
500℃
压强 D.
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
四、某物质的转化率(或百分含量)-温度(或压强)图: 对于反应mA(g)+nB(g) pC(g)+qD(g)
A%
200℃
300℃
P
吸 >
•正反应 热 吸 m+n p+=q
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
化学平衡
常见化学平衡图像问题的处理
由下列图象能分析得出什么结论?
A%
A%
0
T
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
三、某物质的转化率(或百分含量)-时间-温度(或 《化学平衡》PPT全文课件【人教版】优秀课件(实用教材) 压强)图(先拐先平,温度、压强均更高)
对于反应mA(g)+nB(g) pC(g)+qD(g)
对于反应mA(g)+nB(g) pC(g)+qD(g)
B%
T2P2 T1P2 T1P1
t •首先判断压强高低:P1<P2 则:m+n<应吸热
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
AB3%
温度
A.
1×105Pa
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
1×106Pa
时间 C.
时间 B.
AB3% 100℃
500℃
压强 D.
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
四、某物质的转化率(或百分含量)-温度(或压强)图: 对于反应mA(g)+nB(g) pC(g)+qD(g)
A%
200℃
300℃
P
吸 >
•正反应 热 吸 m+n p+=q
《 化学平 衡》PPT 全文课 件【人 教版】 优秀课 件(实 用教材 )
化学平衡
常见化学平衡图像问题的处理
由下列图象能分析得出什么结论?
A%
A%
0
T
2021届高中化学竞赛理论辅导课件-物理化学(入门)04化学平衡
2020年9月20日
§4.1 反应的等温方程和平衡常数
4.亲和势(affinity)
1922年,比利时热力学专家德唐德(De donder)首先引进了化学 反应亲和势的概念。他定义化学亲和势A为
A
def
(
G
)T
,
p
B
BB
A是状态函数,体系的强度性质。 用A判断化学反应的方向具有“势”的性质,即:
rGm
G
T ,P
BB
2020年9月20日
§4.1 反应的等温方程和平衡常数
公式理解:
• 在一个无限量的体系内,体系的发生一个mol变化引起G的变化
• 在一个有限量的体系内,体系发生一个微小变化d ,引起体系发
生一个dG的变化。
对rGm 的理解: 1)量纲:J.mol-1 2) 强度性质,与体系的物质的量无关 3)对同一化学反应来讲,其具体值与计量方程式写法有关 4)随着反应的进行,由于浓度发生变化,则B发生变化,引起变化,
dD + eE +…. gG + hH
+……
rGm
rGm
(T )
RT
ln
( (
fG fD
/ /
p p
)g ( fH / p )d ( fE / p
)h )e
rGm (T ) RT ln Qf
逸度商
(
fG
g
)
(
fH
)h
Q = p
p
f ( fD )d ( fE )e
p
p
2020年9月20日
§4.1 反应的等温方程和平衡常数
2020年9月20日
§4.1 反应的等温方程和平衡常数
§4.1 反应的等温方程和平衡常数
4.亲和势(affinity)
1922年,比利时热力学专家德唐德(De donder)首先引进了化学 反应亲和势的概念。他定义化学亲和势A为
A
def
(
G
)T
,
p
B
BB
A是状态函数,体系的强度性质。 用A判断化学反应的方向具有“势”的性质,即:
rGm
G
T ,P
BB
2020年9月20日
§4.1 反应的等温方程和平衡常数
公式理解:
• 在一个无限量的体系内,体系的发生一个mol变化引起G的变化
• 在一个有限量的体系内,体系发生一个微小变化d ,引起体系发
生一个dG的变化。
对rGm 的理解: 1)量纲:J.mol-1 2) 强度性质,与体系的物质的量无关 3)对同一化学反应来讲,其具体值与计量方程式写法有关 4)随着反应的进行,由于浓度发生变化,则B发生变化,引起变化,
dD + eE +…. gG + hH
+……
rGm
rGm
(T )
RT
ln
( (
fG fD
/ /
p p
)g ( fH / p )d ( fE / p
)h )e
rGm (T ) RT ln Qf
逸度商
(
fG
g
)
(
fH
)h
Q = p
p
f ( fD )d ( fE )e
p
p
2020年9月20日
§4.1 反应的等温方程和平衡常数
2020年9月20日
§4.1 反应的等温方程和平衡常数
化学选修4《化学平衡》化学平衡图像PPT课件
T2P2 T1P2 T1P1
t •m+n<p+q •时间-温度 (或压强)图像
解法精要:“先拐先平,数值大” 在化学平衡图象中,先出现拐点的
反应则先达到平衡,先出现拐点的曲线表 示的温度较高或表示的压强较大。
可编辑课件
14
练习:对于反应
mA (g) + nB (g) pC (g) 有如
•对于反应mA(g)+nB(g) pC(g)+qD(g)
A
B
的
的
转
T1
转
P1
化 率
T2
化 率
P2
A% •正反应吸热
t
t
•m+n<p+q
C%
T1 T2
P1
P2
t
t
•正反应放热
•m+n=p+q
可编辑课件
12
三、某物质的转化率(或百分含量)-时间温度(或压强)图:
例:对于反应mA(g)+nB(g)
B%
pC(g)+qD(g)
可编辑课件
3
一、浓度 - 时间图:
例: c
练: c 0.4 0.3 0.2 0.1
可用于:
看起点和终
1)写出化学反应方程式: 点:分清反
C A
A+2B 3C 2)求反应物的转化率:
应物和生成 物,浓度
B
A的转化率=33.3%
B的转化率=66.7% t
(或物质的 量)减小的
B 12))写求5A出反化应学物3反的B+应转2C方化程率式::是 增 成反 大 物应 的 ,物 是 生, 生 成
v
v正
化学选修四--化学平衡状态-PPT
B. 1 mol NO2、1.2 mol NO
C. 2 mol NO
D. 0.7 mol O2
3、当可逆反应2SO2+O2
2SO3达平衡时, 通入18O2,
再次平衡时, 18O存在于
(D )
A.SO3 O2 C.SO2 O2
B.SO2 SO3 D.SO2 O2 SO3
在反应CO+H2O 高催温化高剂C压O2+H2中,将 0.01molCO和0.01mol H2O (g)通入1L密闭容 器中,反应一段时间后,各物质浓度不变
专题2 化学反应速率与化学平衡
第二单元 化学反应的方向和限度
化学平衡状态
一碗水里放很多糖,会出现什么情况?
溶解平衡状态 具有化学反应限度的反应也总会出现一个 平衡状态
高炉炼铁的主要反应为:Fe2O3+3CO 高温 2Fe +3CO2 从炼铁炉口排出的尾气中含有一定量的CO。100多年 前,人们曾认为这是由于 CO与铁矿石接触时间不够的 缘故。为使反应进行的完全,当时曾耗巨资改建高炉, 以延长 CO和Fe2O3的接触时间,结果尾气中CO的含量 并未减少。你知道这是为什么吗?
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化 ⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2 A.②⑧ B.②⑤⑧ C.①③④⑦ D.②⑤⑥⑧
(2)、化学平衡状态的判 断
平衡平衡
平衡平衡 平衡平衡 不一不定一平定平衡衡 平衡平衡 平衡平衡 不一不定一平定衡平衡 不一不定一平定平衡衡 平衡平衡 不不一一定定平平衡衡
A. A生成的速率与C分解的速率相等 B. A、B、C的浓度相等 C. 单位时间生成n molA同时消耗3n molB D. A、B、C的分子数之比为1:3:2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2BrCl (g)+ I2(g) 2IBr(g)+ Cl2(g) K 3 = K 1 ·K 2 = 0.45×0.051=0.023
4.1.3 平衡常数与 反应速率系数的关系
Kc
k 正
k 逆
exp
Ea(正)- Ea(逆)
RT
exp r Hm RT
若反应开始时,GeO和W2O6 的分压均 为100.0kPa,平衡时 GeWO4 (g) 的分压为 98.0kPa。求平衡时GeO和W2O6的分压以及 反应的标准平衡常数。
解: 2GeO (g) + W2O6 (g) 2 GeWO4 (g)
开始pB/kPa 100.0
100.0
变化pB/kPa -98.0
H2 (g) I2 (g) 2HI(g)
K
[ p(HI) / p ]2
[ p(H2 ) / p ][p(I2 ) / p ]
对于溶液中的反应:
Sn2+(aq)+2Fe3+(aq) Sn4+ (aq)+2Fe2+(aq)
K
[c(Sn [c(Sn
4 2
/c /c
)][ c(Fe 2 /c )][ c(Fe3 /c
)] 2 )] 2
对于一般的化学反应:
aA(g) bB(aq) cC(s) xX(g) yY(aq) zZ(l)
K
pX/ p pA/ p
xcY/ c acB/ c
y b
K 是温度的函数,与浓度、分压无关。
标准平衡常数表达式必须与化学反应计 量式相对应。
100.0kPa
100%
49%
§4.2 标准平衡常数的应用
4.2.1 判断反应的程度 4.2.2 预测反应的方向 4.2.3 计算平衡的组成
4.2.1 判断反应的程度
K 愈大,反应进行得愈完全; K 愈小,反应进行得愈不完全; K 不太大也不太小(如 10-3< K <103),
反应物部分地转化为生成物。
p
]
2.0
98.0 1002
1002 51.0
100
4.7103
平衡转化率:
def
B
n0
B neq n0 B
B
例如:
GeO 100.0 2.0kPa 100% 98%
100.0kPa
W2 O 6
100.0 51.0kPa
4.2.2 预测反应的方向
反应商:
对于一般的化学反应:
aA (g)+ bB(aq)+cC(s) xX(g)+yY(aq)+zZ(l)
任意状态下:
J def [ pi (X) / p [ pi (A) / p
]x[ci (Y) / c ]a[ci (B) / c
]y ]b
反应商判据:
J<K J=K J>K
- 98.0 2
平衡pB/kPa 100.0-98.0
100.0-
98.0 2
0 98.0 98.0
p(GeO)=100.0 kPa - 98.0 kPa =2.0kPa
p(W2O6)=100.0
kPa
-
98.0 2
kPa=51.0
kPa
K
[
[ pGeWO4 / p ]2 pGeO/ p ]2[ pW2O6 /
2HI(g) H2(g) I2(g)
K
3
[
p ( H 2 ) / p ][ [ p(HI ) /
p(I2 ) p ]2
/
p
K3 ] =(K 1 )-1
多重平衡原理 例题:已知25℃时反应
①2BrCl(g) Cl2(g)+Br2(g)的K 1 =0.45 ②I2(g)+Br2(g) 2IBr(g)的K 2 =0.051 计算反应 ③2BrCl (g)+ I2(g) 2IBr(g)+ Cl2(g)的 K 3 。 解:反应① + ②得:
Van’t Hoff 方程式:
ln K 2 r H m
K1
R
11 T1 T 2
或 lg K 2 r H m
11
K1
2 . 303 R T 1 T 2
4.1.4 标准平衡常数的实验测定
例题:恒温恒容下,GeO(g)与W2O6 (g) 反 应生成GeWO4 (g) :
2GeO (g) +W2O6 (g) 2 GeWO4 (g)
H2 (g) I2 (g) 2HI(g)
K1
K1
[ p(HI) / p ]2
[ p(H2 ) / p ][p(I2 ) /
p
]
1 2 H 2 (g)
1 2 I 2 (g)
HI(g) K 2
K
2
[
[ p(HI) / p ] p(H2 ) / p ]1/ 2[ p(I2 )
/
p
]1/ 2 (K 1 )1/2
4.1.1 化学平衡的基本特征
大多数化学反应都是可逆的。例如:
c / mol
t/s
L1
H2
(g)
I2
(g)
0 0.0100 0.0100
2HI(g)
正 106 逆 107
mol L1 s1
0 7.60 0
2000 0.00397 0.00397 0.0121 1.20 2.04
反应正向进行; 系统处于平衡状态; 反应逆向进行。
4.2.3 计算平衡的组成
例题:已知反应CO(g)+Cl2(g) COCl2(g) 在恒温恒容条件下进行,373K时K =1.5108。
第四章 化学平衡 熵和Gibbs函数
§4.1 标准平衡常数 §4.2 标准平衡常数的应用 §4.3 化学平衡的移动 §4.4 自发变化和熵 §4.5 Gibbs函数
§4.1 标准平衡常数
4.1.1 化学平衡的基本特征
4.1.2 标准平衡常数表达式 4.1.3 平衡常数与
反应速率系数的关系
4.1.4 标准平衡常数的实验测定
4850 0.00213 0.00213 0.0157 0.345 3.43
反应开始 :c(H2),c(I2) 较大, c(HI) = 0, υ 正较大,υ逆为 0;反应进行:c(H2),c(I2)减小, υ 正减小,c(HI)增大,υ逆增大;某一时刻:υ正= υ 逆,系统组成不变,达到平衡状态。
正
H2 (g) I2 (g)
0.02
逆
2HI(g)
正 逆
0.01
化学平衡:
在一定条件下,可逆反应处于化学 平衡状态:
正 逆 0
特征: (1)系统的组成不再随时间而变。 (2)化学平衡是动态平衡。 (3)平衡组成与达到平衡的途径无关。
4.1.2 标准平衡常数表达式
对于气相反应:
4.1.3 平衡常数与 反应速率系数的关系
Kc
k 正
k 逆
exp
Ea(正)- Ea(逆)
RT
exp r Hm RT
若反应开始时,GeO和W2O6 的分压均 为100.0kPa,平衡时 GeWO4 (g) 的分压为 98.0kPa。求平衡时GeO和W2O6的分压以及 反应的标准平衡常数。
解: 2GeO (g) + W2O6 (g) 2 GeWO4 (g)
开始pB/kPa 100.0
100.0
变化pB/kPa -98.0
H2 (g) I2 (g) 2HI(g)
K
[ p(HI) / p ]2
[ p(H2 ) / p ][p(I2 ) / p ]
对于溶液中的反应:
Sn2+(aq)+2Fe3+(aq) Sn4+ (aq)+2Fe2+(aq)
K
[c(Sn [c(Sn
4 2
/c /c
)][ c(Fe 2 /c )][ c(Fe3 /c
)] 2 )] 2
对于一般的化学反应:
aA(g) bB(aq) cC(s) xX(g) yY(aq) zZ(l)
K
pX/ p pA/ p
xcY/ c acB/ c
y b
K 是温度的函数,与浓度、分压无关。
标准平衡常数表达式必须与化学反应计 量式相对应。
100.0kPa
100%
49%
§4.2 标准平衡常数的应用
4.2.1 判断反应的程度 4.2.2 预测反应的方向 4.2.3 计算平衡的组成
4.2.1 判断反应的程度
K 愈大,反应进行得愈完全; K 愈小,反应进行得愈不完全; K 不太大也不太小(如 10-3< K <103),
反应物部分地转化为生成物。
p
]
2.0
98.0 1002
1002 51.0
100
4.7103
平衡转化率:
def
B
n0
B neq n0 B
B
例如:
GeO 100.0 2.0kPa 100% 98%
100.0kPa
W2 O 6
100.0 51.0kPa
4.2.2 预测反应的方向
反应商:
对于一般的化学反应:
aA (g)+ bB(aq)+cC(s) xX(g)+yY(aq)+zZ(l)
任意状态下:
J def [ pi (X) / p [ pi (A) / p
]x[ci (Y) / c ]a[ci (B) / c
]y ]b
反应商判据:
J<K J=K J>K
- 98.0 2
平衡pB/kPa 100.0-98.0
100.0-
98.0 2
0 98.0 98.0
p(GeO)=100.0 kPa - 98.0 kPa =2.0kPa
p(W2O6)=100.0
kPa
-
98.0 2
kPa=51.0
kPa
K
[
[ pGeWO4 / p ]2 pGeO/ p ]2[ pW2O6 /
2HI(g) H2(g) I2(g)
K
3
[
p ( H 2 ) / p ][ [ p(HI ) /
p(I2 ) p ]2
/
p
K3 ] =(K 1 )-1
多重平衡原理 例题:已知25℃时反应
①2BrCl(g) Cl2(g)+Br2(g)的K 1 =0.45 ②I2(g)+Br2(g) 2IBr(g)的K 2 =0.051 计算反应 ③2BrCl (g)+ I2(g) 2IBr(g)+ Cl2(g)的 K 3 。 解:反应① + ②得:
Van’t Hoff 方程式:
ln K 2 r H m
K1
R
11 T1 T 2
或 lg K 2 r H m
11
K1
2 . 303 R T 1 T 2
4.1.4 标准平衡常数的实验测定
例题:恒温恒容下,GeO(g)与W2O6 (g) 反 应生成GeWO4 (g) :
2GeO (g) +W2O6 (g) 2 GeWO4 (g)
H2 (g) I2 (g) 2HI(g)
K1
K1
[ p(HI) / p ]2
[ p(H2 ) / p ][p(I2 ) /
p
]
1 2 H 2 (g)
1 2 I 2 (g)
HI(g) K 2
K
2
[
[ p(HI) / p ] p(H2 ) / p ]1/ 2[ p(I2 )
/
p
]1/ 2 (K 1 )1/2
4.1.1 化学平衡的基本特征
大多数化学反应都是可逆的。例如:
c / mol
t/s
L1
H2
(g)
I2
(g)
0 0.0100 0.0100
2HI(g)
正 106 逆 107
mol L1 s1
0 7.60 0
2000 0.00397 0.00397 0.0121 1.20 2.04
反应正向进行; 系统处于平衡状态; 反应逆向进行。
4.2.3 计算平衡的组成
例题:已知反应CO(g)+Cl2(g) COCl2(g) 在恒温恒容条件下进行,373K时K =1.5108。
第四章 化学平衡 熵和Gibbs函数
§4.1 标准平衡常数 §4.2 标准平衡常数的应用 §4.3 化学平衡的移动 §4.4 自发变化和熵 §4.5 Gibbs函数
§4.1 标准平衡常数
4.1.1 化学平衡的基本特征
4.1.2 标准平衡常数表达式 4.1.3 平衡常数与
反应速率系数的关系
4.1.4 标准平衡常数的实验测定
4850 0.00213 0.00213 0.0157 0.345 3.43
反应开始 :c(H2),c(I2) 较大, c(HI) = 0, υ 正较大,υ逆为 0;反应进行:c(H2),c(I2)减小, υ 正减小,c(HI)增大,υ逆增大;某一时刻:υ正= υ 逆,系统组成不变,达到平衡状态。
正
H2 (g) I2 (g)
0.02
逆
2HI(g)
正 逆
0.01
化学平衡:
在一定条件下,可逆反应处于化学 平衡状态:
正 逆 0
特征: (1)系统的组成不再随时间而变。 (2)化学平衡是动态平衡。 (3)平衡组成与达到平衡的途径无关。
4.1.2 标准平衡常数表达式
对于气相反应:
