第三章 立体化学习题解答
高中化学人教版《选修三》《第三章 晶体结构与性质》精品专题课后练习[8](含答案考点及解析)
](https://img.taocdn.com/s3/m/0bfc0601e97101f69e3143323968011ca300f791.png)
高中化学人教版《选修三》《第三章晶体结构与性质》精品专题课后练习[8](含答案考点及解析)----b61c833e-6ebe-11ec-a7e8-7cb59b590d7d高中化学人教版《选修三》《第三章晶体结构与性质》精品专题课后练习[8](含答案考点及解析)高中化学人文教育版《第三选修课》和《第三章晶体结构与性质》精品专题课后练习【8】(含答案考点及解析)类别:_________________;分数:___________1.a、b属于短周期中不同主族的元素,a、b原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若a元素的原子序数为a,则b元素原子序数为()。
a.a-4b.a+5c.a+3d.a+4[答:]BC【考点】高中化学知识点》物质结构与性质》原子结构与元素周期律【解析】可以看出,B和Al,O和s符合问题的含义,即最外层成对电子占据的轨道数等于未成对电子占据的轨道数。
设a为硼,序数为5,B为铝、氧和硫,序数分别为a+8、a+3、a+11和a+5,依此类推。
2.运用元素周期律分析下面的推断,其中错误的是()。
a.铍(be)的氧化物的水化物可能具有两性b、 Astatine(at)是一种白色固体,hat不稳定,AGAT具有很强的光敏性。
C.硫酸锶(SrSO4)是一种白色固体,不溶于水d.硒化氢(h2se)无色、有毒,比h2s更不稳定[答:]B【考点】高中化学知识点》物质结构与性质》原子结构与元素周期律[分析]从上到下,组元素的颜色ⅶ a逐渐变暗,氢化物的稳定性逐渐减弱,卤化银的光敏性逐渐增加。
因此,可以看出astatine是一种接近黑色的固体,hat不稳定,AGAT 具有很强的光敏性,B项是错误的。
3.硫化氢分子中,形成共价键的原子轨道是a.硫原子的2p轨道和氢原子的1s轨道b.硫原子的2p轨道和氢原子的2p轨道c.硫原子的3p轨道和氢原子的1s轨道d.硫原子的2p轨道和氢原子的3p轨道[答:]C【考点】高中化学知识点》物质结构与性质》原子结构与元素周期律【解析】试题分析:H只有一个电子,占据1s轨道,s的最外层电子占据3P轨道。
有机立体化学习题及答案
H 与 H3C H
H Cl
H
2. H3C Cl HH
Cl 与 H3C H
H
3. CH3
C H
H
C
CH3
C
OH
H
CH3
H
与
CC
CH3
H
C
H
OH
4.
CH3
C H
5. CH3 C H
H
C
CH3
C
H OH
H
C
CH3
C
H
OH
H
OH
C
与
H CC
CH3
CH3
H
H
H
CC
CH3
与
CH3
C16.
CH3 H
O CH3
H
CH3 H OH
Cl
H
C2H5
2S,3S
CH3
HO
H
H
Cl
C2H5
2R,3R
2.
CH3
H
OH
HO
H
CH3
CH3
HO
H
H OH
CH3
CH3 H OH
H
OH
CH3
2S,3S
2R,3.
H H H H
COOH
OH OH OH OH
度。 2. 若将该溶液放在 10cm 长的测试管中测定,你观察到的旋光度应是多少?
十六. 某醇 C5H10O(A)具有旋光性,催化加氢后生成的醇 C5H12O(B)没有旋光性,试写出 (答案
一. 1. (2R,3R,4R)—2,3,4,5—四羟基戊醛或 D-(-)核糖 2. (1R,2R)—2—甲基环丁烷羧酸 3. (1S,3R)—1—氯-3-溴环己烷 4. (3R)—(1Z,4E)—3—氯—1,4—戊二烯—1,2,4,5—四醇
大学-立体化学练习题和答案

立体化学(一) 在氯丁烷和氯戊烷的所有异构体中,哪些有手性碳原子?解:氯丁烷有四种构造异构体,其中2-氯丁烷中有手性碳:氯戊烷有八种构造异构体,其中2-氯戊烷(C 2*),2-甲基-1-氯丁烷(C 2*),2-甲基-3-氯丁烷(C 3*)有手性碳原子:(二) 各写出一个能满足下列条件的开链化合物:(1) 具有手性碳原子的炔烃C 6H 10;(2) 具有手性碳原子的羧酸C 5H 10O 2 (羧酸的通式是C n H 2n+1COOH)。
解: (1)(2)(三) 相对分子质量最低而有旋光性的烷烃是哪些?用Fischer 投影式表明它们的构型。
解: 和 和 (四) 是一个具有旋光性的不饱和烃,加氢后生成相应的饱和烃。
不饱和烃是什么?生成的饱和烃有无旋光性? 解:不饱和烃是或,生成的饱和烃无旋光性。
CH 3C CH 3CH 3ClCH 3CH 2CH 3ClCH 3CH 2CH 2CH 2Cl*3ClCH 3CH 2CH 3C CH 3CH 32ClCH 3(CH 2)4ClCH 3CH 2CH 2CHCH 3Cl CH 3CH 22CH 3ClCH 3CHCHCH 3CH 3CH 3CHCH 2CH 3CH 2ClCH 3CCH 2CH 3CH 3CH 3CHCH 2CH 2ClCH 3***CH 3CH 2CHC CH 3*CH 3CH 2CHCOOHCH 3*CH 2CH 32CH 2CH 3H CH 3CH 2CH 32CH 2CH 3H CH 3CH 2CH 3CH(CH 3)2H CH 3CH 2CH 3CH(CH 3)2HCH 3C 6H 12C 6H 12C 6H 12CH 2CH 3CH=CH 2H CH 3CH 2CH 3CH=CH 2H CH 3(五) 比较左旋仲丁醇和右旋仲丁醇的下列各项:(1) 沸点 (2) 熔点 (3) 相对密度 (4) 比旋光度 (5) 折射率 (6) 溶解度 (7) 构型 解: (1)、(2)、(3)、(5)、(6)相同;(4)大小相同,方向相反; (7)构型互为对映异构体。
人教版高中化学选修三第三章 晶体结构与性质 测试(含答案及详细解析共两套)

绝密★启用前2019秋人教版高中化学选修三第三章晶体结构与性质测试本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分第Ⅰ卷一、单选题(共20小题,每小题3.0分,共60分)1.X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是()A. ZXY3B. ZX2Y6C. ZX4Y8D. ZX8Y122.某物质熔融状态可导电,固态可导电,将其投入水中,水溶液也可导电,则可推测该物质可能是()A.金属B.非金属C.可溶性碱D.可溶性盐3.下列说法正确的是A.分子晶体中只存在非极性共价键B.稀有气体形成的晶体属于分子晶体C.干冰升华时,分子内共价健会发生断裂D.金属元素和非金属元素形成的化合物一定是离子化合物4.氮化硅是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。
下列各组物质熔化时,所克服的微粒间的作用力与氮化硅熔化所克服的微粒间的作用力都相同的是( )A.硝石和金刚石B.晶体硅和水晶C.冰和干冰D.萘和蒽5.某离子化合物的晶胞结构如图所示,则该晶体中X、Y的离子个数之比是()A. 4:1B. 1:1C. 2:1D. 1:26.最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺。
这项技术具有广泛的能源潜在用途,包括为汽车提供原料、为潜水艇提供燃料等。
该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气。
合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜。
下列关于铝、镓的说法正确的是()A.铝的金属性比镓强B.铝的熔点比镓低C. Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应D.铝、镓合金与水反应后的物质可以回收利用冶炼铝7.金属晶体的堆积方式、空间利用率和配位数关系正确的是()A.钋Po——简单立方堆积——52%——6B.钠Na——钾型——74%——12C.锌Zn——镁型——68%——8D.银Ag——铜型——74%——88.某晶体中含有A,B,C三种元素,其排列方式如图所示,晶体中A,B,C的原子个数之比依次为()A. 1∶3∶1B. 2∶3∶1C. 8∶6∶1D. 4∶3∶19.石墨是层状晶体,每一层内,碳原子排列成正六边形,许多个正六边形排列成平面网状结构。
(完整word版)高中化学选修3第三章晶体结构与性质讲义及习题

(完整word版)高中化学选修3第三章晶体结构与性质讲义及习题高中化学选修三第三章晶体结构与性质一、晶体常识1、晶体与非晶体比较2、获得晶体的三条途径①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
3、晶胞晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”。
4、晶胞中微粒数的计算方法——均摊法某粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学常见的晶胞为立方晶胞。
立方晶胞中微粒数的计算方法如下:①晶胞顶角粒子为8个晶胞共用,每个晶胞占1/8②晶胞棱上粒子为4个晶胞共用,每个晶胞占1/4③晶胞面上粒子为2个晶胞共用,每个晶胞占1/2④晶胞内部粒子为1个晶胞独自占有,即为1注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状。
二、构成物质的四种晶体1、四种晶体的比较晶体类型分子晶体原子晶体金属晶体离子晶体熔沸点很低很高一般较高,少部分低较高溶解性相似相溶难溶于任何溶剂难溶于常见溶剂(Na等与水反应)大多易溶于水等极性溶剂导电传热性一般不导电,溶于水后有的导电一般不具有导电性(除硅)电和热的良导体晶体不导电,水溶液或熔融态导电延展性无无良好无物质类别及实例气态氢化物、酸(如HCl、H2SO4)、大多数非金属单质(如P4、Cl2)、非金属氧化物(如SO2、CO2,SiO2除外)、绝大多数有机物(有机盐除外)一部分非金属单质(如金刚石、硅、晶体硼),一部分非金属化合物(如SiC、SiO2)金属单质与合金(Na、Mg、Al、青铜等)金属氧化物(如Na2O),强碱(如NaOH),绝大部分盐(如NaCl、CaCO3等)(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。
如熔点:金刚石>碳化硅>硅(3)离子晶体一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。
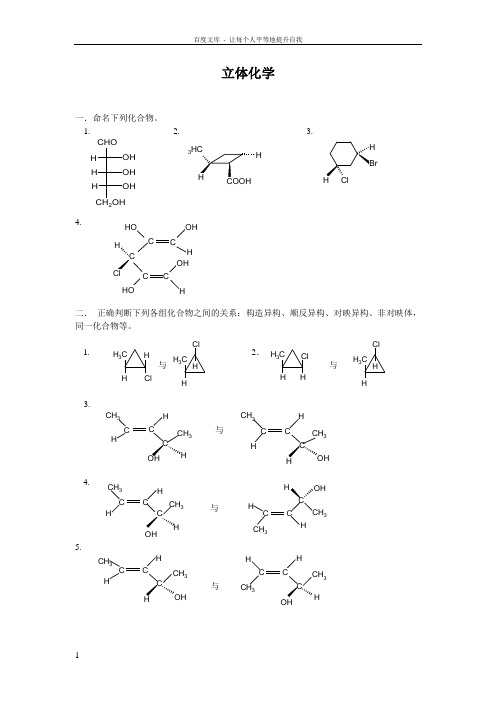
3立体化学参考答案.

第六章 立体化学(参考第三章立体化学基础)6.2 下列化合物中,哪个有旋光异构?标出手性碳,写出可能有的旋光异构体的投影式,用R ,S 标记法命名,并注明内消旋体或外消旋体。
a. 2-溴代-1-丁醇b. α,β-二溴代丁二酸c. α,β-二溴代丁酸d. 2-甲基-2-丁烯酸 参考答案:a.CH 2CH 2CH 2CH 3OH Br CH 2OHH BrCOOH H Br COOH H Br CH 2CH 3( R )( 2R,3R )CH 2OH Br H CH 2CH 3( S )b.HOOCCH CH Br COOH Br ( meso- )COOH H Br COOH Br H COOH Br H COOH H Br ( 2S,3S )c.H 3CCH Br CH COOHBr COOH H Br CH 3H Br COOH Br H COOH Br H COOH H Br COOH Br H ( 2S,3R )( 2R,3S )( 2S,3S )( 2R,3R )COOHBr H CH 3H Br a.CH 2CH 2CH 2CH 3OH Br CH 2OH H Br COOH H Br COOH H Br CH 2CH 3( R )( 2R,3R )CH 2OH Br H CH 2CH 3( S )b.HOOCCH CH COOH Br ( meso- )COOH H Br COOH Br H COOH Br H COOH H Br ( 2S,3S )c.H 3CCH Br CH COOH Br COOH H Br CH 3H Br COOH Br H COOH Br H COOH H Br COOH Br H ( 2S,3R )( 2R,3S )( 2S,3S )( 2R,3R )COOH Br H CH 3H Br a.CH 2CH 2CH 2CH 3OH BrCH 2OH H BrCOOH H Br COOH H Br CH 2CH 3( R )( 2R,3R )CH 2OH Br H CH 2CH 3( S )b.HOOCCH CH Br COOH Br ( meso- )COOH H Br COOH Br H COOH Br H COOH H Br ( 2S,3S )c.H 3CCH Br CH COOH COOH H Br CH 3H Br COOH Br H COOH Br H COOH H Br COOH Br H ( 2S,3R )( 2R,3S )( 2S,3S )( 2R,3R )COOH Br H CH 3H Brd.CH 3C=CHCOOHCH 3( 无 )6.3 可待因是有镇咳作用的药物,但有成瘾性,其结构式如下,用*标出分子中的手性碳原子,理论上它可有多少旋光异构体? 参考答案:有5个手性碳原子OHOOCH 3NCH 3*****理论上它可有25=32个旋光异构体6.5 分子式是C 5H 10O 2的酸,有旋光性,写出它的一对对映体的投影式,并用R,S 标记法命名。
有机化学第三章立体化学详解演示文稿
缩短一个C接到相应缩短后的碳链上:
C C C C C C 2 C C C C C C3
C
C
C CCCC 9
CC
CCCC 同4
CCC
缩短二个C接到相应缩短后的碳链上:
C
C C C C 同3
CCC
C C C C C4 C C C C C 5C C C C C 6
CC
CC
C
C C C C 同4 CCC
C
C C C C C8
E标记。在命名时,将Z,E放到括弧中,写在名称前面。
H
CH3
CC
C2H5
Cl
(Z)-2-氯-2-戊烯
H
Cl
CC
C2H5
CH3
(E)-2-氯-2-戊烯
第9页,共63页。
分子中有一个以上双键时,分别判断每个双键是Z还是E, 命名时低位号者写在前,高位号者写在后,中间用逗号隔 开,放到括弧中,写在名称之前。
为同一化合物
CH3 HO 2 H
H 3 OH
C2H5 I
OH
H2
CH3
和
HO 3
C2H5
H
II
用基团交换法(C2和C3都要交换)
CH3 HO 2 H
H 3 OH
C2 CH3与OH 交换 1 次
OH
2
H3C
H
H 3 OH
C2 CH3与H 交换 2 次
C2H5 I
C2H5 I 的非对映异构体
(接下页)
如:-CH2CH3 > -CH3 -CH2Cl > -CH2F
-CH2OCH3 > -CH2OH -CH(CH3)2 > -CH2CH(CH3)2
化学选修3第三章精选题含答案
第三章1.关于晶体的说法正确的是()A.晶体就是固体B.有些晶体是纯净物,有些晶体是混合物C.晶体从外观上看是有规则几何形状的固体D.不同的晶体可能有不同的几何形状2.下列过程中不能得到晶体的是()A.降低NaCl饱和溶液的温度所得到的固体B.气态水直接冷却成固态水C.熔融的KNO3冷却后所得的固体D.将液态的塑料冷却后所得到的固体3. 普通玻璃和水晶的根本区别在于()A.外形不一样B.普通玻璃的基本构成粒子无规则地排列,水晶的基本构成粒子按一定规律做周期性重复排列C.水晶有固定的熔点,普通玻璃无固定的熔点D.水晶可用于能量转换,普通玻璃不能用于能量转换4.将一块缺角的胆矾晶体悬置于饱和硫酸铜溶液中,一段时间后(温度不变),发现缺角的晶体变完整了。
若溶剂不挥发,则这段时间内晶体和溶液的质量变化分别是A.晶体质量减小,溶液质量变大B.晶体质量变大,溶液质量减小C.晶体和溶液质量都不变D.无法确定5. 水的状态除了气.液和固态外,还有玻璃态。
它是由液态水急速冷却到l 6 5K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是:A.水由液态变为玻璃态,体积缩小 B.水由液态变为玻璃态,体积膨胀C.玻璃态是水的一种特殊状态 D.玻璃态水是分子晶体6. 从物体的外形来判断是否是晶体,下列叙述中正确的是( )A.玻璃具有规则的几何外形,所以它玻璃是晶体B.无规则外形的物体,一定不是晶体C.敲打一块石英后,使它失去了天然面,没有规则的外形了,但它仍是晶体D.晶体在外形上都具有规则的几何形状,其对应的表面之间的夹角大小相等7. 下列关于晶体与非晶体之间的区别的叙错误的是()A.化学性质不同 B.物理性质不同 C.外观形状不同 D.微粒状态不同8. 关于晶体的结构说法正确的是()A.晶体内部的质点排列规则有序B.凡是有棱角的物质就是晶体C.晶体的外观规则,但是有些内部结构是无序的D.粉末状的物质不是晶体9.有关晶胞的叙述正确的是()A.晶胞是晶体结构中的基本结构单元B.根据晶体的不同,晶胞可以是多种形状的几何体C.晶胞都是平行六面体D.晶胞都是正八面体10.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。
人教版高中化学选修三第三章 晶体结构与性质(含答案)
第三章晶体结构与性质一、单选题1.下列化合物,按其晶体的熔点由高到低排列正确的是A. SiO2CsCl CBr4CF4B. SiO2CsCl CF4CBr4C. CsCl SiO2CBr4CF4D. CF4CBr4CsCl SiO22.如图,石墨晶体结构的每一层里平均每个最小的正六边形占有碳原子数目为()A. 2B. 3C. 4D. 63.下列说法正确的是()A.分子晶体中一定存在分子间作用力,不一定存在共价键B.分子中含两个氢原子的酸一定是二元酸C.含有金属阳离子的晶体一定是离子晶体D.元素的非金属性越强,其单质的活泼性一定越强4.如图为金属镉的堆积方式,下列说法正确的是( )A.此堆积方式属于非最密堆积B.此堆积方式为A1型C.配位数(一个金属离子周围紧邻的金属离子的数目)为8D.镉的堆积方式与铜的堆积方式不同5.下列性质适合于分子晶体的是()A.熔点1070 ℃,易溶于水,水溶液导电B.熔点2853 ℃,液态不导电,水溶液也不导电C.能溶于CS2,熔点112.8 ℃,沸点444.6 ℃D.熔点97.81 ℃,质软导电,密度为0.97 g·cm-36.下列有关金属晶体的说法中不正确的是()A.常温下不都是晶体B.最外层电子数少于3个的原子不都是金属C.任何状态下都有延展性D.都能导电、传热7.下面的排序不正确的是()A.晶体熔点由低到高:F2<Cl2<Br2<I2B.熔点由高到低: Na>Mg>AlC.硬度由大到小:金刚石>碳化硅>晶体硅D.晶格能由大到小: MgO>CaO>NaF> NaCl8.如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中○—X、●—Y、⊗—Z。
其对应的化学式不正确的是()A.答案AB.答案BC.答案CD.答案D9.为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,可以进行下列实验,其中合理、可靠的是() A.观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体。
有机化学第三章立体化学基础(2024)
手性药物的合成。手性药物是指具有手性中心的药物分子。在合成手性药物时,需要利用 立体化学原理来控制产物的立体构型。例如,通过引入手性辅剂或利用不对称催化等方法 ,可以实现手性药物的高效合成。
22
06
2024/1/25
立体化学在药物设计中的重要性
23
药物活性与手性关系
手性对药物活性的影响
手性药物的两个对映异构体可能具有 不同的生物活性,其中一个可能具有 治疗效果,而另一个可能无效或有毒 。
手性中心判断方法
7
2024/1/25
03
观察碳原子连接的四个基团或 原子是否相同,若不相同则为 手性中心。
04
使用Cahn-Ingold-Prelog规则 (CIP规则)进行判断。
9
手性分子表示方法
2024/1/25
Fischer投影式
01
将碳链竖直表示,横前竖后,横向基团朝右,纵向基团朝上。
透视式
一个物体不能通过旋转和平移操作与其镜 像完全重合的性质。
对称性的定义
一个物体可以通过旋转和平移操作与其镜 像完全重合的性质。
手性与对称性的关系
手性是对称性的一个特例,即没有对称中 心或对称面的物体具有手性。
手性在化学中的应用
手性化合物在生命体系中具有重要的作用 ,如氨基酸、糖类等。
5
构型与构象
构型的定义
02
将碳链放平,基团朝向观察者方向。
Newman投影式
03
沿碳-碳键的键轴方向观察,将碳原子和与之相连的基团放在纸
平面上,其他基团则竖立在纸平面上。
10
2024/1/25
03
对称性与对称操作
11
对称元素及类型
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cl H Br H3C
S
Cl Br
R R
CH2CH3 H I
R
H3C H OH
S
S
OH
E D
5
3-18命名下列化合物
A
Br H3C H3C
B
Br H OH H HO
C
CH3 CH3 H H OH
S S
H
R S
CH3
S
HO
R
H
CH3
(2S,3S)-3-溴-2-丁醇
D
Br H H
E
Br CH3 OH H HO H
无光学活性,有对称面
9
CH2Br HO HO BrH2C
CH2Cl H H H H HO ClH2C H
S R R
Br
R
OH H OH
R
光学活性
10
C2H5 CH3 Br CH2CH3
CH2CH3 H3C H3C C2H5 Br H Br H
CH2CH3 CH3 CH3 C2H5
8
3-21判断下列化合物是否有光学活性?并表 明不对称碳原子的构型。
CH2CH3 H HO H CH2OH Br H
S
I H
R
HO H H CH2OH
R
I
S
Br
CH2CH3
第三章 立体化学
习题解答
1
3-13写出下列四式的关系,并表明分子中不对称碳原子的构型
A
CH3 Cl H3C
B
H H OH Cl HO
C
OH H3C CH3 CH3 H H Cl
D
C2H5 CH3 OH
R
S R
CH3
Cl CH3 C2H5 C2H5
R
C2H5
HO H HO CH3 CH3 H H3C C2H5 H HO Cl OH CH3 CH3 Cl Cl C2H5 CH3 H C2H5
COOH
4
3-17指出下列分子中不对称碳原子的构型,并指出 (A),(B),(C),(D),(E)之间的关系。
CH3 I Cl I H CH3 CH3 Br Cl I Cl
R
R
Br H
R R
OH H Br
S
OH H
R
H H3CH2C H OH
S
CH2CH3
S
S
CH2CH3
A
B
C
CH2CH3 H H
R R
CH3
R R
CH3 C2H5
6
3-20将组中各化合物改写成 Fischer 投影式
H H3C Br H OH CH2CH3 H3C Br H H CH2CH3 OH
CH2CH3 HO H CH3 H Br H H
CH2CH3 OH Br CH3
7
CH3 H3C H3CH2C H Br CH2CH3 H H3C
Fischer式
锯架式
伞形式
Newman式
3
3-15下面的分子中有几个手性碳原子?每个手性碳原子的构 型是什么?该分子有几个旋光异构体?其中有几对异构体? 每一个化合物有几个非对映异构体?
CHO
R
H H H OH
S S
OH OH
根据分子式可能的异构体数目为23=8, 有四对对映异构体,每一个化合物有 六个非对映异构体。
CH3
S S
C2H5
Cl HO CH3 Cl
C2H5 CH3 H
R S
CH3
B,D为同一种化合物,A,C为对映异构体; A与B,A与D,B与C,C与D为非对映异构体。
2
3-14写出(2S,3R)-3-氯-2-溴戊烷的Fischer投影式, 并写出其优势构象的锯架式、伞形式、Newman式。
CH3 CH3 H H C2H5 Br Cl C2H5 H Br Cl H Cl C2H5 Br H H CH3 CH3 H Br C2H5 Cl H
