(完整版)北京市第二类体外诊断试剂临床试验指导原则(2016年版)
第二类体外诊断试剂注册申报资料要求及说明

第二类体外诊断试剂注册申报资料要求一、监管信息(一)章节目录应当包括本章的所有标题和小标题,注明目录中各内容的页码。
(二)申请表按照要求填写完整,电子申报申请表在系统中填报完整后自动生成。
(三)术语、缩写词列表如适用,应当根据注册申报资料的实际情况,对其中出现的需要明确含义的术语或缩写词进行定义。
(四)产品列表以表格形式列出拟申报产品的包装规格、主要组成成分,以及每个包装规格的标识(如货号、器械唯一标识等)和描述说明。
(五)关联文件1.提交事业单位法人证书。
(如适用)2.通过国家药品监督管理局《创新医疗器械特别审查程序》、江苏省药品监督管理局《江苏省第二类医疗器械创新产品注册程序(试行)》的产品申请注册时,应当提交通过创新医疗器械审查的相关材料。
3.主文档授权信如适用,申请人应当对主文档引用的情况进行说明。
申请人应当提交由主文档所有者或其备案代理机构出具的授权申请人引用主文档信息的授权信。
授权信中应当包括引用主文档的申请人信息、产品名称、已备案的主文档编号、授权引用的主文档页码/章节信息等内容。
(六)申报前与监管机构的联系情况和沟通记录1.在产品申报前,如果申请人与监管机构针对申报产品以会议形式进行了沟通,或者申报产品与既往注册申报相关。
应当提供下列内容(如适用):(1)列出监管机构回复的申报前沟通。
(2)既往注册申报产品的受理号。
(3)既往申报前沟通的相关资料,如既往申报会议前提交的信息、会议议程、演示幻灯片、最终的会议纪要、会议中待办事项的回复,以及所有与申请相关的电子邮件。
(4)既往申报(如自行撤销/不予注册上市申请等)中监管机构已明确的相关问题。
(5)在申报前沟通中,申请人明确提出的问题,以及监管机构提供的建议。
(6)说明在本次申报中如何解决上述问题。
2.如不适用,应当明确声明申报产品没有既往申报和/或申报前沟通。
(七)符合性声明申请人应当声明下列内容:1.申报产品符合《体外诊断试剂注册与备案管理办法》和相关法规的要求。
北京市第二类体外诊断试剂临床试验指导原则(2016年版)

北京市第二类体外诊断试剂临床试验指导原则(2016年版)(征求意见稿)本原则适用于指导北京市第二类体外诊断试剂检测方法等效性临床研究,对临床试验机构和参比系统的选择、样本要求、临床实验方案、临床试验数据分析等提出了一般性要求。
申请人应在完成产品分析性能评估、拟定产品标准后,方可申请该产品的临床评价。
临床评价开始前,申请人应根据产品特点及使用目的,确定临床评价的项目和方法,制定合理可靠的临床评价方案。
申请人应根据国家相关法律法规、标准及技术指导原则的要求合理评价产品的安全性和有效性。
一、临床试验机构的选择临床评价开始前,申请人应根据申报产品特点选择临床试验机构。
临床试验机构应当具有与申报产品相适应的条件及能力。
试验机构的选择应符合以下要求:(一)应选择至少两家获得国家食品药品监督管理总局资质认可的医疗机构。
医疗机构的临床实验室(简称实验室)应符合《医疗机构临床实验室管理办法》(卫医发〔2006〕73号)的要求,并优先考虑经中国合格评定国家认可委员会(CNAS)依据《医学实验室质量和能力认可准则》(CNAS-CL02等同ISO15189)或《检测和校准实验室能力认可准则》(CNAS-CL01等同ISO17025)认可的实验室。
(二)实验室应有完善的室内质控程序,并应优先选择连续两年以上室间质量评价相关专业结果合格的实验室。
整个实验过程都应处于有效的质量控制下,并有措施保证试验数据的准确性及可重复性。
(三)实验室的检测人员应具有相应资质(项目负责人至少具有相关专业中级或以上技术职称)。
(四)实验室应有能力提供临床评价所需的各类样本。
(五)临床试验必须获得临床试验机构伦理委员会的同意。
二、参比检测系统的选择以下将申报产品的检测系统称为考核系统,所选择的对照检测系统称为参比系统。
(一)实验室应保证所用检测系统的完整性和有效性。
考核系统和对照系统的主要分析性能指标(如准确性、精密度、线性范围等)应满足临床要求。
体外诊断试剂临床试验技术指导原则

体外诊断试剂临床试验技术指导原则一、概述体外诊断试剂的临床试验(包括与已上市产品进行的比较研究试验)是指在相应的临床环境中,对体外诊断试剂的临床性能进行的系统性研究。
申请人应在符合要求的临床单位,在满足临床试验最低样本量要求的前提下,根据产品临床预期用途、相关疾病的流行率和统计学要求,制定能够证明其临床性能的临床试验方案,同时最大限度地控制试验误差、提高试验质量并对试验结果进行科学合理的分析。
临床试验报告是对临床试验过程、结果的总结,是评价拟上市产品有效性和安全性的重要依据,是产品注册所需的重要文件之一。
本指导原则仅对体外诊断试剂临床试验提出了一般性的要求。
由于体外诊断试剂产品具有发展快、专业跨度大、临床预期用途各异的特点,不同临床预期用途产品的临床试验方法及内容不尽相同。
申请人应根据产品特点及临床预期用途,制定合理的临床试验方案。
国家食品药品监督管理总局也将根据体外诊断试剂发展的需要,适时修订本指导原则。
二、临床试验的基本原则(一)基本要求1.临床试验必须符合赫尔辛基宣言的伦理学准则,必须获得临床试验机构伦理委员会的同意。
研究者应考虑临床试验用样本,如血液、羊水、胸水、腹水、组织液、胸积液、组织切片、骨髓等的获得或试验结果对受试者的风险性,应提交伦理委员会的审查意见及受试者的知情同意书。
对于例外情况,如客观上不可能获得受试者的知情同意或该临床试验对受试者几乎没有风险,可经伦理委员会审查和批准后免于受试者的知情同意。
2.受试者的权益、安全和健康必须高于科学和社会利益。
3.为受试者保密,尊重个人隐私。
防止受试者因检测结果而受到歧视或伤害。
4.临床前研究结果支持进行临床试验。
(二)临床试验机构及人员的要求1. 第三类体外诊断试剂申请人应当选定不少于3家(含3家)、第二类体外诊断试剂申请人应当选定不少于2家(含2家)临床试验机构,按照有关规定开展临床试验。
2.体外诊断试剂的临床试验机构应获得国家食品药品监督管理总局资质认可。
体外诊断试剂临床试验技术指导原则

体外诊断试剂临床试验技术指导原则(征求意见稿)一、概述体外诊断试剂的临床试验(包括与已上市产品进行的比较研究试验)是指在相应的临床环境中,对体外诊断试剂的临床性能进行的系统性研究。
申请人应在符合要求的临床单位,在满足临床试验最低样本量要求的前提下,根据产品临床预期用途、相关疾病的流行率和统计学要求,制定能够证明其临床性能的临床试验方案,同时最大限度地控制试验误差、提高试验质量并对试验结果进行科学合理的分析。
临床试验报告是对临床试验过程、结果的总结,是评价拟上市产品有效性和安全性的重要依据,是产品注册所需的重要文件之一。
本指导原则仅对体外诊断试剂临床试验提出了一般性的要求。
由于体外诊断试剂产品具有发展快、专业跨度大、临床预期用途各异的特点,不同临床预期用途的产品的临床试验方法及内容不尽相同。
申请人应根据产品特点及临床预期用途,制定合理的临床试验方案。
国家食品药品监督管理总局也将根据体外诊断试剂发展的需要,适时修订本指导原则。
二、临床试验的基本原则(一)基本要求1.必须符合赫尔辛基宣言的伦理学准则。
伦理考虑:研究者应考虑临床试验用样本,如血液、羊水、胸水、腹水、组织液、胸积液、组织切片、骨髓等的获得或试验结果对受试者的风险性,应提交伦理委员会的审查意见及受试者的知情同意书。
对于例外情况,如客观上不可能获得受试者的知情同意或该临床试验对受试者几乎没有风险,可不提交伦理委员会的审查意见及受试者的知情同意书,但临床研究者应提供有关伦理事宜的说明。
2.受试者的权益、安全和意志高于临床试验的需要。
3.为受试者保密,尊重个人隐私。
防止受试者因检测结果而受到歧视或伤害。
4.临床前研究结果支持进行临床试验。
(二)临床试验机构及人员的要求1.体外诊断试剂的临床试验机构应获得国家食品药品监督管理总局资质认可。
2.申请人应根据产品特点及其预期用途,综合不同地区人种、流行病学背景、病原微生物的特性等因素选择临床试验机构。
临床试验机构必须具有与试验用体外诊断试剂相适应的专业技术人员,及仪器设备,并能够确保该项试验的实施。
市第二类体外诊断试剂临床试验指导原则版完整版

市第二类体外诊断试剂临床试验指导原则版完整版市第二类体外诊断试剂是指应用于人体液、组织、细胞等体外材料的试剂,用于诊断、筛查、预测、监测和疾病管理的辅助工具。
临床试验是评价这些试剂的安全性和有效性的必要步骤,是临床研究的重要环节。
以下是市第二类体外诊断试剂临床试验指导原则的完整版:一、试验目的1.评估试剂的诊断准确性和性能指标,确保其可靠性和有效性。
2.研究试剂与疾病的关联性,进一步了解其临床应用价值。
3.评价试剂对疗效预测、预后监测等方面的作用,为临床实践提供科学依据。
二、试验设计1.确定试验类型,如前瞻性研究、回顾性研究、交叉验证研究等。
2.选择研究对象,包括人群样本的选择和疾病诊断标准的确定。
3.分组设计,将研究对象按照特定标准分为试验组和对照组,确保研究结果的可比性。
三、伦理审查1.提交试验方案和相关材料,经伦理委员会审查通过后方可进行试验。
2.确保参与者知情同意,试验过程中随时维护其权益和安全。
四、试验数据采集和分析1.确定试验数据采集的内容和方法,如样本采集、试验操作等。
2.对数据进行统计分析,包括统计量的计算、显著性检验等。
3.提供结果的可视化和解释,便于对试剂的效果和特异性进行评估。
五、试验结果报告1.撰写试验报告,包括试验目的、设计、方法、结果和结论等内容。
2.严格按照科学规范进行文献引用和结果解释,确保结果的可靠性和可信度。
3.报告的撰写应符合相关法规和规范,如《临床试验报告规范》等。
六、质量控制和风险管理1.对试验中的操作和数据采集进行质量控制,确保数据的准确性和可靠性。
2.针对可能出现的风险和意外事件制定风险管理措施,及时采取相应措施。
七、试验结果的转化和应用1.结合试验结果,制定相应的临床应用指南和操作流程,指导医务人员的实际操作。
2.对试剂的临床应用进行监测和评估,及时调整和更新相关指南和流程。
以上是市第二类体外诊断试剂临床试验指导原则的完整版,通过严格执行这些指导原则,可以确保临床试验的科学性和规范性,为试剂的临床应用提供科学依据,并最终提高诊断准确性和疾病管理水平。
体外诊断试剂技术审查指导原则
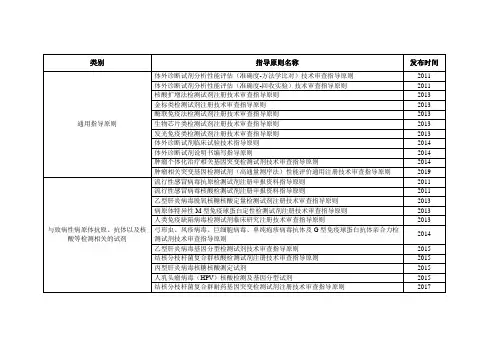
与致病性病原体抗原、抗体以及核酸等检测相关的试剂
流行性感冒病毒抗原检测试剂注册申报资料指导原则
2011
流行性感冒病毒核酸检测试剂注册申报资料指导原则
2011
乙型肝炎病毒脱氧核糖核酸定量检测试剂注册技术审查指导原则
2013
病原体特异性M型免疫球蛋白定性检测试剂注册技术审查指导原则
2013
人类免疫缺陷病毒检测试剂临床研究注册技术审查指导原则
2017
降钙素原检测试剂注册技术审查指导原则
2019
糖化白蛋白测定试剂注册技术审查指导原则
2020
用于激素检测的试剂
人绒毛膜促性腺激素检测试剂(胶体金免疫层析法)注册技术审查指导原则(2016修订版)
2016
促甲状腺素检测试剂注册技术审查指导原则
2016
促黄体生成素检测试剂(胶体金免疫层析法)注册技术审查指导原则
呼
基于核酸检测方法的金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌检测试剂注册技术审查指导原则
2019
沙眼衣原体和/或淋病奈瑟菌核酸检测试剂注册技术审查指导原则
2019
乙型肝炎病毒e抗原、e抗体检测试剂注册技术审查指导原则
2020
EB病毒核酸检测试剂注册技术审查指导原则
脑利钠肽/氨基末端脑利钠肽前体检测试剂注册技术审查指导原则
2019
尿酸测定试剂注册技术审查指导原则
2019
尿素测定试剂注册技术审查指导原则
2019
氨基酸、肉碱及琥珀酰丙酮检测试剂注册技术审查指导原则
2019
总胆汁酸测定试剂注册技术审查指导原则
2020
肌酐测定试剂注册技术审查指导原则
2020
其它
流式细胞仪配套用检测试剂注册技术审查指导原则
免于进行临床试验的第二类体外诊断试剂目录
064
碱性磷酸酶检测试剂
6840
用于检测人体样本中碱性磷酸酶的活性,临床上主要用于肝胆疾病和骨骼疾病的辅助诊断。
065
乳酸脱氢酶检测试剂
6840
用于检测人体样本中乳酸脱氢酶的活性,临床上主要用于心肌梗死、肝病等疾病的辅助诊断。
004
总蛋白检测试剂
6840
用于检测人体样本中总蛋白的含量,临床上主要用于辅助评价肝脏功能。
005
白蛋白检测试剂
6840
用于检测人体样本中白蛋白的含量,临床上主要用于辅助评价肝脏功能及营养评估等。
006
前白蛋白检测试剂
6840
用于检测人体样本中前白蛋白的含量,临床上主要用于反映肝损害程度及营养评估等。
030
胃蛋白酶原Ⅱ检测试剂
6840
用于检测人体样本中胃蛋白酶原Ⅱ的含量,临床上主要用于评价胃底粘腺病变。
031
抗链球菌溶血素O检测试剂
6840
用于检测人体样本中抗链球菌溶血素O的含量,临床上主要用于急性风湿热的辅助诊断。
032
降钙素检测试剂
6840
用于检测人体样本中的降钙素(CT)的含量,临床上主要用于甲状旁腺功能的辅助诊断。
066
乳酸脱氢酶同工酶检测试剂
6840
用于检测人体样本中乳酸脱氢酶同工酶的活性,临床上主要用于心肌梗死、肝病等疾病的辅助诊断。
067
γ-谷氨酰基转移酶检测试剂
6840
用于检测人体样本中γ-谷氨酰基转移酶的活性,临床上主要用于肝胆系统疾病的辅助诊断。
068
γ-谷氨酰基转移酶同工酶检测试剂
(完整版)北京市第二类体外诊断试剂临床试验指导原则(2016年版)
北京市第二类体外诊断试剂临床试验指导原则(2016年版)(征求意见稿)本原则适用于指导北京市第二类体外诊断试剂检测方法等效性临床研究,对临床试验机构和参比系统的选择、样本要求、临床实验方案、临床试验数据分析等提出了一般性要求。
申请人应在完成产品分析性能评估、拟定产品标准后,方可申请该产品的临床评价。
临床评价开始前,申请人应根据产品特点及使用目的,确定临床评价的项目和方法,制定合理可靠的临床评价方案。
申请人应根据国家相关法律法规、标准及技术指导原则的要求合理评价产品的安全性和有效性。
一、临床试验机构的选择临床评价开始前,申请人应根据申报产品特点选择临床试验机构。
临床试验机构应当具有与申报产品相适应的条件及能力。
试验机构的选择应符合以下要求:(一)应选择至少两家获得国家食品药品监督管理总局资质认可的医疗机构。
医疗机构的临床实验室(简称实验室)应符合《医疗机构临床实验室管理办法》(卫医发〔2006〕73 号)的要求,并优先考虑经中国合格评定国家认可委员会(CNAS )依据《医学实验室质量和能力认可准则》(CNAS-CL02等同ISO15189)或《检测和校准实验室能力认可准则》(CNAS-CL01等同ISO17025)认可的实验室。
(二)实验室应有完善的室内质控程序,并应优先选择连续两年以上室间质量评价相关专业结果合格的实验室。
整个实验过程都应处于有效的质量控制下,并有措施保证试验数据的准确性及可重复性。
(三)实验室的检测人员应具有相应资质(项目负责人至少具有相关专业中级或以上技术职称)。
(四)实验室应有能力提供临床评价所需的各类样本。
(五)临床试验必须获得临床试验机构伦理委员会的同意。
二、参比检测系统的选择以下将申报产品的检测系统称为考核系统,所选择的对照检测系统称为参比系统。
(一)实验室应保证所用检测系统的完整性和有效性。
考核系统和对照系统的主要分析性能指标(如准确性、精密度、线性范围等)应满足临床要求。
北京市药品监督管理局关于发布第二类医疗器械(含体外诊断试剂)注册申报事项及资料要求的通告
北京市药品监督管理局关于发布第二类医疗器械(含体外诊断试剂)注册申报事项及资料要求的通告文章属性•【制定机关】北京市药品监督管理局•【公布日期】2021.12.30•【字号】通告〔2021〕4号•【施行日期】2022.01.01•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】医政医管综合规定正文北京市药品监督管理局关于发布第二类医疗器械(含体外诊断试剂)注册申报事项及资料要求的通告为贯彻执行国家药品监督管理局《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(国家药品监督管理局公告2021年第121号)、《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家药品监督管理局公告2021年第122号)要求,北京市药品监督管理局对本市现有第二类医疗器械产品首次注册等事项及申报资料进行调整,现予公布,自2022年1月1日起施行。
一、自2022年1月1日起,注册申请人应当登陆北京市药品监督管理局企业服务平台(网址:/bfdaww/common/index/style/login/login.jsp )进行相关事项申报,申报资料、申请表单以北京市药品监督管理局网站(网址:/)相应办事指南为准。
二、自2022年1月1日起,注册申请人应当在申报第二类医疗器械产品注册时提交与产品研制、生产有关的质量管理体系相关资料,北京市药品监督管理局不再单独设立医疗器械注册质量管理体系核查申报事项。
三、2022年1月1日前已在办理过程中的第二、三类医疗器械首次注册申请,尚未申请或尚未完成医疗器械注册质量管理体系核查的,应当直接向北京市医疗器械审评检查中心提交相应注册质量管理体系核查资料。
四、依据《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)、《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号)要求,第二类医疗器械产品注册证登记事项变更调整为第二类医疗器械产品注册证变更备案,第二类体外诊断试剂产品注册证登记事项变更调整为第二类体外诊断试剂产品注册证变更备案;第二类医疗器械产品注册证许可事项变更调整为第二类医疗器械产品注册证变更注册,第二类体外诊断试剂产品注册证许可事项变更调整为第二类体外诊断试剂产品注册证变更注册。
体外诊断试剂分析性能评估系列指导原则
附件:《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》目录1.体外诊断试剂分析性能评估指导原则――编制说明2.体外诊断试剂分析性能评估指导原则——检测限3.体外诊断试剂分析性能评估指导原则——线性范围4.体外诊断试剂分析性能评估指导原则——可报告范围5.体外诊断试剂分析性能评估指导原则——准确度(回收实验)6.体外诊断试剂分析性能评估指导原则——准确度(方法学比对)7.体外诊断试剂分析性能评估指导原则——精密度8.体外诊断试剂分析性能评估指导原则——干扰实验9.体外诊断试剂分析性能评估指导原则——稳定性10.体外诊断试剂分析性能评估指导原则——参考值(参考区间)附件1:体外诊断试剂分析性能评估指导原则编制说明《体外诊断试剂注册管理办法(试行)》颁布后,体外诊断试剂产品的注册过程中要求提供申报产品的分析性能评估资料,产品性能评估是产品研发、制定产品标准等过程的重要技术支持研究过程,并可能对产品的质量造成一定的影响。
目前国际上对体外诊断试剂的性能评估通常是以美国临床实验室标准化组织(Clinical and Laboratory Standards Institude以下称为CLSI)的相关标准为依据,也是美国FDA 推荐采用的评价标准,但我国还没有相关的标准及指导原则的要求。
为进一步明确体外诊断试剂分析性能评估的技术要求,我中心组织有关专家起草产品分析性能评估指导原则,以明确体外诊断试剂产品性能评估的技术要求。
体外诊断试剂产品性能评估包括检测限、线性范围、可报告范围、准确度(回收实验)、准确度(方法学比较)、精密度、干扰实验、稳定性、参考区间共九个项目。
起草的主要依据CLSI发布的以下标准:1. C28-A2: How to define and determine reference intervals in the clinical laboratory; Approved Guideline-Second Edition.2. EP5-A: Evaluation of precision performance of clinical chemistry devices; Approved Guideline.3. EP6-A: Evaluation of the linearity of quantitative measurement procedures; A Statistical Approach; Approved Guideline.4. EP7-A: Interference testing in clinical chemistry; Approved Guideline.5. EP9-A2: Method comparison and bias estimation using patient samples; Approved Guideline-Second Edition.每项性能的主要研究方法均采用以上标准和国内实际采用的评价方法相结合的方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京市第二类体外诊断试剂临床试验指导原则(2016年版)(征求意见稿)本原则适用于指导北京市第二类体外诊断试剂检测方法等效性临床研究,对临床试验机构和参比系统的选择、样本要求、临床实验方案、临床试验数据分析等提出了一般性要求。
申请人应在完成产品分析性能评估、拟定产品标准后,方可申请该产品的临床评价。
临床评价开始前,申请人应根据产品特点及使用目的,确定临床评价的项目和方法,制定合理可靠的临床评价方案。
申请人应根据国家相关法律法规、标准及技术指导原则的要求合理评价产品的安全性和有效性。
一、临床试验机构的选择临床评价开始前,申请人应根据申报产品特点选择临床试验机构。
临床试验机构应当具有与申报产品相适应的条件及能力。
试验机构的选择应符合以下要求:(一)应选择至少两家获得国家食品药品监督管理总局资质认可的医疗机构。
医疗机构的临床实验室(简称实验室)应符合《医疗机构临床实验室管理办法》(卫医发〔2006〕73号)的要求,并优先考虑经中国合格评定国家认可委员会(CNAS)依据《医学实验室质量和能力认可准则》(CNAS-CL02等同ISO15189)或《检测和校准实验室能力认可准则》(CNAS-CL01等同ISO17025)认可的实验室。
(二)实验室应有完善的室内质控程序,并应优先选择连续两年以上室间质量评价相关专业结果合格的实验室。
整个实验过程都应处于有效的质量控制下,并有措施保证试验数据的准确性及可重复性。
(三)实验室的检测人员应具有相应资质(项目负责人至少具有相关专业中级或以上技术职称)。
(四)实验室应有能力提供临床评价所需的各类样本。
(五)临床试验必须获得临床试验机构伦理委员会的同意。
二、参比检测系统的选择以下将申报产品的检测系统称为考核系统,所选择的对照检测系统称为参比系统。
(一)实验室应保证所用检测系统的完整性和有效性。
考核系统和对照系统的主要分析性能指标(如准确性、精密度、线性范围等)应满足临床要求。
(二)参比系统的试剂、仪器、校准品均应已取得医疗器械注册证;考核系统的仪器、校准品应已取得医疗器械注册证或与考核试剂同步注册,且进度基本一致。
(三)参比系统应选择与考核产品方法学原理相同(如同为酶联免疫反应、同为化学发光免疫反应等)或相似的,其方法学分析性能应优于或近似于考核产品。
(四)对于定量产品,参比试剂的性能技术指标(如线性范围、精密度等)应与考核试剂近似或更优,两者的参考区间不宜差别过大;对于定性产品,两者检出限/临界值应基本一致;对于半定量产品,两者的分段区间应基本一致。
(五)定性产品可选性能更优的半定量或定量产品作为参比试剂(统计数据时应先将定量/半定量测试结果按照其自身说明书中确定的参考区间/临界值分别划归阴性、阳性结果后,再进行两个试剂测试结果间的等效性分析)。
同理,半定量产品可选择定量产品作为参比试剂。
三、试验样本的选择(一)应明确临床样本要求,考核系统与参比系统所用样本及其要求应一致。
应注明样本采集、预处理、保存、输送的要求及条件(如明确采血管种类、抗凝剂要求等)。
注:推荐使用新鲜样本,如果使用贮存样本时,应注明贮存条件及时间,在数据分析时应考虑其影响并说明。
应明确样本纳入及排除的准则,对厂家声称的可能对检测结果有明显干扰作用的样本,如溶血、脂血或黄疸等样本尽量避免使用(分析干扰因素时除外)。
(二)应考虑样本中被测量的分布。
样本量及其分布应符合统计学及具体产品相关指导原则的要求。
定量测试的产品,样本中待测物浓度原则上应覆盖考核系统检测范围且均匀分布,并应包含医学决定水平。
落在参考区间以外的比例应不低于试验总量的30 。
定性测试的产品,应该包含一定数量的阳性、阴性和接近临界值样本,阳性样本比例应不低于30%。
如果检测系统同时可给出诸如OD值、S/CO 值等量化结果,应一并给出,以验证其数据分布的合理性。
半定量测试的产品,样本在各分段区间的试验例数应尽量均匀,且各分段区间内试验例数不宜低于30例。
如果阳性样本数达不到上述要求,应有充分合理的理由,并应由临床试验机构出具解释说明情况。
临床试验机构各自的试验例数不宜低于100例。
(三)关于样本类型的选择。
考核试剂和参比试剂的样本类型应与其各自产品说明书要求一致。
考核试剂声称的不同样本类型(如血液、尿液),应分别进行临床试验。
如果声称同时适用于血清/血浆/全血样本,那么血清(或血浆或全血)的试验例数按照《体外诊断试剂临床试验技术指导原则》的要求,并同时在至少两家临床机构共验证不少于100例受试者的自身血清、血浆和/或全血样本测试结果间的一致性(采用考核试剂评价),其中不同浓度样本分布情况与总例数中分布情况应一致。
四、临床试验方案本文主要考虑采用已批准上市产品作为参比系统,评价考核系统和参比系统的等效性。
临床试验实施前,研究人员应从流行病学、统计学、临床医学、检验医学等多方面考虑,设计科学、合理的临床试验方案。
各临床试验机构的方案应一致,且保证在整个临床试验过程中被遵循实施,不可随意改动。
整个试验过程应在临床试验机构的实验室内并由其实验室的技术人员操作完成,申报单位的技术人员除进行必要的技术指导外,不得干涉实验进程。
临床试验过程、试验结果处理及试验报告应真实、客观、公正,不受外来因素的干预。
试验方案中应确定样本纳入/排除标准,任何已经入选的样本再被排除出临床试验都应记录在案并说明原因。
在试验操作过程中和判定试验结果时,应采用盲法以保证试验结果的客观性。
各试验单位选用的对照试剂及第三方复核试剂应保持一致,以便进行合理的统计学分析。
五、试验过程的管理及数据分析对于定量检测,可以通过分析检测结果的相关性及偏倚/偏差进行评价;定性/半定量检测,可以通过分析检测结果的一致性进行等效性评价。
必要时,临床试验研究还应考虑诊断灵敏度、诊断特异性等其他性能的评估。
(一)试验前的准备负责临床试验的检测人员应有足够的时间熟悉检测系统的各环节(试剂、质控及仪器操作程序等),熟悉评价方案并进行预试验。
考核系统和参比系统都应建立适当的质控程序,应保证检测结果的可靠性。
(二)试验过程的管理每天试验时间应根据被测物在样本中的稳定性及试验时间长短决定,其原则为试验时间不得长于被测物在样本中的稳定时间。
每批样本尽可能在考核系统及参比系统同时开始检测,并保证同一样本在规定时间内完成比对试验。
原则上,每种方法对每个样本单次测试即可(以下临床试验统计计算方法均基于此原则,如果为双次测定则可参照NLSI EP9-A2)。
推荐进行平行检测,试验过程中要观察离群值(任一样本,如其两种方法测试的绝对差值/相对差值超出所有样本两种方法测试绝对差值/相对差值的均值的4倍,则被判断为离群值)。
离群值的个数不得超过2.5%(比如,在100个样本的临床试验中,不得出现3个离群值)。
若未超限,则删除离群值后进行分析;如超出此限又找不到合理原因,应重新收集样本进行分析。
(三)定量产品回归及偏倚估计的数据分析对于定量产品,应至少进行以下数据分析——1.绝对偏倚图考核系统与参比系统每个样本测定值之差与相应两系统测试均值作散点图。
观察并分析各点的绝对偏倚分布情况。
2.相对偏倚图考核系统与参比系统每个样本测定值之比值与相应两系统测试均值作散点图。
观察并分析各点的相对偏倚分布情况。
3. 回归分析考核系统每个样本测定值与相对应的参比系统测定值作散点图(以考核系统作Y轴,参比系统作X轴)。
目测数据分布的均匀性,对线性段作相关分析,原则上要求r≥0.975,不满足时应扩大样本量再评价,若仍然达不到此要求应有充分合理的解释,并参照EP9-A2的方法进行相应“分部偏倚法”分析(通常将数据分成三组(低、中、高)进行分析,每组应含大约相同的数据。
如果医学决定水平与两组分界值接近,可改变分组以避免在偏倚估计中的不连续性)。
计算a值及b值,列出线性回归方程式。
并计算回归系数及截距的95%可信区间。
Y=a+bX---------------------------------------------------------- (1)4.医学决定水平处的预期偏倚及其可信区间对于任何给定的X值,Y的估计值------------------------------------------------------- (2)在给定的医学决定水平Xc处的预期偏倚(Bc)的估计值,按以下公式计算:----------------------------------------------- (3) Bc的95%可信区间(在Xc处的真正偏倚)按以下公式计算:-------- (4)其中估计值的标准误的计算公式如下:-------------------------------------------- (5)5.结果判断与解释将医学决定水平预期偏倚的可信区间与允许误差的限值相比较(建议参照1/2CLIA’88、1/2室间质评可接受范围、1/2来源于生物变异的总允许误差、卫生行业标准等相关要求设定允许误差),如达到相关标准,判定两检测系统等效,如未达到该标准,两检测系统不等效,需进一步临床验证。
(四)定性及半定量产品的等效性数据分析1.定性检测产品应分析阳性符合率、阴性符合率、总体符合率,以及相应的95%可信区间。
以交叉表的形式(如表1)总结两种试剂的定性检测结果,对定性结果进行四格表kappa(或卡方)检验以验证两种试剂定性结果的一致性。
表1. 配对计数资料统计表参比系统阳性阴性合计考核阳性系统阴性a bc da+bc+d合计a+c b+d a+b+c+d对上述资料进行Kappa一致性分析,Kappa系数≥0.75,为高度一致,认为两系统等效;Kappa系数≥0.4,认为一致,但需进一步进行相关统计学分析;Kappa系数<0.4,则认为两系统不一致,两系统不等效。
Kappa系数计算公式如下:Kappa=(P A-P e)/ (1-P e) -------------------------------------- (6)其中,P A为“实际一致率”,P e为“理论一致率”。
以表1为例,计算方法如下:P A=(a+d)/ (a+b+c+d) ---------------------------------------- (7)P e=[(a+b) (a+c)+(c+d) (b+d)]/ (a+b+c+d)2 -------------- (8)阳性/阴性符合率及其95%可信区间应满足临床要求,如达不到要求则需重新设计临床方案。
对两种系统检测结果明显不一致的样本,应采用临床诊断金标准方法或其他方法进行确认试验,并结合患者的临床病情对差异原因进行分析。
如果考核系统与参比系统的检测结果显示不一致样本均是位于临界值附近且例数很少,则对不一致原因作简要分析,不需进行第三方复核。
