电导法测定弱电解质的电离平衡常数及数据处理41943
实验一 电导法测定弱电解质的电离平衡常数

实验一电导法测定弱电解质的电离平衡常数实验目的:通过电导法测定弱电解质的电离平衡常数,探究电导法测定电离平衡常数的原理和操作方法。
实验原理:弱电解质的电离平衡常数K为:K=α²C/(1-α) (其中,α表示电离度,C表示弱电解质的浓度)。
由于弱电解质的电离度很小,可以近似认为它的电离度是常数。
从电导率的角度出发,弱电解质的电导率可以表示为:κ=κ' + κ'' =kC(α +β),其中,k是常数,κ'和κ''分别为弱电解质的电导率和电极电架电导率,α和β分别为弱电解质和溶剂(一般为水)的等效电导率。
通常实验中只能测量到总电导率,但是可以通过电导率对浓度和电离度的关系进行分析,进而计算出弱电解质的K值。
实验步骤:1.将所需量的KCl、NaCl和HCl等指定量的不同浓度的溶液加入电导池中。
在每次测量前,用去离子水清洗电导池。
2.打开电导计电源开关,选择对应的测量范围,将电导池放入电导计的电极架内。
3.读取电导计显示的电导率值,将其记到实验记录表中。
4.根据所加入的某一种量浓度的水溶液电离平衡常数的已知值,计算α和K值。
将计算结果记录到实验记录表中。
5.重复以上步骤,测定其他浓度水溶液的电导率和计算α和K值。
6.将α和K值以绘制α和C的曲线等形式呈现。
通过分析α和C的曲线,确定弱电解质的电离平衡常数K。
实验注意事项:1.电导池在使用前需清洗,以保证测量结果的准确性。
2.一定要记录所有测量数据,保证测量结果的可重复性。
3.将实验结果以图表等形式呈现,进行分析和论证。
实验结果:所得结果表明,电导法测定弱电解质的电离平衡常数是可靠准确的。
通过实验,还可以得到弱电解质电离度与浓度的变化规律,进一步了解了电解质溶液中的离子平衡关系。
电导法测定弱电解质的电离常数实验数据处理
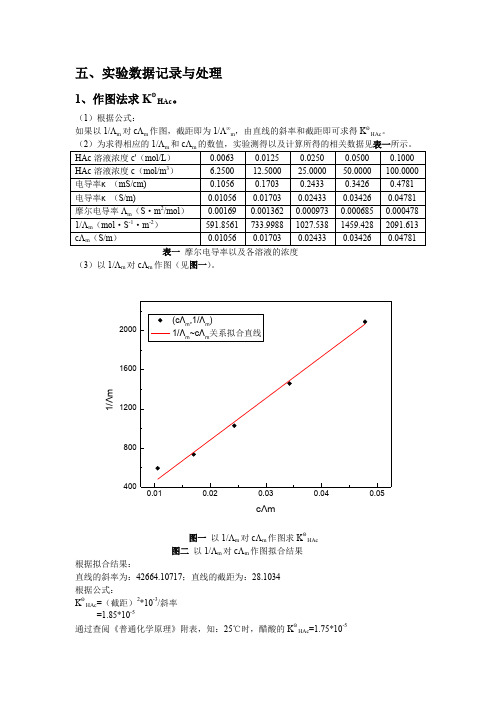
五、实验数据记录与处理1、作图法求K ΘHAc 。
(1)根据公式:如果以1/Λm 对cΛm 作图,截距即为1/Λ∞m ,由直线的斜率和截距即可求得K ΘHAc 。
表一 摩尔电导率以及各溶液的浓度 (3)以1/Λm 对cΛm 作图(见图一)。
1/ΛmcΛm图一 以1/Λm 对cΛm 作图求K ΘHAc 图二 以1/Λm 对cΛm 作图拟合结果 根据拟合结果:直线的斜率为:42664.10717;直线的截距为:28.1034 根据公式: K ΘHAc =(截距)2*10-3/斜率 =1.85*10-5通过查阅《普通化学原理》附表,知:25℃时,醋酸的K ΘHAc =1.75*10-5相对误差:5.71%2、求醋酸的电离度α。
根据弱电解质的电离度与摩尔电导率的关系: 求出五组不同浓度的醋酸溶液的电离度,见表二。
其中25℃下的Λ∞由表三得到。
表二 醋酸溶液的电离度 表三 不同温度下无限稀释的醋酸溶液的摩尔电导率(10S ·m /mol )3、计算法求K ΘHAc根据公式:通过计算的方法求得K Θ,与作图法以及标准值比较,相关数据见表四。
表四 计算的方法求得K HAc根据计算的结果,只有c/16的K ΘHAc 与其他数据相差较大,这与通过作图拟合时的数据一致,通过图一中对无根数据的拟合,可以看出也是c/16的数据点偏离拟合直线比较多,应该是实验误差所致。
4、对第一次实验数据的处理以及处理结果。
注:本次实验我们小组测量了两次,原因是第一次实验测量的数据通过拟合直线虽然斜率是可靠的,但是其截距是负值,这与直线方程的截距物理意义不符合,通过询问前面几组的数据,我们发现用右侧仪器的小组数据都出现了这样一个问题,因此我们决定用另外一个仪器第二次测量。
表五 第一次测量的实验数据及相关计算数值(2)作图法求KΘHAc1/ΛmcΛm图三 第一次实验数据以1/Λm 对cΛm 作图求K ΘHAc 图四 第一次实验数据以1/Λm 对cΛm 作图拟合结果 根据拟合结果:直线的斜率为:36293.42452;直线的截距为:-266.69365 根据公式:因为截距为负值无法加入计算,因此用表三中25℃时的摩尔电导率代入计算:求得K ΘHAc =(1/0.03908)2/斜率=1.80*10-5通过查阅《普通化学原理》附表,知:25℃时,醋酸的K ΘHAc =1.75*10-5 相对误差:2.86%。
实验二 电导法测定弱电解质的电离平衡常数和难溶盐的溶度积

作图求得
和
二、实验原理
5.电导法测定溶度积
(PbSO4 ) (溶液) (水) 3 3 c(饱和) 10 10 m (PbSO4 ) m (PbSO4 )
1 2 1 (PbSO4 ) m ( Pb ) m ( SO 2 4 ) 2 2 2
二、实验原理
4. 解离平衡常数
HAc 起始时: c 平衡时: c(1-α) H+ + Ac0 0 cα cα
c 2 Λm $ K$ c Λm ( Λm Λm )
c Λm $ 1 1 c $ 2 Λm K ( Λm ) Λm
1 $ cΛ 作图求得 。 K 对c对 对c 作图求得 和 m Λm
二、实验原理
2.摩尔电导率
溶液的摩尔电导率是指含有1mol电解质的溶液置于相 距为1m的两平行板电极之间的电导。以Λm表示:
10 Λm c
3
Λm的单位是Sm2 mol-1,c的单位为moll-1。
二、实验原理
3. 电离度
Hale Waihona Puke Λm ΛmΛm可由实验测得的 求出。
Λm (H + ) λm (Ac ) HAc λm Λm (HCl) Λm (NaAc) Λm (NaCl)
注意单位,数据处理时要转成S m-1
4.
四、实验数据处理
1 对c Λ m 作图求得 K $(HAc)。 1. Λm
2. 计算硫酸铅溶度积 K sp 。
电解质溶液的电导G是其电阻R的倒数,其大小与两 电极间的距离(l)成反比,与电极的面积(A)成正比。 A l 表示为:G 或 G K cell G A l Kcell称为电导池常数,
电导法测定弱电解质的电离常数

一、实验目的1. 学会用电导法测定醋酸的电离平衡常数;2. 熟悉电导池、电导池常数、溶液电导(或电导率)等相关基本概念;3. 掌握电桥法测量溶液电导的实验方法和技术。
二、实验原理根据Arrhenius(阿累尼乌斯)的电离理论,弱电解质与强电解质不同,它在溶液中仅部分解离,离子和未解离的分子之间存在着动态平衡。
如醋酸水溶液中,设c为醋酸的原始浓度,αc为解离度,其解离平衡为:式中电导率κ的单位是S·m-1,为测量的电导电极两极片间的间距,A为电极片的截面积,对于一个固定的电导池,l和A都是定值,故比值l/A为一常数,称为电池常数Kcell。
所以有κ=Kcell/R(6)根据以上关系,只要我们在指定温度下测得不同浓度下的电导率κ(用电导率仪)或溶液的电阻(用1000Hz交流电下的惠斯通电桥测),就可以计算出摩尔电导率∧m,再根据式(3),即可计算出解离常数K来。
本实验我们采用测溶液电阻的方法,先用已知电导率的KCl标准溶液测出那个条件下的特征电阻值RS,算出Kcell;然后使用同一电导池测定待测乙酸溶液的电阻Rx,最后就可以得到解离常数K因此,实验中必须考虑的是,在增大交流电频率以防极化的同时,还要尽量消除相位差对电桥平衡的影响。
比较好的办法是,选择1000Hz的交流频率,尽可能使电流通过电导池里的溶液电阻而不是寄生电容Cx,从而使电导池上的电压降的相位移动较小,而不至于影响测量精度。
三、仪器和试剂仪器:XD-7型低频信号发生器1台,ZX56型电阻箱1台,SJ8001型示波器1台,恒温水浴1套,260型铂电导电极(镀铂黑)1支,带支管试管4支,25ml移液管1支,容量瓶2只(50ml),小烧杯,洗瓶,导线若干。
试剂:0.01000mol/L KCl溶液,0.1mol/L 左右的HAc溶液(准确浓度c标于瓶签)。
四、实验步骤1. 调节恒温水浴温度为25.00±0.1℃2. c/2和c/4浓度HAc溶液的配制:用移液管移取25.00ml真实浓度为c(标于瓶签上)的HAc溶液,注入50ml容量瓶中,然后加蒸馏水至刻度并摇匀即成,其真实浓度分别为原溶液浓度的1/2。
电导法测定弱电解质的电离平衡常数及数据处理41943

电导法测定醋酸电离常数一、实验目的1.了解溶液电导、电导率和摩尔电导率的概念;2.测量电解质溶液的摩尔电导率,并计算弱电解质溶液的电离常数。
二、实验原理电解质溶液是靠正、负离子的迁移来传递电流。
而弱电解质溶液中,只有已电离部分才能承担传递电量的任务。
在无限稀释的溶液中可以认为电解质已全部电离,此时溶液的摩尔电导率为Λ∞m,而且可用离子极限摩尔电导率相加而得.一定浓度下的摩尔电导率Λm与无限稀释的溶液中摩尔电导率Λ∞m是有差别的.这由两个因素造成,一是电解质溶液的不完全离解,二是离子间存在着相互作用力。
所以,Λm通常称为表观摩尔电导率.Λm/Λ∞m=α(U++ U—)/(U+∞+ U-∞)若U+= U—,,U+∞=U-∞则Λm/Λ∞m=α式中α为电离度。
AB型弱电解质在溶液中电离达到平衡时,电离平衡常数K aө,起始浓度C0,电离度αAB A+ + B-起始浓度mol/L:C00 0平衡浓度mol/L:C0·(1-α) αC0 αC0K cө=[c(A+)/cө][c(B—)/cө]/[c(AB)/cө]=C0α2/(1-α)=C0Λm2/[cөΛ∞m(Λ∞m—Λm)]根据离子独立定律,Λ∞m可以从离子的无限稀释的摩尔电导率计算出来.Λm可以从电导率的测定求得,然后求出K aө.Λm C0/cө =Λ∞m2K cө/Λm-Λ∞m K cө通过Λm C0/cө~1/Λm作图,由直线斜率=Λ∞m2K cө,可求出K cө。
三、仪器与试剂DDS-11A(T)型电导率仪1台;恒温槽1套;0。
1000mol/L醋酸溶液。
四、实验步骤1。
调整恒温槽温度为25℃±0.3℃。
2。
用洗净、烘干的义形管1支,加入20.00mL的0.1000mol/L醋酸溶液,测其电导率。
3.用吸取醋酸的移液管从电导池中吸出10.00mL醋酸溶液弃去,用另一支移液管取10.00mL电导水注入电导池,混合均匀,温度恒定后,测其电导率,如此操作,共稀释4次。
电导法测弱电解质的解离平衡常数

新乡医学院物理化学实验课教案首页授课教师姓名职称:新乡医学院化学教研室a~l在一■定温度下,溶液的摩尔电导与离子的真实浓度呈正比, 因而也与a呈正比,所以:.如醋酸: HAc + H 2。
H3O++ Ac电导法测弱电解质的解离平衡常数、实验目的1. 溶液电导的基本概念,掌握电导测定的实验方法。
2. 基本掌握DDS-307型电导率仪的使用。
3. 测定醋酸溶液的解离平衡常数。
4. 测定难溶盐的溶解度。
1、实验原理电解质溶液的导电能力的大小,等于它的电阻的倒数丄,电导以R L表示,则 1L =R则l 1 AR ,所以:=A P lAK — l式中■■-称为比电导(或电导率),其单位为S -m-1,其值为电阻率的倒数。
则一L丄A式中的丄A 对于一定的电导电极而言是一个常数,A为极板面积,丨为极间距-^JAJ称为电导池常数,电导池常数可通过测定已知比电导的电解质溶液(如氯化钾标准溶液)来确定。
电解质溶液的电导,可以通过平衡电桥法进行测定,但目前多采用电导仪。
DOS-IIA(或D)型电导率仪可以直接测出溶液的比电导。
电解质溶液的电导是随着溶液浓度的改变而改变的,当溶液中含有1摩尔溶质时的电导称为摩尔电导率以A m表示■.式中c为摩尔浓度,A m的单位为Sm-1 mol-1根据电离学说,弱电解质的解离a随着溶液的稀释而增大,当溶液无限稀释时,弱电解质全部电离为无限稀释的摩尔电导)。
平衡浓度:c(1- a )2ca1 - a因此由实验测得醋酸溶液的摩尔电导,就可以求得它的解离常数。
般难溶盐类在水中的溶解度很小,其饱和溶液浓度很难用普通滴定法测定,但可用根据溶液m.-QOm —10 ( m olL")则难溶盐的溶解度10cM ( g,1 0 0ml )仪器:DDS — 307型电导率仪DLS-10 型电导电极 DLS-1型电导电极电导法测定,其基本原理是:难溶盐的饱和溶液是很稀的,可以近似视为无限稀释溶液,所 以其摩尔电导可由离子摩尔电导求得。
物化实验指导-电导法测定弱电解质的电离常数

实验二 电导法测定弱电解质的电离常数一、目的要求1.了解溶液的电导,电导率和摩尔电导率的基本概念。
2.学时用电导法测定醋酸的电离平衡常数。
3.掌握电导率仪的使用方法。
二、实验关键1.浓度和温度是影响电导的主要因素,故移液管和容量瓶必须清洗干净,浓度配制要准确;测定电导时电极必须与待测溶液同时一起恒温。
2.测电导水的电导时,铂黑电极要用电导水(去离子水)充分冲洗干净,测定中电极不可互换。
三.实验原理电解质溶液是靠正,负离子的迁移来传递电流。
而弱电解质溶液中,只有已电离部分才能承担传递电量的任务。
在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为∞Λm ,而且可用离子极限摩尔电导率相加而得:∞-∞+∞Λ+Λ=Λ , , m m m∞+Λ , m 和∞-Λ , m 分别为无限稀释时的离子电导。
对乙酸在25℃时,∞Λm =349.82+409=390.8 S ·cm 2·mol -1。
一定浓度下的摩尔电导率m Λ与无限稀释的溶液中的摩尔电导率∞Λm 是有差别的。
这是由两个因素造成,一是电解质溶液的不完全离解,二是离子间存在着相互作用力。
所以m Λ通常称为表观摩尔电导率。
根据电离学说,弱电解质的电离度α随溶液的稀释而增大,当浓度c →0时,电离度α→1。
因此在一定温度下,随着溶液浓度的降低,电离度增加,离子数目增加,摩尔电导增加。
在无限稀释的溶液中α→1,m Λ→∞Λm ,故α=∞ΛΛmm 根据电离平衡理论,当醋酸在溶液中达到电离平衡时,其电离常数K 与初始浓度C 及电离度α在电离达到平衡时有如下关系:αα-=12C K 将α=∞ΛΛmm 代入上式,得到 )(2m m m m C K Λ-ΛΛΛ=∞∞ 在一定温度下,由实验测得不同浓度下的m Λ值,由上式可得C m Λ=K ∞Λm 2mΛ1-K ∞Λm 以C m Λ对mΛ1作图得一直线,其斜率为K ∞Λm 2 ,截距为K ∞Λm 。
电导法测定弱电解质实验报告

电导法测定弱电解质实验报告一、实验目的1、掌握电导法测定弱电解质电离平衡常数的原理和方法。
2、学会使用电导率仪测量溶液的电导率。
3、加深对弱电解质电离平衡概念的理解。
二、实验原理1、弱电解质的电离平衡弱电解质在溶液中部分电离,存在电离平衡。
例如,醋酸(CH₃COOH)在水溶液中电离为醋酸根离子(CH₃COO⁻)和氢离子(H⁺):CH₃COOH ⇌ CH₃COO⁻+ H⁺其电离平衡常数(Ka)可以表示为:Ka = CH₃COO⁻H⁺/ CH₃COOH2、电导率与浓度的关系电导率(κ)是指相距 1m、截面积为 1m²的两平行电极间溶液的电导(G)。
溶液的电导率与溶液中离子的浓度和离子的迁移速率有关。
对于弱电解质溶液,电导率随浓度的变化而变化。
在无限稀释的溶液中,弱电解质全部电离,此时的电导率称为极限电导率(κ∞)。
在一定浓度范围内,弱电解质的电导率(κ)与其浓度(c)成正比,即:κ =Λm c其中,Λm 为摩尔电导率。
3、摩尔电导率与电离度摩尔电导率(Λm)是指含有 1mol 电解质的溶液在相距 1m 的两平行电极间所具有的电导。
对于弱电解质,其摩尔电导率与电离度(α)的关系为:Λm =Λm∞ α其中,Λm∞ 为无限稀释时的摩尔电导率。
通过测定不同浓度下弱电解质溶液的电导率,计算出摩尔电导率,进而求得电离度和电离平衡常数。
三、实验仪器与试剂1、仪器电导率仪、恒温槽、移液管(25mL、50mL)、容量瓶(100mL)、烧杯(100mL)。
2、试剂醋酸溶液(约 01mol/L)、去离子水。
四、实验步骤1、调节恒温槽温度至 25℃。
2、用去离子水冲洗电导电极,并用滤纸吸干。
3、测定去离子水的电导率,重复测量三次,取平均值作为水的电导率。
4、配制不同浓度的醋酸溶液(1)用移液管准确移取2500mL 原始醋酸溶液于100mL 容量瓶中,用去离子水稀释至刻度,摇匀,得到浓度约为 005mol/L 的醋酸溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电导法测定醋酸电离常数一、实验目的1.了解溶液电导、电导率和摩尔电导率的概念;2.测量电解质溶液的摩尔电导率,并计算弱电解质溶液的电离常数。
二、三、四、实验原理电解质溶液是靠正、负离子的迁移来传递电流。
而弱电解质溶液中,只有已电离部分才能承担传递电量的任务。
在无限稀释的溶液中可以认为电解质已全部电离,此时溶液的摩尔电导率为Λ∞m,而且可用离子极限摩尔电导率相加而得。
一定浓度下的摩尔电导率Λm与无限稀释的溶液中摩尔电导率Λ∞m是有差别的。
这由两个因素造成,一是电解质溶液的不完全离解,二是离子间存在着相互作用力。
所以,Λm通常称为表观摩尔电导率。
Λm/Λ∞m=α(U++ U-)/(U+∞+ U-∞)若U+= U-,,U+∞=U-∞则Λm/Λ∞m=α式中α为电离度。
AB型弱电解质在溶液中电离达到平衡时,电离平衡常数K aө,起始浓度C0,电离度α有以下关系:AB A+ + B-起始浓度mol/L:C00 0平衡浓度mol/L:C0·(1-α) αC0 αC0K cө=[c(A+)/cө][c(B-)/cө]/[c(AB)/cө]=C0α2/(1-α)=C0Λm2/[cөΛ∞m(Λ∞m-Λm)]根据离子独立定律,Λ∞m可以从离子的无限稀释的摩尔电导率计算出来。
Λm可以从电导率的测定求得,然后求出K aө。
Λm C0/cө =Λ∞m2K cө/Λm-Λ∞m K cө通过Λm C0/cө~1/Λm作图,由直线斜率=Λ∞m2K cө,可求出K cө。
三、仪器与试剂DDS-11A(T)型电导率仪1台;恒温槽1套;0.1000mol/L醋酸溶液。
四、实验步骤1.调整恒温槽温度为25℃±0.3℃。
2.用洗净、烘干的义形管1支,加入20.00mL的0.1000mol/L醋酸溶液,测其电导率。
3.用吸取醋酸的移液管从电导池中吸出10.00mL醋酸溶液弃去,用另一支移液管取10.00mL电导水注入电导池,混合均匀,温度恒定后,测其电导率,如此操作,共稀释4次。
4.倒去醋酸溶液,洗净电导池,最后用电导水淋洗。
注入20mL电导水,测其电导率。
五、实验注意事项1.本实验配制溶液时,均需用电导水。
2.温度对电导有较大影响,所以整个实验必须在同一温度下进行。
每次用电导水稀释溶液时,需温度相同。
因此可以预先把电导水装入锥形瓶,置于恒温槽中恒温。
六、数据记录及处理第一次实验:实验温度:25.2℃,电导池常数K(l/A):0.94 m-1,Λ∞m=390.72 s.cm2/mol-1表1 醋酸电离常数的测定计算:Λm/s.m2.mol-1=(κHAC -κ电导水)us.cm-1×10-4/[c(HAC)mol.L-1×103]={(κHAC -κ电导水) ×10-7/c(HAC)}Λm(1)={(0.520×103-2.90)/(1.000×10-1)}×10-7=5.17×10-4s.m2.mol-1Λm(2)={(0.375×103-2.90)/(5.000×10-2)}×10-7=7.44×10-4s.m2.mol-1Λm(3)={(0.265×103-2.90)/(2.500×10-2)}×10-7=1.05×10-3s.m2.mol-1Λm(4)={(0.187×103-2.90)/(1.250×10-3)}×10-7=1.47×10-2s.m2.mol-1Λm(5)={(0.129×103-2.90)/(6.250×10-4)}×10-7=2.02×10-2s.m2.mol-1Λ∞m(HAC)=Λ∞m(H+)+Λ∞m(AC-)=349.82s.cm2.mol-1+40.9s.cm2.mol-1 =390.72 s.cm2/mol=3.9072×10-2s.m2.mol-1α=Λm/Λ∞mα(1)= 5.17×10-4/ 3.9072×10-2=0.0142α(2)= 7.44×10-4 / 3.9072×10-2=0.0199α(3)= 1.05×10-3 / 3.9072×10-2=0.0275α(4)= 1.47×10-2 / 3.9072×10-2=0.0397α(5)= 2.02×10-2/ 3.9072×10-2=0.0545K cө=C0Λm2/[Λ∞m(Λ∞m-Λm)K cө(1)=1.000×10-1×(5.17×10-4)2/[390.72×(390.72-5.17)×10-8]=1.78×10-5 K cө(2)=5.000×10-2×(7.44×10-4)2/[390.72×(390.72-7.44)×10-8]=1.85×10-5 K cө(3)=2.500×10-2×(1.05×10-3)2/[390.72×(390.72-1.05)×10-8]=1.85×10-5 K cө(4)=1.250×10-3×(1.47×10-3)2/[390.72×(390.72-1.47)×10-8]=1.85×10-5 K cө(5)=6.250×10-3×(2.02×10-3)2/[390.72×(390.72-2.02)×10-8]=1.76×10-5 K cө(平均值)= 1.82×10-5表2 醋酸电离常数的测定C 0/c o Λm /S -1.m -2.m o l1/Λm /s .m 2.mol-1直线斜率=Λ∞m 2K c ө=2.721×10-8,K c ө=2.721×10-8/(390.72×10-4)2=1.78×10-5第二次实验:实验温度:24.9℃,电导池常数K (l/A):0.94 m -1,Λ∞m =390.72 s.cm 2/mol -1表1 醋酸电离常数的测定计算:Λm /s .m 2.mol -1=(κHAC -κ电导水)us .cm -1×10-4/[c (HAC)mol .L -1×103]={(κHAC -κ电导水) ×10-7/c (HAC)}Λm(1)={(0.522×103-3.10)/(1.000×10-1)}×10-7=5.17×10-4s.m2.mol-1Λm(2)={(0.372×103-3.10)/(5.000×10-2)}×10-7=7.44×10-4s.m2.mol-1Λm(3)={(0.266×103-3.10)/(2.500×10-2)}×10-7=1.05×10-3s.m2.mol-1Λm(4)={(0.185×103-3.10)/(1.250×10-3)}×10-7=1.46×10-2s.m2.mol-1Λm(5)={(0.131×103-3.10)/(6.250×10-4)}×10-7=2.05×10-2s.m2.mol-1Λ∞m(HAC)=Λ∞m(H+)+Λ∞m(AC-)=349.82s.cm2.mol-1+40.9s.cm2.mol-1 =390.72 s.cm2/mol=3.9072×10-2s.m2.mol-1α=Λm/Λ∞mα(1)= 5.19×10-4/ 3.9072×10-2=0.0133α(2)= 7.38×10-4 / 3.9072×10-2=0.0189α(3)= 1.05×10-3 / 3.9072×10-2=0.0269α(4)= 1.46×10-2 / 3.9072×10-2=0.0372α(5)= 2.05×10-2/ 3.9072×10-2=0.0524K cө=C0Λm2/[Λ∞m(Λ∞m-Λm)K cө(1)=1.000×10-1×(5.19×10-4)2/[390.72×(390.72-5.17)×10-8]=1.79×10-5K cө(2)=5.000×10-2×(7.38×10-4)2/[390.72×(390.72-7.44)×10-8]=1.82×10-5K cө(3)=2.500×10-2×(1.05×10-3)2/[390.72×(390.72-1.05)×10-8]=1.86×10-5K cө(4)=1.250×10-3×(1.46×10-3)2/[390.72×(390.72-1.47)×10-8]=1.80×10-5K cө(5)=6.250×10-3×(2.05×10-3)2/[390.72×(390.72-2.02)×10-8]=1.81×10-5K cө(平均值)= 1.82×10-5表2 醋酸电离常数的测定实验温度:24.9℃,电导池常数K(l/A):0.94 m-1,Λ∞m=390.72 s.cm2/mol-1C 0/c oΛm /S .m 2.m o l-11/Λm / S -1.m -2.mol直线斜率=Λ∞m 2K c ө=2.720×10-8,K c ө=2.720×10-8/(390.72×10-4)2=1.78×10-5。
