乳酸测定
乳酸 检测标准

乳酸检测标准
1.范围
2.本标准规定了乳酸的检测方法,适用于各种样品中乳酸含量的测定。
3.原理
4.本方法采用高效液相色谱法,通过色谱柱分离乳酸与其他组分,使用紫外
检测器检测乳酸的峰面积,从而计算乳酸的含量。
5.试剂
3.1 乳酸标准品:纯度应大于99%。
3.2 甲醇:色谱纯。
3.3 超纯水:电阻率大于18MΩ·cm。
6.仪器
4.1 高效液相色谱仪:具有紫外检测器。
4.2 色谱柱:C18反相色谱柱,柱长250mm,内径4.6mm,粒径5μm。
4.3 恒温水浴锅:温度波动±0.5℃。
7.样品制备
5.1 称取适量样品,加入超纯水制成溶液。
5.2 将溶液过膜,供高效液相色谱分析。
8.分析条件
6.1 流动相:甲醇+水=70+30(体积比)。
6.2 流速:1mL/min。
6.3 检测波长:210nm。
6.4 柱温:30℃。
6.5 进样量:10μL。
9.操作步骤
7.1 打开高效液相色谱仪,预热30分钟。
7.2 将乳酸标准品和样品分别注入色谱柱中。
7.3 记录色谱图,得到乳酸的峰面积。
7.4 根据峰面积计算乳酸含量。
10.结果表示
11.根据峰面积计算乳酸含量,可以使用以下公式进行计算:
12.乳酸含量(%)= (峰面积/标准品峰面积)×标准品浓度×100%
13.其中,标准品浓度为乳酸标准品的浓度,单位为mg/mL。
乳酸含量的测定

乳酸的测定—中和滴定法应用范围:本方法采用滴定法测定乳酸(C3H6O3)的含量。
方法原理:供试品加水溶解后,再精密加入氢氧化钠滴定液(1mol/L)25mL,煮沸5分钟,加酚酞指示液2滴,趁热用硫酸滴定液(0.5mol/L)滴定,并将滴定的结果用空白试验校正,酚酞指示液变红时停止滴定,读出硫酸滴定液使用量,计算乳酸含量。
试剂:1. 水(新沸放置至室温)2. 氢氧化钠滴定液(1mol/L)3. 硫酸滴定液(0.5mol/L)4. 酚酞指示液5. 甲基红-溴甲酚绿混合指示液6. 乙醇7.基准邻苯二甲酸氢钾8.基准无水碳酸钠试样制备:1. 氢氧化钠滴定液(1mol/L)配制:取澄清的氢氧化钠饱和溶液56mL,加新沸过的冷水使成1000mL。
标定:取在105℃干燥至恒重的基准邻苯二甲酸氢钾约6g,精密称定,加新沸过的冷水50mL,振摇,使其尽量溶解;加酚酞指示液2滴,用本液滴定,在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。
每1mL氢氧化钠滴定液(1mol/L)相当于204.2mg的邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度。
C(NaOH)=m/0.2042*(V1-V2)M——邻苯二甲酸氢钾的质量;V1——氢氧化钠的消耗量;V2——空白贮藏:置聚乙烯塑料瓶中,密封保存;塞中有2孔,孔内各插入玻璃管1支,1管与钠石灰管相连,1管供吸出本液使用。
2.酸滴定液(1 mol/L)配制:取硫酸30mL,缓缓注入适量的水中,冷却至室温,加水稀释至1000mL,摇匀。
标定:取在270-300℃干燥恒重的基准无水碳酸钠约1.5g,精密称定,加水50mL 使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液颜色有绿色变为暗紫色。
每1mL硫酸滴定液(1mol/L)相当于53.00mg的无水碳酸钠。
根据本液消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
乳酸测定在临床中的意义

乳酸测定在临床中的应用
Septic shock bundle(6小时内完成)
• 初始液体复苏后仍存在低血压患者应使用缩血管药物维 持 MAP≥65mmHg
• 仍持续动脉低血压者,和/或初始血乳酸>4mmol/L者: ①CVP≥8mmHg②SCVO2≥70%
乳酸测定在临床中的应用
进一步研究显示:感染性休克病人复苏6h内乳酸 清除率≥10%者,血管活性药用量明显低于清除率低 的病人,且病死率也明显降低(47.12% vs 72.17% , P < 0.105) ;积极复苏后仍持续高乳酸血症者预后 不良,故提出高乳酸时间(lactime)的概念,即乳酸>酸清除不足
ARDS时肺乳酸释放量可>60mmol/h,远超过 正常状态下的释放量,且乳酸释放量与肺损伤程 度显著正相关,其机制可能系炎性细胞和细胞因 子促进了糖酵解的过程。
乳酸升高的原因
2.乳酸清除不足
此外,可见于重症肝炎、糖尿病、高D-乳酸血 症常见于小肠广泛切除,小肠短路术后及慢性胰 腺功能不全等疾病时。
乳酸测定在临床中的应用
更多的学者认为连续监测血乳酸水平,尤其是乳酸清除 率对于疾病预后的评价更有价值。因此,动态监测乳酸浓 度变化或计算乳酸清除率可能是更好的监测指标。
严重感染与感染性休克时应该监测动脉血乳酸及清除 率的变化(C级)。
成人严重感染与感染性休克血流动力学监测与支持指南(2006)
乳酸测定在临床中的应用
乳酸测定在临床中的应用
血乳酸升高常见于休克患者,由于血容量的减 少(低血容量性休克),心输出量减少(心源性 休克)或脓毒症(感染性休克)等引起。休克情 况下导致乳酸升高的原因与组织缺氧或氧的利用 缺陷有关。
乳酸测定在临床中的应用
乳酸测定
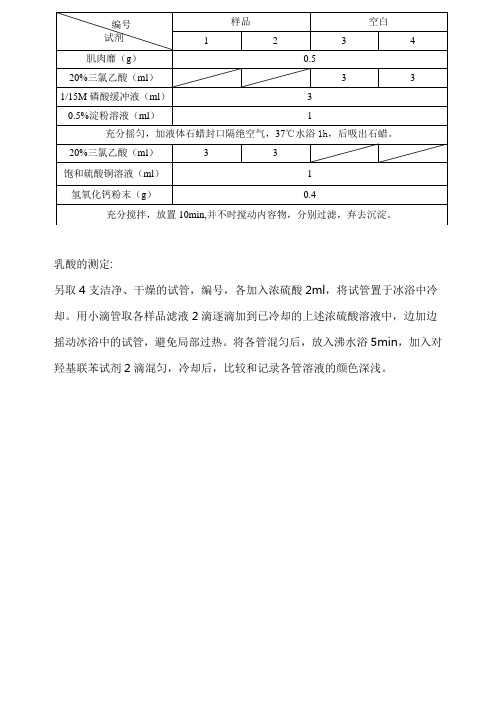
乳酸的测定:
另取4支洁净、干燥的试管,编号,各加入浓硫酸2ml ,将试管置于冰浴中冷却。
用小滴管取各样品滤液2滴逐滴加到已冷却的上述浓硫酸溶液中,边加边摇动冰浴中的试管,避免局部过热。
将各管混匀后,放入沸水浴5min ,加入对羟基联苯试剂2滴混匀,冷却后,比较和记录各管溶液的颜色深浅。
编号 试剂 样品 空白
1
2
3
4
肌肉靡(g ) 0.5
20%三氯乙酸(ml )
3 3
1/15M 磷酸缓冲液(ml ) 3 0.5%淀粉溶液(ml )
1
充分摇匀,加液体石蜡封口隔绝空气,37℃水浴1h ,后吸出石蜡。
20%三氯乙酸(ml ) 3
3
饱和硫酸铜溶液(ml ) 1 氢氧化钙粉末(g )
0.4
充分搅拌,放置10min,并不时搅动内容物,分别过滤,弃去沉淀。
五、实验结果:
肌糖原酵解作用实验结果
空白组(左,基本透明无色)样品组(右,紫罗兰色)
根据实验图判断,样品管中发生了肌糖元酵解,生成的乳酸转变为乙醛后与对羟基联苯反生明显的显色反应,呈现紫罗兰色,空白管因酶失活未发生反应,无颜色变化。
六、实验注意事项
1、实验中用淀粉代替了肌糖元,因为淀粉与肌糖元结构类似,均为葡萄糖分子的高聚糖,淀粉因支链少分解较糖原稍慢,应保证37度水浴时间充足。
2、滴加液体甘油石蜡不宜过多,避免后期过滤困难。
3、测定乳酸的试管必须保证干燥、洁净。
4、最后除糖及蛋白质步骤一定要彻底,保证滤液无杂质干扰,以免影响显色结果。
乳酸测定-纸层析原理

乳酸等有机酸的测定——纸层析法一、展层试剂展层剂:水:苯甲醇:正丁醇=1:5:5(V/V,另加1% 的甲酸);显色剂:0.04% 溴酚蓝乙醇溶液(用0.1%/L NaOH 调节pH 至6.7);2% 乳酸(标准液),无水乙醇二、纸层析1、制备待测样品——从酸奶中分离的纯种接种到含糖发酵液体培养基的试管中,37℃培养3天,(离心,收集上清液);2、层析滤纸的制备——将新华1号层析滤纸剪成25cm*10cm的长条状,在距层析纸一端约3cm处用铅笔划线,在其上再画4点做点样标记(据两侧1.7cm处各点一点,中间2点间距为2.2cm)并注明点样编号(样品液2点,2%乳酸和未接种的糖发酵液培养基各一点)。
3、配制展开剂4、点样:先用无水乙醇清洗微量进样器,再分别取各样品20ul点样,每一个样品均需要用电吹风吹干。
(分别吸取发酵液,多次点样于滤纸条上,样点直径不宜超过2mm,)5、层析:将点好样的层析纸放入层析缸中,经展层剂蒸汽饱和一夜后,再正式让底部均匀浸入展开剂中展层,但不可浸及样点。
观察展开情况,待展开剂前沿到达离层析纸另一端约5cm处(上行20cm,在室温20度下8~9h)左右后,取出层析纸,空气中风干,吹干。
6、显色——以0.04% 溴酚蓝乙醇溶液为显色剂,待层析液挥发之后,向层析滤纸均匀喷洒(用喷雾器),对比标准乳酸与试样中所含乳酸所出现黄色斑点位置,并参考对照样品的层析斑,以确定试样中是否含有乳酸,并计算Rf值。
注释:物质被分离后在纸层析图谱上的位置是用Rf值(比移值Rf value 又称Rf值) 来表示:Rf = 原点到层析中心的距离/ 原点到溶剂前沿的距离在一定的条件下某种物质的Rf值是常数。
Rf值的大小与物质的结构、性质、溶剂系统、层析滤纸的质量和层析温度等因素有关,是一个定性分析的重要参数。
纸层析法是用纸作为载体的一种色谱法,Paper Chromatography原理纸层析法又称纸色谱法,依据极性相似相溶原理,是以滤纸纤维的结合水为固定相,而以有机溶剂作为流动相。
乳酸检验方法

乳酸检验方法
乳酸的检验方法较多,包括EDTA定钙法、羟基联苯法、乳酸脱氢酶法、高效液相色谱法和酶电极分析法等。
1、EDTA定钙法。
通过发酵液中的乳酸与CaCO3反应生成乳酸钙,再用EDTA标准溶液滴定乳酸钙中的钙,最终计算乳酸含量。
但该方法测得值高于实际乳酸含量,误差较大。
2、羟基联苯法。
通过发酵饲料中加入硫酸铜和浓硫酸,使乳酸与羟基联苯反应生成加色产物,再通过测定光吸收值来计算乳酸含量。
该方法准确度稍高。
3、乳酸脱氢酶法。
利用乳酸脱氢酶催化乳酸与辅酶NADH反应,通过测定NADH的生成量来确定乳酸含量。
该方法准确性较高,速度较快,但成本较高,适用于特定时期快速检测乳酸含量的场合。
4、高效液相色谱法。
通过简单处理发酵液样品,使用反相色谱柱并以磷酸为流动相,在特定波长下进行检测,可以准确分离并测定乳酸、苹果酸和富马酸。
5、酶电极分析法。
利用固定化乳酸氧化酶催化乳酸的氧化反应产生电流变化,通过测量电流来计算乳酸含量。
该方法具有高专一性、长期稳定性和快速灵敏的特点,适用于快速测定乳酸含量的情况。
此外,还有电位滴定法、离子交换树脂法、气相色谱法、光度法和磁共振法等乳酸含量测定方法。
乳酸测定的实验报告(3篇)

第1篇一、实验目的1. 学习并掌握乳酸测定的原理和方法。
2. 了解乳酸在生物体内的重要作用。
3. 掌握实验操作的规范性和安全性。
二、实验原理乳酸(Lactic Acid)是一种有机酸,在生物体内主要作为能量代谢的中间产物。
乳酸的测定方法有多种,本实验采用酶法测定乳酸浓度。
酶法测定乳酸的原理是:乳酸脱氢酶(Lactate Dehydrogenase,LDH)催化乳酸和NAD+发生氧化还原反应,生成丙酮酸和NADH。
NADH在特定波长下有特征性吸收,通过测定吸光度变化,可以计算出乳酸的浓度。
三、实验材料与仪器材料:1. 乳酸标准溶液(已知浓度)2. 纯乳酸3. NAD+4. 丙酮酸5. 酶试剂6. 水浴锅7. 移液器8. 比色计仪器:1. 移液器2. 比色计3. 水浴锅4. 实验室天平四、实验步骤1. 标准曲线绘制:a. 取一系列已知浓度的乳酸标准溶液,分别加入酶试剂,混匀。
b. 将混合液放入水浴锅中,在特定温度下反应一定时间。
c. 取反应后的溶液,用比色计测定吸光度。
d. 以乳酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品测定:a. 取一定量的待测样品,加入酶试剂,混匀。
b. 将混合液放入水浴锅中,在特定温度下反应一定时间。
c. 取反应后的溶液,用比色计测定吸光度。
d. 根据标准曲线,计算样品中乳酸的浓度。
五、实验结果与分析1. 标准曲线绘制:通过绘制标准曲线,可以得到乳酸浓度与吸光度之间的关系。
在本实验中,标准曲线呈线性关系,相关系数R²>0.99,说明该方法具有良好的线性。
2. 样品测定:对不同样品进行乳酸测定,得到以下结果:| 样品编号 | 乳酸浓度(mg/L) || -------- | ----------------- || 1 | 100.0 || 2 | 200.0 || 3 | 300.0 || 4 | 400.0 || 5 | 500.0 |根据实验结果,样品中乳酸浓度与加入的乳酸量呈线性关系,说明该方法可用于乳酸的测定。
细胞中乳酸的测定__概述说明以及解释

细胞中乳酸的测定概述说明以及解释1. 引言在生物学研究中,对细胞的代谢产物进行测定是十分重要的,乳酸作为一种常见的代谢产物,在细胞中具有重要的作用。
乳酸能够通过乳酸脱氢酶催化反应将其转化为丙酮酸,从而参与细胞内能量代谢过程。
然而,过多的乳酸积累可能会导致细胞功能异常,并在某些疾病状态下出现。
本文旨在概述并解释细胞中乳酸的测定方法与技术,并探讨其在生物学研究中的重要性和应用。
文章将从以下几个方面展开:首先介绍乳酸在细胞中的作用,包括其参与能量代谢以及与其他代谢产物之间的相互关系;接着详细介绍乳酸测定方法的种类,涵盖传统的生化分析方法以及近年来发展起来的新型技术;最后对乳酸测定结果进行分析,并回顾相关研究发现和比较分析。
文章内容将包括实验方法与技术部分,介绍了采集细胞样本的方法、乳酸测定的实验步骤以及常用的乳酸测定技术。
进一步地,文章将提供实验结果与分析部分,对细胞样本中乳酸含量的分析结果进行阐述,并对结果进行解释和讨论。
此外,文章还将从已有研究成果出发,探讨与比较不同研究之间的关联性。
最后,在结论与展望部分,笔者将对实验结果进行总结和归纳,并给出进一步研究方向的展望和建议。
通过这篇长文的撰写,希望能加深对细胞中乳酸测定方法与技术的理解,并为相关领域的研究提供参考和指导。
2. 细胞中乳酸的测定2.1 乳酸在细胞中的作用乳酸是一种重要的代谢产物,在细胞内发挥着关键作用。
它是糖酵解过程中生成的主要产物之一,尤其在无氧代谢情况下积累较多。
乳酸可被肌肉细胞转化为能量并参与体内能量供应。
此外,乳酸还在心肌等组织中起到了调节pH值和血液循环、增加脑功能等方面的作用。
2.2 乳酸测定方法的种类目前常见的测定细胞中乳酸含量的方法有多种,其中包括生化分析方法、色谱法、光谱法等。
生化分析方法通常利用相关试剂对乳酸进行反应,并通过检测反应产物来间接确定乳酸含量。
色谱法则采用气相或液相色谱技术,将混合物中存在的乳酸分离并测定其峰面积或峰高度来计算含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
安捷伦6890气相色谱仪,FID检测器,色谱柱为HP-FFAP19091F-413型(30m*0.32mm*0.25μm)毛细管柱。
色谱定量结果:乙酸(记为A乙g/L)下同、丙酸(A丙g/L)、丁酸(A丁g/L)、异丁酸(A异丁g/L)、戊酸(A戊g/L)、己酸(A己g/L)、庚酸(A庚g/L)、辛酸(A辛g/L)。
样品
测定值(mg/L)
平均值
SD
RSD(%)
1
2
3
4
5
6
7
乳酸
271.15
271.53
272.33
272.19
271.69
271.53
271.64
271.72
0.41
0.15
1.5.4回收率
取20ml样品各3份,其中1份作本底量,另外2份各添加已知量的标准液,经上述样品预处理后,测出乳酸在样品中的含量,并根据检测量计算出乳酸的回收率和精密度,结果表明样品的回收率及准确度满足分析要求,结果见表2。
3.3乳酸含量的求取
根据陈周平对浓香型白酒的测定,白酒中的有机酸含量有下列趋势:乙酸>己酸>乳酸>丁酸>甲酸>戊酸>棕榈酸>亚油酸>油酸>辛酸>异丁酸>丙酸>异戊酸>庚酸,而乙酸、己酸、乳酸、丁酸的含量加上辛酸、异丁酸、戊酸、庚酸、丙酸的含量占其总酸含量的95%以上,其他的酸特别是高级脂肪酸的含量只有在发酵期较长的优质酒中才有一定的含量,在一般发酵期和一般质量的酒中,含量甚微,因此,未测出的有机酸基本都可以忽略不计。所以乳酸的含量求得为:
1.3试剂及标准溶液的配制
1.3.1内标溶液的配制
精确称取2-乙基正丁酸0.25克,置于50ml容量瓶中,以60%(V/V)的酒精定容至刻度,摇匀。
1.3.2标准物储备液的配制
精确称取乳酸0.5g,置于50ml的容量瓶中,以蒸馏水定容至刻度,摇匀,配成标准储备液。
1.4 样品预处理
1.4.1试样处理
1.2色谱条件
色谱柱为HP-FFAP19091F-413型(30m*0.32mm*0.25μm)毛细管柱,进样口温度250℃,检测器温度300℃,柱箱升温程序170℃保持8min,以15℃/min升温到200℃保持5min,进样口压力为35kpa,柱流量0.6ml/min,分流比为进样0.1min以内不分流,之后分流比为30ml/min。
1.5.2样品的测定
准确吸取20ml酒样,在250ml烧杯中,准确加入5.0g/L的2-乙基正丁酸内标溶液1.0ml,按上述方法进行样品预处理后,注样1μl,以上述标准工作曲线测定乳酸的含量。
1.5.3精密度
用内标工作曲线法测定样品,平行测定7次,精密度满足分析要求,其结果见表1。
表1精密度试验结果(n=7)
表2回收率试验结果(n=5)
样品
本底值(mg/L)
加入量(mg/L)
本底值与实测值之差(mg/L)
平均回收率(%)
RSD(%)
乳酸
242.26
59.21
56.96
96.2
0.015
242.26
296.04
303.45
102.5
0.38
2、比色法
比色法是常规化学分析中一种经常使用的分析方法,它可以对白酒中的乳酸进行有效的定性定量分析,酒样中乳酸的含量可在显色后与乳酸标准系列管的比色中得出。
乳酸测定
———————————————————————————————— 作者:
———————————————————————————————— 日期:
白酒中乳酸的测定方法
1、气相色谱法
1.1仪器与试剂
安捷伦6890气相色谱仪,FID检测器,酸度计
色谱纯乳酸(Aldrich Chemicalcompany提供),苄基溴,2-乙基丁酸,无水乙醇
A乳酸=A总-A乙-A丁-A丙-A异丁-A戊-A己-A庚-A辛
式中:各值均以乙酸计。
附录1总酸与总的酸
总酸:是用0.1mol/LnaOH去滴定50ml酒样,以1%酚酞为指示剂,至微红色,为其终点,通过计算得出酒Leabharlann 总酸的含量(以乙酸 计,g/L)。
总的酸:是将色谱检测出的各种酸(没按乙酸计),全加在一起的量。
准确吸取20ml酒样,在250ml烧杯中,准确加入5.0g/L的2-乙基丁酸内标溶液1.0ml,电磁搅拌下用0.035mol/L左右的四丁基氢氧化铵中和至pH8.5~9。定量移至125ml的蒸发皿中,水浴蒸干。冷却后加入5命令丙酮,使充分溶解,静置片刻,吸取上层清液2ml于10ml洁净、干燥的带盖比色管中备用。
3.综合法
综合法是指利用理化分析和色谱分析数据,求取乳酸的含量。
根据陈周平对浓香型白酒的测定结果,己酸、乙酸、乳酸、丁酸4种酸占有机酸总量的90%以上,以总酸含量减去色谱柱流出各单一酸种的含量即得乳酸的含量。
3.1总酸的测定
总酸的测定方法遵循GB/T1.345.4-89中规定的方法,因此,它测得的是白酒中所有酸含量的总和,记为A总g/L(以乙酸计)。
各种酸(A1、A2、……)的量当折成总酸(以乙酸计时)须引入一个系数(f1、f2、……)才能将二者有机的联系起来。引入的系数可按下式计算:
根据这一公式,寻找有关酸的换算系数,详见表3,总的酸可按下式,换算成总酸:
总的酸(没按乙酸计)=A1+A2+……
总酸(按乙酸计)=f1A1+f2A2+……
1.5结果与讨论
1.5.1线性关系的测定
精确吸取乳酸标准储备液0.1ml、0.4ml、0.8ml、1.2ml、1.6ml、分别置于5个250ml烧杯中,然后各精确加入1ml的内标液,加入20ml蒸馏水,配成5个不同浓度的标准工作液,按上述方法进行样品预处理,分别平行测定4次,取平均值。以待测组分与内标溶液的质量浓度比X为横坐标、峰面积比Y为纵坐标,绘制标准工作曲线。在0~950mg/L的范围内,对乳酸的测定值进行线性回归,回归方程的斜率为0.77678,在Y轴上截距为-0.0009395,相关系数r为0.99975,工作曲线具有良好的线性。
1.4.2酯化
按计算用100μl微量注射器吸取苄基溴,加入上述比色管中加盖,摇匀。在室温(不低于15℃)下静置酯化反应2h备用。
式中:c——四丁基氢氧化铵的浓度(mol/L)
V——四丁基氢氧化铵的滴定体积(ml)
171.04——苄基溴的相对分子量
1.438——苄基溴的相对密度
2/5——试样分取比例
1.3——苄基溴过量30%,以保证酯化完全
