有机化学基础醛和酮教案
醛与酮教学案
(3)乙醛是具有________气味的无色液体,分子式是C2H4O,结构简式是________,________溶于水,可由乙醇氧化而得。
4.丙酮是最简单的酮,是具有特殊气味的无色______,与水________,并能溶解多种有机物,可用作________,也是重要的有机合成原料。
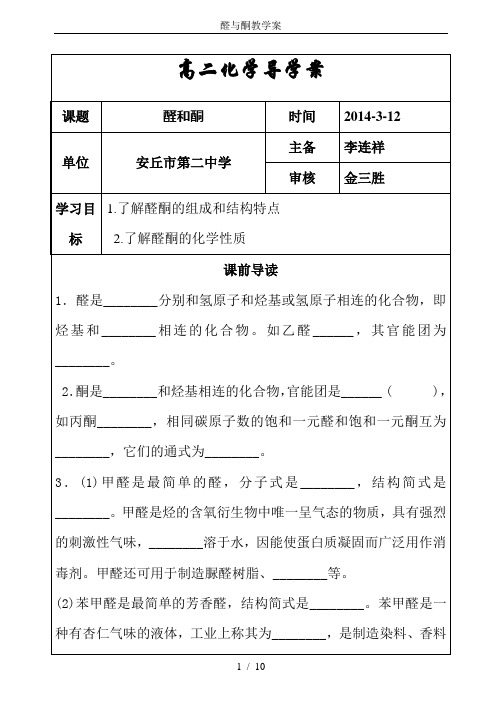
高二化学导学案
课题
醛和酮
时间
2014-3-12
单位
安丘市第二中学
主备
李连祥
审核
金三胜
学习目标
1.了解醛酮的组成和结构特点
2.了解醛酮的化学性质
课前导读
1.醛是________分别和氢原子和烃基或氢原子相连的化合物,即烃基和________相连的化合物。如乙醛______,其官能团为________。
跟踪训练2.为了鉴别己烯、甲苯和乙醛,可以使用下列何组试剂()
A.新制的Cu(OH)2悬浊液及溴水B.酸性KMnO4和溴水
C.银氨溶液及酸性KMnO4溶液D.FeCl3溶液和溴水
跟踪训练3.(双选)已知柠檬醛的结构简式为:
根据所学知识判断下列说法不正确的是()
A.它可使酸性高锰酸钾溶液褪色B.能发生银镜反应
能够发生水解反应的有:。
(3)写出丙中含有的含氧官能团的名称。
(4)请写出鉴别甲的方法(指明所选试剂及主要现象):。
(5)写出丙物质发生银镜反应的化学方程式:。
6.肉桂醛是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。工业上可通过下列反应制备:
+CH3CHO +H2O
(1)请推测B侧链上可能发生反应的类型:_____________________________。(任填两种)
有机化学第十一章 醛酮

NaCl + SO2↑ + H2O
Na2CO3 NaHCO3 + Na2SO3
(C)转化成α-羟基腈 α-羟基磺酸钠与NaCN作用,其磺酸基则被氰基取代生成α-
羟基腈。如:
CHO NaHSO3
OH C
Na C N
SO3Na
OH C
CN
HCl H2O
OH C
COOH
优点:可以避免使用易挥发、有毒的HCN,且产率较高。
O
O
CH3-C-CH2-C-CH3
2,4 戊二酮
H3C O
3 甲基环戊酮
练习
命名下列化合物。
O CH3 CH3CCH2C=CH2
4-甲基-4-戊烯-2-酮
CH3CHCH2CHO OH
3-羟基丁醛
O CH3CHCH2CCH3
Cl
4-氯-2-戊酮
O CCH3
CHO
CHO
苯乙酮
CH2CHO
苯甲醛
CH3
3-甲基苯甲醛
= = R
++ δ
δ
R δ+ δ
CO >
CO
H
R
羰基碳原子连有基团的体积↑,空间位阻↑,不利于亲核试剂
进攻,达到过渡状态所需活化能↑,故反应活性相对↓。
综上所述,下列醛、酮进行亲核加成的相对活性为:
Cl3C C=O
H
> C=O
> CH3 C=O
R
> C=O
Ar
> C=O
>
H
H
H
H
H
= CH3 C O >
α -二醛或酮:两个羰基直接相连。 β -二醛或酮:两个羰基间隔一个碳原子。
高中化学第2章第3节第1课时醛和酮教案鲁科版选修5

第1课时醛和酮目标与素养:1.了解常见的醛、酮(存在、结构、物理性质)。
(宏观辨识)2.掌握醛、酮的化学性质和二者的异同。
(微观探析)一、常见的醛、酮1.醛、酮(1)结构特点(2)通式饱和一元脂肪醛的分子通式为C n H2n O(n≥1);饱和一元脂肪酮的分子通式为C n H2n O(n≥3)。
分子中碳原子数相同的饱和一元脂肪醛、酮互为同分异构体。
微点拨:书写醛的结构简式时,醛基中C、H、O三原子的排列顺序一定是CHO。
2.醛、酮的命名:醛、酮的命名和醇的命名相似。
请写出下面的两种物质的名称:3.常见的醛和酮二、醛和酮的化学性质1.羰基的加成反应(1)加成原理(2)加成反应①加成试剂有HCN、NH3、醇等。
②典型加成反应:乙醛与HCN :2.氧化反应 (1)催化氧化乙醛催化氧化的方程式:2CH 3CHO +O 2――→催化剂2CH 3COOH 。
(2)被弱氧化剂氧化 ①银镜反应:CH 3CHO +2[Ag(NH 3)2]OH ――→△CH 3COONH 4+2Ag↓+3NH 3+H 2O 。
②与新制氢氧化铜悬浊液的反应:CH 3CHO +2Cu(OH)2――→△CH 3COOH +Cu 2O↓+2H 2O 。
微点拨:银镜反应口诀:银镜反应很简单,生成醋酸铵,还有一水二银三个氨。
3.还原反应(1)还原产物:加H 2之后得到,产物属于醇类。
(2)与氢气加成的通式1.判断正误(正确的打“√”,错误的打“×”) (1)含有羰基的化合物属于酮。
( )(2) 的名称为2甲基1丁醛。
( ) (3)醛、酮都可以发生还原反应。
( ) (4)醛和酮都可以发生银镜反应。
( ) (5)碳原子数相同的饱和一元醛和饱和一元酮完全燃烧,生成的二氧化碳和水的物质的量相等。
( )[提示] (1)× (2)× (3)√ (4)× (5)√ 2.下列说法正确的是( ) A .甲醛是甲基跟醛基相连而构成的醛 B .醛的官能团是—COH C .甲醛和丙酮互为同系物D .饱和一元脂肪醛的分子组成符合通式C n H 2n O(n ≥1)D [甲醛的结构式为,是氢原子与醛基相连而成的,醛的官能团为“—CHO”并非“—COH”,故A 、B 两项错误;甲醛和丙酮属于不同类别的物质,故甲醛与丙酮不是同系物,C 项错误;饱和一元脂肪醛的分子通式均为C n H 2n O(n ≥1),D 项正确。
有机化学- 醛和酮

Fehling试剂
银镜
砖红色 沉淀
有机化学(第9版)
三、化学性质
(三)氧化反应和还原反应
1. 氧化反应 芳香醛不被Fehling试剂氧化。
有机化学(第9版)
三、化学性质
(三)氧化反应和还原反应
2. 还原反应
或NaBH4
有机化学(第9版)
三、化学性质
(三)氧化反应和还原反应
2. 还原反应:Clemmensen还原
三、化学性质
(二)α-碳及α-氢的反应
3. 卤代反应
碱催化发生多卤代反应
有机化学(第9版)
三、化学性质
(二)α-碳及α-氢的反应
3. 卤代反应
氧化剂
碘仿反应
能发生碘仿反应的化合物包括: 乙醛、乙醇、甲基酮、甲基仲醇
有机化学(第9版)
三、化学性质
(三)氧化反应和还原反应
1. 氧化反应 醛易被氧化成羧酸,酮很难被氧化。
有机化学(第9版)
四、重要的醛酮与醌类
(一)甲醛
• 凝固蛋白质 消毒 • 防腐 保存标本
甲醛
• 甲醛气体可刺激黏膜,使皮肤硬化,致癌 • 聚合 多聚甲醛 福尔马林长期放置浑浊或产生沉淀
H2O
40%
10%
福尔马林 (formalin)
有机化学(第9版)
四、重要的醛酮与醌类
(二)丙酮与酮体
3. 与Grignard试剂加成
伯醇
仲醇
叔醇
有机化学(第9版)
三、化学性质
(一)亲核加成反应
4. 与氨衍生物的加成
有机化学(第9版)
三、化学性质
(一)亲核加成反应
4. 与氨衍生物的加成
高二下学期化学《醛》集体备课教案

高二下学期化学《醛》集体备课教案本教案是为高二下学期化学课程中的《醛》部分,进行集体备课的参考资料,旨在帮助教师们更好地组织和展开教学。
教案中将涵盖课程的内容、教学目标、教学方法和教学评估等方面的内容,以期能够帮助教师们提高教学效果,提高学生们的学习成绩。
一、课程内容本次课程主要探讨醛的化学性质和反应,包括醛的物理性质和化学性质、醛的还原性、羰基化合物的基本反应以及醛的氧化和加成反应等内容。
二、教学目标1.了解醛的基本性质和化学反应,掌握其还原性、氧化性和加成反应等方面的特点和规律。
2.学习羰基化合物的基本反应,比如醛和酮的加成反应、聚合反应和环化反应等,掌握其反应机理和实际应用。
3.培养学生的综合实验操作能力,让学生们能够实践和探究化学知识,提高其实验技能和创新能力。
三、教学方法本次教学采用多种教学方法相结合的方式,包括:1.板书法:通过板书展示课程的重点内容和相关公式等内容,为学生提供参考和记忆。
2.教师讲解法:通过教师的讲解和示范,向学生们传授相关知识,提高学生们的认知能力。
3.实验教学法:通过实验的方式,加深学生们对化学知识的理解和掌握,激发其探究和创新精神。
4.互动教学法:通过课堂互动、小组讨论和学生演讲等方式,提高学生们的交流和合作能力,促进学习效果的提升。
四、教学评估为了评估学生们的学习效果和教学效果,我们将采用多种评估方法,包括考试、作业、实验及课堂表现等,以体现学生们对知识点的理解和掌握程度,同时也为教师们提供参考,调整教学策略,提高教学效果。
结语本次化学《醛》集体备课教案的编写,旨在为教师们提供一份参考资料,促进教师们在化学教学中取得更好的教学效果。
希望教师们能够认真学习和使用本教案,积极探索和创新教学方法,提高自身的教学能力和质量。
同时,也希望学生们能够在学习中认真听讲和思考,积极参加实验和讨论等活动,提高自身的学习效果和科学素养。
有机化学第10章 醛和酮

Witting反应是在醛酮基碳所在处形成碳碳双键的一个重要方法,产物中 没有双键位置不同的异构体。反应条件温和,产率也较好,但产物双键 的构型较难控制。 Witting也因该工作而与Brown H C共享了1979年的诺 贝尔化学奖。 另一种类型的磷叶立德试剂是霍纳(Horner L)提出的:用亚磷酸 酯为原料来代替三苯基膦与溴代乙酸酯得到的试剂磷酸酯,后者在强碱 作用下形成Horner试剂。
另一种类型的磷叶立德试剂是霍纳(Horner L)提出的:用亚磷酸 酯为原料来代替三苯基膦与溴代乙酸酯得到的试剂磷酸酯,后者在强碱 作用下形成Horner试剂。
补充: 醛、酮与炔化钠的加成
R-CC-Na+ NaNH2 (-NH3) R-CCH +
C=O
NH3(液) 或乙醚
C C ONa CR H O 2
• 醛和脂肪族甲基酮(或七元环以下的环酮)与之反应,生成
• -羟基磺酸钠
白色
过量
在酸碱下可逆反应,分离提纯
-羟基磺酸钠与等摩尔的NaCN作用,则磺酸基可被氰基取代, 生成 -羟基腈,避免用有毒的氰化氢,产率也比较高。
3、与醇的加成
*1 反应情况介绍 ① 与醛反应 CH3CH=O + CH3CH2OH
(hydrazine)
C 6H 5 H C O + H2NNH O2 N NO2
(hydrazone)
C 6H 5 H C NNH O 2N NO2 + H 2O
2,4–二硝基苯肼
O O + H2NNHCNH2
2,4–二硝基苯腙
O NNHCNH2 + H2O
氨基脲
(semicarbazine)
缩氨基脲 (半卡巴腙)
高中化学人教版2019选修三教案醛酮
第三章烃的衍生物第三节醛酮本节内容在高中化学所介绍的含氧衍生物(醇、醛、羧酸)中,醛起着承上启下的作用,向前联系着醇,向后联系着羧酸,它既可引入羟基又可引入羧基,在官能团的转化、化学键的结构变化和有机合成中占有核心地位,同时通过探究学习也可以让学生学会自主构建化学知识体系的方法。
教学难点:乙醛的化学性质讲义教具【导入新课】自然界的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用。
【学习任务一】认识醛类物质1.醛的定义2.醛的官能团3.饱和一元醛的通式4.常见的醛及其物理性质、应用【讲解】1.醛是由烃基(或氢原子)与醛基相连而构成的化合物,简写为RCHO。
2.醛的官能团:醛基(—CHO)3.饱和一元醛的通式为C n H2n O。
4.乙醛:乙醛是无色、具有刺激性气味的液体,密度比水的小,沸点20.8 ℃,易挥发,易燃烧,能与水、乙醇等互溶。
甲醛、苯甲醛物理性质【学习任务二】以乙醛为例,探究醛类物质的化学性质[环节一]书写乙醛的结构简式,搭建其分子的结构模型,分析乙醛的结构特点【讲解】1.乙醛分子式:C2H4O,结构式:,结构简式:CH3CHO,结构模型:核磁共振氢谱:乙醛的核磁共振氢谱有2组峰,峰面积比为3:1。
[环节二]预测乙醛可能具有的化学性质1.从C=O的结构特点和烯烃C=C的性质出发,分析乙醛可能与H2、HCN发生的加成反应,写出化学方程式。
【讲解】1.加成反应(1)催化加氢乙醛蒸气和氢气的混合气体通过热的镍催化剂,乙醛与氢气即发生催化加氢反应,得到乙醇。
(2)与HCN加成(3)原理解释在醛基的碳氧双键中,由于氧原子的电负性较大,碳氧双键中的电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。
当极性分子与醛基发生加成反应时,带正电荷的原子或原子团连接在氧原子上,带负电荷的原子或原子团连接在碳原子上。
2.实验探究【实验3-7】实验操作:在洁净的试管中加入1 mL2% AgNO3溶液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。
高中化学_醛酮的化学性质教学设计学情分析教材分析课后反思
《有机化学基础》第二章第3节第2课时醛、酮的化学性质【学习目标】1. 通过分析官能团和化学键的特点,推断有机物在化学反应中的断键位置,预测其化学性质,体会物质的结构与性质的关系。
2. 掌握醛的化学性质及确定醛基的化学方法,培养学生实验操作技能。
3. 了解醛和酮在生产和生活中的应用,体会有机化学在生产、生活中的巨大作用。
通过甲醛加强学生环境保护意识的教育。
【课前任务】1.复习课本第2章第1节的有机反应类型;2.在网上搜素并整理资料,了解甲醛在生活中的用途及其对环境的危害。
【导学流程】阅读课本71-74页,完成对下列问题的学习。
【探究一】根据乙醛的特殊结构,预测断键位置及能发生的反应类型。
提示:从官能团、化学键的极性、碳原子的饱和程度等角度分析。
根据你的预测,写出下列反应。
(1)乙醛与HCN反应(引入官能团)__________________________________________________________________(2)乙醛与NH3反应(引入官能团)__________________________________________________________________(3)乙醛与H2反应(引入官能团,由类转化为类)__________ _【注】此反应还可以从哪个角度分析反应类型?【探究二】乙醛是否能发生发生氧化反应(具有还原性)?1、自己设计实验证明乙醛能被氧化?如何验证乙醛的氧化性强弱?试剂:酸性KMnO4溶液O2(催化剂)新制Cu(OH) 2悬浊液(弱氧化性)[Ag(NH3)2]OH 溶液(银氨溶液)(弱氧化性)2、银镜反应(银氨溶液:)观察银镜反应的实验现象并记录,分析结论。
3、观察醛与与新制的氢氧化铜悬浊液反应的现象并记录分析结论。
4、哪些物质还能氧化乙醛?5、分析乙醛发生氧化反应中的断键情况,比较丙酮与乙醛的结构,思考酮类是否也能发生类似的氧化反应?【课后作业】1、从结构上分析甲醛有什么特殊性?试写出甲醛发生银镜反应、甲醛与新制氢氧化铜悬浊液反应的方程式。
第九章醛和酮亲核加成反应
第九章 醛和酮 亲核加成反应第一节 结构、命名和物理性质一、醛和酮的定义醛和酮都是分子中含有羰基(碳氧双键)的化合物,因此又统称为羰基化合物。
羰基与一个烃基相连的化合物称为醛(甲醛与两个氢相连),与两个烃基相连的称为酮。
CO R'CR O HCR(H)O羰基 醛 酮二、醛和酮结构羰基是醛、酮的特征官能团。
羰基碳原子是sp 2杂化的,即碳原子以三个sp 2轨道与其它三个原子的轨道重叠形成三个σ键,碳原子上未参加杂化的p 轨道与氧原子上的p 轨道侧面重叠形成一个π键。
由于氧原子的电负性比碳原子大,故碳氧双键电子云偏向于氧原子,使氧原子带负电荷(δ-),而碳原子带正电荷(δ+),易被亲核试剂进攻发生亲核加成反应;由于羰基的吸电子作用,羰基的α-H 活性增强,表现出α-H 的酸性,进而发生羟醛缩合,卤代等反应。
此外,醛、酮还可以发生氧化、还原反应及其它一些反应。
醛、酮的结构与化学性质关系如下:CH R'H (H)R羰基的还原反应羰基的亲核加成反应醛的氧化反应H 的反应三、醛和酮的分类和命名(一)分类醛和酮根据烃基结构类型,可分为脂肪和芳香醛、酮;根据烃基的饱和程度,又分为饱和与不饱和醛、酮;根据羰基的数目,还分为一元、二元和多元醛、酮。
(二)命名 1.普通命名法结构简单的醛、酮,可采用普通命名法命名。
醛按分子中含有的碳原子数称为“某醛”,芳基作为取代基;酮则根据羰基所连的两个烃基来命名,简单的烃基放前,复杂的烃基在后,最后加“酮”字来命名。
2.系统命名法结构复杂的醛、酮主要采用系统命名法。
即选择含有羰基的最长碳链为主链,从距羰基最近的一端编号,由于醛基总是位于碳链的一端,不用标明醛基的位次,但酮的羰基位于碳链中间,位次必须标明。
将取代基的位次和名称放在母体名称前。
芳香烃基总是作为取代基。
多元醛、酮命名时,应选取含羰基尽可能多的碳链为主链,注明羰基的位置和数目。
不饱和醛、酮,应选择连有羰基和不饱和键在内的最长碳链做主链,并使羰基编号最小。
实验教案醛和酮的性质1
2.醛与酮活泼甲基的检验—碘仿反应
5支试管,分别加入1mL蒸馏水和3-4滴试样,再分别加入1mL10%NaOH溶液,滴加KI-I2至溶液呈黄色,继续振荡至浅黄色消失,析出浅黄色沉淀,若无沉淀或出现白色乳浊液,则放在50-600C水浴中微热几分钟,(如溶液变成无色,可补加KI-I2溶液)观察结果。
(3)Feling试验
Fehling试剂(由硫酸铜与酒石酸钾钠的碱性溶液混合而成)与醛一起加热,Cu2﹢
被还原成砖红色的氧化亚铜沉淀析出,醛被氧化成羧酸。
(4)Benedict试验
Benedict试剂(柠檬酸钠、碳酸钠和硫酸铜的混合液)。
脂肪醛还原Benedict试剂生成黄至红色Cu2O沉淀,而芳香醛、酮则成负性结果。可用本实验鉴别脂肪醛和芳香醛、脂肪醛和酮。
5支洁净的试管中分别加入1mLTollen试剂,再分别加入2滴试样,摇匀,静置,若无变化,放在50-600C水浴温热几分钟,观察银镜的生成。
试样:甲醛、乙醛、苯甲醛、丙酮、环己酮
(3)Feling试验
在4支试管中分别加入FelingA和FelingB各0.5mL摇匀分别加入3-4滴试样,摇匀,沸水浴加热3-5min,观察颜色的变化。
答:Tollen试剂的主要用途是鉴别醛类(有时也可以用于鉴定末端炔烃和还原性糖)。配制Tollen试剂时,若加过量的氨水,将会生成雷酸银(AgONC),而雷酸银受热时产生爆炸。另外,过量的氨水也会影响试剂的灵敏度。
Tollen试剂显阳性反应是产生亮的银镜或黑色银的沉淀(末端炔烃得到白色的炔银沉淀)。
试样:乙醛、丙酮、乙醇、异丙醇、1-丁醇
3.区别醛与酮的反应
(1)Schiff试验
在5支试管中分别加入1mL品红醛试剂(Schiff试剂),然后分别滴加2滴试样,振荡摇匀,放置数分钟,然后分别向溶液中逐滴加入浓硫酸或浓盐酸,边滴边摇,观察现象?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学基础 § 3 烃的含氧衍生物 教案
§3-2 醛和酮
一、醛类
1、概念和分子组成结构
(1)醛类—由烃基和醛基相连而构成的有机物。
讲解:醛基一定要连在碳原子上,例如:
讲解:特例
(2)分子组成:饱和一元脂肪醛:C n H 2n O(n ≥1) 示性式:C n H 2n+1CHO(n ≥0) 注意:饱和一元脂肪醛的Ω=1
注意:醛基必须写为-CHO ,绝对不能写成-COH ,且C-H 不要省略。
(3)分子结构:C=O 键类似C=C ,键角为120°,例如: 设问:插入氧原子为什么影响了氢原子数目 讲解:形成了双键。
(4)类别
按 烃 基:脂肪醛、脂环醛、芳香醛 按醛基数目:一元醛、二元醛、多元醛
例如:
(5)同分异构体:碳链异构和官能团异构
练习:写出C 4H 8O 的同分异构体的结构简式并用系统法和习惯法命名。
C H 3O C H
O
C H O
苯(基)甲醛
C H O
环己醛
H C H O
讲解:C 3H 7CHO
设问:还有什么同分异构体 讲解:不饱和醚和环醚,请举例。
设问:丙醛的如何变换成为丙酮 例题: 2、醛类的性质 (1)物理性质:
甲醛为无色气体,有刺激性气味,易溶于水。
注:37~40%的甲醛溶液俗称“福尔马林”—Formalin 。
乙醛为无色液体,易挥发(20.8℃),与水和乙醇互溶。
读书:P56图3-11、12、资料卡片 (2)化学性质
①氧化反应—氧化成酸 A 、与银氨溶液反应—银镜反应 演示:P57实验3-5
配置:1mL2%AgNO 3溶液,边振荡边滴入2%的氨水,直至沉淀刚好完全溶解。
反应:324Ag NH H O AgOH NH +++⋅=↓+、332AgOH+2NH =[Ag(NH )]OH 总式:32324Ag 3NH H O [Ag(NH )]OH NH ++++=+
现象:无色溶液→白色沉淀→棕褐色沉淀→无色溶液 操作:在上述银氨溶液中滴加3滴乙醛,置于温水浴中。
现象:试管内壁生成银白色金属
反应:
简写为:2333234CH CHO 2[Ag(NH )]OH C H O H C 2Ag 3N OON H ∆
+↓++→+
讲解:反应的本质是在醛基的C —H 之间插入一个氧原子。
通式:32423RCHO 2[Ag(NH )]OH RCOONH H O 2Ag 3NH ∆
+→++↓+ 设问:离子方程式
讲解:+
32423RCHO 2[Ag(NH )]+2OH RCOO +NH H O 2Ag 3NH ∆
--++→++↓+
设问:为什么上述反应是乙醛的氧化反应 讲解:1
3
R CHO R COOH ++→,1
32[Ag(NH )]OH Ag +→ 总之:氧化—脱氢或加氧,还原—加氢或脱氧。
规律:CHO~2Ag -
应用:此反应用于工业制镜子、保温瓶及醛基的检验。
设问:甲醛的银镜反应
讲解: HCHO~4Ag 例题:DX27L2B B 、与Fehling 试剂反应
配置:2mL10%NaOH 溶液,滴加4~6滴2%的CuSO 4溶液,振荡。
反应:22Cu 2OH Cu(OH)+-+=↓ 讲解:NaOH 过量!
操作:在上述斐林试剂加入乙醛,加热至沸腾。
C H 3C H O
C H 3C O H O
+ 4NH 3 + 2Ag ↓+ H 2O △
+ 2[Ag(NH 3)2]OH C
H 3C
ONH 4O
+ 3NH 3 + 2Ag ↓+ H 2O
讲解:乙醛过量,Cu(OH)2过量则受热分解生成黑色CuO 。
现象:生成砖红色沉淀
反应:
简写为:32322CH CHO 2Cu(OH)+NaOH CH COONa Cu O 3H O ∆
+→+↓+ 讲解:反应的本质是在醛基的C —H 之间插入一个氧原子。
通式:222RCHO 2Cu(OH)+NaOH RCOONa Cu O 3H O ∆
+→+↓+ 规律:22CHO~2Cu(OH)~Cu O -↓ 应用:此反应用于醛基的检验。
设问:醛能不能使酸性高锰酸钾溶液和溴水退色
讲解:银氨溶液和斐林试剂都只是弱氧化剂。
同样-CHO -COOH → 练习:写出乙醛和溴水反应的化学方程式。
设问:丙酮能不能发生类似反应
设问:哪些物质能与银氨溶液和斐林试剂反应只是醛类 归纳:含有醛基的有机物—醛类、甲酸及其盐和酯、醛糖。
例题:DX27L2
②与氢气加成—还原成伯醇
讲解:
简写为:Ni
3232CH CHO H CH CH OH ∆
+−−→ 练习:写出丙醛、丙酮与氢气反应的化学方程式。
讲解: N 2i 32232CHO C CH CH H C H H H CH O ∆
+−−→ C H 3C H O
C H 3C OH O
+ Cu 2O ↓+ 2H 2O △
+ 2Cu(OH)2H C C H H H
O
Ni + H 2H C CH H H
H OH
设问:此类加成反应的规律
讲解:醛加氢还原成伯醇,酮加氢还原成仲醇。
练习:写出通式 讲解:Ni
2
2RCHO H RCH OH ∆
+−−→、 思考:想一想,醇的催化氧化
讲解:2
2H 2O RCHO RCH OH −−→
←−−、 讲解:2RCH OH RCHO RCOOH →→ 例题:DX27L1+B 、L3~L4+B 二、乙醛和丙酮的用途 1、丙酮简介 读书:P58科学视野
讲解:丙酮为无色液体,易挥发,有令人愉快(不难受)的气味,与水和乙醇混溶。
是重要的溶剂和原料。
2、乙醛用途:生产乙酸的原料。
甲醛有消毒、防腐性能。
设问:工业上以乙炔和水为原料生产乙醛,试写出反应的化学方程式。
讲解:
讲解:具有 结构的有机物加入斐林试剂会生成绛蓝色溶液。
例如: 葡萄糖中加入斐林试剂生成绛蓝色溶液,加热至沸腾再生成砖红色沉淀。
讲解:羟醛缩合反应—α-H 的反应
例如:a 2N OH
33O H H O 2CH CH C CH CHCHO ∆
−−−→=+ R 1C R 2O + H 2△
R 1CH R 2OH
R 1C R 2O
H R 1CH R 2OH
2
C
H CH + H-OH
H C
C H H OH
H C C H
H O
H
催化剂
例题:CP26Ex15、16
讲解:如何检验CH 2=CHCHO 中的碳碳双键
讲解:碳碳双键和醛基均能与溴水和酸性高锰酸钾溶液反应: 例题:
01、一氧化碳、烯烃和氢气在催化剂作用下发生烯烃的醛化反应,又叫羰基合成,如由乙烯
可制丙醛:
CH 2=CH 2+CO+H 2−−−→催化剂
CH 3CH 2CHO 由丁烯进行醛化反应的产物中,属于醛的有
(A)2种 (B)3种 (C)4种 (D)5种 解:
02、有机物甲可氧化生成羧酸,也可还原生成醇。
由甲生成的羧酸和醇在一定条件下反应可
以生成化合物乙,其分子式为C 2H 4O 2下列叙述不.
正确的是 (A)甲分子中碳的质量分数为40% (B)甲在常温、常压下为无色液体 (C)乙比甲的沸点高 (D)乙和甲的实验式相同 解:甲为甲醛HCHO
讲解:“对称”的酯:22R COO CH R R COOH R CH OH ---→-+--
03、1,5-戊二醛(简称GA)是一种重要的饱和直链二元醛。
2%的GA 溶液对禽流感、口蹄疫
等疾病有良好的防治作用。
根据上述信息,判断下列说法中正确的是 (A)戊二醛的分子式为C 5H 8O 2,符合此分子式的二元醛有5种 (B)1mol 的戊二醛与足量的银氨溶液反应,最多可得2mol 单质银 (C)戊二醛不能使酸性高锰酸钾溶液褪色
(D)戊二醛经催化氧化可以得到的戊二酸有4种同分异构体 解:1
2
3
2
1
C C C C C ----:1-1、1-2、1-3、1-2/、2-3、2-2
04、从甜橙的芳香油中可分离得到如右图结构的化合物:现有试剂:
①KMnO4酸性溶液②H2/Ni ③Ag(NH3)2OH ④新制Cu(OH)2悬浊液
能与该化合物中所有官能团都发生反应的试剂有
(A)①②(B)②③(C)③④(D)①④
05、(2004全国)心酮胺是治疗冠心病的药物。
它具有如下结构简式:
下列关于心酮胺的描述,错误的是
(A)可以在催化剂作用下和溴反应(B)可以和银氨溶液发生银镜反应
(C)可以和氢溴酸反应(D)可以和浓硫酸与浓硝酸的混合液反应
06、有机物A、B、C都是重要的化工原料,A~D之间有如下图所示的转化关系:
(1)A中官能团的名称为:
(2)A→C的实验现象为:
反应的化学方程式为:
(3)1molA与2molH2加成得产物B,完成B+C→D的化学方程式:
反应类型为:
解:C3H4O2:CH2=CHCOOH
答:
(1)醛基、碳碳双键(2)产生砖红色沉淀
CH2=CHCHO+2Cu(OH)2∆→CH2=CHCOOH+Cu2O+2H2O
CH2=CHCOOCH2CH2CH3+H2O取代反应(3)CH 2=CHCOOH+CH3CH2CH2OH24SO
H
浓
△。
