凝血因子抗体检测(王学锋)
4种活化部分凝血活酶时间试剂因子敏感性的量化评估及临床应用探讨

4种活化部分凝血活酶时间试剂因子敏感性的量化评估及临床应用探讨王威;何晓璇;仝晓宁;刘哲;邓凯;王刚【摘要】目的量化评估4种活化部分凝血活酶时间(APT T)试剂的FⅧ、FⅨ、FⅪ、FⅫ 敏感性,分析其临床适用范围.方法采用美国临床和实验室标准化协会(CLSI)H47-A2的APTT 试剂敏感性评估方法,检测由标准血浆和单因子缺乏血浆配制的<1% ~100% 不同因子水平混合血浆的APTT值.APTT试剂敏感性由非线性回归曲线与正常参考区间上限的交叉点确定,并用百分活度(%)表示.结果试剂A(上海太阳生物技术有限公司,鞣花酸)的因子敏感性为FⅧ 54.0%,FⅨ37.3%,FⅪ56.5%,FⅫ 36.4%;试剂B(上海太阳生物技术有限公司,白陶土)的因子敏感性为FⅧ 25.6%,FⅨ16.5%,FⅪ23.8%,FⅫ 18.6%;试剂C(西门子公司)的因子敏感性为FⅧ 42.9%,FⅨ 30.0%,FⅪ 45.3%,FⅫ 28.4%;试剂D(思塔高公司)的因子敏感性为FⅧ26.1%,FⅨ 17.6%,FⅪ 19.1%,FⅫ 21.0%.结论 4种A PT T 试剂的内源性因子敏感性差异较大.试剂A适用于亚临床型血友病A、B的筛查;试剂C适用于术前筛查;试剂B和试剂D适用于内源性单因子缺乏的确证试验.%Objective To evaluate the responsiveness to single factor levels of four APTT reagents,and an-alyze the different scopes of clinical application.Methods We evaluated,according to the recommendation of the CLSI H47-A2 guideline,the responsiveness to single factor levels of four APT T reagents by using factor-deficient plasmas spiked with a calibration plasma to produce individual factor activities ranging from <1% to 100%.The APTT responsiveness in percent activity(%)could be determined from the intersection of the curve and the upper limit of the APTT normal referencerange for that APTT reagent.Results APTT re-sponsiveness ofSUNBIO(ellagic acid)was as follows:F Ⅷ 54.0%,F Ⅸ 37.3%,F Ⅺ 56.5%,F Ⅻ 36.4%;APTT responsiveness of SUNBIO(kaolin)was as follows:FⅧ25.6%,FⅨ16.5%,FⅪ23.8%,FⅫ 18.6%;APTT responsiveness of Siemens Dade Actin was as follows:F Ⅷ 42.9%,F Ⅸ 30.0%,F Ⅺ 45.3%,F Ⅻ28.4%;APTT responsiveness of STAO ?-PTTA was as follows:FⅧ 26.1%,FⅨ 17.6%,FⅪ 19.1%,FⅫ21.0%.Conclusion The responsiveness of the tested APTT reagents to single factor deficiency is highly vari-able.SUNBIO(ellagic acid)is suitable for assisting diagnosis of subclinical hemophilia A andB;Siemens Dade Actin is suitable for preoperativescreening;SUNBIO(kaolin)and STAO?-PTTA is suitable for identifying single intrinsic pathway factor deficiencies.【期刊名称】《检验医学与临床》【年(卷),期】2018(015)008【总页数】4页(P1118-1120,1124)【关键词】APTT试剂;CLSIH47-A2;内源性凝血因子;敏感性【作者】王威;何晓璇;仝晓宁;刘哲;邓凯;王刚【作者单位】西安交通大学第一附属医院检验科,西安710061;西安交通大学第一附属医院检验科,西安710061;西安交通大学第一附属医院检验科,西安710061;西安交通大学第一附属医院检验科,西安710061;西安交通大学第一附属医院检验科,西安710061;西安交通大学第一附属医院检验科,西安710061【正文语种】中文【中图分类】R446.1活化部分凝血活酶时间(APTT)可以反映内源性凝血途径和(或)共同途径的因子缺乏,并且在多因子缺乏或者明显的单因子缺乏时表现为时间延长,但当因子缺乏时,APTT是否延长及延长的程度取决于APTT试剂对内源性凝血因子的敏感性。
凝血因子检测及临床意义

凝血因子检测及临床意义一、凝血因子Ⅱ、Ⅴ、Ⅶ、Ⅹ的促凝活性测定(一)正常值(一期法)1、凝血因子Ⅱ:72.9%~118.9%。
2、凝血因子Ⅴ:64.5%~140.3%。
3、凝血因子Ⅶ:85.8%~123.2%。
4、凝血因子Ⅹ:89.5%~120.3%。
(二)影响因素1、血和抗凝剂比例应准确。
2、标本要及时送检,不能久置,时间长了活性减低。
(三)临床意义测定单一凝血因子缺乏和缺乏程度,用于先天性或获得性凝血因子缺乏疾病的检查。
1、血浆中凝血因子Ⅱ、Ⅴ、Ⅶ、Ⅹ增高,意义同内源性凝血因子测定,但肝病除外。
2、血浆中凝血因子Ⅱ、Ⅴ、Ⅶ、Ⅹ减低,见于先天性因子Ⅱ、Ⅴ、Ⅶ、Ⅹ缺乏症,但较少见,获得性减低者见于维生素K缺乏症、肝脏疾病,DIC和口服抗凝剂等。
二、凝血因子Ⅷ、Ⅸ、Ⅺ、Ⅻ的促凝活性测定(一)正常值(一期法)1、凝血因子Ⅷ:77.3%~128.7%。
2、凝血因子Ⅸ:67.6%~128.5%。
3、凝血因子Ⅺ︰C:81.6%~118.4%。
4、凝血因子Ⅻ︰C:71.7%~113.1%。
(二)影响因素1、血和抗凝剂比例应准确。
2、标本要及时送检,不能久置,时间长了活性减低。
(三)临床意义可测定单一凝血因子缺乏和缺乏程度,用于先天性或获得性凝血因子缺乏疾病的检查。
1、血浆量:Ⅷ、Ⅸ、Ⅺ、Ⅻ增高,主要见于高凝状态和血栓性疾病,尤其是静脉血栓形成性疾病,如深静脉血栓形成、肺栓塞、肾病综合征、口服避孕药、妊娠高血压综合征、恶性肿瘤、肝病时Ⅷ升高。
2、血浆中凝血因子Ⅷ降低,见于血友病A。
按减低的程度分为重(<2%)、中型(2%~5%)、轻型(5%~25%)以及亚临床型(25%~45%),血管性血友病(vWD)的降低程度不如血友病明显,一般在20%~40%,DIC时凝血因子Ⅷ被消耗,故也减少。
3、凝血因子Ⅸ降低,见于血友病B,临床分型同血友病A,其次见于肝脏疾病、维生素K缺乏症:CDIC和口服抗凝剂等。
4、凝血因子Ⅺ降低,见于凝血因子Ⅺ缺乏症、肝脏疾病和DIC等。
凝血因子Ⅺ(FⅪ)试剂盒检测说明书
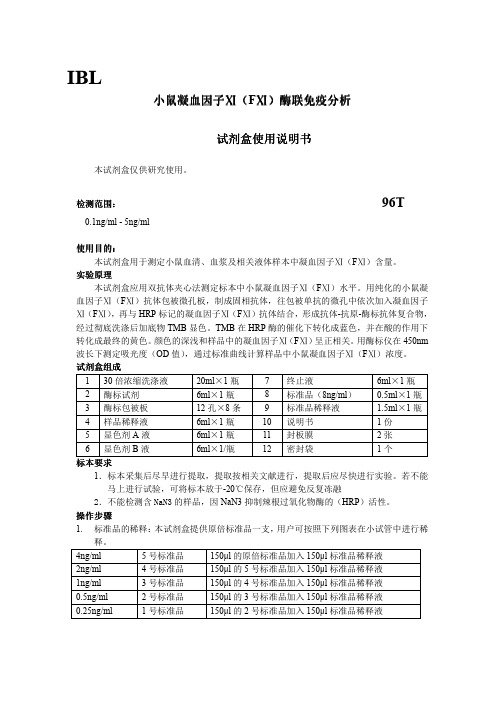
小鼠小鼠凝血因子凝血因子凝血因子ⅪⅪ(F Ⅺ)酶联免疫酶联免疫分析分析分析试剂试剂盒使用说明书盒使用说明书盒使用说明书本试剂盒仅供研究使用。
检测范围检测范围:: 96T0.1ng/ml - 5ng/ml使用目的使用目的::本试剂盒用于测定小鼠血清、血浆及相关液体样本中凝血因子Ⅺ(F Ⅺ)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中小鼠凝血因子Ⅺ(F Ⅺ)水平。
用纯化的小鼠凝血因子Ⅺ(F Ⅺ)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入凝血因子Ⅺ(F Ⅺ),再与HRP 标记的凝血因子Ⅺ(F Ⅺ)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的凝血因子Ⅺ(F Ⅺ)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中小鼠凝血因子Ⅺ(F Ⅺ)浓度。
试剂盒组成 1 30倍浓缩洗涤液 20ml ×1瓶 7 终止液6ml ×1瓶 2 酶标试剂 6ml ×1瓶 8 标准品(8ng/ml ) 0.5ml ×1瓶 3 酶标包被板 12孔×8条 9 标准品稀释液 1.5ml ×1瓶 4 样品稀释液 6ml ×1瓶 10 说明书 1份 5 显色剂A 液 6ml ×1瓶 11 封板膜 2张 6显色剂B 液6ml ×1/瓶12密封袋1个标本标本要求要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP )活性。
操作步骤1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
4ng/ml 5号标准品 150µl 的原倍标准品加入150µl 标准品稀释液 2ng/ml 4号标准品 150µl 的5号标准品加入150µl 标准品稀释液 1ng/ml 3号标准品 150µl 的4号标准品加入150µl 标准品稀释液 0.5ng/ml 2号标准品 150µl 的3号标准品加入150µl 标准品稀释液 0.25ng/ml 1号标准品150µl 的2号标准品加入150µl 标准品稀释液IBL2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
人凝血因子检验方法

人凝血因子检验方法引言人凝血因子是一组在血液凝固过程中起关键作用的蛋白质。
凝血因子检验是评估一个人的凝血功能是否正常的重要方法。
本文将介绍人凝血因子检验的方法,包括常用的实验室检测方法和新兴的分子诊断技术。
1. 凝血因子简介人体内共有13种已知的凝血因子,它们按照其参与凝血反应的顺序被编号为Ⅰ至ⅩⅢ。
这些凝血因子在正常情况下相互协作,形成一个复杂而精确的平衡系统,以维持正常的止血和溶栓过程。
2. 常用实验室检测方法2.1 凝血酶原时间(PT)PT是评估外源性凝血通路功能的指标。
该测试使用钠柠檬酸抗凝剂处理患者的血液样本,然后添加磷酸钙和组织因子来启动凝血反应。
通过计算患者样本中形成凝块所需时间来确定PT值。
2.2 部分凝血活酶时间(APTT)APTT是评估内源性凝血通路功能的指标。
该测试使用钠柠檬酸抗凝剂处理患者的血液样本,然后添加磷酸钙和活化的部分凝血活酶来启动凝血反应。
通过计算患者样本中形成凝块所需时间来确定APTT值。
2.3 血小板计数和出血时间除了凝血因子本身,血小板也是维持正常止血过程中不可或缺的组成部分。
进行完整的凝血功能检查时,还需要评估患者的血小板计数和出血时间。
3. 分子诊断技术近年来,随着分子生物学技术的不断发展,越来越多的新兴检测方法被应用于人凝血因子检验中。
3.1 多重PCR多重PCR(Polymerase Chain Reaction)是一种高效且灵敏的分子生物学技术,可以同时检测多个基因突变。
在人凝血因子检验中,多重PCR可以用于快速筛查常见突变引起的凝血因子缺陷。
3.2 基因测序基因测序是一种直接测定DNA序列的方法。
通过对凝血因子相关基因进行全序列测定,可以发现罕见突变或新的基因变异,为凝血功能异常的诊断提供更准确的依据。
3.3 基因芯片技术基因芯片技术是一种高通量的基因分析方法,可以同时检测上千个基因。
在人凝血因子检验中,基因芯片技术可以用于快速筛查多个凝血相关基因的变异。
凝血因子抗体检测

凝血因子抗体检测凝血因子抗体检测是一种检测机体是否出现对凝血因子产生抗体的方法。
凝血因子是血液中参与凝血过程的一类蛋白质,它们在正常情况下能够协同作用,形成血凝块,并阻止血液过多流失。
而当机体出现对凝血因子产生抗体时,会造成凝血功能异常,导致出血倾向或血栓形成等疾病。
凝血因子抗体检测主要用于排除或诊断先天性或后天性凝血因子缺乏症、自身免疫系统性疾病和其他疾病引起的抗凝血因子免疫血液病。
其中,自身抗凝血因子免疫血液病是一类自身免疫性疾病,常见的有抗磷脂抗体综合征(APS)、自身抗凝血酶抗体综合征(CAC)、抗凝血酶抗体和抗磷脂抗体同时存在等。
凝血因子抗体检测一般包括两个方面:常规凝血因子抗体和磷脂抗体的检测。
常规凝血因子抗体检测可以检测循环中凝血因子特异性抗体,用于诊断先天性或后天性凝血因子缺乏症。
而磷脂抗体检测主要用于检测一些自身免疫性疾病,如APS,由于自身产生的抗体可与凝血系统相关的磷脂结合,导致凝血系统功能异常。
常规凝血因子抗体检测主要包括凝血因子八、凝血因子九、凝血因子十一、凝血因子十二、凝血因子十三等凝血因子的抗体检测。
这些抗体的检测一般采用酶联免疫吸附试验(ELISA),通过对患者血清中的抗体与特定凝血因子抗原进行结合,然后用特定的辅助试剂检测反应的产物,从而判断血液中的抗体含量。
磷脂抗体检测一般采用磷脂筛选试验和磷脂抗体定量试验。
磷脂筛选试验通常采用凝集试验、凝血试验等方法,通过观察血浆与磷脂之间的凝集程度来判断是否存在磷脂抗体。
而磷脂抗体定量试验则可以进一步确定磷脂抗体的水平。
常用的磷脂抗体定量试验有凝血抑制试验、酶联免疫吸附试验等。
凝血因子抗体检测的结果可以帮助医生判断病情、指导治疗以及评估疗效。
对于先天性或后天性凝血因子缺乏症患者来说,抗体检测可以帮助确定凝血因子缺乏的类型和程度,并制定相应的治疗方案。
对于自身免疫性凝血功能障碍患者来说,抗体检测可以帮助明确诊断,并指导治疗。
常规凝血检测指标在产后出血中的意义

检 测 结 果 采 用 团 体 比较 t检 验 , E c l 件 进 行 统 用 xe 软 计学处理 。
结 果
D C演进 。 临 床 上 早 期 使 用 肝 素 可 以 防 止 血 液 向 低 凝 状 态 I
的转 化 。 妊 娠 时 期 孕 妇 抗 凝 血 酶 ( T) 性 较 正 常 人 低 , A 活 而 肝 素 能增 加 A 的活 性 , 活 活 化 的凝 血 因 子 , 缓 凝 血 过 T 灭 延
A T 降 低 5s 上 J 本 研 究 测 得 AP T 值 在 产 时 第 2 PT 以 。 T
组 最 高 , 照 组 最 低 , 者 相 比差 异 有 显 著 性 ( 对 两 P< 0 0 ) .5 , 表明此时 A T 已反映血液 的低 凝状 态 , 示 产后 大量 出 P T 提 血 导 致 AP T 延 长 时 , 采 取 各 种 积 极 治 疗 措 施 防 止 向 T 应
的相关性进行探 讨。
较产时』升 明显 ( 一 P< 0 0 , . 5 P<0 0 ) 而 对 照 组 变 化 不 明 .1 , 显, 明 F 表 g的 变 化 与 产 后 出 血 量 相 关 。产 时 第 l组 和第 2
组
均 比 对 照 组 低 , 仪 第 2组 与 对 照 组 相 比 , 异 有 显 但 差
二 、 测 项 目 检
全血 或 F g等 血 液 制 品 导 致 F g恢 复 。可 几 F 尢 g不 能 作 为
D C的 早 期 检 测 指 标 , 能 反 映 出 产 后 出 血 的 发 展 情 况 或 I 但 疗 效 , 客 观 判 断 产 妇 的 出 血 情 况 , 定 妊 娠 期 、 娩 期 及 对 制 分 产褥期 的正常参考 值范围 有重要临床 意义 。 D C按 病 程 进 展 可 分 为 高 凝 期 、 耗 性 低 凝 期 和 继 发 I 消
应用血凝、ELISA试验检测牛口蹄疫免疫抗体、非结构蛋白抗体

应用血凝、ELISA试验检测牛口蹄疫免疫抗体、非结构蛋白
抗体
徐继鹏;王仕刚;李丙文;靳桂君;孙春玲
【期刊名称】《兽药市场指南》
【年(卷),期】2007(000)003
【摘要】口蹄疫(FMD)被O正列为A类传染病之首,从九十年代开始,随着人们防疫意识的增强。
天津市武清区采用每年春、秋两次集中防疫。
并随时补针的措施。
使口蹄疫的预防工作卓有成效。
但是,由于周边国家和地区常有口蹄疫发生的报道.为了掌握天津市武清区口蹄疫的免疫状况,天津市武清区动物疫病监测中心于2006年10月开始应用血凝、ELISA试验方法在全区29个乡镇进行了FMD 免疫抗体、非结构蛋白抗体(自然强毒感染抗体)的检测。
【总页数】1页(P45)
【作者】徐继鹏;王仕刚;李丙文;靳桂君;孙春玲
【作者单位】天津市武清区畜牧兽医技术服务中心
【正文语种】中文
【中图分类】S855.3
【相关文献】
1.4种ELISA方法检测牛口蹄疫非结构蛋白抗体的ROC评价 [J], 王欢;张润祥;李迪;曹永生;高明春;王君伟
2.ELISA法检测牛口蹄疫免疫非结构蛋白抗体的试验研究 [J], 才让吉
3.应用正向间接血凝试验与酶联免疫吸附试验检测猪 O 型口蹄疫免疫抗体的比较分析 [J], 汤海平;林映升;林跃华;陈祝茗
4.应用ELISA试验检测猪瘟免疫抗体 [J], 周秋平;黄绍明;黄章生;王家涛
5.ELISA检测牛口蹄疫非结构蛋白抗体 [J], 索南卓玛
因版权原因,仅展示原文概要,查看原文内容请购买。
血浆凝血因子Ⅷ、Ⅸ、Ⅺ和Ⅻ促凝血活性测定

血浆凝血因子Ⅷ、Ⅸ、Ⅺ和Ⅻ促凝血活性测定摘要】目的讨论血浆凝血因子Ⅷ、Ⅸ、Ⅺ和Ⅻ促凝血活性测定。
方法对样本进行临床检验。
结论参考范围(一期法)FⅧ:C 54.29%~168.51%,FⅨ:C 50.09%~222.05%,FⅪ:C 81%~118%, FⅫ:C 61 %~148%。
因子Ⅷ、Ⅸ、Ⅺ和Ⅻ的促凝活性检测与Ⅱ:C、V:C、Ⅶ:C、X: C等一样,都是以相当正常人的百分活性来表示的,故工作参考值很重要,志愿者以100例为好,且年龄段分布要有代表性,制成的混合血浆在一30℃下也只能保持3个月。
每次检测都必须制作标准曲线。
【关键词】血浆凝血因子Ⅷ、Ⅸ、Ⅺ和Ⅻ促凝血活性测定参考范围(一期法)FⅧ:C54.29%~168.51%,FⅨ:C50.09%~222.05%,FⅪ:C81%~118%,FⅫ:C61 %~148%。
结果评价1.生理情况血浆凝血因子Ⅷ曾称为抗血友病因子(antihemophilic factor,AHF)或抗血友病球蛋白(antihemophilic globulin,AHG),正常人血浆浓度很不稳定,一般为0.1mg/L,分子质量为3330000,肝脏可能是主要的合成场所,其基因定位于X性染色体(Xq28),长度为186kb。
凝血因子Ⅸ也称为凝血活酶成分(plasma thromboplastin com-ponent,或叫christmas因子,分子质量为56000,正常血浆浓度为3~4mg/L,为肝脏合成的维生素K依赖性凝血因子,其基因定位于X染色体(Xq27.1),长度为34kb。
凝血因子Ⅺ,又称血浆凝血活酶前质(plasma thromboplastin antecedent,PTA),是一种较为稳定的凝血蛋白,血浆正常浓度为4~6mg/L,分子质量为160 000,由肝脏合成,基因定位于4号染色体(4q35),长度为23kb。
因子Ⅻ,也称Hageman因子,正常血浆浓度为29mg/L,分子质量为80 000,主要由肝脏合成,基因定位于第5号染色体(5q33-ter),长度为11.9kb。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 免疫法检测不适合于抗体测定,因为其不能区分 所检测的抗体是否具有生物学活性
抗体类型
• 时间依赖型抗体:FVIII
• 时间非依赖性抗体:其他相关凝血因子抗 体
抗体检测临床意义
• 抗体阳性:获得性 因子替代治疗后产生抗体
• 指导免疫抑制剂的使用 • 指导所需因子的使用量 • 监测出血倾向
1
111
9
2
116
10
3
100
11
4
110
12
5
108
13
6
110
14
7
105
15
8
120
16
mean
Factor VIII activity 110 120 110 120 113 110 110 112
110
在使用时,需将Nijmegen血浆进行稀释,使其终浓 度为100%
3.检测:
准备患者血浆、标准品和质控品,若怀疑 FVIII抗体滴度较高,需将患者血浆进行一定 比例的稀释,常用稀释度为:1/2,1/4,1/8, 1/16,加入等量Nijmegen血浆后置于37℃水 浴2小时(加盖)
Brand: Pacific Haemostasis Lot No:800-601x Expiry Date:01/2009 Blank
Brand: Dade Lot No:536550 Expiry Date:22/11/2008 Blank Brand: Technoclone Lot No:486900D Expiry Date:31/12/2008 Blank
9
>2
18
>2
32
1.6
38
1.4
45
1.1
稀释度
原倍 1/2 1/4 1/8 1/16
BU结果
>2 >4 6.4 11.2 17.5
Type II 型抗体结果判读
剩余FVIII活性(%) >80 66-80 <66
结果报告
阴性
阴性,同时报告剩余 FVIII活性
BU 结果:需同时报告下列两个值 1.剩余FVIII水平在30-60%之间的 稀释度所得的BU值 2.最接近50%剩余FVIII活性的稀 释度所对应的BU值
• 平行曲线:报标准曲线上相对应的因子活 性
• 不平行曲线:提示有抑制物存在,进行抑 制物检测,包括因子抗体和狼疮抗凝物
凝血因子活性检测
• FVIII为例:
Test .
Clotting time(s)
100
Standard
. .
80
.
1/40
.
60
1/20
.
1/10
40
20
5
10
20 30
50
100
凝血因子活性和抗体检测
上海交通大学医学院附属瑞金医院 王学锋
凝血因子活性测定原理
• 基于APTT的凝血因子活性测定:内源性凝 血因子,包括
FVIII:C, FIX:C, FXI:C, FXII:C, FX:C
• 基因PT的凝血因子活性测定:外源性凝血 因子,包括
FVII:C, FII:C, FV:C, FX:C
96.1
No end point
55.5
Blank=<1u/dL
63.0
69.8
94.6
Blank=1u/dL
44.4
50.3
56.1
78
Blank=<1u/dL
1:160
结果
77.3
不予使用,因该乏因子血
浆中FVIII活性为 4u/dL
78.6
可用于重症血友病患者的
检测
105
FVIII<1,但该批号的供应
Nijmegen 血浆 300ul
+
原倍血 浆300ul
Nijmegen 血浆 300ul
+
½稀释 300ul
Nijmegen 血浆 300ul
+
¼稀释 300ul
Nijmegen 血浆300ul
+ 1/8稀释 300ul
Nijmegen 血浆 300ul
+
1/16稀释 300ul
Nijmegen 血浆 300ul
(每次均需有新的定标曲线)
结果判读
• 取最接近50%活性的稀释度,在半对数表上读 取相应的Bethedsa单位,然后乘以相应的稀释 倍数即为该份标本的抗体滴度。
稀释度 残余FVIII活性 BU单位
1/4 23.5%
2.02
1/8 49.1%
1
1/16 68.3%
0.68
结果 8
• Type 1 抗体:I型酶动力曲线,FVIII灭活量 呈时间依赖性,表现为所取得的BU值与稀 释度成正比。
注:制备过程中最好使用塑料容器
• 2.Nijmegen血浆定标:
取制备好的Nijmegen血浆一份,检测其 FVIII活性,需采用两种标准品分别进行检 测,多次检测后取平均值
Calibration of Nijmegen
sample
1/5
标准品 1(118) Nijmegen 标准品2(52) 51.1 Nijmegen 标准品2(50) 51.1 空白
量较少,不予使用
76.2 空白=1u/dL,不予使 用
61
尽管 FVIII <1, 但该曲线
过于平坦,不予使用
注意事项
• 使用同一批号的APTT试剂:APTT试剂的 激活程度各批号间存在差异
• 乏因子血浆更换批次时需重新定标
抗体测定原理
• 抗体的确定和定量均是在待检血浆中加入外源性 因子(如正常混合血浆)形成混合物,即刻或经 一定时间孵育后,检测目的因子活性减低的量, 同时检测对照(用确定不含抗体的血浆)中因子 活性减低程度。
+浆中FVIII活性基数,制备相应的 标准品
FVIII活性 基数 <10
15
25
Nijmegen 血浆量 100ul
115ul
125ul
FVIII乏因子 血浆量 100ul
85ul
75ul
• 水浴结束后立刻将试管置于冰上,防止 FVIII降解
• 同FVIII活性测定方法检测经孵育后样本中 的剩余FVIII活性。
1:5
1:10
49.3
54.9
77.3
83.8
48.6
54
95.5
96.8
58.2
67.5
147
150
42.8
49.9
93
93
35.7
39.8
77.8
77.6
1:20
1:40
1:80
61
65.5
70.9
84.8
Blank=4u/dL
59.7
65.7
71.8
96.3
Blank=<1u/dL
76.5
86.7
FVIII抗体检测 Nijmegen法
• 老的Bethesda法缺点:在低抗体滴度的情况 下可出现假阳性结果
• 1996年ISTH推荐用改良的Bethesda法:采用 Nijmegen混合血浆,其为经过PH缓冲的正 常人混合血浆,稳定性、特异性和敏感性 更好。该方法的名称为Nijmegen法。
适用于所有产生抗体的病人体内抗体水平检测:无论其 所用的为何种替代治疗产品(包括Refacto)
FVIII:C 检测原理
• 基于APTT测定
待检血浆 (FVIII缺乏)
+
乏FVIII因子血浆
(含有除FVIII因 子外的所有因子)
APTT检测
方法
• 1.样本、标准品和质控标本准备: 用因子稀释液对样本进行稀释: 标准品:1/10(100%) 样本:1/10,1/20,1/40(非常重要)
浓度极低时可采用1/5,1/10,1/20 质控标本:根据要求
• 2.准备乏因子血浆,根据说明书进行复溶, 置室温一定时间后备用
• 3.将试剂和样本置于仪器中的相应位置,先 进行标准曲线定标,后再进行样本检测
结果分析
• 标准曲线:在半对数表(因子活性取对数, APTT时间取直线)上做出标准曲线
• 在半对数表上作样本的曲线(三个稀释度 对应三点APTT值)
结果分析
dilutions
1/10 1/20 48.4 54.9
49.5 55.6 56.4 61.6 49.3 55.5 55.8 61.2 92.5
result
1/40 标准品1 标准品2
60.4
61.8
110
120
61.3
110
120
<1
<1
Calibration of Nijmegen pool
Factor VIII activity
• Type 2 抗体:II型酶动力曲线,灭活FVIII量 不呈时间依赖性,表现为所取得的BU值与 稀释度不成正比。
Type I型抗体结果判读
剩余FVIII活性(%) 结果报告
>80
阴性
66-80
阴性,但需同时报告剩 余FVIII水平
<66
BU值
Type II 型抗体结果判读
剩余FVIII BU 活性(%)
FVIII抗体单位
• 新的和旧的Oxford单位:已弃用 • Bethesda单位:目前ISTH推荐的世界统一
的标准单位
1BU定义:37℃孵育2小时后,中和正常血浆 (FVIII活性100%)中50%的FVIII所需抑制物的 量
