药品留样与稳定性考察的区别
一文读懂药品的留样和稳定性考察

⼀⽂读懂药品的留样和稳定性考察MediCafe⼀句话点评:药品的留样是GMP中重要的章节,也是GMP审核中必看的地⽅。
前⾔新版GMP 第225 条明确了“留样”的概念:企业按规定保存的、⽤于药品质量追溯或调查的物料、产品样品为留样。
并特别指出,⽤于产品稳定性考察的样品不属于留样。
对于“稳定性考察”,新版 GMP 专辟“持续稳定性考察”⼀节,详细规定了各项要求。
在有关持续稳定性考察条款中,还有稳定性试验、长期稳定性试验等表述。
⽬前,不少企业⽣产与研发的实验室对药品留样、稳定性考察、持续稳定性考察的概念理解的不是很清楚,更⽆法保证药品研发、⽣产程序的规范运⾏。
今天我们来梳理下这三个概念。
留样考察⽬的:⽤于药品质量追溯或调查物料、产品考察对象:主要针对每批⽣产的市售产品;和⼯艺中涉及的物料考察时间、频次:留样应保存⾄药品有效期后⼀年;除稳定性较差的原辅料外,⽤于制剂⽣产的原辅料留样⾄少保存⾄产品放⾏后⼆年;每年需要进⾏⽬检观察考察环境:与产品标签上贮存条件⼀致考察批次:每批产品均有留样,⽤于制剂⽣产的原辅料每批均需有留样考察项⽬:⽬检观察或对物料进⾏鉴别考察需量:全检两倍量(⽆菌检查和热原检查等除外)稳定性考察考察⽬的:考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的⽣产、包装、贮存、运输条件提供科学依据,同时通过试验建⽴药品的有效期。
考察对象:产品研发阶段需要进⾏影响因素试验(⽆包装)、加速试验(市售包装)、长期稳定性研究试验(市售包装);产品批准上市后⾸次投产前三批应进⾏长期稳定性试验;需要对中间产品的稳定性进⾏考察,确定中间产品的贮存期限。
考察时间、频次:影响因素试验考察 10 天,于第 5 天、10 天取样;加速试验考察 6 个⽉,于第 1 个⽉、2 个⽉、3 个⽉、6 个⽉末分别取样⼀次,按照稳定性重点考察项⽬检测;长期稳定性考察⾄少与药品有效期考察时间等长,前 12⽉、6 个⽉末分别取样⼀次,按照稳定性重点考察项⽬检测;长期稳定性考察⾄少与药品有效期考察时间等长,前 12个⽉,每 3 个⽉取样⼀次,之后与第 18 个⽉、24 个⽉、36 个⽉分别取样进⾏检测,将结果与 0 ⽉⽐较以确定有效期。
药物制剂留样制度与稳定性研究

3.1影响因素试验
(1)高温试验: 供试品开口置于适宜的洁净容器中,
60℃ 温度下放置 10 天,在第 5 天和第 10 天取样,按稳定性重点考察项目进行检测。若 供试品有明显变化(如含量下降5%),则在 40℃条件下同法进行试验。若 60℃无明显变化, 不再进行40℃试验。
3.1影响因素试验
(2)高湿度试验: 供试品置于恒湿密闭容器中,在25℃分别于相对湿 度90%±5%条件下放置10天,于第5天和第10天取样, 按稳定性重点考察项目要求检验,同时准确称量试 验前后供试品的重量,以考察供试品的吸湿潮解性 能。若吸湿增重5%以上,则在相对湿度75%±5% 条 件下,同法进行试验;若吸湿增重5%以下,且其他 考察项目符合要求,则不再进行此项试验。
1、稳定性研究的目的与意义
考察原料药或药物制剂在温度、湿度、光线 的影响下随时间变化的规律,为药品的生产、 包装、储存、运输条件提供科学依据,同时通 过试验建立药品的有效期。为物料储存期和有 效期提供数据。
1、稳定性研究的目的与意义
制剂工艺研究
质量研究
稳定性研究
2、稳定性试验的基本要求
(1)稳定性试验包括影响因素试验、加速试验 和长期试验。
2、稳定性试验的基本要求
(3)供品质量标准一致。
(4)加速试验与长期试验所用供试品包装方式 应与上市产品一致。
2、稳定性试验的基本要求
(5)研究药物稳定性,要采用专属性强、准确、 精密、灵活的药物分析方法与有关物质(含降解 产物及其他变化所生成的产物)的检查方法,并 对方法进行验证,以保证药物稳定性试验结果的 可靠性。在稳定性试验中,应重视有关物质的检 查。
药物制剂留样制度与 稳定性研究
一、药物制剂留样制度
留样观察和稳定性试验GMP

5
稳定性试验
1、稳定性试验的目的: 考察原料药或药物制剂在温度、湿
度、光线的影响下随时间变化的规律, 为药品的生产、包装、储存、运输条件 提供科学依据,同时通过试验建立药品 的有效期。
留样观察和稳定性试验GMP
6
稳定性试验
2、质量管理部门应开展对原料、中间产品 及成品质量稳定性的考察,根据考察结果 来评价原料、中间产品及成品的质量稳定 性,为确定物料储存期和有效期提供数据。 3、稳定性试验的内容:
留样申请单内容包括:
文件编号、代号、品名、批号、规格、日期、留检样 品的法定样及实验样、需要的样品量及理由、申请人签 名留样员签名和填写申请单日期等。
留样登记表内容包括:
文件编号、日期、代号、品名、批号、数量单位、留 样量及经手人等
留样观察和稳定性试验GMP
2
留样观察
留样观察还要填写留样观察记录,并建立 留样台帐。
剂,要求用 3 批供试品进行。
留样观察和稳定性试验GMP
8
稳定性试验
模生产的,供试品量相 当于制剂稳定性实验所要求的批量,原料药合成 工艺路线、方法、步骤应与大生产一致。 药物制剂的供试品应是放大试验的产品(如片 剂或胶囊剂在10000片左右或10000粒左右,特殊 剂型、特殊品种所需数量,根据具体情况灵活掌 握),其处方与生产工艺应与大生产一致。
留样观察
1、企业质量部门的中心检验室应设立留样 观察室,建立物料、中间产品和成品的 留样观察制度,明确规定留样品种、批 数、数量、观察项目、观察时间等,并 指定专人进行留样观察,填写留样观察 记录,建立留样台帐。定期做好总结, 并报有关领导。
留样观察和稳定性试验GMP
1
留样观察
留样观察要填写留样申请单和留样登记表。
药品留样观察和稳定性试验

2020年7月19日星期日
留样观察
1、企业质量部门的中心检验室应设立留样 观察室,建立物料、中间产品和成品的 留样观察制度,明确规定留样品种、批 数、数量、观察项目、观察时间等,并 指定专人进行留样观察,填写留样观察 记录,建立留样台帐。定期做好总结, 并报有关领导。
•
留样观察
2、留样观察室的场地应能满足留样要求,并 有足够的样品存放设施,有温湿度测试装 置和记录。留样量要满足留样期间内测试 所需的样品量。
3、产品留样应采用产品原包装或模拟包装, 留样储藏条件应与产品规定的储藏条件相 一致。留样样品保存到药品有效期后一 年,不规定效期的药品保存三年。
•
留样观察
4、产品留样期间如出现异常质量变化,应 填写留样样品质量变化通知单,报送质 量管理部门负责人,由质量管理部门负 责人呈报有关领导及部门采取必要的措 施。
(1)稳定性试验包括影响因素试验、加速试验 和长期试验。 影响因素试验适用于原料药的考察,用 1
批原料药进行; 加速试验和长期试验适用于原料药与药物制
剂,要求用 3 批供试品进行。
•
稳定性试验
4、稳定性试验的基本要求:
(2)原料药供试品是一定规模生产的,供试品量相 当于制剂稳定性实验所要求的批量,原料药合成 工艺路线、方法、步骤应与大生产一致。 药物制剂的供试品应是放大试验的产品(如片 剂或胶囊剂在10000片左右或10000粒左右,特殊 剂型、特殊品种所需数量,根据具体情况灵活掌 握),其处方与生产工艺应与大生产一致。
•
稳定性试验
1、影响因素试验:
(1)高温试验:供试品置于适宜的密封洁净容器 中,60℃ 温度下放置 10 天,在第 5 天和第 10 天 取样,按稳定性重点考察项目进行检测。 若供试品有明显变化(如含量下降5%),则在 40℃条件下同法进行试验。若 60℃ 无明显变 化,不再进行40℃试验。
药品留样、稳定性试验与持续稳定性考察的关系与区别

Fagui Yanzheng yu Zhuangbei ♦法规验证与装备药品留样、稳定性试验与持续稳定性考察的关系与区别胡士高窦颖辉罗京京杨士友(安徽省食品药品审评认证中心,安徽合肥230051)摘要:通过对留样、稳定性试验与持续稳定性考察三种行为的目的、适用范围、考察内容等进行分析阐 述,找出其之间的关系和区别,为药品生产企业进一步理解其内涵提供帮助。
关键词'留样;稳定性试验;持续稳定性考察;分析;区别The Relationship and Difference Among Reference Sample^Stability Testingand On-going Stability StudyHu Shigao Dou Yinghui Luo Jingjing Yang Shiyou(Anhui Center For Food And Drug Evalvation&Certification,Anhui Hefei230051) Abstract:In this article,we analyzed the purpose,applicable scope and subject studied of reference sample, stability testing and on-going stability study,to find the relationship and difference among these three kinds of behavior,which would provide further understanding for pharmaceutical enterprises.Key words:Reference sample;Stability testing;On-going stability study;Analysis;Differenceo引言《药品生产质量管理规范(2010年修订)》(以下 简称新修订药品GMP)自2011年3月1日实施以来,药品GMP检查员在日常认证检查中发现,有的药品 生产企业无法厘清留样、稳定性试验与持续稳定性 考察三种行为之间的关系和区别,不同程度地存在 着概念不清、措施混淆、质量风险和法律风险并存 等情形。
药品留样管理与持续稳定性考察制度

药品留样管理与持续稳定性考察制度药品生产质量管理规范第二百二十五条企业按规定保存的、用于药品质量追溯或调查的物料、产品样品为留样。
用于产品稳定性考察的样品不属于留样。
留样应当至少符合以下要求:(一)应当按照操作规程对留样进行管理(按文件执行)(二)留样应当能够代表被取样批次的物料或产品(代表性)(三)成品的留样:1.每批药品均应当有留样:如果一批药品分成数次进行包装,则每次包装至少应当保留一件最小市售包装的成品:(同批产品包装多少次就得留样多少次)2.留样的包装形式应当与药品市售包装形式相同,原料药的留样如无法采用市售包装形式的,可采用模拟包装:(成品的留样必须和卖出的产品包装相同)3每批药品的留样数量一般至少应当能够确保按照注册批准的质量标准完成两次全检(无菌检查和热原检查等除外)(中药饮品一般不需要注册就按药典标准或内控标准)4.如果不影响留样的包装完整性,保存期间内至少应当每年对留样进行一次目检观察,如有异常,应当进行彻底调查并采取相应的处理措施;5.留样观察应当有记录6.留样应当按照注册批准的贮存条件至少保存至药品有效期后一年:7如企业终止药品生产或关闭的,应当将留样转交受权单位保存,并告知当地药品监督管理部门,以便在必要时可随时取得留样。
(如果企业关闭或此药品不生产了,要告知药品监督管理局,)(四)物料的留样:1.制剂生产用每批原辅料和与药品直接接触的包装材料均应当有留样。
与药品直接接触的包装材料(如输液瓶),如成品已有留样,可不必单独留样;(很多企业是成品留样了,成品包含在里面的,包材就不留样了)2.物料的留样量应当至少满足鉴别的需要。
3.除稳定性较差的原辅料外,用于制剂生产的原辅料(不包括生产过程中使用的溶剂、气体或制药用水)和与药品直接接触的包装材料的留样应当至少保存至产品放行后2年。
如果物料的有效期较短,则留样时间可相应的缩短:(留样期限可以随着有效期变动,保留期限到有效期后面没什么意义)4.物料的留样应当按照规定的条件贮存,必要时还应当适当包装密封。
留样观察及稳定性试验(GMP)

文件编号、代号、品名、批号、规格、日期、留检样 品的法定样及实验样、需要的样品量及理由、申请人签 名留样员签名和填写申请单日期等。
留样登记表内容包括:
文件编号、日期、代号、品名、批号、数量单位、留 样量及经手人等
留样观察
留样观察还要填写留样观察记录,并建立 留样台帐。
留样观察记录内容包括:
稳定性试验
3、长期试验:
长期试验是在接近药物的实际储存条件下进行,其目 的为制订药物的有效期提供数据。 供试品要求 3 批,市售包装,温度在25℃±2℃、相 对湿度 60%±10% 的条件下放置12 个月,每 3 个月取样 一次,分别于0个月、3个月、6个月、9个月、12个月按稳 定性重点考察项目进行检测。12个月以后,分别于18个月、 24个月、36个月仍需继续考察,取样进行检测。将结果与 0月的数据比较,以确定药物的有效期。
稳定ห้องสมุดไป่ตู้试验
2、长期试验:
对温度特别敏感的药物,长期试验可在6℃±2℃ 的条件下放置12个月,按上述时间要求进行检测, 12个月以后仍需按规定继续考察,制订在低温储存 条件下的有效期。 有些药物制剂还应考察使用过程中的稳定性。
药物稳定性重点考察项目
原料药:性状、熔点、含量、有关物质、吸湿性及 根据药品性质选顶的考察项目。 片剂:性状、含量、有关物质、崩解时限或溶出 度。 胶囊剂:外观、内容物色泽、含量、有关物质、崩 解时限或溶出度、水分,软胶囊要检查内 容物有无沉淀。 注射剂:外观色泽、含量、pH值、澄明度、有关物 质。
稳定性试验
1、影响因素试验:
(3)强光照射试验:
供试品放在装有日光灯的光照箱或其他适宜的光照 装置内,于照度为 4500lx±500lx 的条件下放置10 天, 于第 5 天和第 10 天取样,按稳定性重点考察项目进行 检测,特别要注意供试品的外观变化。 此外,根据药物的性质,必要时可设计实验,探讨 pH 值与氧及其他条件对药物稳定性的影响,并研究分解 产物的分析方法。
留样、稳定性考察、持续稳定性考察区别
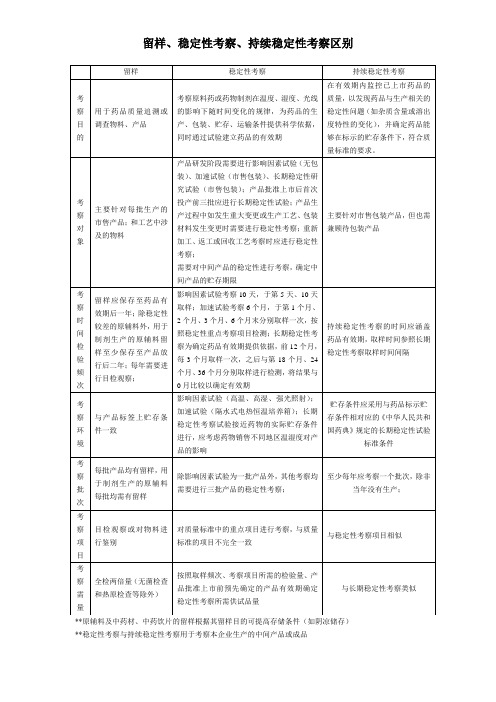
考察环境
与产品标签上贮存条件一致
影响因素试验(高温、高湿、强光照射);加速试验(隔水式电热恒温培养箱);长期稳定性考察试验接近药物的实际贮存条件进行,应考虑药物销售不同地区温湿度对产品的影响
贮存条件应采用与药品标示贮存条件相对应的《中华人民共和国药典》规定的长期稳定性试验标准条件
考察对象
主要针对每批生产的市售产品;和工艺中涉及的物料
产品研发阶段需要进行影响因素试验(无包装)、加速试验(市售包装)、长期稳定性研究试验(市售包装);产品批准上市后首次投产前三批应进行长期稳定性试验;产品生产过程中如发生重大变更或生产工艺、包装材料发生变更时需要进行稳定性考察;重新加工、返工或回收工艺考察时应进行稳定性考察;
留样
稳定性考察
持续稳定性考察
考察目的
用于药品质量追溯或调查物料、产品
考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期
在有效期内监控已上市药品的质量,以发现药品与生产相关的稳定性问题(如杂质含量或溶出度特性的变化),并确定药品能够在标示的贮存条件下,符合质量标准的要求。
考察批次
每批产品均有留样,用于制剂生产的原辅料每批均需有留样
除考察;
至少每年应考察一个批次,除非当年没有生产;
考察项目
目检观察或对物料进行鉴别
对质量标准中的重点项目进行考察,与质量标准的项目不完全一致
与稳定性考察项目相似
考察需量
全检两倍量(无菌检查和热原检查等除外)
按照取样频次、考察项目所需的检验量、产品批准上市前预先确定的产品有效期确定稳定性考察所需供试品量
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
留样、稳定性考察、持续稳定性考察的区别
首先,三种不同概念的理解是不同的。
1、留样的目的主要是为了追溯用的,或者对于某批次的物料、产品进行调查时候使用的,重点在于追溯和调查;
2、稳定性考察主要是为了考察产品有效期用的,在一定的环境如温湿度等影响下的一种变化趋势,稳定性考察的数据目的在于提供科学证据,以适用于药品的生产、储存、运输等过程;
3、持续稳定性考察是为了在药品的有效期内监控产品的质量,以确定药品在规定的储存条件下符合质量标准的要求;
根据以上的概念描述,我们不难发现,留样主要是针对每批市售的产品,稳定性考察针对的是上市投产前三批以及重要变更、工艺变化、重新加工等,而持续稳定性考察针对的是市售的包装产品。
目的不同,概念不同,考察点不同,所以考察的时间也不同,留样要至少保存至药品有效期后一年,稳定性考察按照药典规定进行加速考察6个月以及长期稳定性考察,前12个月,每3个月取样,之后与第18个月、24个月、36个月分别取样,并将结果与零时进行比较。
而持续稳定性考察的时间必须要包涵药品的有效期。
不要忘记,留样最好每批产品都要留,稳定性考察进行三批最好,持续稳定性考察每年至少考察一个批次。
