第四章 热力学第一定律
第四章 热力学第一定律 4

1 V4 T1 T2 V1
Q2 Q1
V3 V2
V2 V1 V2 V1
V4 V1
V3 V4
V2 V1
Q 2 R T 2 ln
V2 V1
R T 2 ln
T2 T1
R T1 ln
Q2 Q1
V R T 2 ln 2 V1
Q 2 Q1 j
j1
n
§4.6.2 卡诺热机
为了对热机的最大可能效率进行理论研究,1824年法国工 程师卡诺设想了一种理想的热机,称为卡诺热机;这种热机的 循环过程称为卡诺循环。 卡诺循环在温度为T1、T2的两个热源间工作,由两个等温 过程和两个绝热过程构成。一般所说的卡诺循环是准静态的, 且无摩擦等耗散现象。 P 当工质是气体时,卡诺循 环可以用P-V图表示。 可见:在卡诺循环中,工质从T1 热源吸热Q1,向T2热源放热 Q 2 , 向外输出功W′ 。
T
⑵ 转换点、转换曲线:
同一工质在不同的温度段对应的焦汤系 数的趋势是可以不同的。 从T-P 图上看,这种现象是由等焓线的斜率决定的。
P
⑵ 转换点、转换曲线: 同一工质在不同的温度段对应的焦汤系数的趋势是可以不同的。 从T-P 图上看,这种现象是由等焓线的斜率
T P H
则有:
W' Q1
Q1 Q2 Q1 1 Q2 Q1
——热机效率
说明
若循环存在m个高温热源,n个低温热源,热机的吸放热为:
Q 1 i ( i 1, 2 , m ) 及 Q 2 j ( j 1, 2 , n )
则热机效率公式中的吸放热为:
化工热力学__第四章___热力学第一定律及其应用

孤立体系:体系与环境之间没有物质和能量交换。
体系
封闭体系:体系与环境之间没有物质,有能量交换。
敞开体系:体系与环境之间有物质和能量交换。
体系吸热为正值,放热为负值; 体系对环境作功为正值,得功为负值。
化工热力学 第四章 热力学第一定律及其应用 第一节
§4-1、闭系非流动过程的能量平衡
体系能量的变化=体系与环境交换的净能量。
Ws ——机械设备交换的功,也叫轴功。
化工热力学 第四章 热力学第一定律及其应用
E Q Ws i
(e t2
t1
i
Pivi )midt
i
t2 t1
(e j
Pjv j )m jdt
e U gz 1 u2
h U pv
2
再将 e pv U pv gz 1 u代2 入,得:
2、绝热稳定流动方程式
流体:可压缩,与外界无热、无轴功交换.
h 1 u2 0 ——绝热稳定流动方程式 2
⑴、喷管与扩压管 喷管:流体通过时压力沿着流动方向降低,而流速加快的部 件称为喷管。 当出口流速﹤音速时,可用渐缩喷管:
当入口流速﹤音速,当出口流速﹥音速时,用拉法尔喷管 :
亚音速
超音速
扩压管:在流动方向上流速降低、压力增大的装置称为扩压管。
化工热力学 第四章 热力学第一定律及其应用
喷嘴与扩压管
h
u 2 2
gz
q ws
是否存在轴功?
否
是否和环境交换热量? 通常可以忽略
位能是否变化?
否
h 1 u2 0
2
化工热力学 第四章 热力学第一定律及其应用
热学第二版-秦允豪-第四章答案

第四章热力学第一定律(题号有所不同)5-1.0.020Kg的氦气温度由升为,若在升温过程中:(1)体积保持不变;(2)压强保持不变;(3)不与外界交换热量,试分别求出气体内能的改变,吸收的热量,外界对气体所作的功,设氦气可看作理想气体,且,解:理想气体内能是温度的单值函数,一过程中气体温度的改变相同,所以内能的改变也相同,为:热量和功因过程而异,分别求之如下:(1)等容过程:V=常量A=0由热力学第一定律,(2)等压过程:由热力学第一定律,负号表示气体对外作功,(3)绝热过程Q=0由热力学第一定律5-2.分别通过下列过程把标准状态下的0.014Kg氮气压缩为原体积的一半;(1)等温过程;(2)绝热过程;(3)等压过程,试分别求出在这些过程中气体内能的改变,传递的热量和外界对气体所作的功,设氮气可看作理想气体,且,解:把上述三过程分别表示在P-V图上,(1)等温过程理想气体内能是温度的单值函数,过程中温度不变,故由热一、负号表示系统向外界放热(2)绝热过程由或得由热力学第一定律另外,也可以由及先求得A(3)等压过程,有或而所以===由热力学第一定律,也可以由求之另外,由计算结果可见,等压压缩过程,外界作功,系统放热,内能减少,数量关系为,系统放的热等于其内能的减少和外界作的功。
5-3 在标准状态下的0.016Kg的氧气,分别经过下列过程从外界吸收了80cal的热量。
(1)若为等温过程,求终态体积。
(2)若为等容过程,求终态压强。
(3)若为等压过程,求气体内能的变化。
设氧气可看作理想气体,且解:(1)等温过程则故(2)等容过程(3)等压过程5-4 为确定多方过程方程中的指数n,通常取为纵坐标,为横坐标作图。
试讨论在这种图中多方过程曲线的形状,并说明如何确定n。
解:将两边取对数或比较知在本题图中多方过程曲线的形状为一直线,如图所示。
直线的斜率为可由直线的斜率求n。
或即n可由两截距之比求出。
5-5 室温下一定量理想气体氧的体积为,压强为。
新版热学(秦允豪编)习题解答第四章热力学第一定律-新版.pdf

CV T0 2
CV (
R 2R
1
1
27 3 2
T2 T0
T0
(2)由( 1)式:
8
3
1.5 )
(3)左侧初态亦为 P0 T 0 V 0 ,终态为 P1V1T1
27
P1 P2
P0
∵ 活塞可移动,
8 ,由 PV
RT
RT 2
P0 V 0 T 2
V2
P2
T0
P2
14
V 1 2V 0 V 2
V0
9
P0V 0
3 T0
19
23
q 2 1 .60 10
6 .02 10 C
( q 2N Ae )
两极间电压为 , A q
19
A 1 .229 2 1 .60 10
6 .02
Q'
5
2. 858 10
23
10
82 . 84 %
4.4.7 设 1mol 固 体状 态 方程 为: v v 0 aT bP , 内 能 表示 为: u CT
Py L y S
P0 LS
其中 P0
gh 0
Py P0 可改写为
L Ly
1 P0
对微小振动 y L
Py P0
y 1
L
y
1 P0
1
1 P0
L
y P0
L
h0 gy
L
由功能关系:
m gy
1 mv 2 2
m max gy max
AP
式中 A P 是由于右端空气压强 P y 与左端空气压强 P0 对水银柱作功之和,且
2
T0
27 P0
8
热学学 第四章 热力学第一定律.
植物,通过氧化把化学能转化为热和机械能。
16
亥姆霍兹 德国 物理学家(1821~1894) 《力之守恒》 化学、力学、电磁学、热学
17
• 2 内能
内能:在热学参考系下,所有分子的无规则运动的能量之和。
热学参考系:使系统宏观静止的参考系
用的能量,在过程中保持为常数,因此可以省略。
• 内能具体包含哪些能量---普遍
分子的动能(包括平动、转动、振动)
+分子内部的振动势能
+分子间的势能
18
---原子核内的能量,不能被运用,省略。 ---系统整体运动的能量,不是内能,排除。 (系统的整体平动、转动的动能) ---对于理想气体,分子间势能在任何过程中始终保持为常数, 可以省略。 • 例子:单原子分子理想气体的内能。 每个分子的动能之和。---热学坐标系。 • 例子:刚性双(多)原子分子理想气体的内能。 每个分子的平动动能之和,每个分子的转动动能之和。 • 例子:非刚性双(多)原子分子理想气体的内能。 每个分子的平动动能之和,每个分子的转动动能之和。每个分 子的振动动能之和,每个分子的振动势能之和。 • 例子:前面的例子都为非理想气体时。 都要包含分子间的势能之和。
系统和外界在非功过程交换的能量,称为热量
注意:1)热量过程量。
2)系统和外界必须有温度差,才能交换热量。
3)系统和外界交换能量的方式只有两种:功,热量。
§4.3 热力学第一定律
本质:能量转化和守恒定律在热学系统的表现。
1 历史
14
焦耳(1818-1889),英国。 热功当量
w电=I 2Rt=JQ w重力=JQ Q cmT
《热学》第四章和第五章复习

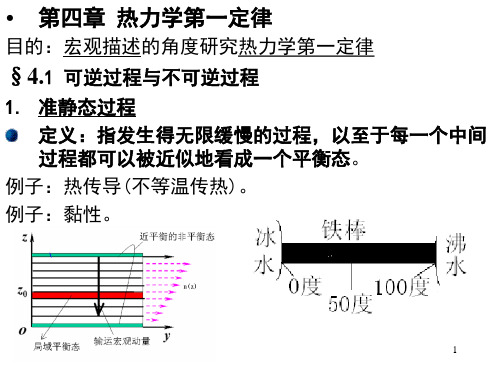
第四章 热力学第一定律 基本要求一、 可逆和不可逆过程 (1)准静态过程(2)理解什么是可逆过程,什么是不可逆过程.知道只有无耗散的准静态过程才是可逆过程。
二、 功和热量 (1)明确功是在力学相互作用过程中能量转移,热量是在热学相互作用过程中的能量的转移,它们都是过程量,它们都是过程量。
知道“作功”是通过物体宏观位移来完成;而“热传递”是通过分子之间的相互作用来完成。
(2)知道功有正负,熟练掌握从体积膨胀功微分表达式pdV W d -=出发计算体积膨胀功。
从几何上理解功的大小等于p-V 图上热力学过程曲线下面的面积。
三、热力学第一定律(1)知道能量守恒与转化定律应用到热学中就是热力学第一定律。
明确热力学第一定律是把内能、功和热量这三个具有能量量纲的物理量结合在一个方程中:即 W Q U +=∆; (2)一微小过程中热力学第一定律表示为:W d Q d dU +=;对于准静态过程热力学第一定律表示为:pdV Q d dU -=(3)内能是态函数,内能一般应是温度和体积的函数。
内能应当包含分子的热运动动能和分子之间的相互作用势能,也应包括分子内部的能量;在热学中的内能一般不包括系统做整体运动的机械能。
四、热容和焓(1)知道热容的定义、热容是过程量、热容与物体的量有关。
(2)知道焓的定义pV U H +=;知道焓的物理意义。
五、热力学第一定律对理想气体的应用(1)知道焦耳定律;即理想气体的内能仅是温度的函数;知道理想气体的焓也只是温度的函数。
内能和焓的微分可分别表示为:dT C dU m V ,ν=;dT C dH m p ,ν=;这两个公式适用于理想气体任何过程。
(2)理想气体的准静态过程的热力学第一定律可表示为pdV dT C dQ m V +=,ν;利用上式可得迈耶公式:R C C m V m p =-,,ν;(3)会熟练利用热力学第一定律处理一些常见热力学过程。
(4)会推导准静态绝热过程方程,熟记并会熟练利用绝热过程方程,同时应知道绝热过程方程的适用条件。
大学物理-热力学
存在温差而发生的能量传递 .
功与热量的异同 1)过程量:与过程有关;
T1 T2
T1 Q T2
2)等效性:改变系统热运动状态作用相同;
1卡 = 4.18 J , 1 J = 0.24 卡
3)功与热量的物理本质不同 .
功
宏观运动
分子热运动
热量
分子热运动
分子热运动
五、 内 能 (状态量)
物体内分子做无规运动的动能和势能的总和叫做 物体的内能。内能由系统的状态唯一地决定。内能的 改变量只由初末状态决定,和变化的具体过程无关。
p
A*
1
p
A*
1
2 *B
o
V
2 *B
o
V
理想气体内能 : 表征系统状态的单值函数 ,
理想气体 的内能仅是温度的函数 U U (T )
永 动 机 的 设 想 图
第一类永动机试图在不获 取能源的前提下使体系持续 地向外界输出能量。历史上 最著名的第一类永动机是法 国人亨内考在十三世纪提出 的“魔轮”,十五世纪,著 名学者达芬奇也曾经设计了 一个相同原理的类似装置, 1667年曾有人将达芬奇的设 计付诸实践,制造了一部直 径5米的庞大机械,但是这些 装置经过试验均以失败告终。
Cp,m CV ,m R
CV ,m
CV ,m
CV ,m
R 1
R
1
W 1 (T1 T2 ) 1 ( p1V1 p2V2 )
绝热过程方程的推导
dQ 0, dW dU pdV vCV ,mdT
pV vRT
pdV Vdp R pdV CV ,m
整理得
dp dV 0
pV
p
p2
2 T2
热学_热力学第一定律
3、理想气体在几种等值过程中功的计算 前提:理想气体的无摩擦准静态过程。 等温过程:
W =∫
V2
V1
V2 dV = νRT ln pdV = νRT ∫ V1 V V1
V2
气体膨胀时, d V > 0
d W > 0 系统对外界作功。
p p2 C
等 温
Q P1V1 = P2V2
A
P1 W = νRT ln P2
1)对过程 adb
0 a d V
Qadb = ΔU &#
2)对过程 ba
Qba = ( U a − U b ) + W2 = −105 − 42 = −147 J
放热
§4.4 一、定体热容与内能
热容量与焓
p b d c a T 0 V e T+dT
等体过程a—b, ΔV=0,W=0
宏观位移 转 换 分子间作用 传 递
1卡 = 4.18 焦耳 系统内能 系统内能
外界机械能 外界内能
§4.3 内能 热力学第一定律 一、内能 1. 定义: 微观上:热力学系统内部的能量。 包括所有分子热运动动能EK与分子间的势能EP
U = Uk + U p
U = U ( T ,V )
宏观上:系统内能的增量等于绝热过程中外界对 系统作的功。——内能定理
△U > 0 ,系统内能增加。△U < 0,系统内能减少。
2)热力学第一定律的另一种表述: 第一类永动机是不可能制成的。 第一类永动机:不需要任何动力 和燃料,却能对外作功的机器。
3) Q = Δ U + W , dQ = dU + dA 适用于任何系统的任何过程
对微小准静态过程: d Q = d U + p d V 对有限准静态过程: Q = Δ U + pdV V1 i 而 Δ U = ν R Δ T 只适用于理想气体。 2 4)热力学第一定律是大量实验的结果,具有普遍性。 5)实质是包含热能在内的能量转化与守恒定律。
第四章热力学第一定律
转化为热量Q向外释放; 若:dV 0, 等温膨胀,气体对外所做功 PdV > 0,
来源于自外界吸收的热量Q。
V2
W PdV
V1
V2
因而准静态过程的吸热情况为: Q W PdV
V1
理气等温过程内能不变: dU=0
Q
W
V2
PdV
V1
T2
RT
T1
dV V
RT lnV2
V1
RT ln P1
T1
T1
T1
T1
T2
T2
T2
( C p,m R)dT (CP,m R)dT CV ,mdT
T1
T1
T1
三、等温过程:
P
T=常量,dT=0 的过程
理气等温过程内能不变: dU=0 o
U2 U1 0 Q W
T1 T2 V
若:dV 0, 等温压缩,外界对气体所做功 -PdV > 0,
打开活塞阀门,使气体膨胀到B中。 此过程外界没有对气体做功,气体也没有对外界做功,因 而这是不受阻碍的自由膨胀,有:
W外气= W’气外=0 ΔW 0 当气体自由膨胀并与水达平衡后用温度计测量水温。
实验表明: ΔT 0
ΔQ 0 绝热自由膨胀过程
ΔU ΔQ ΔW 0
即:自由绝热膨胀中恒有:
CP,m
CV ,m
dQP ,m dT
dQV ,m dT
R
dQP,m dQV ,m RdT
例:如图,同种单原子理想气体放在同 一容器的两个部分,抽去中间隔板 使之均匀混合。求:混合后的温度 和压强。
解:绝热: ΔQ 0
混合前后: ΔV 0 ΔW 0
绝热壁
P1 V1 T1
热力学第一定律
热力学系统中的力学作用形式多样, 如:压强、表面张力、弹性力、 电磁力、等等。
2. 作用效果
使热力学系统的力学平衡条件被破坏,在系统状态 变化过程中伴随有能量转移,其形式即:作功。
3. 一些常见过程中元功的计算
作用力为广义力, 状态变化量为广义位移,
记 Y 为广义力,X 为广义位移,
则其元功为: W YX .
3.车载的能量有限。
冷却外壳
离合器部分
驱动电机系统概述
二、驱动电机的分类
按照结构和工作原理不同,目前的驱动电动机有直流电动机、交流异步电动 机、永磁同步电动机、开关磁阻电动机等几种。
1.直流电动机 直流电动机通过定子绕组产生磁场,向转子绕组通入直流电,并用换向装置对 绕组内电流在适当时候进行换向,使转子绕组始终受到固定方向的电磁转矩。
驱动电机系统概述
一、驱动电机简介
用于驱动车辆的电动机称为驱动电动机。其任务是在驾驶人的控制下,高效
率地将蓄电池的电量转化为车轮的动能,或者将车轮的动能反馈到蓄电池中。
驱动电动机的工作条件与一般工业电动机有明显不同,体现在以下方面。
1.驱动电动机的转速、转矩变化范围大;
发动机
电动机
就业变速箱
2.驱动电动机所处的使用环境恶劣;
三、驱动电机的额定指标 驱动电动机的额定指标是指根据国家标准及电动机的设计、试验数据而确定的额
定运行数据,是电动机运行的基本依据。电动机的额定指标主要包括以下各项。 1.额定功率。额定功率是指额定运行情况下轴端输出的机械功率(W或kW)。 2.额定电压。额定电压是指外加于线端的电源线电压(V)。 3.额定电流。额定电流是指电动机额定运行(额定电压、额定输出功率)情况下
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华北科技学院化工热力学Chemical Engineering Thermodynamics第四章 热力学第一定律4.1 闭系非流动过程的能量平衡能量平衡式 体系能量的变化=体系与环境交换的净能量。
即:(能量)入 − (能量)出 = (能量)存封闭体系非流动过程的热力学第一定律:ΔU = Q + W4.2 开系通用的能量平衡方程4.3 稳流过程的能量平衡1. 开系稳流过程的能量平衡状态是稳定的 稳流过程 流动是稳定的 1)外部环境对流体提供的能量(对于1kg流体): ①外功(ws)—净功或有效功,J/kg; 规定:外界提供给流体功, ws为正; 流体传递给外界功,ws为负。
②热量(q)—获得的热量,J/kg;4.3 稳流过程的能量平衡2) 流体在流动过程中本身所具有的能量(对于1kg流体): ① 内能 U: J/kg; ② 位能: ③ 动能: ④ 静压能(压强能) m kg: 动能 = mu2/2, J 1 kg: 动能 = u2/2 , J/kg m kg: 位能 = mgZ, J 1 kg: 位能 = gZ, J/kgm kg-V m3 : 静压能 = pV , J 1V kg- m3 m:静压能=pV p = m ρ, J/kg4.3 稳流过程的能量平衡衡算范围:1-1′至2-2′截面 衡算基准:1kg不可压缩流体 基准水平面:0-0′平面流动系统依据: 输入总能量=输出总能量1 2 p1 1 2 p2 U 1 + gz1 + u1 + + we + q = U 2 + gz2 + u2 + 2 ρ 2 ρ总能量衡算式4.3 稳流过程的能量平衡1 ρ= v1 2 p1 1 2 p2 U 1 + gz1 + u1 + + ws + q = U 2 + gz2 + u2 + 2 ρ 2 ρ 1 2 1 2 U 1 + gz1 + u1 + p1v + ws + q = U 2 + gz2 + u 2 + p2 v 2 2h = U + Pv2 u12 u2 h1 + gZ1 + + ws + q = h2 + gZ 2 + 2 2P97,例4-11 2 Δh + gΔZ + Δu = ws + q 2mkg1 ΔH + mgΔZ + mΔu 2 = Ws + Q 21kg流体稳流能量衡算式mkg流体稳流能量衡算式4.3 稳流过程的能量平衡2. 稳流过程能量平衡的简化形式(1)机械能平衡方程式(柏努利方程): 流体不可压缩→ρ=常数=1/v,v△p=△p/ρ 无热、无轴功交换→q=0,ws=0 理想流体,无粘性→摩擦损耗hf=0,△U=0Δh + gΔZ + 1 2 Δu = ws + q 2条件△h=△U+v△pΔpρ+ gΔZ +1 Δu 2 = 0 24.3 稳流过程的能量平衡(2)绝热稳定流动方程式 条件:可压缩,与外界无热、无轴功交换。
1 2 Δu = 0 2 z根据此式可计算流体终温、质量流速、出口截面积 Δh +等,因此它是喷管和扩压管的设计依据。
dh = Tds + vdp = δq + vdp z另外,δq = 0,T ≠ 0,ds = 0 ∴为等熵过程 dh = vdpz节流:△H≈0,等焓过程 孔板、阀门、多孔塞 P↓,∆u≈04.3 稳流过程的能量平衡(3)与外界有大量热、轴功交换的稳流过程 (动能≈0,势能≈0)ΔH = Q + WS 或 Δh = q + wsa. 有大量热、无轴功交换,Ws=0泵、压缩机、透平ΔH = Q,Δh = q换热器、反应器体系状态变化,如发生化学反应,相变化,温度变化, 与环境交换的热量(反应热,相变热,显热) 等于体系的焓差b. 无热交换(绝热) Q = 0ΔH = W S或Δh = wsP99,例4-2,34.3 稳流过程的能量平衡3. 轴功(1)可逆轴功Ws(R)的计算: 无任何摩擦损失的轴功 ①对于静止的或流动的封闭体系 单位质量流体:Δh = q + ∫ vdpp1 p2dh = tds + vdp = δqR + vdpws ( R ) = ∫液体p2 p1可逆1 Δh + gΔZ + Δu 2 = ws + q 21 2 vdp + gΔZ + Δu 2p2ws(R)=v△pws ( R ) = ∫ vdpp1②绝热可逆过程(等熵):dh = vdpWS ( R ) = ΔH4.3 稳流过程的能量平衡3. 轴功(2)实际轴功Ws的计算: 产功设备(透平):WS实 < WS ( R ) 可逆轴功为最大功ηm :机械效率其大小与机器 制作水平有关WS ηm = <1 WS ( R )耗功设备:WS实 > WS ( R )ηm =WS ( R ) WS<1可逆轴功为最小功P105,例4-4,54.3 稳流过程的能量平衡4. 热量衡算热量衡算:无轴功交换,只有热交换过程的能量衡算 稳流过程的热量衡算的基本关系式: △H=Q 四种热效应: ① 显热――物流的温度变化 ② 潜热――物流的相变化 ③ 混合热效应――多股物流混合 ④ 反应热效应――化学反应产生 热量衡算方法:(四选择) ¾ 选择控制体 ¾ 选择物流量¾选择基准状态¾ 选择初始态4.3 稳流过程的能量平衡物流A:温度TA1→TA2,放热QA,流量mA,平均等压热容CpmhA 物流B:温度TB1→TB2,吸热QB ,流量mB,平均等压热容CpmhB 换热器:热损失QL 对于换热器,△H=Q △H= △HA+△HB,Q=QL=QA +QB △HA=mACpmhA(TA2-TA1) △HB=mBCpmhB(TB2-TB1) 换热器的热量平衡式: QL=mACpmhA(TA2-TA1)+mBCpmhB(TB2-TB1)TA2 A物流 TA1 QB QL QA TB1 B物流 TB2换热器热平衡4.3 稳流过程的能量平衡循环气:冷凝氨量mL ,温度TG1→TG2,流量mG,CpmhG 液氨:汽化液氨量mA ,温度TA1→TA2,流量mA,CpmhA 氨冷器:热泄入QL 对于氨冷器,△H= △HG+△HA=QL △HG=mGCpmhG(TG2-TG1)+ mL△hL循环气入TG1 气氨TA2△HA=mACpmhA(TA2-TA1)+ mA△hA 氨冷器的热量平衡式: QL=mACpmhA(TA2-TA1)+mA△hA循环气出TG2QL液氨TA1 氨冷器热平衡+mGCpmhG(TG2-TG1)+mL△hL4.4 气体压缩过程概述常用于压缩气体的机械有: ¾ 压缩机(终压>0.3MPa,压缩比>4)¾ 鼓风机(终压0.015~0.3MPa,压缩比<4) ¾ 通风机(终压<0.015MPa(表压) 往复式 按运动机构,压缩机 叶轮式外界输入功4.4 气体压缩过程1. 压缩过程热力学分析理想压缩过程: 整个过程均为可逆,不存在任何摩擦 损耗,输入的功完全用于压缩气体。
往复式压缩机压缩过程示意图: 活塞 冲程排气活门 吸气活门冲程:活塞从一端到另一端的行程距离称为冲程或行程4.4 气体压缩过程绝热(Ws,T2,V2)>多变(Ws,T2,V2)>等温(Ws,T2,V2)P2P 3 2a 2b 2c 1、恒温压缩过程: PV=常数,-Q=W(s) 2、绝热压缩过程: PVK=常数 3、多变压缩过程: PVm=常数 1<m<KP 1V 往复式压缩机压缩过程示意图14.4 气体压缩过程2. 单级压缩机可逆轴功的计算(1)等温压缩 理想气体:PV=RT △H=Q+Ws等温△H=0,Ws(R)= -Q2Ws(R)由T1 和压缩比 P2/P1决定P P WS ( R ) = ∫P VdP = ∫ RT1 dP = RT1 ln 2 PP211PP1(2)绝热过程 Q=0 PVK=常数 Ws=△H= VdP ∫ PP214.4 气体压缩过程气体压缩过程所耗的理论轴功决定于 始温下绝热指数K和压缩比。
WS ( R ) ⎡ ⎛ P2 K ⎢ RT1 ⎜ = ⎢⎜ K −1 ⎝ P1 ⎢ ⎣ ⎞ ⎟ ⎟ ⎠K −1 KK −1 ⎤ ⎡ ⎤ K ⎛ ⎞ P K 2 ⎥ − 1⎥ = ⎟ P1V1 ⎢⎜ 1 − ⎥ K −1 ⎢⎜ ⎥ P1 ⎟ ⎝ ⎠ ⎢ ⎥ ⎥ ⎣ ⎦ ⎦式中,K为绝热指数,与气体性质有关。
理想气体K的取值: 单原子气体:K=5/3 双原子气体:K=7/5 三原子气体:K=4/3 混合气体的绝热指数Km:yi 1 =∑ K m − 1 i Ki − 1Ki:某组分的绝热指数 yi:某组分的摩尔数4.4 气体压缩过程(3)多变压缩WS ( R )PVm=常数⎡ ⎛ P2 m P1V1 ⎢⎜ = ⎢⎜ m −1 ⎝ P1 ⎢ ⎣ ⎞ ⎟ ⎟ ⎠m −1 mP114,例4-8m −1 ⎤ ⎡ ⎤ m ⎛ ⎞ P m 2 ⎥ ⎟ − 1⎥ = − RT1 ⎢⎜ 1 ⎥ m −1 ⎢⎜ ⎥ P1 ⎟ ⎝ ⎠ ⎢ ⎥ ⎥ ⎣ ⎦ ⎦式中,m为多变指数。
(4)真实气体压缩功 a. Z变化不大: 取平均值:Zm=(Z进 +Z出)/2,将Zm看成常数 真实气体压缩功=Zm×理想气体压缩功 b. Z变化大: 绝热过程: 多变过程: △H=Ws(R) Ws(R)=△H-Q4.4 气体压缩过程3. 多级压缩功的计算气体的压缩,通常都是采用多级压缩。
多级压缩可用适当的压缩比,并且各级都设有中 间冷凝器,使之更趋近于等温压缩。
多级压缩所消耗的总功,应为各级压缩所消耗功 的代数和,因此可减少总的功耗。
4.4 气体压缩过程单级等温压缩: 功为ABFHA所包围的面积P2PF HED单级绝热压缩: 功为ABDHA所包围的面积 C 二级绝热压缩: 功为ABCGEHA所包围的面积 阴影部分面积: BP2′ P 1IGA V二级绝热压缩节省的功二级压缩P-V 图4.4 气体压缩过程设,某理想气体由P1压缩至PS+1(S级压缩),总功耗为各 级压缩功之和:WS ( R ) ⎡ ⎛ P2 m = P1V1 ⎢⎜ ⎢⎜ m −1 ⎝ P1 ⎢ ⎣ ⎞ ⎟ ⎟ ⎠m −1 m⎤ ⎡ ⎛ P3 m − 1⎥ + P2V2 ⎢⎜ ⎥ m −1 ⎢⎜ ⎝ P2 ⎥ ⎢ ⎦ ⎣⎞ ⎟ ⎟ ⎠m −1 mm −1 ⎤ ⎡ ⎤ m ⎛ ⎞ P m s +1 ⎥ ⎟ − 1⎥ + LL + PS VS ⎢⎜ 1 − ⎥ ⎢⎜ ⎥ m −1 Ps ⎟ ⎝ ⎠ ⎥ ⎢ ⎥ ⎦ ⎣ ⎦各级进气温度相同,且为理想气体。
故:P 1V1 = P 2V2 = LL = P SVS = RT1因此上式写成:WS ( R )m−1 m−1 ⎡ ⎛ P2 ⎞ m ⎛ P3 ⎞ m m ⎢ ⎟ ⎟ = RT1 ⎜ +⎜ ⎜ ⎟ ⎜ ⎢⎝ P m −1 P2 ⎟ 1 ⎠ ⎝ ⎠ ⎢ ⎣⎛ PS +1 ⎞ + LL + ⎜ ⎟ ⎜ P ⎟ S ⎠ ⎝m−1 m⎤ − S⎥ ⎥ ⎥ ⎦Ws(R)绝对值最小的条件:它对中间各压力的一阶偏导数=04.4 气体压缩过程⎡ ∂W S ( R ) ⎤ =0 ⎢ ⎥ ⎣ ∂P2 ⎦ P1 P3 LL⎡ ∂WS ( R ) ⎤ =0 ⎥ ⎢ ⎣ ∂P3 ⎦ P1P2 LL……PS +1 P2 P3 = = LL = =r 于是得: P1 P2 PS(压缩比)r相同,各级功耗也相同,Ws(R),1= Ws(R),2=…… W s(R),sQ P2 = P1rP3 = P2 r = P1r 2SPs +1 = Ps r = P1r s所以最适宜的压缩比 r =sPS +1 代入表示总功的式子,则: P1m =S RT1 (r m −1m −1 mWS ( R ) = ∑ WS ( R ),ii=s− 1)4.4 气体压缩过程4. 气体压缩的实际功耗实际压缩过程,有摩擦,所以耗功>可逆功 损失功:流动过程的损耗,机械传动部分的损耗 设,ηm为考虑各种摩擦损耗因素的机械效率,则压 缩过程的实际功耗为:WS =WS ( R )ηmηm由压缩机类型及实际而异,由实验测定。
