二氧化硫的制备和性质
二氧化硫的性质(共5张PPT)

(3)、与碱性氧化物反应:SO2+Na2O=Na2SO3
【思考】硫有哪些常见化合价?根据有关理论推测 SO2除具有酸 的通性外,可能还具有的性质。
2:具有还原性
SO2的漂白性与(氯气1不)同 、2SO2+O2
2SO3
(1)、与H2O反应: SO2+H2O H2SO3(亚硫酸)
第二节 二氧化硫
一、二氧化硫的性质
(一)、物理性质
无色,有刺激性气味的有毒气体,密度比空气大,易液化(沸点是10 oC),易溶于水(常温常压下一体积水能溶解40个体积的二氧化硫). 【思考】
1、 实验室制SO2 气体,应注意什么?该如何收集?SO2溶于 水所对应的酸是什么?这说明它是什么氧化物?
答: 实验室制SO2应注意防止空气污染!用向上排空气法收集。 SO2溶于水生成亚硫酸 H2SO3,说明二氧化硫是酸性氧化物(亚
1、 实验室制SO2 气体,应注意什么?该如何收2集?SO2溶于水所对应的酸是什么?这说明它是什么氧化物? 2
【SO思2考+N】aO21HH2=mONaoHSlCO32lH22的+氯O2 水与 中2H2+,O2 所点燃得2溶H2O液的漂白作用强吗?
(2)、SO2+X2+2H2O=H2SO4+2HX
SO +2HCl 提示:SO +Cl +2H O=H 4、具有漂白性——能使品红褪色
1:具有酸性氧化物的通性
*钙基固硫: 4、具有漂白性——能使品红褪色
CaO+SO2=CaSO3 2CaSO3+O2=2CaSO4
(CaSO4与水作用生成生石膏CaSO4·2H2O)
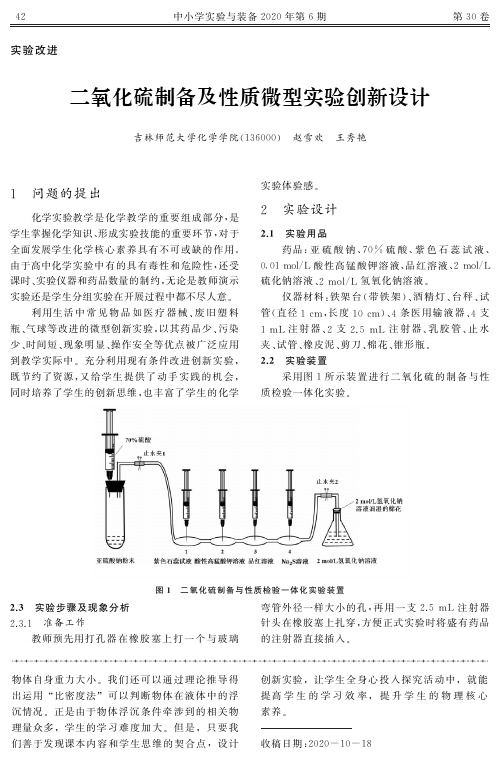
二氧化硫的制备和性质的微型实验

二氧化硫的制备和性质的微型实验作者:赵东洋来源:《中学生数理化·高一版》2017年第02期实验用品:微型实验操作台(带支杆和铁夹)、单球长管(A)、集气管(B)、多用滴管(C)、T形管(D)、导管(E)、胶皮管、带孔橡胶塞(00号)、橡胶塞(2号)、滤纸条、小烧杯、微型酒精灯、品红试纸、pH试纸,浓硫酸(约70%)、亚硫酸钠粉末、品红溶液、溴水、酸性高锰酸钾溶液、氢氧化钠溶液。
实验步骤:1.检查装置的气密性。
如图1组装连接仪器,把导管下端插入液面以下,在集氣管管口塞紧橡胶塞(2号),挤压多用滴管的吸泡,导管口出现气泡,松开不再挤压,导管内形成一段水柱,过一会儿,液面不下降,说明装置不漏气。
2.制取收集二氧化硫,试验二氧化硫的性质。
把单球长管用铁夹固定在微型实验操作台上(图1中未画出),先加入适量亚硫酸钠粉末,再用多用滴管分别从管口滴入品红溶液、溴水和酸性高锰酸钾溶液(注意:三种溶液各滴在一小片滤纸条上,各间隔一段时间滴加)。
用带有导管和集气管的橡胶塞(00号)塞紧单球长管的管口,导管下端插入盛有适量水的小烧杯中。
把吸有少量浓硫酸(约70%)的多用滴管插入单球长管的支管中(两者之间用胶皮管密封连接),挤压吸泡,逐滴滴入浓硫酸,亚硫酸钠粉末溶解。
过一会儿,滤纸条上的三种溶液都褪色,证明浓硫酸与亚硫酸钠反应有二氧化硫生成。
用酒精灯对着滤纸条部位缓缓加热,滴有品红溶液的滤纸条又恢复红色。
3.研究二氧化硫的溶解性。
将生成的气体用向上排空气法收集在集气管中。
用湿润的品红试纸在集气管管口检验气体,红色褪去,说明集气管中已经基本收集满了二氧化硫。
用橡胶塞(2号)塞紧集气管管口,继续将生成的气体向下通入水中。
当反应停止后,观察到导管内液面逐渐上升,最后几乎充满整个集气管。
用pH试纸检验溶液,溶液呈酸性。
所有剩余废液用适量氢氧化钠溶液中和处理后倒入水槽中,清洗,整理仪器。
(责任编辑王琼霞)。
二氧化硫制备及性质微型实验创新设计
5 可反复操作,直至完全反应
4 个输液器滴壶中的反应速率很快,现象鲜明
但转瞬即逝,学生操作时可以通过两处止水夹的开
3.
2 实验药品微量化,实验现象明显化
随着实验装置的微型化,实验药品也相应实现
关控制反应的即时停止和发生,继续推动注射器内
了微量化,进一步降低了实验成本.输液器滴壶无
观察 4 个滴 壶 中 颜 色 的 变 化.微 型 微 量 化 的 设 计
5 mL 待
检验的紫色石 蕊 试 液、酸 性 高 锰 酸 钾 溶 液、品 红 溶
氢氧化钠溶液,加入右侧锥形瓶中至其容积的1/3,
NaOH 溶液浸湿 的 棉 花 团 来 密 封.其 他 药 品 暂 不
加入,
2.
5 mL 注射器在橡胶塞上不拔出,暂 时 用 来
密封小孔.按图 1 所示连接好实验装置,试管用铁
4 mL70% 硫 酸 注 入 试 管
中,启动系列实验反应.
2.
3.
4 观察现象,分析结果
依次观察编号 1、
2、
3、
4滴壶中试液颜色的变
化,填好实验记录表(见表 1).
表 1 二氧化硫性质实验现象与结论
滴壶的编号
实验现象
实验结论
1
紫色石蕊试液变红
SO2 与水反应生成亚硫酸
2
酸性高锰酸钾溶液褪色
4
既节约了资源,又 给 学 生 提 供 了 动 手 实 践 的 机 会,
同时培养了学生的创新思维,也丰富了学生的化学
2 实验设计
2.
1 实验用品
药品:亚 硫 酸 钠、
70% 硫 酸、紫 色 石 蕊 试 液、
/L 酸 性 高 锰 酸 钾 溶 液、品 红 溶 液、
二氧化硫课件

02
二氧化硫的来源和用途
自然来源
火山喷发
火山活动是二氧化硫的主要自然 来源之一。当火山爆发时,岩浆 中的硫化合物会与大气中的氧气 发生反应,生成二氧化硫气体。
天然硫化物矿床
某些天然硫化物矿床在受到风吹 雨打或地壳运动的影响时,会释 放出二氧化硫气体。
人为来源
燃烧化石燃料
燃烧化石燃料(如煤、石油和天然气 )是二氧化硫排放的主要人为来源之 一。在燃烧过程中,燃料中的硫化合 物会与氧气反应生成二氧化硫。
二氧化硫(SO2) PPT课件
• 二氧化硫的物理和化学性质 • 二氧化硫的来源和用途 • 二氧化硫对环境和健康的影响 • 二氧化硫的治理和控制 • 二氧化硫的未来研究方向
01
二氧化硫的物理和化学性质
物理性质
01
02
03
04
颜色与状态
无色气体,有刺激性气味。
沸点与熔点
沸点为-10℃,熔点为72.4℃。
探索二氧化硫在工业生产中的应用
二氧化硫作为一种常见的工业原料,在许多领域都有广泛的应用。研究二氧化硫在工业生产中的应用,不仅可以 提高生产效率,还可以为二氧化硫找到更多的应用场景。
挑战与展望
应对二氧化硫பைடு நூலகம்放法规的挑战
随着环保法规的日益严格,如何应对二氧化硫排放法规的挑战成为重要的研究方向。通过深入研究二 氧化硫的排放机理和减排技术,可以为制定合理的排放标准提供科学依据。
展望二氧化硫研究的未来发展方向
随着科技的不断进步,二氧化硫的研究将不断深入。展望未来,二氧化硫的研究将更加注重跨学科的 合作,涉及的领域也将更加广泛。同时,随着大数据、人工智能等新技术的应用,二氧化硫的研究将 更加精准和高效。
THANKS
二氧化硫的性质和作用

(1) SO2可使酸性KMnO4溶液褪色。 (2) SO2可使溴水褪色。
SO2 + Br2 + 2 H2O = H2SO4 + 2HBr
(3)与O2的反应: 2SO2 + O2
催化剂
△
2SO3
---工业上利用这一原理生产硫酸
3.氧化性:
失2×2e+4
SO2 + 2 H2S = 3 S ↓ +2 H2O
H价,处于中间价态, SO2中的 SO S为 +4 3 + 2O = H2SO4 所以可能既有氧化性,也可能有还原性。
2、SO2主要来源
(1)主要来自 化石燃料的燃烧
( 2)含硫矿 石的冶炼
( 3 )硫酸、磷酸、纸浆等工业排 放的废气
3、酸雨的危害
①影响水生物的繁殖;
②使土壤肥力下降,逐渐酸化;
练习
2、根据实验现象,描述SO2的性质:
(1)SO2使滴有酚酞的NaOH溶液红色褪去, SO2体现 酸 性; (2) SO2使品红褪色,SO2体现 漂白 性; (3) SO2使KMnO4褪色,SO2体现 还原 性。
3、Cl2与SO2相遇时会发生反应: SO2 + Cl2 + 2H2O = H2SO4 + 2HCl。 Cl2与SO2都有漂白作用,若将等物质的 量的这两种气体充分混合后通入品红和 BaCl2的混合溶液,能观察的现象是 ( C ) ①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀 A、①② B、①③ C、②③ D、②④
——化合漂白
注意:SO2 的漂白是可逆的!
“黄”银耳是怎样“变”成“雪白雪白”的
分析下列物质变色的原因。 1、将SO2通入酸性KMnO4溶液, 酸性KMnO4溶液褪色。 SO2的还原性 2、SO2通入溴水,溴水褪色。 SO2的还原性 3、SO2通入紫色石蕊试液,溶液变红。
二氧化硫的制备和性质-教案

第二节二氧化硫的制备和性质教学设计【教学目标】(一)《普通高中化学标准》对于本课的要求认识二氧化硫的主要性质与作用,实验探究硫酸型酸雨的形成过程,了解二氧化硫对空气的污染,知道硫酸型酸雨的形成原因和防治方法,培养良好的环境保护意识。
(二)三位教学目标1. 知识与技能:①认识二氧化硫的主要性质和作用;②了解二氧化硫对空气的污染知道硫酸型酸雨的形成原因和防治二氧化硫所导致的空气污染的方法;③会书写简单的化学方程式。
2. 过程与方法:①通过对二氧化硫性质的实验探究,进一步学习基本的化学实验技能,并且理解硫酸型酸雨的形成过程;②借助于生产实际和环境保护等社会热点内容,创设了促进学生改变学习方法的情景,在活动中获取知识,提高学生学以致用的意识和解决问题的能力。
3. 情感态度与价值观:①认识科学探究的意义,体会实验探究的过程和乐趣;②通过问题讨论和实验探究,激发勇于探索的精神,培养严谨的科学态度和合作意识;【教学重点、难点】教学重点:二氧化硫的性质与作用,建立环境保护意识。
教学难点:设计实验探究二氧化硫的性质。
【课堂导入】【实物展台】化学表演:龚喻《想当电工的粗铜》【问题设计】龚喻同学把铜冶炼出来了,这个铜和我们今天要学习的二氧化硫的制备有没有什么联系呢?在实验室中制备二氧化硫的方法有哪些?【PPT展示】一、实验室制备二氧化硫【合作学习】男同学和女同学PK赛,看谁写得多,谁写得好。
【自主学习】问题1:三种制备二氧化硫的方法哪一个更好?说说你的理由?问题2:制备二氧化硫,选择20%、70%、98%的硫酸,哪一种更好?【学生回答】【小结】实验室制备气体考虑的原则①原料尽量采用非气体②反应条件加热或不加热③方便收集,所以我们采用固液不加热的方法制备气体,选用的硫酸浓度为70%左右。
【实验探究】分别把SO2通入下列溶液会有怎样的实验现象呢?【自主学习】实物展台展示学生讨论的结果【问题讨论】把SO2通入石蕊中,石蕊会先变红,然后会怎么样?会不会褪色?把SO2通入NaOH和酚酞的混合溶液中,红色褪去,是不是漂白?把SO2通入酸性高锰酸钾溶液中,红色褪去,是不是漂白?把SO2通入溴水中,橙色褪去,是不是漂白?【阅读教材】必修一P90,二氧化硫具有漂白性,它能漂白某些有色物质,二氧化硫的漂白作用是由于它能与某些有色物质生成不稳定的无色物质。
二氧化硫 3

酸雨能使非金属建筑材料(混凝土、砂浆和灰砂砖) 表面硬化水泥溶解,出现空洞和裂缝,导致强度降低, 从而建筑物损坏。
• 举世闻名的乐山 大佛目前正经受 着酸雨的侵蚀, 由于大佛本身岩 石比较疏松,再 加上处于酸雨去, 使得侵蚀速度大 大加快,给文物 保护工作带来了 极大的困难
酸雨的来源
想想看: 酸雨的污染来源有哪 些?
(二)酸雨的形成
燃料燃烧产生的SO₂和NOx等气体经过复杂的物理化学过程形 成硫酸和硝酸,形成酸雨或者酸雪。
(二)酸雨的形成
主要途径 H2SO3 途 SO2 + H2O 径 一 2H2SO3 + O2 2H2SO4 催化剂 途 2SO2 +O2 2SO3 径 二 SO3+H2O→H2SO4
总反应式:2SO2+O2+H2O
催化剂
2H2SO4
27
如何防治?
1.开发新能源,如氢能,太阳能,水能, 潮汐能,地热能等 2.使用燃煤脱硫技术,减少二氧化硫排放 3.工业生产排放气体处理后再排放 4.少开车,多乘坐公共交通工具出行 5.使用天然气等较清洁能源,少用煤
1972年6月5日,具有历史意 义的人类环境会议在瑞典首 都斯德哥尔摩召开,通过了 著名的《人类环境宣言》, 并确定每年6月5日为“世界 环境日”。从1974年起,每 年联合国环境规划署确定一 个主题,开展“世界环境日” 活动,其中1983的主题是防 治酸雨
污 染 来 源
自然物质:
火山爆发喷出大量之硫化物及悬浮固体物,自然水 域表面释放之硫化氢,动植物分解产生有机酸,土 壤微生物及海藻释放之硫化氢、二甲基硫及氮化物
人为物质:
工业化后,燃料之大量使用,燃烧过程中产生CO、 HC、SO2、NOXNOX及悬浮固体物,排放至大气环境 中,经光化学反应生成硫酸、硝酸等酸性物质
二氧化硫的制备和性质

二氧化硫的化学性质
1、与水反应
SO2+H2O
H2SO3(亚硫酸)
*此反应为可逆反应; 亚硫酸是一种弱酸
2、与碱性氧化物反应
SO2+CaO =CaSO3 工业“固硫”
2CaSO3+O2=2CaSO4
3、与碱反应
SO2 +2NaOH=Na2SO3+H2O SO2(过量)+NaOH=NaHSO3 实验室制取SO2,可选择 碱液NaOH 吸收尾气, 防止空气污 染。
二氧化硫的制备和性质
二氧化硫的实验室制备
浓H2SO4 Na2SO3粉末
二氧化硫的检验: 品红溶液褪色
验满: 湿润的品红试纸褪色
SO2
收集: 向上排空气法
密度比
空气大
Na2SO3+H2SO4(浓) ==Na2SO4+H2O+SO2↑
颜色 无色
状态 气态
气味
刺激性 气味
密度
大于 空气
毒性
水溶性Βιβλιοθήκη 有毒 易溶于水SO2+2Ca(OH)2=CaSO3↓+H2O 澄清石灰水变浑浊 2SO2 (过量) +Ca(OH)2=Ca(HSO3)2
气体 CO2 、 SO2 能使澄清石灰水变浑浊的 鉴别SO2与CO2: 品红 试剂
二氧化硫的实验室制备
浓硫酸 (干燥剂)
NaOH溶液 (尾气吸收)
Na2SO3+H2SO4(浓) ==Na2SO4+ H2O + SO2↑
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节二氧化硫的制备和性质
教学设计
【教学目标】
(一)《普通高中化学标准》对于本课的要求认识二氧化硫的主要性质与作用,实验探究硫酸型酸雨的形成过程,了解二氧化硫对空气的污染,知道硫酸型酸雨的形成原因和防治方法,培养良好的环境保护意识。
(二)三位教学目标
1. 知识与技能:
①认识二氧化硫的主要性质和作用;
②了解二氧化硫对空气的污染知道硫酸型酸雨的形成原因和防治二氧化硫所导致的空气污染的方法;
③会书写简单的化学方程式。
2. 过程与方法:
①通过对二氧化硫性质的实验探究,进一步学习基本的化学实验技能,并且理解硫酸型酸雨的形成过程;
②借助于生产实际和环境保护等社会热点内容,创设了促进学生改变学习方法的情景,在活动中获取知识,提高学生学以致用的意识和解决问题的能力
3. 情感态度与价值观:
①认识科学探究的意义,体会实验探究的过程和乐趣;
②通过问题讨论和实验探究,激发勇于探索的精神,培养严谨的科学态度和合作意识;
【教学重点、难点】
教学重点:二氧化硫的性质与作用,建立环境保护意识。
教学难点:设计实验探究二氧化硫的性质。
【课堂导入】【实物展台】化学表演:龚喻《想当电工的粗铜》【问题设计】龚喻同学把铜冶炼出来了,
这个铜和我们今天要学习的二氧化硫的制备有没有什么联系呢?在实验室中制备二氧化硫的方法有哪些?【PPT展示】一、实验室制备二氧化硫
【合作学习】男同学和女同学PK赛,看谁写得多,谁写得好。
【自主学习】问题1三种制备二氧化硫的方法哪一个更好?说说你的理由?
问题2:制备二氧化硫,选择20%、70%、98%的硫酸,哪一种更好?
【学生回答】
【小结】实验室制备气体考虑的原则①原料尽量采用非气体②反应条件加热或不加热③方
便收集,所以我们采用固液不加热的方法制备气体,选用的硫酸浓度为70%左右。
【实验探究】分别把SO2通入下列溶液
会有怎样的实验现象呢?
【自主学习】实物展台展示学生讨论的结果
【问题讨论】把SO2通入石蕊中,石蕊会先变红,然后会怎么样?会不会褪色?
把SO2通入NaOH和酚酞的混合溶液中,红色褪去,是不是漂白?
把SO2通入酸性高锰酸钾溶液中,红色褪去,是不是漂白?
把SO2通入溴水中,橙色褪去,是不是漂白?
【阅读教材】必修一P90,二氧化硫具有漂白性,它能漂白某些有色物质,二氧化硫的漂白作用是由于它能与某些有色物质生成不稳定的无色物质。
这种物质容易分解而使有色物质恢复原来的颜色。
【小结】SO2的漂白性在溶液中只针对品红溶液。
【问题讨论】把SO2通入足量的澄清石灰中,对应的方程式应该如何书写?
【课堂训练】1•酸性氧化物的通性
(1)
与水反应_____________________________________________________________________________ (2)
与足量的氢氧化钠溶液________________________________________________________________ (3)
与足量的石灰水______________________________________________________________________ (4)与足量的氢氧化钡溶液
(5)(16江苏)S02与Na2CO3溶液反应生成NaHSO 3和CO2,其离子方程式为
【PPT展示】正确的化学方程式的书写
【问题讨论】二氧化硫中硫的价态是正四价,而硫的家族梦想是正六价,也就是说二氧化
硫是还原性是比较强的。
大家想想看,二氧化硫能与哪些具有氧化性的物质反应呢?
【课堂训练】2•还原性
(1)_____________________________________________________________________________________ 与氧气
(2)_____________________________________________________________________________________ 与氯水
(3)_____________________________________________________________________________________ 与稀硝酸(离子方程式) ______________________________________________________________________ (4)_____________________________________________________________________________________ 与H2O2
(5)_____________________________________________________________________________________ 与浓硫酸_____________________________________________________________________________________ 【问题讨论】二氧化硫有还原性,浓硫酸有氧化性,当二氧化硫遇到浓硫酸,会有怎样神
奇的反应发生呢?二氧化硫能不能用浓硫酸来干燥呢?
【小结】相邻价态不反应。
所以二氧化硫能够用浓硫酸来干燥。
【课堂训练】将SO2通入下列溶液中,写方程
SO2+CaCl2
SO2+BaCl2
SO2+Ba(NO 3) 2
SO2+Ca(ClO) 2
【问题讨论】二氧化硫通入到氯化钙溶液中能不能生成沉淀?通入到氯化钡溶液中呢?
【小结】二氧化硫与氯化钙、氯化钡溶液中不反应。
【问题讨论】二氧化硫通入到硝酸钡溶液中能不能生成沉淀?通入到次氯酸钙溶液中呢?
【小结】二氧化硫与硝酸钡、次氯酸钙能发生氧化还原反应。
【课堂训练】(17年浙江)下列离子方程式不正确的是()
A. 澄清石灰水中通入过量的二氧化碳CO 2+OH-=HCO 3-
B. 金属钠和水反应2Na+2H 2O=2Na ++2OH -+H 2 f
C. 酸性氯化亚铁溶液中加入双氧水2Fe2++H 2O2=2Fe3++O2 f +2H
D. 三氧化硫与氯化钡溶液生成沉淀的反应SO3+Ba2++H 2O=BaSO 4 J +2H 【小结】本节课你应该知道的知识点
一、二氧化硫的实验室制法
二、二氧化硫的化学性质
小口诀:石灰水,也叛变,二氧化硫生沉淀。
氯钙氯钡哑无言,次钙硝钡望氧还。
【板书】第二节二氧化硫的制备和性质
一.反应原理:固液不加热法
①硫在氧气中燃烧
②氧化还原法制二氧化硫
③复分解法制二氧化硫_
二•化学性质
1特性:漂白性
2.通性:酸性氧化物
3•还原性:强还原性
4•氧化性:氧化H2S等
【课后作业】教师推送的题目《二氧化硫的制备和性质》
错题的整理与反思。
