chapter9 离子化合物的结构化学习题解答
结构化学 习题答案 1-10章习题及答案

其中,1 kcal = 4.184 J,E 是以 10 为底的指数。
kJ/mole 2.62550E+03 4.18400E+00 9.64853E+01 1.19627E-02 1.00000E+00
第二章习题
kcal/mole 6.27510E+02 1.00000E+00 2.30605E+01 2.85914E-03 2.39006E-01
eV 2.721138E+01 4.33641E-02 1.00000E+00 1.23984E-04 1.03643E-02
cm-1 2.1947463137E+05
sin n 2
1, wmax
1 1 4 6
(3) w 1 4
8 根据态叠加原理,(x) 是一维势箱中粒子一个可能状态。
能量无确定值。平均值为 25 h2 104 ml 2
9
和
2 的本征函数,其相应的本征值分别为 dx2
-m2和-1。11
Dˆ Xˆ XˆDˆ 1
值。
(a) eimx (b) sinx (c) x2+ y2 (d) (a-x)e-x 11有算符 Dˆ d dx, Xˆ X , 求 DˆXˆ XˆDˆ 。 参考答案
1 象电子等实物粒子具有波动性被称作物质波。物质波的
波动性是和微粒行为的统计性联系在一起的。对大量粒子
而言,衍射强度(即波的强度)大的地方,粒子出现的数
现在 2h 2 的概率?(c) 角动量 z 分量的平均值?
2.4 已知类氢离 子 He+的某 一状态波函 数为: =
高中结构化学试题及答案

高中结构化学试题及答案一、选择题(每题2分,共20分)1. 原子半径最大的元素是:A. 氢B. 氧B. 钠D. 氟2. 以下哪个元素的电子排布不是按照能量最低原理排列的?A. 氢B. 锂C. 氮D. 氧3. 化学键中,哪种键的性质是“头对头”的?A. 离子键B. 共价键C. 金属键D. 氢键4. 以下分子中,哪个是极性分子?A. CO2B. CH4C. H2OD. C2H45. 以下哪种化合物属于共价化合物?A. NaClC. H2OD. Fe6. 原子核外电子的排布遵循哪一条规则?A. 能量最低原理B. 泡利不相容原理C. 洪特规则D. 所有上述规则7. 以下哪种物质是离子晶体?A. 金刚石B. 石墨C. 食盐D. 干冰8. 以下哪种物质是金属晶体?A. 金刚石B. 石墨C. 铜D. 石英9. 以下哪种物质是分子晶体?A. 金刚石B. 石墨C. 铜D. 冰10. 以下哪种物质是原子晶体?A. 金刚石B. 石墨D. 冰答案:1. C 2. D 3. B 4. C 5. C 6. D 7. C 8. C 9. D 10. A二、填空题(每空1分,共10分)11. 原子中电子数等于________,质子数等于________。
12. 化学键的类型主要有________、________和金属键。
13. 根据分子的极性,分子可以分为________分子和极性分子。
14. 离子晶体是由________构成的,而金属晶体是由________构成的。
15. 原子晶体具有高硬度和高熔点的特性,这是因为它们具有________结构。
答案:11. 中子数,质子数 12. 离子键,共价键 13. 非极性 14. 离子,金属原子 15. 紧密排列的原子三、简答题(每题5分,共10分)16. 请简述什么是共价键,并给出一个例子。
17. 请解释什么是金属键,并说明金属晶体的一般特性。
答案:16. 共价键是由两个原子之间共享一对电子而形成的化学键。
第9章 离子化合物的结构化学j

rk+=(a-2rc1-)/2=(628-2×181)/2=133pm
(a) 负负接触,正负离子不完全接触 (b)正负离子之间正好都能接触 (c)正负离子接触, 但负离子之间不能接触
已知 MgS 和 MnS 的晶胞参数具有相同的数值 520pm,所以是负负离子接触,而 正负离子不接触。CaS(a=567pm)为正负离子接触而负负离子不接触,试求 S2和 Ca2+的离子半径各是多少?
答案:八面体
0.54
KCl 属于 NaCl 型晶体,实验测得 KCl 的晶胞参数 a=6.28pm,且已知 cl-半径为 181pm,求 k+半径
答案:解:KCl 型晶体中晶胞型式为立方面心,在面对角线上
2a =1.414×628=888pm
4rc1- =4×181=724pm
4rc1-< 2a ,说明 C1-已被 K+撑开,即 K+与 C1-接触
NaCl 晶体属于下列哪种点阵型式( a. 立方 P b. 立方 I c. 立方 F 答案:c
) d. 立方 C
CSCl 晶体属于下列哪种点阵型式( ) a. 立方 P b. 立方 I c. 立方 F d. 立方 C 答案:a
有一 AB 型离子晶体,若 r+/r-=0.85,则正离子的配位数为( )
6 2 r 1.225r r / r 0.225
六配位的正八面体空隙
2(r r ) 2(2r ) r / r 0.414
八配位的正方体空隙
CN 8 正 方 体 边 长(从 负 离 子 球 心 计 算)为2r , 体 对 角 线 为2(r r ). 所 以: 2(r r ) 3(2r ) r r 1.732r r / r 0.732
《无机化学》第九章分子结构课后习题参考答案

第九章分子结构课后习题参考答案2解:(1)Hg 原子的价电子构型是:5d 106s 2因中心原子Hg 采用sp 杂化,则分子为直线形。
(2)因中心原子Si 采用sp 3杂化,则分子构型为正四面体(3)因中心原子B 采用sp 2杂化,则分子构型为平面三角形(4)因中心原子N 采用sp 3杂化,有一对孤对占据杂化轨道,所以分子构型为三角锥形(5)因中心原子N 采用sp 2杂化,有一对孤对占据杂化轨道,所以分子构型为V 形(6)因中心原子Si 采用sp 3d 2杂化,所以分子构型为正八面体3解:(1)42414=⨯+=VP ,σ键数为4,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为正四面体。
用杂化轨道理论说明:因分子中共有四对成键,则需提供四条杂化轨道,所以Si 采用sp 3杂化形成四条sp 3杂化轨道供四对成键电子占据,分子构型为正四面体。
(2)224=+=VP ,σ键数为2,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为直线形。
杂化轨道理论:(3)32133⨯+=VP ,σ键数为3,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为平面三角形。
用杂化轨道理论说明:因分子中共有三对成键,则需提供三条杂化轨道,所以B 采用sp 2杂化形成三条sp 2杂化轨道供三对成键电子占据,分子构型为平面三角形。
(4)42135=⨯+=VP ,σ键数为3,有1对孤对电子对,则价电子对空间构型为四面体,而扣除孤对电子占据的位置,分子空间构型为三角锥形。
杂化轨道理论:(5)42126=⨯+=VP ,σ键数为2,有2对孤对电子对,则价电子对空间构型为四面体,而扣除孤对电子占据的位置,分子空间构型为V 形。
杂化轨道理论:(6)326=+=VP ,σ键数为2,有1对孤对电子对,则价电子对空间构型为平面三角形,而扣除孤对电子占据的位置,分子空间构型为V 形。
杂化轨道理论:4解:(1)521127=+⨯+=VP ,σ键数为2,有3对孤对电子存在,其价电子对空间构型为三角双锥,扣除孤电子对所占据的位置,其离子几何构型为直线形。
离子化合物的结构化学

100 131
(有效半径比)
F- 作简单立方堆积, Ca2+填入立方体空隙(占据 分数50%),配位比为8∶4(F-的配位数为4, Ca2+的配位数为8)。
上一内容 下一内容 结束放映
ABn型二元离子晶体几种典型结构型式
属于立方面心点阵, 结构单元为一个CaF2 空间群为: 分数坐标: Ca2+: (0,0,0), (1/2,1/2,0),(1/2,0,1/2), (0,1/2,1/2) F-:(1/4,1/4,1/4), (3/4,1/4,1/4), (1/4,3/4,1/4), (1/4,1/4,3/4), (3/4,3/4,1/4), (3/4,1/4,3/4), (1/4,3/4,3/4), (3/4,3/4,3/4) 或将各离子坐标平移1/4
(1) 正方体(立方)空隙(配位数为8)
小球在此空隙中既不滚动也不撑开时, r+/r- 比值为: 体对角线 =2r++2r2r-
立方体棱长 = 2r-)
2 (r
+
+r
2( r r )
3 2 r
0 .7 3 2
r r
在正方体空隙中,球数 : 空隙数 =1 : 1
上一内容 下一内容 结束放映
TiO2为四方简单点阵,结构单元为2个TiO2
空间群为:
分数坐标: Ti4+:
D4h P
14
4 2 21 2 m n m
1 1 1 (0, 0, 0 ), ( , , ) 2 2 2
O2-: ( u , u , 0 ), (1
u ,1 u , 0 ), (
1 2
u,
1 2
安徽高中化学竞赛-结构化学 第九章 离子化合物的结构化学习题

1、 NaCl与CaF
2
晶体的相同之处是:( B)
(A) 结构基元 (B) 负离子堆积方式 (C) 点阵型式
2、 4:4是下列哪一种晶体的CN
+/CN
-
:( C)
(A) CsCl (B) NaCl (C) 六方ZnS
3、对于CaF
2
晶体,“简单立方”一词描述的是它的( B )
(A) 负离子堆积方式 (B) 点阵型式 (C) 正离子堆积方式
4、某种离子晶体AB被称为NaCl型, 这指的是( B)
(A) 它的化学组成 (B) 它的结构型式 (C) 它的点阵型式
5、立方和六方ZnS的CN
+/CN
-
都是4:4: 它们在下列哪一点上不同?
A. 负离子堆积方式
B. 正离子所占空隙种类
C. 正离子所占空隙分数
6、CsCl型与CaF
2
型晶体在哪一点上相同?(B )
+ / CN
-
B.正离子所占空隙种类
C.正离子所占空隙分数
7、正、负离子半径比大于等于0.225、小于0.414时,CN
+
理论值是:(B)
A. 6
B. 4
C. 8
8、在离子晶体中,决定正离子配位数的关键因素是( A )
(A) 正负离子半径比 (B) 正负离子电价比 (C) 正负离子电负性之
9、 4:4是下列哪一种晶体的CN
+/CN
-
:( C)
(A) CsCl (B) NaCl (C) 六方ZnS。
离子化合物的结构化学习题

第九章离子化合物的结构化学习题一、填空题1.某二元离子晶体AB 具有立方硫化锌型结构,试填写:(1)该离子晶体的点阵型式:________________________;(2)正离子A 2+的分数坐标:_________________________;(3)负离子B 2-的分数坐标:_________________________;(4)晶胞中结构基元数目:__________________________;(5)每个结构基元由多少个A 2+和B 2-组成:____________;(6)负离子B 2-的堆积方式:_________________________;(7)正离子所占空隙类型:__________________________;(8)正离子所占空隙分数:__________________________;(9)正离子至负离子间的静电键强度为:_____________;(10)和负离子直接邻接的正离子与该负离子间的静电键强度总和:_______。
2.已知KCl 晶体具有NaCl 型结构,Cl -和K +离子半径分别为181pm 和133pm ,则KCl 晶体之晶胞参数a =___________________。
3.已知Ca 2+和O 2-的离子半径分别为99pm 和140pm ,CaO 晶体中O 2-按立方最密堆积排列,晶体结构完全符合离子晶体的结构规律。
Ca 2+填入____________空隙中,晶体所属的点群为_____________,晶胞参数为_________________,晶体密度为________________。
(Ca 的相对原子质量40.0)4.实验测得钙离子的半径=99pm ,硫离子的半径=184pm 。
根据Pauling 规则推测CaS+2Ca r −2S r 晶体中Ca 2+离子周围由S 2-离子构成_____________配位多面体,Ca 2+离子周围S 2-离子的配位数是_______________。
结构化学第九章习题解析
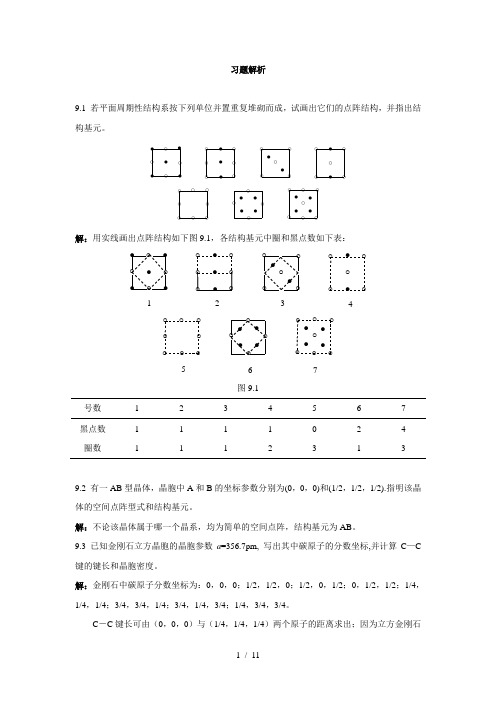
习题解析9.1 若平面周期性结构系按下列单位并置重复堆砌而成,试画出它们的点阵结构,并指出结构基元。
●●●●●●●●●●●●●●●●●●●●○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○解:用实线画出点阵结构如下图9.1,各结构基元中圈和黑点数如下表:●●●●●●●●●●●●●●●●●●●●○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○1234567图9.1号数 1 2 3 4 5 6 7黑点数 1 1 1 1 0 2 4 圈数 1 1 1 2 3 1 39.2 有一AB型晶体,晶胞中A和B的坐标参数分别为(0,0,0)和(1/2,1/2,1/2).指明该晶体的空间点阵型式和结构基元。
解:不论该晶体属于哪一个晶系,均为简单的空间点阵,结构基元为AB。
9.3 已知金刚石立方晶胞的晶胞参数a=356.7pm, 写出其中碳原子的分数坐标,并计算C—C 键的键长和晶胞密度。
解:金刚石中碳原子分数坐标为:0,0,0;1/2,1/2,0;1/2,0,1/2;0,1/2,1/2;1/4,1/4,1/4;3/4,3/4,1/4;3/4,1/4,3/4;1/4,3/4,3/4。
C-C键长可由(0,0,0)与(1/4,1/4,1/4)两个原子的距离求出;因为立方金刚石a=b=c =356.7pmr c-c=×356.7pm = 154.4pm 密度D =ZM/N A V=-1-10323-1812.0g mol (356.710cm)(6.022 10mol )⨯⋅⨯⨯⨯ = 3.51 g·cm -39.4 立方晶系的金属钨的粉末衍射线指标如下:110,200,211,220,310,222,321,400,试问:(a)钨晶体属于什么点阵形式?(b)X-射线波长为154.4pm, 220衍射角为43.62°,计算晶胞参数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(b)为便于书写,在下列 Bron-Haber 循环中略去了个物理量的单位—— kJ ⋅ mol 。
−1
146.4
1 −601.2 → Mg(s)+ O 2 (g) ⎯⎯⎯ MgO(s) 2
498.4/2 O(g) -141.8 O-(g) Y2 -3943
Mg(g) 737.7 Mg+(g) 1450.6
2
1.7476 × 6.022 × 1023 mol −1 × 2 × ( −2 ) × ( −1.602 × 10−19 C ) ⎛ 0.31× 10−10 m ⎞ = i⎜1 − ⎟ −12 4 × 3.14 × 8.854 × 10−12 C 2 i J −1 i m −1 × 210 × 10−12 m ⎝ 210 × 10 m ⎠
2−
所占。请据此回答或计
5
乐山师范学院 化学与生命科学学院
(b) 写出此晶体的化学式; (c) 指出晶体的点阵型式、结构单元和点群; (d) 指出 Ti4+的氧配位数与 Ba2+的氧配位数; (e) 计算两种正离子半径值( O (f)
2−
半径为 140pm) ;
检验此晶体是否符合电价规则,判断此晶体中是否存在分立的络离子基团;
2−
(g) Ba2+和 O (h) 解:
联合组成哪种型式的堆积?
O 2− 的配位情况怎样?
Mg2+(g) + O2-(g)
1
乐山师范学院 化学与生命科学学院
−601.2kJ imol −1 − (146.4 + 737.7 + 1450.6 + 249.2 − 141.8 − 3943) kJ imol −1 + Y2
Y2 = 899.7 kJ i mol −1
【9. 写出下列 NaCl 型晶体点阵能大小的次序及依据的原理: 2】 CaO, NaBr, SrO, ScN, KBr, BaO。 解:晶体点阵能的计算公式可写为:
θ 330 = 57.7°
也可根据 d hkl =
1 d ( hkl ) 直接由(d)中已经算出的 d (110) 求出 d (330) (这里 n = 3 ) ,代入 n
sin θ =
λ
2d330
,进而求出 θ 330 。
+ +
(f)若把 NH 4 看成球形离子,则 NH4Cl 晶体属 Oh 点群,若 NH 4 不因热运动而转动,则不 能简单地把它看作球形离子。此时 4 个 H 原子按四面体方向有序的分布在立方晶胞的体对 只保留了 3 个 I 4 , 角线上[见图 9.5 (b) NH4Cl 晶体不再具有 C4 轴和对称中心等对称元素, ], 4 个 C3 和 6 个 σ 。因此,其对称性降低,不再属于 Oh 点群而属于 Td 点群。
乐山师范学院 化学与生命科学学院
09 离子化合物的结构化学
【9.1】 MgO 的晶体结构属 NaCl 型, Mg − O 最短距离为 210pm。 (a) 利用公式计算点阵能 U
U=
AN A Z + Z − e 2 ρ (1 − ) re (4πε 0 ) re
− − 2−
ρ = 0.31× 10−10 m
+ +
Z+ Z− 。 re
而键长从 CaO 到 BaO 依次增大,所以点阵能绝对值从 CaO 到 BaO 依次减小。根据同样的 道理,第三组中两个溴化物点阵能的绝对值大小次序为 NaBr > KBr。ScN 和 CaO 相比,前 者的键长大于后者,但差别不是很大,而前者的电价却比后者大很多,因而前者的点阵能绝 对值比后者大。BaO 和 NaBr 相比,前者电价大而键长小,因而其点阵能绝对值大于后者。 综上所述,6 种晶体点阵能大小次序为: ScN > CaO > SrO > BaO > NaBr > KBr 【9.3】已知离子半径:Ca2+99pm,Cs+182pm, S 184pm, Br 195pm,若立方晶系 CaS 和 CsBr 晶体均服从离子晶体的结构规则,请判断这两种晶体的正、负离子的配位数,配位 多面体型式,负离子的堆积方式,晶体的结构型式。 解:由已知数据计算出两种晶体的正、负离子的半径比 r+ / r− ,根据半径比即可判断正离子 的配位数 CN+、配位多面体的形式和负离子的堆积方式。由正离子的配位数和晶体的组成 。根据上述结果和已知的 即可判断负离子的配位数 CN-(CN-=CN+×正离子数/负离子数) 若干简单离子晶体的结构特征即可判断 CaS 和 CsBr 的结构型H4Cl 晶体为简单立方点阵结构,晶胞中包含 1 个 NH 4 和 1 个 Cl ,晶胞参数 a=387pm。 (a) 若 NH 4 热运动呈球形,试画出晶胞结构示意图; (b) 已知 Cl 半径为 181pm,求球形 NH 4 的半径; (c) 计算晶体密度; (d) 计算平面点阵族(110)相邻两点阵面的间距; (e) 用 Cu Kα射线进行衍射,计算衍射指标 330 的衍射角 (θ ) 值; (f) 若 NH 4 不因热运动而转动,H 为有序分布,请讨论晶体所属的点群。
AN Ae 2 ⎛ 1 ⎞ Z+ Z− U= ⎜1 − ⎟ × re 4πε 0 ⎝ m ⎠
由于题中所论金属同属 NaCl 型,因而它们的 Madelung 常数 A 相同,而 Born 指数 m 差别 也不大,所以点阵能大小主要取决于 将所论晶体分为 3 组: ScN;CaO,SrO,BaO;NaBr,KBr。 第二组中 3 个氧化物的正、负离子的电价都相同,但离子半径从 Ca2 到 Ba2 依次增大,因
d(110) = a ( h 2 + k 2 + l 2 )
(e) sin θ =
−
1 2
= 387 pm × (12 + 12 + 02 )
−
1 2
= 274 pm
λ
2d hkl
h 2 + k 2 + l 2 代入已知数据得:
sin θ 330 =
154.2 pm 32 + 32 + 02 = 0.8452 2 × 387 pm
1 Mg(s)+ O 2 (g) ⎯⎯ MgO(s) → 2
解: (a)
498.4 kJ ⋅ mol 146.4 kJ ⋅ mol
−1 −1
−1
737.7 kJ ⋅ mol
1450.6 kJ ⋅ mol
− 601.2 kJ ⋅ mol−1
U=
AN A Z + Z − e2 ⎛ ρ ⎞ ⎜1 − ⎟ 4πε 0 re ⎝ re ⎠
的能量)不能直接在气相中测定,试利用
(b) O 原子的第二电子亲和能( O + e ⎯⎯ O →
下列数据及(1)中得到的点阵能数据,按 Born-Haber 循环计算。
O − (g) ⎯⎯ O(g)+e − →
141.8 kJ ⋅ mol
−1 −1
O 2 (g) ⎯⎯ 2O(g) → Mg(s) ⎯⎯ Mg(g) → Mg(g) ⎯⎯ Mg + (g)+e − → Mg + (g) ⎯⎯ Mg 2+ (g)+e− →
+ -
−
关系:
2(rNa + + rH− ) = a rH− = a − r + = 142pm 2 Na
- -
NaH 水解生成 H2 和 NaOH,说明 H 接受质子的能力比 OH 强,即 NaH 的碱性比 NaOH 的 碱性还强。 ,试从结构观点予以 【9.7】 第三周期元素氟化物的熔点从 SiF4 开始突然下降(见下表) 分析,说明。 化合物 熔点/℃ NaF 993 MgF2 1261 AlF3 1291 SiF4 -90 PF5 -83 SF6 -50.5
解:NaF 和 MgF2 都是典型的离子晶体.分属于 NaCl 型和金红石型。A1F3 晶体中虽然由 于 Al3 的价态较高半径较小而存在着一定程度的离子极化,但它仍属于离子晶体。晶体中
+
正、负离子间有较强的静电作用,故三种晶体的熔点都较高。 虽然三种离子晶体分属于不同的结构型式,Madelung 常数有差别,但影响它们点阵能 大小的主要因素是离子的电价和离子键的长度。从 NaF 到 A1F3,正离子的电价逐渐增高而 半径逐渐减小,因而点阵能逐渐增大,致使晶体的熔点逐渐升高。 随着正离子电价的进一步升高和半径的进一步减小, 极化能力进一步增强。 从而使化合 物的键型和构型都发生了变化。从 SiF4 开始的三个氯化物已不是离子化合物了。原子间靠 共价键结合形成分子,分子间靠范德华力结合形成晶体。由于范德华力比离子键弱得多,因 而这 3 个氟化物的熔点大大降低。 从 SiF4 到 SF6 熔点逐渐略有升高,是因为分子间作用力(主要是色散力)略有增大所致。 【9.8】经 X 射线分析鉴定,某一离子晶体属于立方晶体,其晶胞参数 a=403.1pm。晶胞 中顶点位置为 Ti4+所占,体心位置为 Ba2+所占,所有棱心位置为 O 算: (a) 用分数坐标表达诸离子在晶胞中的位置;
图 9.5
4
乐山师范学院 化学与生命科学学院
【9.6】 NaH 具有 NaCl 型结构。已知立方晶胞参数 a=488pm,Na+半径为 102pm,推算负 离子 H 的半径,根据反应
−
NaH+H 2O ⎯⎯ H 2↑+NaOH →
阐明 H 的酸碱性。 解:由于 NaH 具有 NaCl 型结构,因而 Na 的半径 rNa + ,H 的半径 rH− 及晶胞参数 a 有如下
4
1 1 3a − rCl − = 3 × 387 pm − 181 pm = 154 pm 2 2
