172号公告--承接人体生物等效性试验和Ⅰ期临床试验情况(附件1)
药品注册核查要点与判定原则(生物等效性试验和药物Ⅰ期临床试验)(征求意见稿)

附件2-2药品注册核查要点与判定原则(生物等效性试验和药物Ⅰ期临床试验)(征求意见稿)为保证药品注册核查质量,统一核查范围和判定标准,根据《药品管理法》《药品注册管理办法》等法律法规及相关指导原则,特制定《药品注册核查要点与判定原则(生物等效性试验和药物Ⅰ期临床试验)》。
本要点和判定原则在生物等效性试验和药物Ⅰ期临床试验注册核查方面列举了相应的核查项目,旨在明确现场核查的重点环节和关键要素;核查结果应当依据判定原则进行综合评定。
一、目的药品注册现场核查(生物等效性试验和药物Ⅰ期临床试验)的目的主要是通过对生物等效性试验和药物Ⅰ期临床试验研究的原始资料进行数据可靠性的核实和/或实地确证,检查生物等效性试验和药物Ⅰ期临床试验的合规性,核实相关申报资料的真实性、一致性。
二、范围(一)本核查要点和判定原则适用于国家药品监督管理局药品审评中心(以下简称药审中心)根据审评需求发起、由国家药品监督管理局食品药品审核查验中心(核查中心)组织实施的涉及生物等效性试验和I期临床试验的药品注册研制现场核查。
(二)生物等效性试验和药物Ⅰ期临床试验的注册核查主要对临床试验机构和分析检测单位承担试验职责情况,包括执行试验方案、数据记录和结果报告等方面进行核查。
必要时,可对申请人、合同研究组织、数据管理单位或临床试验用药物制备情况进行现场核查,对临床试验用药物进行抽查检验。
三、现场核查要点(一)临床部分1.临床试验条件与合规性(1)临床试验应当在具备相应条件并按规定进行备案的药物临床试验机构进行。
(2)开展临床试验,应当获得药品监督管理部门许可,或按照要求完成备案。
项目开始实施时间(首例受试者签署知情同意书)不早于试验许可或备案时间。
(3)开展临床试验,应当经伦理委员会审查同意。
项目开始实施时间不早于伦理审查书面同意时间。
(4)临床试验机构应当具备与承担试验项目相适应的条件。
临床试验实际开展场地应当与申报资料中试验地址一致,应当有足够空间,且分区合理,各分区能够满足试验实施的需求。
CDE-76个常见一般性技术问题解答
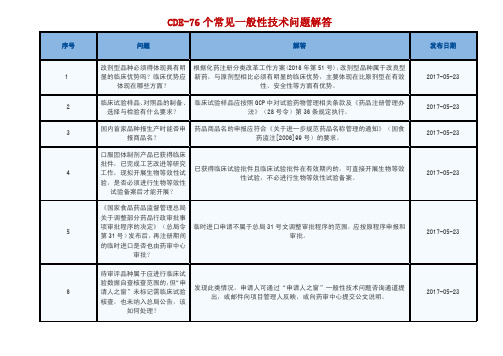
评,完成审评后由业务管理处按同审评序列注册申请的申报时间顺序制作 送签文件和放行。因此,申报时间靠后但先完成审评的注册申请,需等待 排在其前面的任务完成后才能转入下一环节。纳入优先审评程序的注册申
2017-05-23
请不受按序放行的限制,各环节均应第一时间处理。
国产注册申请应请向省局提出撤回申请,由省局把撤回申请和省局意见单
同规格品种” 项填写该制剂已被受理或关联审批的原料药、辅料、药包材、
关于原辅包关联申报的制剂申
23
请表填报问题
制剂或不同规格品种的受理号/登记号及名称。完成临床研究申请上市的申 请,还需填写原临床申请受理号、临床试验批件号、临床试验登记号或生
2018-03-12
物等效性试验备案号等。
按照《总局关于调整药品注册受理工作的公告》(2017 年第 134 号)规定:
关于根据药品批准文件要求完 按照《关于进一步规范药品注册受理工作的通知》(2015 年第 122 号)要
28
成上市后相关技术研究的申报 求,此类情形应按补充申请申报,按照《药品注册管理办法》附件 4 药品
2018-03-12
方式
补充申请注册事项第 18 项办理。
29Байду номын сангаас
关于已上市眼用制剂增加单剂 量装量规格的申报方式
相应平台进行备案。
33
关于进口产品多个包装厂的申 申请人可在申请表中机构 3(进口药品国外包装厂)一栏可填写多个包装厂
2018-03-12
序号
问题
解答
发布日期
报
名称和地址,各包装厂中间用分号间隔以示区别。
按照《药品注册管理办法》(局令第 28 号)第二十四条规定,申请人委托
治疗阿尔茨海默病药物临床试验技术指导

指导原则编号: 【】治疗阿尔茨海默病药物临床试验技术指导原则(第二稿)二○○七年三月目录一、概述............................................................................. ........................ 3 二、有效性和安全性评价要点. (5)(一)适应症定位 (5)(二)受试人群 (5)(三)有效性评价 (8)(四)安全性评价 (10)(五)临床试验的质量控制............................................................ 11 三、分期试验设计 .................................................................................. 11 (一)Ⅰ期临床试验: .................................................................... 11 (二)Ⅱ期临床试验........................................................................ 13 (三)Ⅲ期临床试验........................................................................ 15 四、预防和控制疾病进展药物的临床试验 .......................................... 16 (一)轻度认知功能损害(MCI)者的临床试验 ................................ 16 (二)控制疾病进展药物的临床试验..................................................17 五、缩略语 ............................................................................ .................. 17 六、参考文献 ............................................................................ .............. 19 七、著者 ............................................................................ ...................... 20 2治疗阿尔茨海默病药物临床试验技术指导原则一、概述痴呆是一种以认知功能缺损为核心症状的获得性临床综合征,如进行性记忆、思维、语言、行为和人格障碍等,可伴随精神和运动功能障碍,其认知损害的程度足以影响日常生活、社交或职业功能或与个人以前相比有显著下降。
2017年具有药物临床试验机构资格的619家医疗机构

国家食品药品监督管理总局国家卫生和计划生育委员会关于药物临床试验机构开展人体生物等效性试验的公告(2017年第119号)2017年10月13日发布为落实《国务院关于改革药品医疗器械审评审批制度的意见》,更好地服务以临床价值为导向的药物创新,有效落实申请人主体责任,现就生物等效性试验有关工作公告如下:一、根据《中华人民共和国药品管理法》《药物临床试验机构资格认定办法(试行)》的有关规定,药品监督管理部门会同卫生行政部门已经认定具有药物临床试验机构资格的医疗机构619家。
经认定的药物临床试验机构均可以开展人体生物等效性试验。
二、药物临床试验机构开展人体生物等效性试验,其伦理审查和试验管理应当符合《涉及人的生物医学研究伦理审查办法》及相关指导原则中的要求、条件和程序,有效保护受试者的权益并保障其安全。
三、注册申请人开展人体生物等效性试验前,应当将拟开展的人体生物等效性试验项目在国家食品药品监督管理总局指定的化学仿制药生物等效性与临床试验备案信息平台(网址:)备案。
四、注册申请人和药物临床试验机构应当遵循《药物临床试验质量管理规范》《药物Ⅰ期临床试验管理指导原则(试行)》及相关技术要求,确保人体生物等效性试验数据真实、完整、可靠,并对全部试验数据承担法律责任。
现场检查未通过的,其数据在药品审评时将不被接受。
五、各省级药品监督管理部门负责对本行政区域内药物临床试验机构开展的人体生物等效性试验项目的监督,负责试验项目的现场检查。
对试验数据真实、完整、可靠承担监督责任。
特此公告。
附件:具有药物临床试验机构资格的医疗机构食品药品监管总局国家卫生计生委2017年9月1日2017年第119号公告附件.docx附件具有药物临床试验机构资格的医疗机构精选。
全国艾滋病检测技术规范(2019年修订版)

4.2.2.3 根据需要,连续在数个印圈上滴加样品。
4.2.2.4于室温下自然干燥至少4小时(潮湿气候下至少干燥24小时),不要加热或堆叠血斑,勿与其它界面接触。
4.3.4 尿液样品,使用专用采尿管,室温下可保存2周,一年之内存放宜在2~8℃。长期保存(一年以上)的样本冻存条件、是否添加防腐剂等以产品说明书为准。
4.3.5 用于CD4+T淋巴细胞检测的全血样品,室温保存,时间不超过24小时。如果用CD45设门,样品保存不超过72小时。
4.3.6筛查阳性样品应及时进行补充试验,筛查阴性样品,可根据具体需要决定保存时间,建议至少保存1个月。特殊用途或专项项目的样品根据具体要求确定保存时间。补充试验阳性样品按照国家生物样品管理的有关规定执行。
4.1.1 样品的编码和记录
4.1.2 应制定样品编码的标准操作程序(SOP),规定样品编码的原则和方法,为样品制定唯一性编码(编号),保证其唯一性。
4.1.3 采血前,先对试管或滤纸进行标记,核对后编码。要将标签贴在试管的侧面,推荐使用预先印制好的、专门用于冷冻储存的耐低温标签。干血斑滤纸应使用具有资质的产品。
4.2.2.5 血斑充分干燥后,将其放入密封袋中,每张干血斑单独保存,避免血斑之间的相互污染,同时放入干燥剂及湿度指示卡,密封包装,保存备用。
4.2.3尿液和口腔黏膜渗出液
4.2.3.1尿液:推荐使用专用采尿管,保持尿液稳定。尿液样品可采集随机尿,女性经期应取中段尿。
4.2.3.2口腔黏膜渗出液:使用试剂盒提供的容器收集样品。存放时间和是否冻存以试剂盒说明书为准。口腔黏膜渗出液应采集口腔渗出液,不是唾液。
遗传办备案填写流程(1)

遗传办备案信息填写流程目录一、登录国家科技部网站 (2)二、点击进入“人类遗传资源行政审批” (2)三、再次注册“人类遗传资源行政审批”账号 (2)四、注册完成后登录 (3)五、新建项目 (4)六、创建项目信息 (4)七、填写申请信息 (4)1.封面信息 (4)2.基本信息及附件 (5)2.1.合作发起方 (6)2.2.合作临床机构 (6)2.3.合同研究组织 (6)2.4.第三方中心实验室 (7)2.5.其他单位 (7)2.6.样本、数据境外接收单位 (8)3.工作方案 (8)3.1.合作中的人类遗传资源 (8)3.2.出口出境方案 (10)4.只是产权归属和分享的安排 (10)5.采集、收集和出口出境计划 (10)6.合作单位签章 (11)7.附件 (11)八、整体校验 (12)九、提交管理员 (12)十、提交形式审查 (12)一、登录国家科技部网站网址:国家科技计划项目申报中心账号需要通过研究单位管理员账号,主研进行申请。
二、点击进入“人类遗传资源行政审批”三、再次注册“人类遗传资源行政审批”账号注册窗口和需要的材料如下:四、注册完成后登录注意:应选择“注册上市优化申请书”。
五、新建项目首次登录填写,需要新建项目。
六、创建项目信息七、填写申请信息1.封面信息2.项目申请信息表3.基本信息及附件3.1.合作发起方添加合作发起方3.2.合作临床机构3.3.合同研究组织3.4.第三方中心实验室3.5.其他单位3.6.样本、数据境外接收单位注:一般上传“无样本、数据境外接收单位说明”,见附件。
4.工作方案4.1.合作中的人类遗传资源4.1.1.项目基本情况及合作中涉及的人类遗传资源的基本情况(简要描述项目情况,按照研究方案阐述说明人类遗传资源的类型、数量、来源及获得途径)示例:1、类型:血浆数量:4864管;规格:1mL/管;来源及获得途径:全血标本的采集在I期病房进行,由被授权的研究人员按照研究单位的SOP 进行样本的采集。
药品注册核查要点与判定原则(生物等效性试验和药物Ⅰ期临床试验)(征求意见稿)

附件2-2药品注册核查要点与判定原则(生物等效性试验和药物Ⅰ期临床试验)(征求意见稿)为保证药品注册核查质量,统一核查范围和判定标准,根据《药品管理法》《药品注册管理办法》等法律法规及相关指导原则,特制定《药品注册核查要点与判定原则(生物等效性试验和药物Ⅰ期临床试验)》。
本要点和判定原则在生物等效性试验和药物Ⅰ期临床试验注册核查方面列举了相应的核查项目,旨在明确现场核查的重点环节和关键要素;核查结果应当依据判定原则进行综合评定。
一、目的药品注册现场核查(生物等效性试验和药物Ⅰ期临床试验)的目的主要是通过对生物等效性试验和药物Ⅰ期临床试验研究的原始资料进行数据可靠性的核实和/或实地确证,检查生物等效性试验和药物Ⅰ期临床试验的合规性,核实相关申报资料的真实性、一致性。
二、范围(一)本核查要点和判定原则适用于国家药品监督管理局药品审评中心(以下简称药审中心)根据审评需求发起、由国家药品监督管理局食品药品审核查验中心(核查中心)组织实施的涉及生物等效性试验和I期临床试验的药品注册研制现场核查。
(二)生物等效性试验和药物Ⅰ期临床试验的注册核查主要对临床试验机构和分析检测单位承担试验职责情况,包括执行试验方案、数据记录和结果报告等方面进行核查。
必要时,可对申请人、合同研究组织、数据管理单位或临床试验用药物制备情况进行现场核查,对临床试验用药物进行抽查检验。
三、现场核查要点(一)临床部分1.临床试验条件与合规性(1)临床试验应当在具备相应条件并按规定进行备案的药物临床试验机构进行。
(2)开展临床试验,应当获得药品监督管理部门许可,或按照要求完成备案。
项目开始实施时间(首例受试者签署知情同意书)不早于试验许可或备案时间。
(3)开展临床试验,应当经伦理委员会审查同意。
项目开始实施时间不早于伦理审查书面同意时间。
(4)临床试验机构应当具备与承担试验项目相适应的条件。
临床试验实际开展场地应当与申报资料中试验地址一致,应当有足够空间,且分区合理,各分区能够满足试验实施的需求。
化学药物临床试验报告的结构与内容技术指导原则

本指导原则只对临床试验报告的结构和内容提出了原则框架,列出了报告 中应涵盖的基本点,不可能做到完全细化。鉴于临床研究的复杂性,对格式和 内容可根据研究的具体情况进行适当的调整。
二、临床试验报告的结构与内容 (一)首篇
首篇是每份临床试验报告的第一部分内容,所有单个的临床试验报告均应 包含该部分内容。
首篇中各标题下的内容均应分页单列。首篇内容不必标注“首篇”的字样。 1
1、封面标题
包括受试药物通用名、研究类型、研究编号、研究开始日期、研究完成日 期、主要研究者(签名)、研究单位(盖章)、统计学负责人签名及单位盖章、 药品注册申请人(盖章)、注册申请人的联系人及联系方式、报告日期、原始资 料保存地点。
3
研究设计(平行、交叉)、分组方法(随机、分层等)、试验各阶段的顺序和持 续时间(包括随机化前和治疗后、撤药期和单盲、双盲治疗期,应指明患者随 机分组的时间,尽量采用流程图的方式以直观表示时间安排情况)、数据稽查及 安全性问题或特殊情况的处理预案、期中分析情况。
1.4.2 试验设计及对照组选择的考虑 应阐明所设对照的确定依据及合理性。 对试验设计中涉及的药物的清洗期、给药间隔时间的合理性的考虑应进行 说明。如果未采用随机化分组,则应详细解释和说明用以有效克服系统选择性 偏倚的其他技术措施。 如果研究中不设对照组,应说明原因。 1.4.3 研究对象的选择 确定合理可行的入选标准、排除标准和剔除标准。 根据研究目的确定入选标准,说明适应症范围及确定依据,选择公认的诊断 标准,注意疾病的严重程度和病程、病史特征、体格检查的评分值、各项实验室 检验的结果、既往治疗情况、可能影响预后的因素、年龄、性别、体重、种族等。 必要时进行合理的论证。 从安全性和试验管理便利性考虑的排除标准应进行说明,并注意排除标准对 整个研究的通用性及安全有效评价方面的影响。 事先确定的剔除标准应从治疗或评价的角度考虑,并说明理由。对剔除的 受试者的随访观察措施及随访时间也应进行描述。 1.4.4 试验过程 详细描述试验用药在临床试验中的应用过程及其相关事宜。 列出试验用药的名称、剂型、规格、来源、批号(如采用多个批号,对各
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
临床试验机构
试验数量(项)
63 52 40 39 31 22 20 18 18 18 16 13 12 11 11 11 10 9 8 8 8 8 7 7 6 6 6 6 6 6 6
32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67
6 5 5 5 5 5 5 4 4 3 3 3 3 3 3 3 3 3 3 3 2 2 2 2 2 2 2 269 70 71 72 73 74 75 76 77 78 79 80 81 82
中国人民解放军第三军医大学第一附属医院 河南省中医药研究院 湖南省肿瘤医院 暨南大学第一附属医院 南方医科大学南方医院 南京医科大学第一附属医院(江苏省人民医院) 青岛大学医学院附属医院 中国人民解放军第二军医大学第三附属医院 上海交通大学医学院附属仁济医院 上海交通大学医学院附属瑞金医院 上海市胸科医院 中国人民解放军第二军医大学第二附属医院 首都医科大学附属北京安定医院 四川大学华西第二医院 郑州大学第一医院
1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
附件1
承接人体生物等效性试验和Ⅰ期临床试验情况
序号
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 中南大学湘雅三医院 辽宁中医药大学附属第二医院 苏州大学附属第二医院 中国人民解放军第四军医大学第一附属医院 华中科技大学同济医学院附属同济医院 辽宁中医药大学附属医院 长春中医药大学附属医院 兰州大学第一医院 辽宁省人民医院 中国医学科学院皮肤病医院 山东大学齐鲁医院 航天中心医院 中国人民解放军南京军区南京总医院 山东大学第二医院 上海市徐汇区中心医院 泰达国际心血管病医院 中南大学湘雅医院 中国人民解放军成都军区昆明总医院 华中科技大学同济医学院附属协和医院 中国人民解放军第三〇七医院 浙江大学医学院附属第二医院 中国人民解放军第三〇二医院 浙江大学医学院附属第一医院 中国人民解放军第二一〇医院 北京大学第一医院 南京大学医学院附属鼓楼医院 南京市第一医院 上海中医药大学附属曙光医院 四川大学华西医院 苏州大学附属第一医院 天津中医药大学第二附属医院
中国人民解放军白求恩国际和平医院 蚌埠医学院附属医院 广州市精神病医院 吉林大学第一医院 江苏省中医院 皖南医学院弋矶山医院 中国医科大学附属盛京医院 四川省人民医院 中南大学湘雅二医院 北京协和医院 中国人民解放军第三军医大学第二附属医院 复旦大学附属华山医院 复旦大学附属中山医院 广东省人民医院 海南医学院附属医院 河北医科大学第二医院 南昌大学第一附属医院 首都医科大学附属北京同仁医院 中国人民解放军第四五八医院 中国医科大学附属第一医院 安徽医科大学国家药品临床研究基地 北京大学第三医院 中国人民解放军北京军区总医院 中国人民解放军第二炮兵总医院 广州市惠爱医院 河北医科大学第四医院 河南省人民医院 宁夏医科大学总医院 上海市公共卫生临床中心 中国人民解放军第二军医大学第一附属医院 天津市肿瘤医院 无锡市人民医院 Prince of Wales Hospital 安徽省肿瘤医院 北京大学临床药理研究所 北京大学人民医院
