专题有关金属及其化合物的计算(课件)-2016-2017学年高一化学上册.pdf
【金版学案】2016-2017学年高中化学 第4章 第2节 铝与铝合金(第1课时)课件 鲁科版必修1

2.等体积、等物质的量浓度的硫酸、氢氧化钠溶液 分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气 的体积比为 5∶6(相同条件下), 则甲、 乙两烧杯中的反应 情况可能是( )
A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量 C.甲中酸过量,乙中铝过量 D.甲中酸过量,乙中碱过量
解析:(1)2Al+3H2SO4===Al2(SO4)3+3H2↑
(2)用扎有针孔的铝箔包住 0.23 克钠,收集到的氢气 为 0.01 mol。( )
(3)根据反应 Na2O+H2O===2NaOH,可知 Al2O3+ 3H2O===2Al(OH)3 成立。( )
(4)所有的金属、金属氧化物及氢氧化物都不可能与 碱发生反应。( )
(5)氧化铝可以制造耐火坩埚的原因是利用 Al2O3 的 高熔点。( ) )
要点二
铝与盐酸、氢氧化钠溶液的反应
问题:一般金属不与碱反应,铝能与强碱反应吗? 铝与盐酸和氢氧化钠溶液反应的实验探究:
项目
铝与盐酸反应
铝与氢氧化钠溶液反应
实验 操作
实验 现象 化学 方程式 离子 方程式 结论
铝片逐渐溶解,有无色气泡冒出,将点燃的木 条放在试管口有爆鸣声 2Al+6H2O+ 2Al+6HCl===2AlCl3 2NaOH===2Na[Al(OH +3H2↑ )4]+3H2↑ - 2Al + 6H O + 2OH 2 2Al+6H+===2Al3++ === 3H2↑ 2[Al(OH)4]-+3H2↑ 铝既能与盐酸反应,又能与氢氧化钠溶液反应, 都产生H2且铝物质的量相同、酸碱均过量时, 放出H2的量相同
2.将上述反应得到的沉淀分别装在三支试管中:在 第一支试管中滴加 2 mol· L-1 盐酸,观察到的现象是白色 沉淀逐渐溶解; 在第二支试管中滴加 2 mol· L-1 氢氧化钠溶液,观察 到的现象是白色沉淀逐渐溶解; 在第三支试管中滴加氨水,观察到的现象是沉淀无 变化(或不溶解)。
第11讲 铁及其化合物(教师版)-2020-2021学年高一化学必修第一册同步培优精品讲义
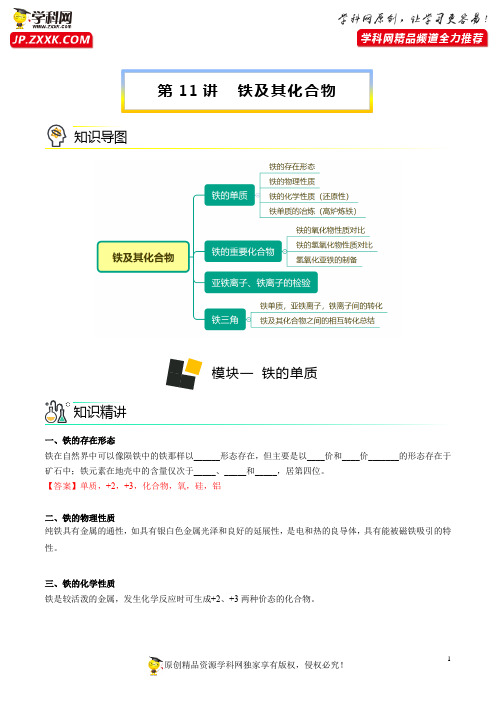
第11讲铁及其化合物知识导图模块一铁的单质知识精讲一、铁的存在形态铁在自然界中可以像陨铁中的铁那样以______形态存在,但主要是以____价和____价_______的形态存在于矿石中;铁元素在地壳中的含量仅次于_____、_____和_____,居第四位。
【答案】单质,+2,+3,化合物,氧,硅,铝二、铁的物理性质纯铁具有金属的通性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性。
三、铁的化学性质铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物。
资料卡片——生铁与纯铁的抗腐蚀性能1.Fe与非金属反应:(横线上填化学方程式)2.Fe与酸反应:(横线上填氧化产物及还原产物)3.Fe与水反应(1)反应原理:_____________________________________________。
【答案】3Fe + 4H2O(g) =====高温Fe3O4 + 4H2(2)实验装置思考与交流【答案】1.提供水蒸气;2.检验反应中生成的H2;3.铁与水反应是有条件的,铁在高温条件下与水蒸气反应,铁不与冷、热水反应,故可以用铁壶盛水。
纯铁的抗腐蚀性能比生铁好。
原因是生铁中含有碳等物质,在有电解质溶液(比如雨水等)情况下会形成原电池,铁作为负极被加速腐蚀。
1.湿棉花的作用:______________________________________________________。
2.肥皂液的作用:______________________________________________________。
3.铁与水可以发生反应,为什么还可以用铁壶来盛水呢?4.铁与盐溶液反应:(横线上填化学方程式)5.常温下,铁在浓硫酸或浓硝酸中会发生钝化。
资料卡片——钝化原理归纳总结——铁的还原性四、铁单质的冶炼(高炉炼铁)铁单质冶炼的原理就是利用还原剂将铁从矿石中还原出来。
专题11金属及其化合物(讲)2017年高考二轮复习化学(无答案)

2017届高三二轮复习讲练测之讲案【新课标版化学】专题十一金属及其化合物(1)考纲要求1.了解金属(如Na、Al、Fe、Cu等)在周期表中的位置及其性质递变的规律。
2.了解常见金属元素及其重要化合物的主要性质及应用。
3.了解合金的概念及其重要应用。
4.以上各部分知识的综合应用。
(2)命题规律钠、铝、铁、铜及其化合物是日常生活中非常重要的金属元素,特别是铁在国民经济中占有极其重要的地位,这部分内容一直是高考考查的重点。
如以钠及其化合物(特别是Na2O2、NaHCO3、Na2CO3)的性质为载体的推断题或实验题、铝及其化合物的两性、Fe2+与Fe3+之间的转化关系、铜的冶炼及Cu(OH)2的性质等。
钠及其化合物、合金与硝酸的反应是每年高考的必考知识点。
估计以后高考试题将会在选择题中以离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等角度考查金属元素及其化合物的性质,也会在非选择题中以金属元素的性质为载体,通过推断题、实验题,考查考生运用金属元素的有关知识分析解决问题的能力。
因此在复习时要注意元素单质及其化合物之间的相互转化,如“铝三角”、“铁三角”,同时在复习时要加强化合物知识与理论部分的联系。
【例1】【2016年高考新课标Ⅱ卷】某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为()A.NaHCO3、Al(OH)3B.AgCl、NaHCO3C.Na2SO3、BaCO3D.Na2CO3、CuSO4【例2】【2016年高考上海卷】已知NaOH+Al(OH)3→N a[Al(OH)4]。
向集满CO 2的铝制易拉罐中加入过量NaOH 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。
上述实验过程中没有发生的离子反应是 ( )A .CO 2+2OH −→CO 32−+H 2OB .Al 2O 3+2OH −+3 H 2O→2 [Al(OH)4]−C .2 Al+2OH −+6H 2O→2 [Al(OH)4] −+3 H 2↑D .Al 3++4 OH −→[Al (OH)4]−1、钠及其化合物(1)知识网络(2)注意事项①钠与盐的溶液反应:钠不能置换出溶液中的金属,钠直接与水反应,反应后的碱再与溶液中的其他物质反应。
【优化指导】2016-2017学年高中化学 第二单元 铁、铜的获取及应用(第2课时)铁、铜及其化合物的应用课件

重难点一
重难点二
情境导入
知识点拨
典例引领
Fe3+和Fe2+的检验 Fe2+在溶液中一般呈浅绿色,有较强的还原性,能与许多氧化剂反 应,如氯气、氧气等。因此含Fe2+的溶液最好现配现用,储存时向其 中加入一些铁粉(三价铁离子有强氧化性,可以与铁单质反应生成 Fe2+),那么Fe2+和Fe3+应该如何检验呢? 讨论探究 请完成以下实验报告:
重难点一
重难点二
情境导入
知识点拨
典例引领
重难点一
重难点二
情境导入
知识点拨
典例引领
重难点一
重难点二
情境导入
知识点拨
典例引领
成功体验2 要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下 实验操作时的最佳顺序为( ) ①加入足量新制氯水 ②加入足量酸性KMnO4溶液 ③加入少量NH4SCN溶液 A.①③ B.③② C.③① D.①②③ 解析:加入NH4SCN溶液后无血红色出现证明无Fe3+,再加入新制 氯水,如有Fe2+,则Fe2+被氧化为Fe3+,溶液显血红色。酸性KMnO4溶 液也能氧化Fe2+,但KMnO4溶液本身为紫色,使Fe3+和SCN-反应后的 血红色不易观察到,故选C。 答案:C
自主阅读
自主检测
四、Fe2+、Fe3+的鉴别和转化 1.Fe2+、Fe3+的鉴别
鉴别方法 与 KSCN 反应
Fe2+ 无明显现象,加氯水后显血 红色
Fe3+ 溶液变为血红色
2.Fe2+和Fe3+的相互转化 (1)Fe2+ Fe3+ 2Fe2+ +Cl 2 2Fe3++2Cl-(写离子方程式,下同) (2)Fe3+ Fe2+ 2Fe3+ +Fe 3Fe2+
高考化学 考点一遍过 专题 铁及其重要化合物试题

冠夺市安全阳光实验学校专题16 铁及其重要化合物一、铁的性质1.铁的物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
2.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应: ①与O 2的反应:常温下:铁被腐蚀生成铁锈,其主要成分为Fe 2O 3。
点燃时:3Fe +2O 2=====点燃Fe 3O 4。
②与Cl 2的反应:2Fe +3Cl 2=====点燃2FeCl 3。
③与S 的反应:Fe +S=====△FeS 。
(2)与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸的反应:①与非氧化性酸反应的离子方程式:Fe +2H +===Fe 2++H 2↑。
②与氧化性酸:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H 2产生。
Fe 过量 3Fe+8H ++23NO -3Fe 2++2NO↑+4H 2O Fe 不足Fe+4H ++3NO -Fe 3++NO↑+2H 2O(4)与某些盐溶液的反应:①与CuSO 4溶液反应的离子方程式:Fe +Cu 2+===Fe 2++Cu 。
②与FeCl 3溶液反应的离子方程式:2Fe 3++Fe===3Fe 2+。
二、铁的氧化物和氢氧化物 1.铁的氧化物的比较铁的氧化物 FeO Fe 2O 3 Fe 3O 4 俗称 无 铁红 磁性氧化铁 色、态 黑色粉末 红棕色粉末黑色晶体 铁的价态 +2+3 +2、+3水溶性 难溶于水 稳定性不稳定性 6FeO+O 22Fe 3O 4 稳定稳定与非氧化性酸的反应 FeO+2H+Fe 2++H 2O Fe 2O 3+6H+2Fe 3++3H 2OFe 3O 4+8H+2Fe 3++ Fe 2++4H 2O与CO 的反应Fe x O y +y COx Fe+y CO 2制取高温熔融,过量的铁与氧气反应 2Fe+O 22FeOFe(OH)3的分解 2Fe(OH)3Fe 2O 3+3H 2O铁在氧气中燃烧 3Fe+2O 2Fe 3O 42.铁的氢氧化物的比较铁的氢氧化物Fe(OH)2Fe(OH)3物理性质白色,难溶于水的固体红褐色,难溶于水的固体化学性质 (1)与非氧化性强酸反应Fe(OH)2+2H+Fe 2++2H 2O(2)与氧化性酸反应3Fe(OH)2+10HNO 33Fe(NO 3)3+NO↑+8H 2O(3)空气中放置被氧化4Fe(OH)2+2H 2O+O 24Fe(OH)3(1)与酸反应Fe(OH)3+3H +Fe 3++3H 2O(2)受热分解2Fe(OH)3Fe 2O 3+3H 2O制备①煮沸蒸馏水,赶走溶解的氧气②煮沸NaOH 溶液,赶走溶解的氧气 ③配制FeSO 4溶液,加少量的还原铁粉④用长滴管将NaOH 溶液送入FeSO 4溶液液面以下Fe 2++2OH −Fe(OH)2↓将NaOH 溶液滴入Fe 2(SO 4)3溶液中Fe 3++3OH −Fe(OH)3↓三、“铁三角”及其应用 “铁三角”的四应用:(1)判断离子共存......: Fe 3+、Fe 2+与3HCO -、2AlO -、23CO -等在溶液中因发生相互促进水解反应而不能大量共存;Fe 2+与3NO -(H +)、ClO −、4MnO -(H +),Fe 3+与S 2−、I −、HS −、23SO -在溶液中因发生氧化还原反应而不能大量共存。
高考化学复习 镁、铝、铁、铜 金属的冶炼

+NO↑+5H2O
性 与还原性 FeO+2HI
质 酸反应 FeI +H O
Fe2O3+ 6HI
Fe3O4+8HI
2FeI2+ I2+3H2O
4H2O
与还原 FeO+CO
Fe2O3+3CO
剂反应 Fe+CO2
2Fe+3CO2
2
2
Fe3O4+4CO
3FeI2+ I2+
3Fe+4CO2
化学专题六
镁、铝、铁、铜
化学专题六
镁、铝、铁、铜
金属的冶炼
[续表]
实验
高温下,铝与氧化铁发生反应,放出大量的热:Fe2O3+2Al
结论
2Fe+Al2O3
原理
应用
①制取熔点较高、活动性弱于Al的金属,如铁、铬、锰、钨等,
3MnO2+4Al
3Mn+2Al2O3;
②金属焊接,如野外焊接钢轨等
化学专题六
镁、铝、铁、铜
金属的冶炼
2
2
2
3
3.既能与盐酸反应,又能与氢氧化钠溶液反应的物质有:Al、Al2O3、Al(OH)3;
多元弱酸的酸式盐,如NaHCO3、NaH2PO4、NaHSO3等;弱酸的铵盐,如
NH4HCO3、CH3COONH4、(NH4)2S等;氨基酸。
化学专题六
镁、铝、铁、铜
金属的冶炼
3.一种重要的复盐——明矾
化学式
被磁铁吸引
结构
与非金属
Cl2
2Fe+3Cl2
2FeCl3
单质
物质的量在化学方程式计算中的应用(课件)-2016-2017学年高一化学上册

摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)等
概念应用于化学方程式进行计算时,通过物质的量与 化学计量数之间的关系以及物质的量与物理量之间的 联系,能使化学计算变得更加简便。
3.基本步骤
4.实例
现有1 L 1 mol/L的盐酸与50 g NaOH样品恰好完全反
应(杂质不与盐酸反应),则该样品中NaOH的含量为多少? (1)设:设样品中NaOH的质量为x (2)写:HCl + NaOH=NaCl+H2O 40 g x
基础梳理
一、物质的量在化学方程式计算中的应用 原子、分子、离子 等粒子构成的,物质 1.物质是由_________________ 之间的化学反应也是这些粒子按一定的数目关系进 行的。化学方程式中的化学______ 计量数可以明确地表示
出化学反应中粒子之间的数目关系:化学方程式中
物质的物 化学计量数 各物质的__________ 之比等于各________ 质的量之 比,等于相同条件下气体体积之比。
气体摩尔体积 2.物质的量(n)、___________ 、(Vm) 摩尔质量(M) 物质的量浓度(c) 可应用 ________________ 和________________ 于化学方程式进行计算。
NA M m n N M NA 22.4L/mol 22.4 L/mol V(标况)
【解析】 关系:
根据Cl2与NaI反应,可得如下 Δm 183
Cl2+2NaI=2NaCl+I2 300 117
m(NaI)
所以m(NaI)= 【答案】 A
15.0 g-9.51 g=5.49 g
=9 g
科学探究
有关化学方程式计算方法的探究 在标准状况下进行甲、乙、丙三组实验。三组 实验各取30 mL同浓度的盐酸,加入同一种镁铝混 合物粉末,产生气体,有关数据列表如下: 实验序号 混合物质量(mg) 甲 255 乙 385 丙 459
常见合金及其应用 2019-2020学年上学期高一化学人教版(必修1)

常见合金及其应用高考频度:★★★☆☆难易程度:★☆☆☆☆典例在线碲锌镉(TeZnCd)晶体可以用于制造红外探测器的基础材料,下列有关它的叙述中不正确的是A.它是由Te、Zn、Cd按一定比例混合而成的,无固定的熔、沸点B.它易导电、导热,具有延展性C.它的熔、沸点比Zn的低D.它的硬度和强度比Cd的大【答案】A【解析】碲锌镉晶体是由Te、Zn、Cd按一定比例熔合而成的具有金属特性的合金,只要比例确定,其组成就固定,因而有固定的熔、沸点;合金具有比成分金属低的熔、沸点,具有较高的硬度和强度。
解题必备一、常见的合金(1)铜合金(2)钢——用量最大、用途最广的合金。
(3)铝合金(4)钛合金二、对合金的深化理解1.合金是混合物而不是纯净物。
2.不锈钢的抗腐蚀能力比纯铁强。
3.合金具有许多优良的物理、化学和机械性能,在许多方面不同于各成分金属,不是简单加合;但在化学性质上,一般认为合金体现的是各成分金属的化学性质。
4.并非所有的金属都能形成合金,两种金属形成合金,其前提是两种金属在同一温度范围内都能熔化,若一种金属的熔点高于另一金属的沸点,则二者不能形成合金。
学霸推荐1.合金的应用极大地促进了人类社会的发展。
下列不属于...合金的是A.狗头兽首铜像B.柔性显示屏C.流通硬币D.潜水器外壳(钛、铝等)2.下列说法正确的是A.金属元素在不同的化合物中化合价均相同B.所有合金都只含有金属元素C.可利用铝热反应冶炼单质镁D.镁合金的硬度和强度均高于纯镁3.下列说法不正确的是A.钢是铁合金,钢的含碳量低于生铁,性能优于生铁B.金属具有的物理通性是具有良好的延展性、导热性、导电性,并有银白色光泽C.符号Al既能表示铝元素,又能表示一个铝原子,还能表示铝单质D.焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是降低熔点4.将9.4克的铜铝合金,投入到足量的稀硫酸中充分反应后,共收集到标准状况下氢气6.72升,计算:(1)参加反应的H2SO4的物质的量;(2)合金中金属铜的质量。
