核外电子分层排布与原子结构模型
核外电子排布

3、核外电子排布的表示方法:
原子结构示意 :
• • • 小圈表示原子核; 圈内的“+”和数字表示原子核带正电和核内 质子数; 弧线表示电子层,弧线上的数字表示该层的电 子数。
一、核外电子排布
1、核外电子的分层排布 : 2、电子排布规律 :
3、核外电子排布的表示方法:
4、1~20号元素原子结构示意图: 5、原子核外电子排布的周期性变化:
1、核外电子的分层排布 :
离核远近 能量高低 电子层数 符号 1 K 2 L 3 M 近→远 高→低 4 N 5 O 6 P 7 Q
2、电子排布规律 :
3.有A、B两种元素,已知元素A的核电荷数为a, 且A3-与Bn+的电子排布完全相同,则元素B的核 电荷数为 ( ) A.a—n一3 B.a +n+33 4.由短周期两种元素形成化合物A2B3 ,A3+比 B2-少一个电子层,且A3+具有与Ne原子相同的 核外电子层结构,下列说法正确的是( )双选 A.A2B3是三氧化二铝 B.A3+与B2-最外层上的电子数相同 C.A是第2周期第ⅢA族的元素 D.B是第3周期第ⅥA族的元素
4、1~20号元素原子结构示意图:
5、原子核外电子排布的周期性变化:
• 同一周期,从左到右,最外层电子数由1 递增至8(第一周期,由1至2) ; • 同一主族,从上到下,电子层数递增。
• 1.A、B两原子,A原子L层比B原子M层少 3个电子,B原子L层电子数恰为A原子L层 电子数的2倍,则A、B分别是 ( ) A.硅和钠 B.硼和氮 C.碳和氯 D.碳和铝 • 2.某元素原子最外层电子数为次外层电子 数的3倍,则该元素原子核内质子数为( ) A.3 B.7 C.8 D.10
第1课时 原子核外电子的排布(24张)

(4)该微粒的还原性很弱,失去1个电子后变为原 子,原子的氧化性很强,这种微粒的符号是_____。
解析 (1)该微粒为中性微粒,即核电荷数等于核外 电子数,为18号元素氩。 (2)该微粒能使溴水褪色,即为还原性微粒,且出现 浑浊,即有难溶性的非金属单质。符合条件的为硫 元素。 (3)该微粒得到一个电子可变成原子,故为19号元素 钾。 (4)该微粒失去一个电子可变成原子,故为17号元素 氯。
答案 失去。
能量较高的电子排布在离原子核较远的
电子层上,原子核对电子的吸引能力弱,故易
4.核外电子的排布规律 分析下表填写下列空白: 稀有气体元素原子的核外电子排布 各电子层的电子数 K
2He(氦) 10Ne(氖) 18Ar(氩) 36Kr(氪) 54Xe(氙) 86Rn(氡)
L 8 8 8 8 8
答案
原子结构示意图中各电子层上的电子
数目必须遵守核外电子的排布规律,该结构 示意图中最外层电子数为9,不符合排布规律。
4.分析离子结构示意图,概括离子的核电荷数 与核外电子数的关系。 答案 阳离子核外电子数小于核电荷数,阴离 子核外电子数大于核电荷数,其差值均为它们 所带的电荷数。
5.原子形成阳离子或阴离子后,其电子层结构 发生了哪些变化? 答案 原子形成阳离子后,要减少一个电子层, 形成阴离子后电子层数不变,但最外层电子数增 多,它们都达到了稳定结构。
答案
(1)Ar
(2)S2-
(3)K+
(4)Cl-
8.A、B、C三种元素,其中有一种金属元素,A、 B原子的电子层数相同,B、C原子的最外层电子 数相同。又知这三种元素原子的最外层电子数之 和为17,原子核中的质子数之和为31。试通过计 算确定这三种元素的名称。 解析 设元素A、B原子最外层电子数分别为y和x,
原子结构示意图

(2)、最外层最多容纳电子数--8---个-------。 (K层为最外层时,最多容纳电子数---2---个-----) (3)、次外层最多容纳电子数-----1---8--个--------(4)、倒数第三层最多容纳电子数--3---2--个-------
②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K层为最外 层时不能超过2个)
次外层最多只能容纳18个电子(K层为次外 层时不能超过2个
倒数第三层最多只能容纳32个电子
注意:多条规律必须同时兼顾。
3、核外电子排布的一般规律:
(1)、第n层最多容纳电子数(n指的是电子层数)
2n 个 --------------2-----------。1→ 2 → 3→ 4→ 5 → 6
+11 ② ⑧ ⑧ ⑧② +17
+11 ② ⑧
⑧ ⑧② +17
结论
1、活泼金属元素易失电子变为带正电荷的 阳离子
Mg 失 2e-
Mg2+(带2个单位正电荷)
2、活泼非金属元素易得电子变为带负电 荷的阴离子
O 得 2e-
O2- (带2个单位负电荷)
Mg
+12
Mg2+
+12
O2-
O
+8
+8
结论:
原子最外层的电子数小于8个时,在 化学反应中总是得到或失去电子而达到 最外层8电子的稳定结构。
1原子结构模型的发展历史 2原子核外电子排布 3原子结构示意图 4化学反应中原子核外电子得失规律
一尺之捶,日取其半,万世不竭。
原子核外电子的排布

2.根据下列各组元素的原子结构示意图分析,
具有相似化学性质的一组是( A )
由于金属、非金属的原子最外层电 子都没有达到相对稳定结构,在化学反 应中容易得、失电子,从而达到相对 稳定结构。那么,得失电子的结果是怎 样的呢?形成的粒子又是什么呢?
二. 离子
钠和氯的原子结构示意图
+11 2 8 1
3.非金属元素的原子最外层电子数一般 ≥ 4 ,在化学反 应中,容易 得到 电子,化学性质 不稳定 。
元素的化学性质主要由原子的 最外层电子数 决定的。
【练习2】1.下列原子的结构示意图中,化学性
质最稳定的是 B ,易失去电子的是 C , 易得到电子的是 AD,属于金属元素的是_C__, 属于非金属元素的是__A__D__,属于稀有气体元 素的是____B_____。
练习
某原子的原子结构示意图为
,该原
子的核电荷数为 ,核外有 个电子层,第
二层上有 个电子,最外电子层上有 个电
子。
【亲手尝试】根据氧原子的结构图画出结构示意图
第一层(2个) 第二层(6个)
(最外层)
+8 2 6
3. 核外电子的排布规律:
⑴第一层最多容纳__2_个电子,第二层最多容纳__8_个电子。 (2)最外层不超过 8 个电子,只有1层的不超过__2_个电子。 ⑶电子先排满第__1_层,再排第__2_层,排满第__2_层,再 排第_3__层。(按照能量由低到高的顺序分层排布)
【讨论与分析】金属元素与非金属元素原子的最 外层电子数分别有什么特点?在化学反应中,为 了达到相对稳定结构,它们得失电子的情况是怎 么的?请举例说明。
最外层电子数 ﹤4
易失电子 不稳定
最外层电子 ≥ 4
原子结构和核外电子排布

考纲解读1.认识原子核的结构,懂得质量数和的含义,掌握构成原子的微粒间的关系,了解元素、核素、同位素的涵义。
2.认识原子核外电子的运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.3.了解多电子原子中核外电子分层排布遵循的原理,掌握1~36号元素的电子排布(原子结构示意图、电子排布式)。
4.了解原子结构模型的发展历史了解原子“基态”、“激发态”的概念。
知识再现一.原子的构成1.原子的构成原子中微粒的作用2.原子中有关量的关系:电性关系质子数= 核电荷数= 核外电子数= 原子序数质量关系质量数(A)= 质子数(Z) + 中子数(N)二.同位素1.概念2.同位素的特点同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。
3.与同素异形体、同分异构体、同系物的比较例题1、据报道,月球上有大量3He存在,以下关于3He的说法正确的是A、是4He的同分异构体B、比4He多一个中子C、是4He的同位素D、比4He少一个质子2、已知自然界氢的同位素16O、17O、18O,氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有 A、3种 B、6种 C、9种 D、12种3、1999年曾报道合成和分离子含高能量的正离子N5+的化合物N5AsF6,下列叙述中错误的是A、N5+共有34个核外电子B、N5+中氮一氮原子间以共有电子对结合C、化合物中N5AsF6中As化合价为-1D、化合物N5A S F6中F化合价为-1三、核外电子的运动1.核外电子的运动特征核外电子质量,运动速率,运动的空间,确定的轨道。
2.电子云能级(原子轨道)电子云的轮廓图称之为原子轨道.四.核外电子的排布1.核外电子的排布能层(电子层)n 符号K L M N O P Q能级(原子轨道)每一能层的电子的能量也可能不同,又将能层分成相应的能级。
第n能层中,就有个能级,分别为ns 但不一定每一个能级中都有电子。
能级数=序数。
核外电子分层排布示意图

(1)x表示该元素原子核内的质子,数 该粒子有 3 个电 子层,y与粒子的 化学性质 关系非常密切。
(2)当x-y=10,该粒子为 原子 别)。
(填类
(3)y=8时,该粒子带有2个单位的负电荷,该
粒子的符号为 S2-
。
(4)当y=1的中性原子与y=7的中性原子化合 时,形成的化合物属于 离子 化合物。
非金属元 一般多于等于 易得电子,形成 不稳定
素
4个
阴离子
决定元素化学性质的是:最外层电子数
钠+氯气
点燃
氯化钠
钠与氯气反应形成氯化钠
二、离子的形成
1、离子:带电的原子或原子团 阳离子
离子 阴离子
离子符号:
2、离子化合物:由阴阳离子相互化合而形成的 化合物,如NaCl
离子与原子的区别和联系
粒子种类
9.某原子结构示意图可表示为
,回答下列问题:
(1)结构示意图中,x表示质子数; y表示 最外层电子。数
(2)当x=16时,y= 6 ; 当y=8时,x= 18 。
10.将H、Li、Na、Mg、Al排成下图形式,根据空行的原子 结构可以得出如下规律:
(1)纵行中,三种元素的原子在结构上的相同点
是最外层电子数相同,不同点是 电子层数不同
最外层最多容纳8个电子
原子核
原子结构示意图
质子数(核电荷数)
要点:
圆圈标核电,
正号写在前,
电子数
弧线呈扇面, 数字一条线。
电子层
3、元素性质与元素最外层电子数的关系
元素分类 最外层电子数 得失电子倾向 化学性质
稀有气体 8个(He为2个) 不易得失、相对 稳定
元素
稳定
电子的核外排布

≥4个
稳定(不得失)
在化学反应中 易失去电子
在化学反应中 易得到电子
总结:元素的性质,特别是化学性质,跟它的原
子的 最外层电子数
关系密切。
练习:
下面的结构示意图正确的是:( )
+3 2 1 A
+3 3 B
+11 2 8 1 +11 2 9
C
D
练习:
画出下列原子的结构示意图:
7N
12Mg
17Cl
部分金属元素的原子结构示意图
3、下列具有相似化学性质的元素组别
是: C、D
。
A.
B.
C.
D.
同学们有没有想过电子是 怎样围绕原子核做高速运
动的呢?
三、原子核外电子的不同运动区域
多电子原子核外电子的分层运动状况
核外电子分层排布
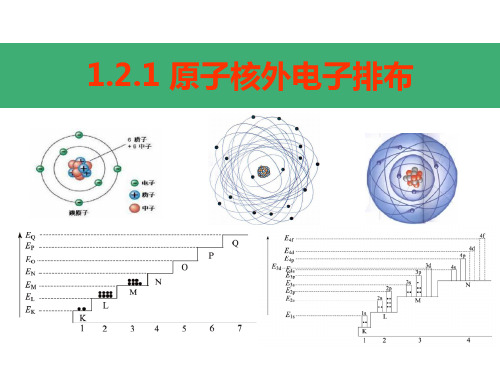
电子按能量高低在核外分层排布。 1234567 K LMNOPQ
由内到外,能量逐渐升高
核外电子的分层排布(又叫分层运动)
电子层符号 K L M N O P Q
电子层序数(n) 1 2 3 4 5 6 7
电子离核的距离 近
远
电子具有的能量 低
高
2、原子结构示意图
如: Na
核内质子数
电子层
原子核
每个电子层上的电子数
称有气体元素原子电子层排布
各电子层的电子数
核电 元素名 元素
荷数 称 符号 K
L
M
N
O
P
最外层电子 数
2
氦
He
2
2
10
氖
Ne
2
8
8
18
氩
Ar
1.2.1 原子核外电子排布
元素的金属性、非金属性。
二、元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性 的变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外 电子排布周期性变化的必然结果。
随堂练习:
1、R元素形成的化合物RH3,其中R的化合价是其 最低负化合价,则R元素最高价氧化物的化学式是:
111
88
77
N(氮) O(氧) F(氟)
70
66
64
Ne(氖) —
11~17 号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷)
原子半
径/pm
186
160
143
117
110
S(硫) 104
Cl(氯) Ar(氩)
99
—
提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。 (2)表中数据的单位是pm(皮米),1pm=10-12m。
1.2.1 原子核外电子排布
一、原子核外电子排布 原子结构示意图
一、原子核外电子排布
各电子层排布的电子数
电子层(从里到外为K、L、M······层) 核电荷数
原子核
一、原子核外电子排布
1、原子核外电子排布
(1)核外电子按能量高低分层排布(运动)
电子层: 根据电子的能量差异和通常运动区域离核
(能层)
〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子 半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表 示原子半径,根据数据表作图,表示出3~9、11~17的元素的 原子最外层电子数与原子半径的函数图像。
3~9号 元素
原子半 径/pm
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
回顾分子原子 小 动
间
二、定义
分子是保持由分子构成的物质的 化学性质的最小粒子 原子是化学变化中的最小粒子
三、联系和区别
分子
分裂 构成
原子
物质
原子的结构
原子还可以再分吗?
原子究竟是什么样子呢?
今天,咱们就来畅游原子的世界!
原子的体积很小
科学史话——原子结构的探索历程
英国化学家道尔顿
α粒子束未 发生偏转
2.原子核在原子中心,带正电、体积小、质量大,能够改变α粒子运
核外电子是如何排布的呢?
排布特点1:电子在核外是分层排布的 排布特点2: 原子的第一层最多排2个电子, 第二层最多排8个电子,最外层电子数最多 不超过8个 排布特点3:元素化学性质与原子最外层电子 数相关
【感悟与收获】 这节课我们畅游了原子的世界,谈谈你的感悟和
原子中各种粒子带电情况如何? 什么叫核电荷数?它与质子数有什么关系?
+ + +
【分组讨论】 观察表3-1中不同原子中各微粒的数目,
你能找出哪些规律?
质子数 1 6 中子数 0 6 原子种类 氢 碳 核外电子数 1 6
氧
钠 氯
8
11 17
8
12 18
8
11 17
原子中:核电荷数==质子数==核外电子数 质子数不一定等于中子数。 (氢原子没有中子) 不同原子,质子数不同。 整个原子不显电性。 原子中某些粒子是带电的,以氧原子为例,说明为什么 原子不显电性?
α粒子:带正电, 质量比电子大得 多,高速轰击金箔。
实验现象:
1.大多数α粒子能穿过金箔而不改变原来的方向。 2.一小部分改变了原来的方向,甚至有极少数的α粒 子被反弹了回来。
α粒子束发生偏转
实验解释:
1.电子在原子内相对很大的空间运动,质量很小,对α粒子运动几 乎不产生影响。
动方向。
α 粒 子 束
数值大小 单位
练习:附录Ⅱ中查找出氮、氯、钠、铁的相对原子质量 (取4位有效数字)
原子 种类 氢 碳 钠 镁
原子核 质子数 中子数 1 6 11 12 0 6 12 12
相对原子质 核外电子 量近似整数 数
1 6 11 12
1 12 16 23 24 56
相对原子质量 ≈8 质子数+中子数 氧 8 8
1 一个碳原子的实际质量的 12
1个原子 氢原子
真实质量Kg 1.67×10
- 27
1 12
碳原子 1.993×10 氧原子 2.657×10
- 26 - 26
16 56
铁原子
9. 2 8 8 x 10
-26
原子的质量与相对原子质量的比较 原子的质量 相对原子质量
含义 一个原子的真实质量 小 kg 相对质量(比值) 大 单位为1
【小知识】物质都有趋向于稳定状态的特点 (如:水往低处流;树上的苹果往下掉)
原子也不例外,也有趋向于稳定结构的特点。 那么,什么样的结构才是原子的稳定结构呢?
氦(He)
氖(Ne)
氩(Ar)
【稳定结构】像稀有气体元素原子这样的结构叫8电 子稳定结构。 若只有一个电子层,则2电子也是稳 定结构(如: He)。
Na Cl
Na+
Cl-
NaCl
化学反应中离子的形成
钠原子Na 失 电 子
+11 2 8 +11 2 8 1
钠 + 氯气 Na Cl2
+17 2 8 7
点燃
氯化钠 NaCl 氯原子Cl
得 电 子
+17 2 8 8
钠离子Na+
氯离子Cl-
Na+Cl-
氯化钠
Na Cl-
+
离子的概念与类别
1.离子的概念:带电荷的原子(或原子团) 叫做离子。 2.阳离子:带正电荷的原子叫做阳离子。 如: H+ 、Na+、 Mg2+ 、Al3+ 阴离子:带负电荷的原子叫做阴离子。 如: O2- 、S2-、 F- 、Cl-、
钠原子的结构 (11个电子)
原子核外电子的排布
1. 核外电子的分层排布
核外电子分层排布示意图 核外电子分层排布规律
电子层:
离 核:
1 2 3 4 5 6 7
近 低 远 高
能 量:
能量低的在离核近的区域运动, 能量高的在离核远的区域运动。
第一层(2个)
第二层(8个)
第三层(1个) (最外层)
钠原子的结构 (11个电子)
实心球模型
1803年,道尔顿提出:构成物质的最小 粒子是原子,原子是不可再分的实心球体。
科学史话——原子结构的探索历程
英国物理学家 汤姆生
枣糕模型
1897年,汤姆生在原子内部发现了电子, 人们终于抛弃了原子不可分割的陈旧观念。
科学史话——原子结构的探索历程
英国科学家 有核模型 卢瑟福 1911年,卢瑟福通过精密的实验证明在原子 中心有一个极小的核,电子绕核做高速旋转。
三、联系和区别
分子
分裂 构成
原子
物质
下列关于分子原子的叙述是否正确
分子原子都是构成物质的粒子 分子大,原子小 分子之间没有间隔,原子之间没有
分子能保持物质的化学性质,原子不能
在化学变化中,分子可以再分,原子不能
再分 分子原子都在不停的运动
小结:
质子(+)
原子核(+) 原子
3.离子所带电荷数由该元素原子的最外层电 子数决定。
4.离子的表示方法:
离子符号
Mg2+
离子符号
书写:电荷数标注在 离子结构示意图 元素符号的右上角 (先写数字;后写电 +12 2 8 性“+”“-”符号)。
5、离子符号的意义:
表示一个镁离子带2个单位的正电荷 2+ Mg 2 一个镁离子 表示2个镁离子(离子符号前面的系数只表 示离子的个数。)
原子结构示意图
圆圈内+号表示原子核带正电荷 弧线上的数字表示 该层的电子数 +11 2 8 1
圆圈表示原子核
弧线表示电子层
圈里的数字表示核内质子数
备注:(1)从图中可以看出质子数等于各层电子数之和 (2)该图无法看出中子数
部分金属元素的原子结构示意图
Na: Mg:
Al:
Li:
部分非金属元素的原子结构示意图
离子与原子的区别和联系
原子 离子
阳离子 阴离子
结构
质子数=电子数
质子数>电子数 质子数<电子数
电性 联系
不带电
得电子
带正电
原子
失电子
带负电
得电子
阳离子 子
阴离
失电子
3. 1911年,著名物理学家卢瑟福等人用一束 带正电的、质量比电子大的多的高速α粒子轰击金 箔。请用已学知识分析解释以下实验现象。
2、某原子结构示意图如右, 16 ,核 该原子的核电荷数为_____ 3 个电子层,第二层 外有______ +16 2 8 6 8 个电子,最外层上 上有______ 有______ 6 个电子。该原子在化 学变化中容易______ 得到 (“得到” 或“失去”) 2 个电子达到 稳定结构。
氯化钠的形成
中子
核外电子(-)
相对原子质量= 一个原子的实际质量(千克) 一种碳-12原子质量的1/12(千克)
原子中:质子数=核电荷数=核外电子数 相对原子质量≈质子数+中子数
学习与探究二 核外电子是怎样运动的?
观看原子的核外电子运动的模拟动画。
氢原子的结构 (1个电子)
行星绕太阳运动
第一层
第二层 第三层
8
16
11
11 26
23 56
26
1 、科学家发现一种新的元素,它的 原子核内有111个质子,161个中子,该 元素原子的核外电子数是( A ), 相对原子质量是 ( D )。 A.111 B.161 C.50 D.272
一、性质
回顾分子原子 小 动
间
二、定义
分子是保持由分子构成的物质的 化学性质的最小粒子 原子是化学变化中的最小粒子
氦原子 +7 2 5 +8 2 6 +9 2 7 +10 2 8
氮原子 氧原子 氟原子 氖原子
+11 2 81 +12 2 8 2 +13 2 8 3 +14 2 8 4 +15 2 8 5 +16 2 8 6 +17 28 7 +18 2 8 8 钠原子 镁原子 铝原子 硅原子 磷原子 硫原子 氯原子 氩原子
练习与应用
1. 填写下表中的空格。
原子种类 核电荷数 质子数 氧 硫 8 16 12 中子数 核外电子数 8 16
8ห้องสมุดไป่ตู้
16 12
8
16
镁
12
12
1个原子 氢原子
真实质量Kg
1.67×10 - 27 0.00000000000000000000000000167 Kg 碳原子 1.993×10 氧原子 2.657×10 铁原子 9. 2 8 8 x 10
英国物理学家 汤姆生 英国物理学家 查德维克 英国科学家 卢瑟福
英国化学家 道尔顿
1803年 实心球模型 1897年 枣糕模型 1918-1932年 发现质子中子 1911年 行星式有核模型
科学史话——原子结构的探索历程
+ ++
学习探究一 原子是怎样构成的?
【智慧阅读】阅读书并讨论:
原子核由哪几种粒子构成?
各元素原子最外层电子数目的特点:
元素 最外层电子 数 稀有气体 8 元素 (He为2) 金 属 元 素 一 般﹤ 4 非金属元 素 一 般﹥4 原子结构 得失电 化学 子趋势 性 质 稳定 稳定
