板种细胞问题(不均匀)
高考生物二轮复习专题专练(29) 微生物的选择培养、鉴定和计数

高考生物二轮复习专题专练(29)微生物的选择培养、鉴定和计数从“高度”上研究高考[典例](2022·全国甲卷)某同学从被石油污染的土壤中分离得到A和B两株可以降解石油的细菌,在此基础上采用平板培养法比较二者降解石油的能力,并分析两个菌株的其他生理功能。
实验所用的培养基成分如下。
培养基Ⅰ:K2HPO4,MgSO4,NH4NO3,石油。
培养基Ⅱ:K2HPO4,MgSO4,石油。
操作步骤:①将A、B菌株分别接种在两瓶液体培养基Ⅰ中培养,得到A、B菌液;②液体培养基Ⅰ、Ⅱ中添加琼脂,分别制成平板Ⅰ、Ⅱ,并按图中所示在平板上打甲、乙两孔。
回答下列问题。
(1)实验所用培养基中作为碳源的成分是______。
培养基中NH4NO3的作用是为菌株的生长提供氮源,氮源在菌体内可以参与合成____________(答出2种即可)等生物大分子。
(2)步骤①中,在资源和空间不受限制的阶段,若最初接种N0个A细菌,繁殖n代后细菌的数量是______________。
(3)为了比较A、B降解石油的能力,某同学利用步骤②所得到的平板Ⅰ、Ⅱ进行实验,结果如表所示(“+”表示有透明圈,“+”越多表示透明圈越大,“-”表示无透明圈),推测该同学的实验思路是_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
菌株透明圈大小平板Ⅱ平板ⅠA+++++B++-(4)现有一贫氮且被石油污染的土壤,根据上表所示实验结果,治理石油污染应选用的菌株是________,理由是________________________________________________________。
2024届高考一轮复习生物教案(新教材人教版鲁湘辽):细胞的增殖

第1课时 细胞的增殖 课标要求 描述细胞通过不同的方式进行分裂,其中有丝分裂保证了遗传信息在亲代和子代细胞中的一致性。
考点一 细胞增殖和细胞周期1.细胞增殖(1)概念:细胞通过细胞分裂增加细胞数量的过程。
(2)意义:是重要的细胞生命活动,是生物体生长、发育、繁殖、遗传的基础。
①单细胞生物:通过细胞增殖而繁衍。
②多细胞生物:从受精卵开始,要经过细胞增殖和分化逐渐发育为成体。
生物体内不断地有细胞衰老、死亡,需要通过细胞增殖加以补充。
(3)过程:包括物质准备和细胞分裂两个相连续的过程。
2.细胞周期 (1)前提条件:连续分裂的细胞。
(2)时间⎩⎪⎨⎪⎧起点:一次分裂完成时终点:下一次分裂完成时 (3)图示含义(4)分裂间期与分裂期的联系:分裂间期为分裂期进行活跃的物质准备,完成DNA 分子的复制和有关蛋白质的合成,同时细胞有适度的生长。
(5)特点:不同种类的细胞,细胞周期不同,分裂间期与分裂期所占的比例也不同。
源于必修1 P115“思维训练”:(1)细胞越大,细胞的表面积与体积的比值越小。
(2)从物质运输的效率看,细胞不能太大的原因是细胞越大,表面积与体积的比值越小,物质运输的效率就越低。
(3)细胞体积是不是越小越好?并说明原因。
提示不是,因为细胞中众多的必需物质和细胞器,都需要一定的容纳空间。
细胞周期可分为分裂间期和分裂期(M期),根据DNA合成情况,分裂间期又分为G1期、S 期和G2期。
为了保证细胞周期的正常运转,细胞自身存在着一系列监控系统(检验点),对细胞周期的过程是否发生异常加以检测,部分检验点如下图所示。
只有当相应的过程正常完成,细胞周期才能进入下一个阶段运行。
为研究某一时期细胞的代谢、增殖或凋亡,常采取一些方法使细胞群体处于细胞周期的同一时期,这就是细胞同步化技术。
(1)与G1期细胞相比,G2期细胞中染色体及核DNA数量的变化是染色体数目不变,核DNA 数目加倍。
(2)以下是能够实现动物细胞周期同步化的三种方法。
细胞传代、铺板 、冻存、复苏等细胞培养相关操作步骤和注意事项

细胞传代的步骤(贴壁细胞为例)
首先,镜下观察细胞密度,90%以上即可传代培养(为了细胞的稳定,距离上 一次传代至少间隔一天。)。
准备工作:无菌枪头、培养瓶、离心管、废液桶等所需物品,培养基、血清、 PBS、胰酶等试剂类,可根据情况,提前放入生物安全柜,进行紫外灭菌;
细胞传代的步骤(贴壁细胞为例)
培养液量 (ml)
0.1 0.2 0.5 1 2 2 5 10 5 15-30
100%细胞量(105) (约) 1 2.5 5 10 25 20 52 137 50 200
培养板需要加入的细胞量
细胞培养板中加入细胞的数量,需要考虑一下几点: 1. 常规实验的设计:转染siRNA(约30%-50%),转染质粒(约70%-
结合镜下观察,调整浓度。 ❖2. 计数细胞:参考前文中各种规格中100%满时细胞的大概数量,再根据实验的
要求,计算加入的细胞的数量。(使用计数板)
细胞计数板的使用
细胞计数板
0.1ul
干净的盖玻片
细胞计数板的使用
10-20 ul 细胞悬液 注意: 避免有气泡!
数上不数下,数左不数右
计算公式: n/4 x104 (个/ml)
4.其他:轻轻移动他人的细胞,轻轻关闭培养箱的门等
细胞冻存
准备工作:FBS,完全培养基,DMSO,或无血清冻存液,冻存管,冻存盒。 常规的细胞传代步骤,至细胞消化后离心完毕,根据细胞的量以及需要冻存的管
数配制冻存液; 冻存液: 10%DMSO+90%FBS/完全培养基(A),或者无血清冻存液(B)。 冻存程序: A : 1. 使用冻存盒:可直接放入-80℃冰箱,第二天转移入液氮罐中。
把细胞转移到生物安全柜中,吸去培养基,加入无菌PBS(只要没过即 可),轻轻摇动清洗细胞,尽量弃尽PBS。
PCR常见问题分析及对策

PCR常见问题分析及对策PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性) 问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低现非特异条带而另一来源的酶则不出现,酶量过多有时也会出现非特异性扩增。
其对策有:①必要时重新设计引物。
②减低酶量或调换另一来源的酶。
③降低引物量,适当增加模板量,减少循环次数。
④适当提高退火温度或采用二温度点法(93℃变性,65℃左右退火与延伸)。
出现片状拖带或涂抹带PCR扩增有时出现涂抹带或片状带或地毯样带。
其原因往往由于酶量过多或酶的质量差,dNTP浓度过高,Mg2+浓度过高,退火温度过低,循环次数过多引起。
其对策有:①减少酶量,或调换另一来源的酶。
②减少dNTP的浓度。
③适当降低Mg2+浓度。
④增加模板量,减少循环次数。
克隆PCR产物的最优条件是什么?最佳插入片段:载体比需实验确定。
1:1(插入片段:载体)常为最佳比,摩尔数比1:8或8:1也行。
应测定比值范围。
连接用5ul 2X连接液, 50ng质粒DNA,1Weiss单位的T4连接酶,插入片段共10ul。
室温保温1小时,或4oC过夜。
在这2种温度下,缺T-凸出端的载体会自连,产生蓝斑。
室温保温1小时能满足大多数克隆要求,为提高连接效率,需4oC过夜。
PCR产物是否需要用凝胶纯化?如凝胶分析扩增产物只有一条带,不需要用凝胶纯化。
如可见其他杂带,可能是积累了大量引物的二聚体。
基础的细胞实验
基础的细胞实验1.体外培养细胞一代生存期➢分为游离期、贴壁期、潜伏期、对数生长期、停止期(平台期)。
➢对数生长期:细胞数随时间变化成倍增长,活力最佳,细胞数量呈指数增长,细胞群体均一。
最适合进行实验研究。
➢细胞摇匀的经验:孔越小,越要好好摇。
种的时候可以有意识的分散种细胞,而不是直接一个小区域种下去。
96孔板种细胞轻点打进孔里,打的太猛细胞容易聚集在边缘。
六孔板手动8字晃匀效果比较好。
种细胞时晃动细胞很重要,但应避免在桌子上推着前后左右晃。
在手中两个方向的八字晃会更稳更好。
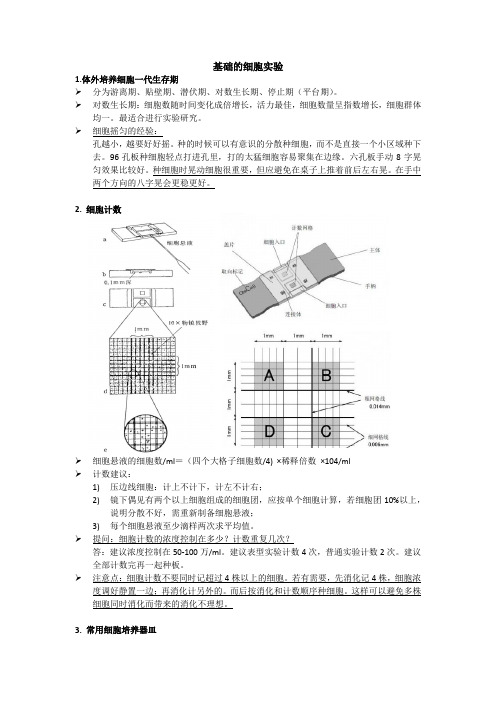
2. 细胞计数➢细胞悬液的细胞数/ml=(四个大格子细胞数/4) ×稀释倍数×104/ml➢计数建议:1)压边线细胞:计上不计下,计左不计右;2)镜下偶见有两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团10%以上,说明分散不好,需重新制备细胞悬液;3)每个细胞悬液至少滴样两次求平均值。
➢提问:细胞计数的浓度控制在多少?计数重复几次?答:建议浓度控制在50-100万/ml。
建议表型实验计数4次,普通实验计数2次。
建议全部计数完再一起种板。
➢注意点:细胞计数不要同时记超过4株以上的细胞。
若有需要,先消化记4株,细胞浓度调好静置一边;再消化计另外的。
而后按消化和计数顺序种细胞。
这样可以避免多株细胞同时消化而带来的消化不理想。
3. 常用细胞培养器皿4. 液氮是低温制品,在使用过程中要防止冻伤。
在液氮中操作及存取冷冻物品时速度要快,要注意轻拿轻放,以免内容物解冻,造成不必要的损失。
5. 细胞传代➢消化温度:室温或37℃。
➢消化时间:不超过10 min,也不可太短(须形成单细胞悬液)。
➢注意点:1)防止细胞成片滑落(4℃消化,延长消化时间较易获得单细胞悬液);2)轻柔吹打,防止机械损伤;3)离心时不超过300 g (1000 rpm),实验室目前离心所用转速为800rpm;4)尽量避免刮伤培养瓶细胞贴附面,否则影响观察且细胞贴壁不均匀;5)及时换液和传代,不可拖延,避免细胞过爆后细胞状态不好。
细胞计数板计数原理

细胞计数板计数原理什么是细胞计数板细胞计数板,也称为海姆斯希计数板(Hemocytometer),是一种常用的实验室工具,用于计数和测量细胞数量。
它通常由玻璃制成,具有一个规定大小的网格板和一个盖片,网格板上刻有成规定尺寸的小方格。
通过在细胞计数板上放置细胞样品,然后通过显微镜观察和计数来确定细胞的浓度和数量。
细胞计数板的主要原理细胞计数板的计数原理基于以下几个方面:1. 成浓缩在使用细胞计数板之前,通常需要对细胞样品进行合适的稀释。
这是为了使细胞浓度在可观察范围内,并且避免细胞过于密集而无法准确计数。
通常使用缓冲溶液或染色剂来稀释样品。
2. 通过计数网格来估算细胞浓度细胞计数板的上方刻有一个特定尺寸的计数网格,通常是一个9或16个小方格组成的大方格。
每个小方格都再次划分成16个更小的方格。
通过显微镜观察,将视野对准计数板上的网格,并记录每个小方格中的细胞数量。
3. 统计与浓度计算在细胞计数过程中,对细胞数量进行计数,并记录每个小方格中的细胞数。
然后,将每个小方格中的细胞数加总,根据总数以及某个特定体积的稀释液,可以推算出细胞的浓度。
细胞计数板的使用步骤下面是一般情况下使用细胞计数板的步骤:1.准备样品稀释液:根据细胞样品的浓度,将其使用合适的溶液(比如缓冲溶液)稀释到合适的浓度,使细胞数在500至5000个之间。
2.取一小部分稀释后的细胞样品并将其放置在细胞计数板的装载槽中。
注意不要过量装载以确保细胞在每个小方格中均匀分布。
3.将细胞计数板覆盖盖片,确保细胞在网格上均匀分散。
4.使用显微镜将细胞计数板放置在平台上,并选择适当的放大倍数来观察细胞。
5.计数过程:从一个固定的起点开始,观察每个小方格并记录其中的细胞数。
按照一定的顺序,逐个计算每个小方格中的细胞数并记录。
6.统计计数:将每个小方格中的细胞数加总,并将总数除以小方格的数量得到每个小方格的平均细胞数。
7.计算细胞浓度:通过将每个小方格的平均细胞数乘以稀释液的体积来计算细胞的浓度。
细胞计数方法------细胞计数板法

细胞计数方法------细胞计数板法实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中的细胞的数目,即可换算出每毫升细胞悬液中细胞的细胞数目。
具体操作:1. 将计数板及盖片擦拭干净,并将盖片盖在计数板。
2. 将细胞悬液吸出少许,滴加在盖片边缘,使悬液充满盖片和计数板之间,静置3min,注意盖片下不要有气泡,也不能让悬液流入旁边槽中。
3. 计算板四大格细胞总数,压线细胞只计左侧和上方的。
然后按公式计算:细胞数/mL=四大格细胞总数/4×104个/ml(注:当细胞很多时,可在四个格中选一定数目较平均的小格,由于每大格中有16个小格,然后计左侧和上方的细胞数,求出每小格的细胞数,取平均值m,m ×16即每个格的平均值。
所以,细胞密度=m×16×104个/ml)说明:公式中除以4,因为计数了4个大格的细胞数。
公式中乘以104因为计数板中每一个大格的体积为:1.0mm(长)×1.0mm(宽)×0.1mm(高)=0.1mm3而 1ml=1000ul=1000mm3(注意:镜下偶见有两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团10%以上,说明分散不好,需重新制备细胞悬液。
)================================================细胞计数板的使用一、血球计数板-基本构造血球计数板是一块特制的厚型载玻片,载玻片上有四个槽构成三个平台。
中间的平台较宽,其中间又被一短横槽分隔成两半,每个半边上面各刻有一小方格网,每个方格网共分九个大格,中央的一大格作为计数用,称为计数区。
计数区的刻度有两种:一种是计数区分为16个大方格(大方格用三线隔开),而每个大方格又分成25个小方格;另一种是一个计数区分成25个大方格(大方格之间用双线分开),而每个大方格又分成16个小方格。
但是不管计数区是哪一种构造,它们都有一个共同特点,即计数区都由400个小方格组成。
CCK8的实验步骤、实验分组及检测方法

CCK8的实验步骤、实验分组及检测⽅法毕业季就像在打怪,⼀个不⼩⼼,就会犯错。
就像最近需要提供可以打论⽂制作费的银⾏卡,我明明在备忘录中备注了,还设置了提醒,但是还是忘记了。
今天研究⽣处⽼师找我才想起来。
刚哥说是因为我已经很久没怎么进⾷碳⽔化合物,所以神经紊乱,记忆减退,最主要是会忘事、变笨。
有⽂献报道称长期⽣酮饮⾷会造成神经系统的紊乱,出现失眠、记忆减退、精神衰弱等神经精神症状。
瞬间觉得这个猜测有⼀定的道理,今天早上就开⼼的吃了⼀根⽟⽶。
结果可能是碳⽔戒断现象,吃了可能2个⼩时不到,就困得不⾏,特别想睡觉。
哎,到底是吃还是不吃呢。
后来想通了,既然是类似戒断现象,那就慢慢加量,明天早上吃1/3根。
先给⼤家分享⼀点我这周的⼩⼩体会和收获吧。
我有个师妹,⼈⼩⼩个,但能量还挺⼤的。
在我未正式和她有接触之前,她属于那种懵懵懂懂的⼩⼥⽣,也不是特别清楚⾃⼰在做什么,但有个很⼤的优点,很⼼细,另外执⾏能⼒也还⾏。
在我们成为了伙伴,⼀起⼯作的这⼤半年中,我们⼀起扩了病毒,⼀起养了细胞,⼀起拍了照,⼀起认识了很多新的东西。
她的改变⾮常⼤,实验越做越好,知道去问为什么,知道查询相关⽂献。
我也越来越放⼼她单独做实验。
最近,我发现她有个特别⽜逼的技能,就是可以⽤把肺组织切⽚切得⾮常漂亮,有层次感,可以切到肺上⽪细胞的纵切⾯,可以切到⽓管的纵切⾯和横切⾯,⽽且切得好的概率越来越⼤,什么都不多说,看下图1,2(这还不是最好的,因为我没有那部分数据)。
我问过她,有没有什么诀窍,她也是糊⾥糊涂的。
不过从现在开始,她已经是个实验有⼼⼈,开始注意在每⼀次⽯蜡切⽚的标本脱⽔、固定、切⽚的每⼀个步骤,做好了记录。
希望在不久的将来她可以写个帖⼦跟⼤家分享⽯蜡切⽚的⼿法。
其实我跟很多⼈都讲过我做实验的经验教训,她是⽐较能听进去的那⼀类。
她现在都可以和我⼀起讨论课题了,我甚是欣慰。
我记得我得硕⼠⽼板在我最开始做实验的时候,跟我说过,在我们起步⽐较晚的时候,最开始都是不段模仿、重复,最后才能赶上,然后才有创新,才有超越。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
细胞不均匀的问题原因:1.培养液量少,由于瓶体内液体有向边缘吸的特性,所以造成中间低洼,细胞容易聚集,建议多加液体2.接种后不要摇晃,传统的思想认为摇一摇能使细胞均匀,但是事实上在摇晃的时候由于剪应力等多种因素的影响,细胞反而分布不均。
解决方案:1)接种到培养瓶的细胞,轻轻地让细胞悬液流遍整个瓶底;2)接种到培养皿或者培养板的细胞,用枪头对准中央加,让细胞悬液自行流遍整个孔,若有少量区域未能覆盖到细胞悬液,可用枪头轻轻牵引悬液,千万不要摇。
细胞悬液铺满后,不宜立刻放入孵箱中,我一般静置>15min,这样接种的细胞很均匀。
3)培养皿划“十”字交叉轻轻混匀(力度不易太大,否则剪切力损伤细胞),重复一次。
轻轻放入孵箱即可。
(1)平底和圆底(U型和V型)培养板的区别和选择:贴壁细胞一般用平底培养板。
悬浮型细胞的培养一般用V型。
U型培养板亦多用于培养悬浮型细胞。
V型培养板有时用做免疫学血凝集的实验。
(2)细胞培养常见问题与解答问:我看到培养板有4、6、12、24、48、96孔几种规格,但不知道到底什么实验用哪种规格。
答:要根据你具体的实验要求,流式一般用6孔,MTT一般用96孔,细胞爬片一般用24孔等,要具体根据你实验来定。
问:我想测吸光度用酶标仪,用多孔细胞培养板行吗?请问酶标板多孔细胞培养板有什么区别?答:用多孔细胞培养板测吸光度肯定可以拉,我们经常用它来做样品的蛋白定量和MTT检测。
区别:酶标板一般要比细胞培养板贵,细胞板主要做细胞培养,但也可以用来测蛋白浓度;酶标板包括包被板和反应板,一般不能用做细胞培养,它主要做免疫酶联反应后的蛋白检测,它需要更高的要求还需要特定的酶标工作液。
常用不同培养板的孔底面积及推荐加液量:不同孔板所加培养液的液面都不宜太深,一般在2-3mm范围,结合不同孔的底面积就可算出各培养孔的适宜加液量。
若加液量过多会影响气体(氧气)交换,而且在搬动过程中易溢出造成污染。
具体所加细胞密度依实验的目的不同灵活掌握。
(3)细胞培养板的密闭和污染问题问:96,24孔培养板或培养皿的盖子都很松,这样是方便了透气,但是细菌、霉菌等污染物会不会也随着溜进去呢?答:1.盖子很松,属于半开放培养,这样的目的是透气(实际上是为了使培养皿外的co2能够与培养皿充分交换,维持培养基的pH值)。
2.凡事有利必有弊,这样当然增加了污染的可能性。
此外这样还会使培养皿内的液体蒸发,这对于精确定量的药物来说就显得值得注意了。
所以以下二条措施是必须的a培养箱内空气必须清洁(定期紫外线照,酒精擦洗,尽量少开关培养箱)b培养箱内的湿度必须始终保持为100%(培养箱内放置无菌蒸馏水的水槽)。
就好像培养皿,也是一个盖倒扣的容器,也不会污染。
主要是因为盖子“L”型边缘产生气流负压的缘故,灰尘上面才附着有微生物,而气流携带的灰尘是无法通过产生负压的盖边缘的。
而透气作用只是通过空气的扩散,不会产生气流,所以只会透气不会透菌。
问:我使用24孔板,在其中的某些孔中有操作(在超净台内),而其它孔中还有细胞要培养.我很担心这样会污染,不知道要注意什么?在超净台内如果操作规范的话应该可以的,我想你可以充分利用培养版的盖子,尽量只暴露要操作的孔,将其它孔用盖子盖起来。
这是我的一点粗浅的见解,抛砖引玉吧!使用前综合考虑一下,充分使用所以的孔;如果只需要使用少数的孔可以只用一边的,其余用盖子盖住,我习惯于先用右侧的孔(右手加样方便)。
其实自己感觉只要注意无菌操作,一般是不会污染的。
操作时用几块玻片把板子一侧垫高,不要把盖子全打开,一般没问题。
(4)细胞分布不均及解决办法问:我的细胞接种培养板,细胞总是聚集在周边部分,该如何处理啊?我看园子里有的战友的细胞却是聚集在中间,是不是板子的质量问题啊?答:请问你的细胞是如何混匀的?是滴管吹打还是振荡培养板?如果是后者,而且是转圈摇匀的话,很有可能由于离心力的作用使细胞甩到周边部分,导致细胞中间少,四周多!自己可是试试!周边一般是相对会多一点,但是中间的数量也不会很少啊~~ 铺板的时候我也没有特异去振荡培养板。
大概是板子的质量问题吧或者是不是铺板时候的细胞密度太低了?我用的corning的板。
一个好办法:在你培养种板之前,把培养板放入培养箱里进行几个小时的饱和后再取出,种入细胞时力量要轻,可采取用滴头在培养板孔的侧面慢慢加入让细胞悬液流入板孔中,培养的细胞基本是均匀生长。
记住千万不要用振荡器振荡,否则你的细胞就会想你说得那样聚积在一起。
我今天把培养板放入培养箱里几个小时,适当的把细胞密度加大了一下,另外多加了一点培养液,今晚看细胞铺的挺好的。
我认为有两种可能解决你问题的办法: 1.加入前吹打均匀;2.从多孔板侧边或底边缓慢加入。
问:我在做原代培养时也遇到过这种情况,我一直以为培养皿铺胶不均匀会导致这种现象,因为混匀的血管段加入到培养皿中时,在相差显微镜下血管段均匀分布在培养皿中,24h后贴壁的血管段就是周边多,中间相对少些。
下次我要试试hkqu战友的方法看能否改变这种现象。
答:这种现象很正常呀,不知你仔细观察过没有,孔直径愈小,这个现象越明显,我试过,24、96孔板这种现象不可避免,因为液体的附壁使得孔内培养液不是成一个液平面,而是周边高,就像凹镜一样,而使用这两种孔板由于需要加干预等原因而不能加足量培养液,使得细胞随培养液一起出现“边集”现象,如果为了使孔中央也有均匀细胞而增加接种细胞数量的话,这要看你需要观察何种指标,如果是MTT,免疫组化的话会因为细胞成层而影响结果。
(5)6孔板接种和换液问题:问:我的细胞传代很正常,但一种到六孔板里(不管加药和对照),总有两三个孔(随机)细胞长得不好,很小,像破碎了。
有人遇到过这种情况吗?到底是啥原因呢?请各位指点答:可能跟你加液的温度有关。
如果你细胞刚刚拿出来换液加液,培养基也是从4度冰箱拿出来不久,很容易细胞就会冻死了。
建议你最好把培养基先在培养箱里边孵育15min先。
另外,跟你细胞的生长状态也有关。
加药之前的细胞可以用高点的血清浓度培养。
保证细胞状态良好。
或者放在37度水浴锅里孵育也可以,或者是培养板本身的问题,你再换换其它培养板试试看。
再有可能就是细胞状态问题了,种板时的血清浓度调高试一下问:最近几天,我用六孔培养板接种细胞,培养24小时后更换培养基,在更换培养基之前,显微镜观察到细胞贴壁,状态非常的好,更换了培养基后,立即用显微镜观察,发现每个孔中都近乎有一半的细胞表现出近乎死亡的状态。
细胞变得非常小,产生大量的碎片,而另一半的细胞一切正常,异常细胞与正常细胞之间存在一条分水岭,上半个圆是好的,下半个圆就不好,这是怎么一回事?答:你可以看一下是不是培养板没放水平。
有一回我也出现过这种情况。
你的培养液如何,如果培养液过期,细胞就不会贴壁。
换一点新配制的培养液试一试。
我也经常碰到,我想可能是板的问题,换一个牌子的板或换用培养瓶就没问题了。
不知楼主所需换液的培养板多不多,换培养基的时候如果没有注意风机的影响,特别是所需换液的培养板很多时,容易使细胞因风吹失水而干缩破裂。
如果如此,换液时应该逐个培养板进行,别怕浪费吸管,注意操作的效率!(6)24孔板接种问题:问:把细胞消化接种到24孔板之后,已经四天了,老是每孔的中间部分长不满,每天换液时都用PBS清洗,第二天换液时都出现同样的情况,每孔的边缘长的很好,中央大量死细胞?答:我是选择孔内铺盖玻片,在玻片上种植。
每次换液都用PBS洗,必要的步骤吗?另外,也有可能和细胞种类有关或者和培养液有关?我想你的培养液可能加的太少了。
由于表面张力的作用,培养板的边缘液体会向上走,造成培养液面呈现一个凹面(就像量筒的液体凹面一样),中央的细胞正好在凹面的最低处,培养液少,细胞的营养不够,甚至干涸掉,空气中的氧气也会造成损伤,即使有增值过来的细胞也会死掉。
另外,检查一下培养箱底部的水是否少了,如果少了,箱内的空气湿度不够,会造成培养液挥发加快,这样即使刚加的液体不少,过一段时间,由于蒸发,液体量会减少,造成中央干涸。
并且这样会改变了培养液的成分浓度,造成渗透压过高。
个人经验认为这是物理问题:24孔板小,细胞接种进去后是很难摇均匀的,结果导致细胞重贴壁后呈现四周密中间稀的状况.至于中间较多死细胞,如果是悬浮状的话,也一样是物理问题。
接种后比较粗暴的碰撞,似乎对摇均匀细胞有一定效果.在为多孔板培养的细胞换液时一定要注意,不要把培养基吸得太干,如果完全吸取,很容易造成细胞干涸,这样的话细胞会很快死亡。
我有一段时间总是遇到这个问题,一个板子中总有一两个孔出现细胞大量死亡,后来发现是上面的原因。
现在我做的时候如果必须把液体吸干,我会一个一个空来吸取,最多一次不超过3孔,然后马上加入液体,同时在作转染时,我会在吸液和加液时将风机关掉,这样基本上会避免细胞死亡。
同时你所说的细胞周围密而中间稀疏,大约有如下原因:1.培养液加得太少。
主要是由于液体张力的问题。
2.细胞接种后震荡太厉害了。
由于离心力作用导致细胞分布到周围。
细胞分布均匀与否有一点很关键,即每种细胞是有个体差异的,别人的细胞操作不一定适合于你.所以要靠自己摸索,且找出专属于自己细胞的一套规律,有如下经验:1.所有待接种的细胞悬液在种板前一定要用吸管混匀。
2.按资料记载,24孔板的液体量为1ml,个人也觉得1ml的量足矣。
3.接种时,要慢慢加样,且记得轻微旋转枪头,这样做对细胞均匀分布有一定效果。
4.接种后最好直接放入培养箱让细胞适应培养板这个新的环境,个人认为没有必要在室温放置一段时间。
5.根据细胞的特性,细胞均喜欢聚集在边缘生长,所以我考虑到,你的问题还有可能是接种时的细胞密度不够,导致周边密集,中间稀疏的错觉。
你的拌种密度是多少?另"要慢慢加样,且记得轻微旋转枪头"的意思就是:加样不能太快,避免细胞在一个加样处聚集,且注意在不同的部位进行加样,即边加边活动枪头,人为使细胞趋于均匀分布,我个人觉得有一定的效果,不知这次我解释清楚没有。
