实验五水总硬度的测定
水硬度测定

水的总硬度的测定一、实验原理水的总硬度是指水中+2Ca 、+2Mg 的总量。
EDTA 和金属指示剂铬黑T )(3In H 分别与+2Mg 、+2Ca 形成络合物,稳定性为---->>>CaIn MgIn MgY Y C a 22,当水样中加入少量铬黑T 指示剂时,它首先和+2Mg 生成红色络合物-MgIn ,然后与+2Ca 生成红色络合物-CaIn 。
+----++=+H HIn CaY Y H CaIn 2222+----++=+H HIn MgY Y H MgIn 2222红色 蓝色二、实验步骤1.取水样:100mL2.控制水样的pH 值:加入氨性缓冲溶液5mL ,控制pH=103.加入掩蔽剂:三乙醇胺掩蔽+3Fe 、+3Al 等。
4.滴定:用EDTA 标准溶液滴定至溶液由紫红色——蓝色三、数据记录及数据处理见实验报告水的硬度有多种表示方法,常以水中Ca 、Mg 总量换算为CaO 含量的方法表示,以每升水中含10mg CaO 为1度 ( o ),用度来表示水的硬度。
即1度=10mg CaO /1L(H 2O)。
100)(/⨯⋅=︒水样)(水的总硬度V M CV CaO EDTA 四、钙硬的测定 移取100mL 水样于250mL 锥形瓶中,加入5mL NaOH L g 140-⋅加少许钙指示剂,用EDTA 标准溶液滴定至溶液由酒红色变为纯蓝色为终点。
水样V Mca CV EDTA l mg Ca 32)(10)(1⨯⨯=-⋅ρ 水样V M V V C Mg EDTA l mg Mg 321)(10)(1⨯⨯-=-⋅ρ五、注意事项 因水样中的钙、镁含量不高、滴定时,反应速度较慢,故滴定速度要慢。
六、思考题1.什么叫水的总硬度?怎样计算水的总硬度?答:水中Ca 2+、Mg 2+的总量称为水的总硬度。
计算水的总硬度的公式为: 1000)(⨯⨯水V M cV CaO EDTA (mg·L -1) 100)(⨯⨯水V M cV CaO EDTA ( o ) 2.为什么滴定Ca 2+、Mg 2+总量时要控制pH≈10,而滴定Ca 2+分量时要控制pH 为12~13?若pH>13时测Ca 2+对结果有何影响?答:因为滴定Ca 2+、Mg 2+总量时要用铬黑T 作指示剂,铬黑T 在pH 为8~11之间为蓝色,与金属离子形成的配合物为紫红色,终点时溶液为蓝色。
水中的总硬度用edta测定方法

水中的总硬度用edta测定方法水中的总硬度是指水中钙离子和镁离子的总含量。
EDTA(乙二胺四乙酸)是一种常用的络合剂,能够与钙离子和镁离子形成稳定的络合物,因此可以用于测定水中的总硬度。
以下是使用EDTA测定水中总硬度的具体方法:一、实验原理EDTA与水中的钙离子和镁离子反应生成稳定的络合物,通过滴定法测定生成络合物的量,可以计算出水中的钙离子和镁离子的总浓度,从而得出水的总硬度。
二、实验步骤1.准备实验溶液:取100mL水样,加入2mL缓冲液(pH=10),摇匀备用。
2.滴定:将实验溶液放入三角瓶中,用EDTA标准溶液滴定至终点,记录消耗的EDTA体积(V1)。
3.绘制标准曲线:用不同浓度的钙离子和镁离子混合溶液绘制标准曲线,得到EDTA与钙离子和镁离子的反应方程式。
4.计算:根据滴定消耗的EDTA体积(V1)和反应方程式,计算出水样中钙离子和镁离子的总浓度,再根据换算系数计算出水的总硬度。
三、实验注意事项1.实验过程中要保证水样的pH值在规定范围内(一般要求pH=10),否则会影响实验结果。
2.滴定时要缓慢进行,并不断搅拌,以保证反应充分进行。
3.绘制标准曲线时,要使用相同浓度的缓冲液,以保证实验结果的准确性。
4.实验过程中使用的试剂和器具要保持清洁,避免污染实验溶液。
5.如果水样中含有其他金属离子(如铁、锌等),会影响EDTA与钙离子和镁离子的反应,因此需要进行相应的处理(如加入掩蔽剂)以保证实验结果的准确性。
四、实验结果分析通过滴定法测定水中总硬度的方法具有操作简便、快速准确等优点,适用于各种不同类型的水样。
实验结果可以通过计算得到水中钙离子和镁离子的总浓度,再根据换算系数计算出水的总硬度。
同时,也可以通过与标准曲线比较,判断水样中钙离子和镁离子的浓度是否符合规定要求。
五、实验结论通过使用EDTA滴定法测定水中总硬度的方法,可以得到水中钙离子和镁离子的总浓度,从而判断出水样的硬度状况。
实验结果表明,该方法具有操作简便、快速准确等优点,适用于各种不同类型的水样。
水中总硬度的测定
水中总硬度的测定一、实验目的1、掌握配位滴定法测定水中硬度的原理和方法。
2、掌握水中硬度的常用表示方法。
3、掌握鉻黑T指示剂的使用条件.二、实验仪器、药品锥形瓶、烧杯、10ml移液管、25ml移液管、铁架台、洗耳球、酸式滴定管铬黑T指示剂、Ca2+标准液(0.01130mol/L)、PH≈10 的氨性缓冲溶液、EDTA 溶液、蒸馏水三、实验原理水的硬度是指水中除碱金属离子的浓度,由于Ca+、Mg2+含量远比其他金属离子为高,所以通常以水中Ca+、Mg2+总量表示水中的硬度水的硬度的测定一般采用EDTA滴定法测定。
在PH≈10 的氨性缓冲溶液中,以鉻黑T为指示剂,用EDTA标准容易直接测定Ca2+、Mg2+总量,溶液由酒红色恰变为纯蓝色即为滴定终点。
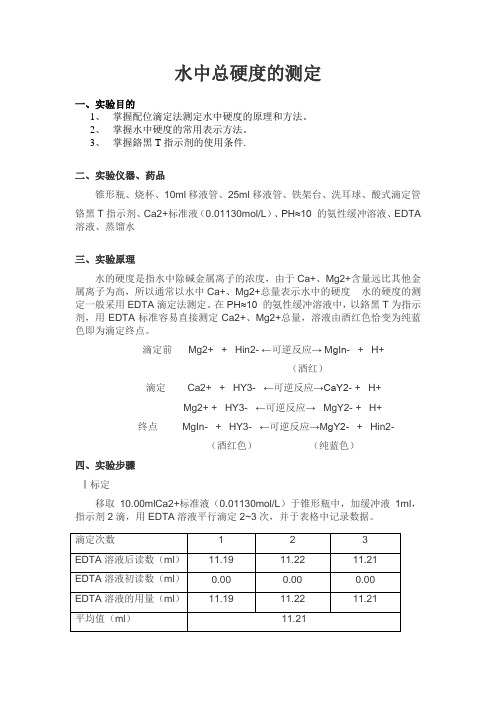
滴定前Mg2+ + Hin2- ←可逆反应→ MgIn- + H+(酒红)滴定 Ca2+ + HY3- ←可逆反应→CaY2- + H+Mg2+ + HY3- ←可逆反应→MgY2- + H+终点MgIn- + HY3- ←可逆反应→MgY2- + Hin2-(酒红色)(纯蓝色)四、实验步骤Ⅰ标定移取10.00mlCa2+标准液(0.01130mol/L)于锥形瓶中,加缓冲液1ml,指示剂2滴,用EDTA溶液平行滴定2~3次,并于表格中记录数据。
Ⅱ测定移取25.00ml自来水于锥形瓶中,加缓冲液1ml,指示剂2滴,滴定至终点,平行滴定2~3次,并于表格中记录数据。
五、实验数据记录及处理实验数据已填于上述表格中实验数据计算:EDTA溶液浓度标定:由C(Ca2+)*V(Ca2+)=C(EDTA)*V(EDTA)得C(EDTA)= C(Ca2+)*V(Ca2+)/V(EDTA)= 0.01130mol/l*10.00ml/11.21ml =0.01008mol/l自来水硬度测定:由n(EDTA)=C(EDTA)V(EDTA)n(Caco3):n(EDTA)=1:1 n(Caco3)=m (Caco3)/ M(Caco3)自来水硬度ρ=m (Caco3)/ Vaq 所以计算可得ρ=0.135g/l=135mg/l六、注意事项:1.各个使用仪器用前需要润洗的注意润洗;2. 络合反应速度较慢,滴定时滴加速度不能太快,特别是临近终点时,要边滴边摇晃。
实验五:EDTA标准溶液的配置和滴定及水总硬度的测定

EDTA的配制、标定及水的硬度分析指导老师吴明君化学生物学一班刘淑岚20123003EDTA 的配制、标定及水的硬度分析指导老师 吴明君化学生物学一班 刘淑岚 20123003摘要 本实验先用CaCO 3为基准物质,加入钙指示剂,标定EDTA 标准溶液,得到其浓度为0.01526±0.00004。
然后以铬黑T 为指示剂,并用已标定过的EDTA 标准溶液测定水的总硬度,得到水的总硬度为12.38±0.16。
再以Ca 指示剂为指示剂测定水的钙硬为12.13±0.17,最后由总硬减去钙硬得镁硬为0.26。
数据分析时运用Q 检验法对数据经行了分析处理。
关键词 EDTA 标准溶液,标定,水的硬度,铵态氮测定Determination of standard solution of NaOH in the titration and ammonium saltstotal alkalinity of industrial sodaAdviser Mingjun Wuchemicobiology class 1 Shulan Liu 20123003Abstract The experiment first using CaCO3 as a reference substance , add calcium indicator , calibration standard EDTA solution to give a concentration of 0.01526±0.00004 . Then chrome black T as indicator , and the determination of total hardness of water has been calibrated with EDTA standard solution , the resulting total water hardness 12.38±0.16 . Ca indicator then measured as an indicator of water calcium hardness is 12.13±0.17 . Finally, subtract hard by the total calcium magnesium hard to get hard 0.26 . Data analysis using Q -test analysis of the data processed by the line .Keywords EDTA standard solution , calibration, water hardness, ammonium determination综述 在环境监测分析中,总硬度为常规分析项目。
水样总硬度实验报告(3篇)

第1篇一、实验目的1. 了解水的总硬度的概念和测定意义;2. 掌握EDTA滴定法测定水样总硬度的原理和方法;3. 熟悉铬黑T指示剂的使用和终点判断;4. 提高实验操作技能和数据分析能力。
二、实验原理水的总硬度是指水中钙、镁离子的总浓度,通常以每升水中含有的碳酸钙的毫克数(mg/L)表示。
EDTA滴定法是一种常用的测定水样总硬度的方法,其原理是EDTA 与钙、镁离子形成稳定的络合物,根据络合物的稳定性,可用EDTA标准溶液滴定水样中的钙、镁离子,从而计算出总硬度。
三、实验器材与试剂1. 器材:- 电子天平- 移液管- 滴定管- 锥形瓶- 烧杯- 玻璃棒- pH计- 恒温水浴锅2. 试剂:- 乙二胺四乙酸二钠(EDTA)标准溶液(0.01mol/L)- 铬黑T指示剂- 盐酸- 碳酸钠- 碳酸氢钠- 水样四、实验步骤1. 标准溶液的配制- 称取0.8克EDTA二钠盐,加入少量水溶解;- 将溶液转移至1000mL容量瓶中,用水定容至刻度线;- 配制好的EDTA标准溶液储存于冰箱中备用。
2. 水样预处理- 取一定量的水样,用碳酸钠和碳酸氢钠调节pH至8.5-9.5;- 用移液管取50mL水样于锥形瓶中,加入适量的铬黑T指示剂;- 用盐酸滴定至溶液由酒红色变为纯蓝色,记录消耗的盐酸体积。
3. 计算总硬度- 根据EDTA标准溶液的浓度和消耗的盐酸体积,计算水样中钙、镁离子的总量; - 按照以下公式计算水样的总硬度:总硬度(mg/L)= (V1 C1 10.67) / V2其中,V1为消耗的EDTA标准溶液体积(mL),C1为EDTA标准溶液的浓度(mol/L),V2为水样的体积(mL),10.67为碳酸钙的摩尔质量与钙离子的摩尔质量之比。
五、实验结果与分析1. 实验结果- 本实验测得水样的总硬度为XXX mg/L。
- 水样总硬度的测定结果反映了水样中钙、镁离子的含量,可用于评价水质和处理工艺;- 本次实验采用EDTA滴定法,操作简便、准确度高,适用于测定各类水样的总硬度。
水的总硬度测定实验报告

水的总硬度测定实验报告一、实验目的。
本实验旨在通过分析水样中的总硬度,了解水质的硬度情况,为水质的评价和处理提供依据。
二、实验原理。
水的硬度是指水中可溶解的钙和镁离子的总量,通常以mg/L或mol/L表示。
水的硬度分为临时硬度和总硬度两种。
临时硬度是指水中的碳酸钙和碳酸镁的含量,可以通过加热水样使其二氧化碳逸出来测定。
总硬度是指水中所有可溶性钙和镁的含量,可以通过滴定法测定。
三、实验步骤。
1. 取一定量的水样,加入适量的EDTA指示剂和pH缓冲液。
2. 用标准EDTA溶液滴定水样,直到水样呈现蓝色终点。
3. 记录所耗用的EDTA溶液的体积V1(ml)。
4. 用同样的方法对蒸馏水进行滴定,得到滴定体积V2(ml)。
5. 计算水样的总硬度,总硬度=(V1-V2)×标准EDTA溶液的浓度×50。
四、实验数据。
水样滴定体积V1(ml),25.6。
蒸馏水滴定体积V2(ml),2.5。
标准EDTA溶液浓度,0.01mol/L。
五、实验结果及分析。
根据实验数据计算得到水样的总硬度为:总硬度=(25.6-2.5)×0.01×50=11.55mg/L。
六、实验结论。
通过本次实验,我们成功测定了水样的总硬度为11.55mg/L。
水的硬度对于日常生活和工业生产都有一定的影响,合理控制水的硬度有助于延长管道和设备的使用寿命,保障水质安全。
因此,对水的硬度进行监测和调节具有重要意义。
七、实验注意事项。
1. 实验中需使用干净的试剂和仪器,避免杂质的干扰。
2. 滴定时需注意滴定液的滴加速度和方向,保持稳定。
3. 实验结束后要及时清洗和收拾实验器材,做好实验室卫生。
八、参考文献。
1. 《分析化学》。
2. 《水质分析与监测技术》。
以上为水的总硬度测定实验报告。
实验5水中硬度的测定

实验5水中硬度的测定(络合滴定法)一、实验目的1.学会EDTA标准溶液的配制与标定方法;2.掌握水中硬度的测定原理和方法。
二、原理在pH=1。
的NH3-NH4CI缓冲溶液中,铬黑T与水中ca2+和mg2+成紫红色络合物.然后用EDTA标准溶液滴定至终点时,置换出铬黑T使溶液呈现亮蓝色,即为终点。
根据EDTA标准溶液的浓度和用量便可求出水样中的总硬度。
如果在pH>12时, mg2+以mg(OH )2沉淀形式被掩散,加钙指示剂,用EDTA标准溶液滴定至溶液由红色变为蓝色,即为终点。
根据EFTA标准溶液的浓度和用量求出水样中Ca2+的含量。
三、仪器和试剂1.滴定管50mL;2. l0mmol/L EDTA标准溶液;3.铬黑T指示剂;4.缓冲溶液(pH=10);5. l0mmol /L钙标准溶液;6.酸性铬蓝K与蔡酚绿B(m/m=I:(2--2.5)混合指示剂(KB指示剂);7.三乙醇胺 20%;8.Na2S溶液 2%;9.4mol/L HCl溶液;10.10%盐酸经胺溶液;11.2mo1/L NaOH溶液。
四、实验内容1.总硬度的测定(1).吸取50mL自来水水样3份,分别放人250mI锥形瓶中。
(2).加5ml,缓冲溶液和1mL 硫化钠溶液(掩蔽Cu 2+、Zn 2+等重金属离子) (3).加0.2g(约1小匀)铬黑T 指示剂,溶液呈明显的紫红色。
(4).立即用14mmol/L EDTA 标准溶液滴定至蓝色,即为终点(滴定时充分摇动,使反应完全),记录用量(V EDTA )。
由下式计算:总硬度(mmol/L)=V V C EDTAEDTA总硬度(CaCO;计,mg/L)=V V C EDTAEDTA ×100.1C EDT ——EDT A 标准溶液的量浓度( mmol/L ) ; V EDTA ——消耗EDTA 标准溶液的体积(mL) ;V 0——水样的体积(mL)100.1——碳酸钙的摩尔质量(CaC03,g/mol ) 2.钙硬度的测定(1).吸取50mI.自来水水样3份,分别放人锥形瓶中。
实验五 水总硬度的测定

一、实验目的 1.掌握水的硬度的表示方法; 2.学习配位滴定法测定水中总硬度的原 理和方法; 3.学会EDTA标准溶液的配制、标定和 稀释; 4.熟悉金属指示剂变色原理及滴定终点 的判断;
学科名词
硬水:含有较多可溶性钙、镁化合物的水。 硬水中含盐量一般以硬度表示。硬度单位是度,1度相当 于每升水中含10mg的CaO。 硬度在8以上者通常称为硬水,地下水(如井水、泉水) 的含盐量较多,属于硬水。在硬水中,钙盐和镁盐以碳 酸氢盐、碳酸盐、硫酸盐、氯化物和硝酸盐的形式存在。 硬度又分为暂时性硬度和永久性硬度。由于水中含有碳 酸氢钙与碳酸氢镁而形成的硬度,经煮沸后可把硬度去 掉,这种硬度称为暂时性硬度。水中含硫酸钙和硫酸镁 等盐类物质而形成的硬度,经煮沸后不能去除的硬度, 称为永久性硬度。
+ EBT
钙硬度的测定
钙含量的测定(pH=12)
Ca2+
+
EDTA NN Ca-NN
无色
Ca-EDTA
蓝色
酒红色
NN
+
无色
蓝色
置换出的指 示剂指示 终点
三、仪器与试剂
仪器:酸式滴定管(25ml)、烧杯(100ml)、吸 量管(5、10ml)、 量筒(100ml)、锥形瓶 (250ml),洗耳球 试剂:自来水样、 EDTA (0.02 mol/L 待标液)、 CaCO3标准溶液(0.02 mol/L )、三乙醇胺 (1:1)、氨性缓冲溶液 K-B 指示剂、铬黑T指示剂(EBT )
钙标准溶液滴定EDTA溶液的数据记录
数据 V ca 2+(ml) △VEDTA(ml) 1 2 3
CEDTA(mol/L)
平均值
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
总硬度的测定方法:
采用络合滴定法 ( EDTA )测定: 在pH≈10的氨性溶液中,采用 铬黑T(In)做指
示剂,用EDTA标准溶液直接测定 Ca2+、Mg2+总量。
水硬度 ? C V EDTA EDTA ? MCaO ? 100 德国度 ( °) V水
水硬度 ? C V EDTA EDTA ? MCaO ? 1000 mg/L V水
水硬度分类表
总硬度度数
(°) 0~4 标 志 很软水
4~8 软水
8~16
中等硬度水
16~30 硬水
30以上 很硬水
? 硬度对工业用水影响很大,尤其是锅炉用水,硬度较高的 水都要经过软化处理并经滴定分析达到一定标准后才能输 入锅炉。其他很多工业对水的硬度也都有一定的要求。生 活饮用水中硬度过高会影响肠胃的消化功能,我国生活饮 用水卫生标准中规定硬度(以CaCO3计)不得超过450mg·L1。
有:K CaY>KMgY>K MgIn>Y CaIn
分别测定水中钙硬和镁硬时,可取等量水样 加NaOH调节溶液 pH=12~13 ,使Mg2+生成 Mg(OH)2沉淀,在滴定时不再参与与 EDTA的络 合反应,在溶液中加入 钙指示剂 用EDTA滴定水 中Ca2+含量,然后再计算出 Mg2+含量。
滴定时, Fe3+、Al3+等干扰离子用 三乙醇胺 掩蔽, Cu2+、Pb2+、Zn2+等重金属离子可用 KCN、 Na2 S或巯基乙酸掩蔽 。
3. 自来水总硬度的测定
用移液管移取 100.00 mL 自来水于 250 mL 锥形瓶中,加入 3 mL 三乙醇胺溶液, 5 mL 氨性 缓冲液,再加入 4-5 滴铬黑 T 指示剂,立即用 EDTA 标液滴定,当溶液由 红色变为蓝色即为终 点。平行测定 3 份,计算水样的总硬度,以 mmol·L-1 和德国度两种方式表示结果。
水的硬度(°)=
c(
EDTA)V( EDTA)M( V(水样)
CaO
)
?
1 10
实验注意事项:
? 配位反应比酸碱反应速度要慢,滴定过程中应慢滴快摇。 ? 配ED制TAED测T定A 水溶的液硬时度加,入终M点gC变l2色的不原敏因锐:。当在水配样制中EMDgT2+A含溶量液太时少加时入,适用
量与MEBgTC形l2,成在紫滴红定色过化程合中物C,a终2+把点M时g,2+从颜M色g由- 紫ED红T色A变中为置纯换兰出色来,,较M为g2+ 敏锐。 ? 滴定终点时溶液为纯蓝色,若蓝中带紫,则EDTA不足;若蓝中带绿, 则EDTA 过量。 ? EBT为一种有机弱酸,不同型体显示不同颜色,当pH﹤6.3时,显紫 红色;pH﹥11.6时,显橙红色;6.3﹤pH﹤11.6时,显兰色。而EBT 与金属离子形成的络合物为紫红色,因此EBT用做金属指示剂使用的 pH范围为6.3~11.6,但实验证明最佳酸度范围为9~10。
三、方法原理
水硬度一般是指水中钙、镁离子的含量。水 的总硬度是指水中 Ca2+、Mg2+的总量。由 Mg2+引 起的称镁硬度,由Ca2+引起的称 钙硬度。
常用表示水硬度的方法是以水中 Ca、Mg总量换 算为CaO、 CaCO3含量。单位为 mmol/L、mg/L 和(°)。
1°表示: 1 L 水中含10 mg CaO 。
准确称取 0.15~0.20 g 基准锌片于50 mL 烧杯中,加入约 5 mL (1+1)HCl 溶液,立即盖上表面皿,待锌片完全溶解后,以少量水 冲洗表面皿,定量转移 至250 mL容量瓶中,用水稀释至刻度,摇匀 备用。
用移液管吸取 25.00 mL Zn2+ 标准溶液于锥形瓶中,加1滴甲基红, 用(1+2)氨水中和锌标准溶液中的HCl(? ),溶液由红变黄时即 可。加20mL水和10mL NH3-NH4Cl缓冲溶液。再加 4-5 滴铬黑T指示 剂,立即用 EDTA 滴定,当溶液由红色转变为蓝色即为终点。平行 滴定 3 次,计算 EDTA 的准确浓度。
滴定中:
Ca2++Mg2++MgIn + Y
终点时:
Ca2++ MgY + MgIn + Y
终点颜色: 酒红色
酒红色
Ca 2+ +Mg 2+ + MgIn
酒红色
CaY +MgY+Mg 2++MgIn 蓝色
CaY +MgY+Mg 2++MgIn
蓝色
w Ca ? C V EDTA 2 EDTA ? M Ca ? 1000 mg / L
络合掩蔽剂注意事项:
? 掩蔽剂不与待测离子络合,即使形成络合物,其稳定性也应远小于待 测离子与EDTA 络合物的稳定性;
? 干扰离子与掩蔽剂形成的络合物应远比与EDTA形成的络合物稳定, 且形成的络合物应为无色或浅色,不影响重点的判断;
? 使用掩蔽剂应注意适用的pH范围。
反应如下:
滴定前:
Ca2++ Mg 2+ + In
实验五 自来水总硬度的测定
(络合滴定法 )
一、实验目的
1、学习 EDTA标准溶液的制方法及滴定终点的 判断;
2、学会用络合滴定法测定水的硬度。 3、了解水硬度的含义及其测定的实际意义。
二、仪器与试剂
电子天平;滴定管;移液管;锥形瓶等。
EDTA(0.02mol/L) ; NH 3-NH4Cl缓冲溶液 ; 铬黑T(0.5%) ; 三乙醇胺( 1:2) ; Na2S NaOH (40 g.L -1) 。
V水
wMg ?
CEDTA(V1
?
V2
) EDTA
?
MMg
?
1000
V水
mg / L
四、操作步骤
1.EDTA溶液的配制
称取0.37-0.47gEDTA二钠盐
100mL蒸馏水 200mL烧杯中
溶解
定量转移至250mL容量瓶中定容
C(EDTA )=
m(EDTA ) M (EDTA)×250
×1000
2. EDTA 的标定
五、数据记录
总硬度测定数据记录
No
1
2
3
EDTA标液浓度 (mol/L)
水样体积(mL)
滴定初始读数(mL)
终点读数(mL)
V(mL)
六、思考题
1. 本节所使用的 EDTA ,应该采用何种指示剂标 定?最适当的基准物质是什么?
2.滴定为什么要在缓冲溶液中进行 ?如果没有缓冲溶 液存在,将会导致什么现象发生?
