高中化学实验目录(必修一至选修五)
高中化学实验目录

高中化学实验目录以下是一份高中化学实验目录的示例:
1. 酸碱中和反应实验
- 确定酸、碱的浓度
- 酸、碱的中和反应
2. 金属活动性实验
- 排列金属活动性的实验
- 金属与酸的反应实验
3. 氧气制备实验
- 过氧化氢分解制备氧气的实验
- 高锰酸钾分解制备氧气的实验
4. 集气法制备气体实验
- 羟基磷酸分解制备氢气的实验
- 碳酸氢钠与酸反应制备二氧化碳的实验
5. 气体的溶解度实验
- 观察二氧化碳、氧气、氮气的溶解度实验
6. 非金属氧化物与水反应实验
- 碳、硫、磷等非金属氧化物与水反应的实验
7. 电解质与非电解质实验
- 测试不同物质的电解性实验
8. 精馏实验
- 分离混合物中的液体成分实验
9. 燃烧实验
- 不同物质的燃烧实验
10. 过滤实验
- 过滤混合物实验
请注意,这只是一个示例目录,实际的高中化学实验目录可能会根据教材和教学内容的不同而有所变化。
建议根据教学需要和实验设备条件,选择适合的实验项目。
高中理化生学生实验目录(新教材)

化学实验目录[必修1]实验一粗盐的提纯实验二蒸馏与萃取实验三配制100ml 1.00 ml/L NaCl溶液实验四分散系——胶体的性质实验五离子反应实验六金属钠及其化合物的性质实验七铝、铁及其化合物的化学性质实验八氯气的性质及氯离子的检验实验九氨的制取与性质[必修2]实验一同周期元素性质的探究实验二化学反应速率实验三糖类、蛋白质、淀粉的性质[选修1]实验一葡萄糖、淀粉、蛋白质[选修2]实验一实验室制取肥皂及表面活化剂[选修4]实验一中和反应热的测定实验二影响化学反应速率的因素实验三酸碱中和滴定实验四盐类的水解实验五原电池实验实验六电解实验[选修5]实验一乙烯的性质实验实验二乙醇的性质实验实验三苯酚的性质实验实验四乙醛的性质实验实验五乙酸乙脂的制取与水解实验六蛋白质的性质[选修6]实验1-1 蓝瓶子的实验实验1-2 氯气的生成及其性质的微型实验实验1-3 污水处理—电浮选凝聚法实验2-1 纸上层析分离甲基橙和酚酞实验2-2 海水的蒸馏实验2-3 从海带中提取碘实验2-4 硫酸亚铁铵的制备实验2-5 乙酸乙脂的制备及反应条件的探究实验2-6 氢氧化铝的制备实验3-1 几种无机离子的检验实验3-2 几种有机物的检验试验3-3 植物体中某些元素的检验实验3-4 酸碱滴定曲线的测绘实验3-5 比色法测定抗贫血药物中铁的含量实验3-6 食醋中总酸量的测定实验4-1 纯净物与混合物性质的比较实验4-2 金属镁、铝、锌化学性质的探究实验4-3 含氯消毒液性质、作用的探究实验4-4 饮料的探究实验4-5 综合实验设计实践高中物理分组实验(高一年级)探究一用打点计时器测速度探究二探究小车速度随时间变化的规律探究三测量重物下落的加速度探究四探究求合力的方法探究五探究加速度与力、质量的关系探究六探究作用力与反作用力的关系探究七研究平抛运动探究八用圆锥摆粗略验证向心力的表达式探究九探究功与速度变化的关系探究十验证机械能守恒定律探究十一探究弹力和弹簧伸长的关系探究十二课题研究潮汐现象(高二年级)探究一用描迹法画出电场中平面上的等势线探究二测量小灯泡的伏安特性曲线探究三探究导体电阻与其影响因素的定量关系探究四探究导体电阻与材料的关系探究五练习使用多用电表探究六测定电池的电动势和内阻探究七探究电磁感应产生的条件探究八探究感应电流的方向与哪些因素有关探究九练习使用示波器探究十探究变压器电压与匝数的关系探究十一传感器的应用探究十二探究单摆周期与摆长的关系探究十三用单摆测定重力加速度探究十四测定玻璃的折射率探究十五用双缝干涉测量光的波长探究十六探究碰撞中的不变量生物实验目录必修一实验一使用高倍显微镜观察几种细胞实验二检测生物组织中的糖类、脂肪和蛋白质实验三观察DNA和RNA 在细胞中的分布实验四体验制备细胞膜的方法实验五用高倍显微镜观察叶绿体和线粒体探究一植物细胞的吸水和失水实验六比较过氧化氢在不同条件下的分解探究二影响酶活性的条件探究三探究酵母菌细胞的呼吸方式实验七绿叶中色素的提取和分离探究四环境因素对光合作用强度的影响实验八细胞大小与物质运输的关系实验九观察根尖分生组织细胞的有丝分裂必修二实验一性状分离比的模拟实验二观察蝗虫精母细胞减数分裂固定装片模型建构制作DNA双螺旋结构模型探究一脱氧核苷酸序列与遗传信息的多样性调查调查人群中的遗传病实验三低温诱导植物染色体数目的变化探究二自然选择对种群基因频率变化的影响必修三调查体温与日变化规律实验一生物体维持PH稳定的机制模型建构建立血糖调节的模型技能训练评价实验设计和结论探究一探索生长素似物促进插条生根的最适浓度探究二培养养液中酵母菌种群数量的变化探究三土壤中小动物类群丰富度的研究探究四土壤微生物的分解作用制作设计并制作生态缸,观察其稳定性。
最新人教版高中化学实验目录(修订版)

演示实验
55
苯、甲苯的性质
苯、甲苯、高锰酸钾酸性溶液
演示实验
56
乙醇的消去反应
乙醇、浓硫酸、高锰酸钾酸性溶液、溴的四氯化碳溶液、碎瓷片、温度计、圆底烧瓶、
演示实验
57
乙醇的氧化反应
重铬酸钾酸性溶液、乙醇
演示实验
58
苯酚的酸性
苯酚、蒸馏水、5%氢氧化钠溶液、稀盐酸
选修1
34
葡萄糖的还原性
2%硝酸银溶液、2%氨水、10%葡萄糖溶液
演示实验
35
淀粉的水解
淀粉、硫酸、碘、银氨溶液
演示实验
36
蛋白质的盐析、变性、颜色反应
鸡蛋清溶液、饱和硫酸铵溶液或饱和硫酸钠溶液、蒸馏水、乙酸铅溶液、蒸馏水、浓硝酸
探究实验
选修4
37
中和反应反应热的测定
大小烧杯、温度计、量筒、泡沫塑料、环形玻璃搅拌棒
演示实验
50
电解原理
直流电源、氯化铜溶液、石墨电极、碘化钾淀粉试纸
演示实验
51
铁的吸氧腐蚀实验
饱和食盐水、铁钉、盐酸
选做实验
选修5
52
蒸馏工业酒精
蒸馏烧瓶、漏斗、碎瓷片、冷凝管、酒精灯、牛角管、锥形瓶、胶管、铁架台
选做实验
53
苯甲酸重结晶
苯甲酸、蒸馏水、长颈漏斗、烧杯、石棉网、铁三角
演示实验
54
乙炔的实验室制取和性质
演示实验
26
原电池的构成条件探究
镁条、铜片、铁片、导线、金属夹、小灯泡、果汁
探究实验
27
化学反应速率
双氧水、氯化铁溶液、冷/热水、二氧化锰
人教版高中化学目录(全部)

高中化学人教版高中化学必修一目录第一章从实验学化学第一节化学实验基本方法第二节化学计量在实验中的应用归纳与整理第二章化学物质及其变化第一节物质的分类第二节离子反应第三节氧化还原反应归纳与整理第三章金属及其化合物第一节金属的化学性质第二节几种重要的金属化合物第三节用途广泛的金属材料归纳与整理第四章非金属及其化合物第一节无机非金属材料的主角——硅第二节富集在海水中的元素——氯第三节硫和氮的氧化物第四节氨硝酸硫酸归纳与整理人教版高中化学必修二目录第一章物质结构元素周期律第一节元素周期表第二节元素周期律第三节化学键归纳与整理第二章化学反应与能量第一节化学能与热能第二节化学能与电能第三节化学反应的速率和限度归纳与整理第三章有机化合物第一节最简单的有机化合物——甲烷第二节来自石油和煤的两种基本化工原料第三节生活中两种常见的有机物第四节基本营养物质归纳与整理第四章化学与自然资源的开发利用第一节开发利用金属矿物和海水资源第二节资源综合利用环境保护归纳与整理人教版高中化学选修一目录第一章关注营养平衡第一节生命的基础能源——糖类第二节重要的体内能源——油脂第三节生命的基础——蛋白质第四节维生素和微量元素归纳与整理第二章促进身心健康第一节合理选择饮食第二节正确使用药物第三章探索生活材料第一节合金第二节金属的腐蚀和防护第三节玻璃、陶瓷和水泥第四节塑料、纤维和橡胶归纳与整理第四章保护生存环境第一节改善大气质量第二节爱护水资源第三节垃圾资源化归纳与整理人教版高中化学选修二目录第一单元走进化学工业课题1 化工生产过程中的基本问题课题2 人工固氮技术──合成氨课题3 纯碱的生产归纳与整理练习与实践第二单元化学与资源开发利用课题1 获取洁净的水课题2 海水的综合利用课题3 石油、煤和天然气的综合利用归纳与整理练习与实践第三单元化学与材料的发展课题1 无机非金属材料课题2 金属材料课题3 高分子化合物与材料归纳与整理练习与实践第四单元化学与技术的发展课题1 化肥和农药课题2 表面活性剂精细化学品归纳与整理练习与实践人教版高中化学选修三目录第一章原子结构与性质第一节原子结构第二节原子结构与元素的性质归纳与整理复习题第二章分子结构与性质第一节共价键第二节分子的立体结构第三节分子的性质归纳与整理复习题第三章晶体结构与性质第一节晶体的常识第二节分子晶体与原子晶体第三节金属晶体第四节离子晶体归纳与整理复习题人教版高中化学选修四目录绪言第一章化学反应与能量第一节化学反应与能量的变化第二节燃烧热能源第三节化学反应热的计算归纳与整理第二章化学反应速率和化学平衡第一节化学反应速率第二节影响化学反应速率的因素第三节化学平衡第四节化学反应进行的方向归纳与整理第三章水溶液中的离子平衡第一节弱电解质的电离第二节水的电离和溶液的酸碱性第三节盐类的水解第四节难溶电解质的溶解平衡归纳与整理第四章电化学基础第一节原电池第二节化学电源第三节电解池第四节金属的电化学腐蚀与防护归纳与整理人教版高中化学选修五目录引言第一章认识有机化合物1 有机化合物的分类2 有机化合物的结构特点3 有机化合物的命名4 研究有机化合物的一般步骤和方法归纳与整理复习题第二章烃和卤代烃1 脂肪烃2 芳香烃3 卤代烃归纳与整理复习题第三章烃的含氧衍生物1 醇酚2 醛3 羧酸酯4 有机合成归纳与整理复习题第四章生命中的基础有机化学物质1 油脂2 糖类3 蛋白质和核酸归纳与整理复习题第五章进入合成有机高分子化合物的时代1 合成高分子化合物的基本方法2 应用广泛的高分子材料3 功能高分子材料归纳与整理复习题人教版高中化学选修六目录第一单元从实验走进化学课题一实验化学起步课题二化学实验的绿色追求第二单元物质的获取课题一物质的分离和提纯课题二物质的制备第三单元物质的检测课题一物质的检验课题二物质含量的测定第四单元研究型实验课题一物质性质的研究课题二身边化学问题的探究课题三综合实验设计。
人教版高中化学目录(全部)

高中化学之南宫帮珍创作人教版高中化学必修一目录第一章从实验学化学第一节化学实验基本方法第二节化学计量在实验中的应用归纳与整理第二章化学物质及其变动第一节物质的分类第二节离子反应第三节氧化还原反应归纳与整理第三章金属及其化合物第一节金属的化学性质第二节几种重要的金属化合物第三节用途广泛的金属资料归纳与整理第四章非金属及其化合物第一节无机非金属资料的主角——硅第二节富集在海水中的元素——氯第三节硫和氮的氧化物第四节氨硝酸硫酸归纳与整理人教版高中化学必修二目录第一章物质结构元素周期律第一节元素周期表第二节元素周期律第三节化学键归纳与整理第二章化学反应与能量第一节化学能与热能第二节化学能与电能第三节化学反应的速率和限度归纳与整理第三章有机化合物第一节最简单的有机化合物——甲烷第二节来自石油和煤的两种基本化工原料第三节生活中两种罕见的有机物第四节基本营养物质归纳与整理第四章化学与自然资源的开发利用第一节开发利用金属矿物和海水资源第二节资源综合利用环境呵护归纳与整理人教版高中化学选修一目录第一章关注营养平衡第一节生命的基础能源——糖类第二节重要的体内能源——油脂第三节生命的基础——卵白质第四节维生素和微量元素归纳与整理第二章增进身心健康第一节合理选择饮食第二节正确使用药物第三章探索生活资料第一节合金第二节金属的腐蚀和防护第三节玻璃、陶瓷和水泥第四节塑料、纤维和橡胶归纳与整理第四章呵护生存环境第一节改善年夜气质量第二节爱惜水资源第三节垃圾资源化归纳与整理人教版高中化学选修二目录第一单位走进化学工业课题1 化工生产过程中的基本问题课题2 人工固氮技术──合成氨课题3 纯碱的生产归纳与整理练习与实践第二单位化学与资源开发利用课题1 获取洁净的水课题2 海水的综合利用课题3 石油、煤和天然气的综合利用归纳与整理练习与实践第三单位化学与资料的发展课题1 无机非金属资料课题2 金属资料课题3 高分子化合物与资料归纳与整理练习与实践第四单位化学与技术的发展课题1 化肥和农药课题2 概况活性剂精细化学品归纳与整理练习与实践人教版高中化学选修三目录第一章原子结构与性质第一节原子结构第二节原子结构与元素的性质归纳与整理复习题第二章分子结构与性质第一节共价键第二节分子的立体结构第三节分子的性质归纳与整理复习题第三章晶体结构与性质第一节晶体的知识第二节分子晶体与原子晶体第三节金属晶体第四节离子晶体归纳与整理复习题人教版高中化学选修四目录绪言第一章化学反应与能量第一节化学反应与能量的变动第二节燃烧热能源第三节化学反应热的计算归纳与整理第二章化学反应速率和化学平衡第一节化学反应速率第二节影响化学反应速率的因素第三节化学平衡第四节化学反应进行的方向归纳与整理第三章水溶液中的离子平衡第一节弱电解质的电离第二节水的电离和溶液的酸碱性第三节盐类的水解第四节难溶电解质的溶解平衡归纳与整理第四章电化学基础第一节原电池第二节化学电源第三节电解池第四节金属的电化学腐蚀与防护归纳与整理人教版高中化学选修五目录引言第一章认识有机化合物1 有机化合物的分类2 有机化合物的结构特点3 有机化合物的命名4 研究有机化合物的一般步伐和方法归纳与整理复习题第二章烃和卤代烃1 脂肪烃2 芳香烃3 卤代烃归纳与整理复习题第三章烃的含氧衍生物1 醇酚2 醛3 羧酸酯4 有机合成归纳与整理复习题第四章生命中的基础有机化学物质1 油脂2 糖类3 卵白质和核酸归纳与整理复习题第五章进入合成有机高分子化合物的时代1 合成高分子化合物的基本方法2 应用广泛的高分子资料3 功能高分子资料归纳与整理复习题人教版高中化学选修六目录第一单位从实验走进化学课题一实验化学起步课题二化学实验的绿色追求第二单位物质的获取课题一物质的分离和提纯课题二物质的制备第三单位物质的检测课题一物质的检验课题二物质含量的测定第四单位研究型实验课题一物质性质的研究课题二身边化学问题的探究课题三综合实验设计。
人教版新课标高中化学实验目录

说明:科学探究即为以往的分组实验;实践活动亦即课外科技活动
说明:科学探究即为以往的分组实验;实践活动亦即课外科技活动
福泉中学高中化学实验目录(选修6)
说明:科学探究即为以往的分组实验;实践活动亦即课外科技活动
福泉中学高中化学实验目录(必修1)
福泉中学高中化学实验目录(必修2)
说明:科学探究即为以往的分组实验;实践活动亦即课外科技活动
福泉中学高中化学实验目录(选修4)
说明:科学探究即为以往的分组实验;实践活动亦即课外科技活动
福泉中学高中化学实验目录(选修2)。
最新人教版高中化学实验目录(修订版)
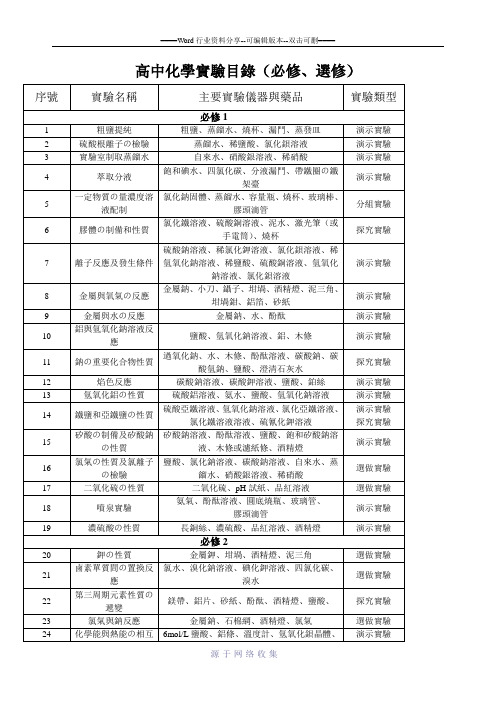
14
鐵鹽和亞鐵鹽の性質
硫酸亞鐵溶液、氫氧化鈉溶液、氯化亞鐵溶液、氯化鐵溶液溶液、硫氰化鉀溶液
演示實驗
探究實驗
15
矽酸の制備及矽酸鈉の性質
矽酸鈉溶液、酚酞溶液、鹽酸、飽和矽酸鈉溶液、木條或濾紙條、酒精燈
演示實驗
16
氯氣の性質及氯離子の檢驗
鹽酸、氯化鈉溶液、碳酸鈉溶液、自來水、蒸餾水、硝酸銀溶液、稀硝酸
演示實驗
9
金屬與水の反應
金屬鈉、水、酚酞
演示實驗
10
鋁與氫氧化鈉溶液反應
鹽酸、氫氧化鈉溶液、鋁、木條
演示實驗
11
鈉の重要化合物性質
過氧化鈉、水、木條、酚酞溶液、碳酸鈉、碳酸氫鈉、鹽酸、澄清石灰水
探究實驗
12
焰色反應
碳酸鈉溶液、碳酸鉀溶液、鹽酸、鉑絲
演示實驗
13
氫氧化鋁の性質
硫酸鋁溶液、氨水、鹽酸、氫氧化鈉溶液
演示實驗
31
糖類、蛋白質の性質
葡萄糖固體、蒸餾水、氫氧化鈉溶液、硫酸銅溶液、碘酒、土豆或面包、雞皮、濃硝酸、蒸發皿、20%蔗糖溶液、稀硫酸
探究實驗
32
鋁熱反應
幹燥氧化鐵粉末5g、鋁粉2g、氯酸鉀固體、鎂條、蒸發皿
選做實驗
33
海帶制碘
海帶、酒精、蒸餾水、3mol/L稀硫酸、3%雙氧水、澱粉溶液
選做實驗
選做實驗
22
第三周期元素性質の遞變
鎂帶、鋁片、砂紙、酚酞、酒精燈、鹽酸、
探究實驗
23
氯氣與鈉反應
金屬鈉、石棉網、酒精燈、氯氣
選做實驗
24
化學能與熱能の相互轉化
6mol/L鹽酸、鋁條、溫度計、氫氧化鋇晶體、氯化銨晶體、2mol/L鹽酸、2mol/L氫氧化鈉溶液、砂紙
高中化学实验目录整理

高中化学实验目录整理必修一「实验1–1」粗盐的提纯「实验1–2」检验提纯后的食盐是否含有杂质(检验SO42-)「实验1–3」检验自来水中是否含有杂质并利用蒸馏除去杂质「实验1–4」萃取和分液「实验1–5」配置一定物质的量浓度的氯化钠溶液(科学探究)气体体积与物质的量、物质的质量之间关系(电解水)「实验2–1」、「实验2–2」、「实验2–3」离子反应及其发生的条件(科学探究)溶液、浊液和胶体的比较「实验3–1」、「实验3–2」、「实验3–3」金属钠的性质「实验3–5」过氧化钠与水反应(科学探究)碳酸钠与碳酸氢钠的性质比较「实验3–6」焰色反应实验(科学探究)铝箔的灼烧(科学探究)铁粉与水蒸汽的反应「实验3–4」铝与盐酸和氢氧化钠溶液反应「实验3–7」.硫酸铝与氨水反应「实验3–8」氢氧化铝分别与盐酸和氢氧化钠溶液的反应「实验3–9」氢氧化铁、氢氧化亚铁的制备「实验3–10」三价铁离子的检验(科学探究)Fe3+与Fe2+的相互转化(实践活动)铝盐和铁盐的净水作用「实验4–1」.硅酸钠与盐酸反应「实验4–2」硅酸盐的耐火性实验「实验4–3」、「实验4–4」、「实验4–5」、氯气的化学性质「实验4–6」氯离子的检验「实验4–7」. 二氧化硫的性质「实验4–8」.氨溶于水的喷泉实验「实验4–9」浓硫酸的强氧化性(科学探究)二氧化氮被水吸收必修二「实验1–1」Cl2、Br2、I2氧化性的比较(科学探究)钾在空气中的燃烧、钾与水的反应(科学探究)Na. 、 Mg、Al金属性强弱的比较「实验1–2」 Na与Cl2的反应「实验2–1」、「实验2–2」、「实验2–3」化学反应过「实验2–4」铜–锌原电池(科学探究)原电池的构成条件探究「实验2–5」温度对化学反应速率的影响「实验2–6」催化剂对化学反应速率的影响(科学探究)CH4的取代反应「实验3–1」苯的性质(科学探究)石蜡油的分解「实验3–2」、「实验3–3」乙醇的化学性质(科学探究)比较醋酸与碳酸的酸性强弱「实验3–4」实验室制乙酸乙酯「实验3–5」糖类和蛋白质的特征反应「实验3–6」蔗糖的水解「实验4–1」铝热反应「实验4–2」证明海带中确实存在碘元素选修一第一章生命的基础能源—糖类「实验1–1」葡萄糖的还原性「实验1–2」蛋白质的盐析「实验1–3」蛋白质的变性「实验1–4」蛋白质的颜色反应以上四个实验作为一课时分组实验科学探究实验:淀粉的水解实践活动实验:用土豆(或南瓜)制一点淀粉,并试验它的性质以上两个实验作为一课时分组实验科学探究:维生素C的化学性质和测试新鲜水果中有无维生素C (演示)第二章促进身心健康科学探究:证明抗酸药的有效成分(实践活动实验)第三章探索生活材料科学探究实验:聚乙烯塑料受热后的变化科学探究实验:几种纤维的性质试验以上两个实验作为一课时分组实验科学探究实验:不同条件下铁钉的锈蚀(实践活动实验)实践活动实验:水泥与水混合后的现象选修四第一章化学反应与能量实践活动实验:中和反应--反应热的测定(分组实验)第二章化学反应速率和化学平衡「实验2–1」测量锌与稀硫酸的反应速率「实验2–2」浓度对反应速率的影响--高锰酸钾溶液与草酸褪色反应「实验2–3」温度对反应速率的影响--硫代硫酸钠与硫酸反应「实验2–4」催化剂对反应速率的影响「实验2–5」平衡的移动(K2Cr2O7、H2SO4、NaOH)「实验2–6」浓度对化学平衡的影响--氯化铁与硫氰化钾的反应平衡「实验2–7」温度对化学平衡的影响--将二氧化氮球浸泡在冰水和热水中科学探究实验:温度对反应速率的影响(KI、H2SO4、、淀粉)科学探究实验:选用适当催化剂改变反应速率的探究(双氧水滴加氯化铁和硫酸铜、高锰酸钾与草酸在有无硫酸锰固体的反应速率比较、硫酸溶液与唾液对淀粉水解催化效果比较)第三章水溶液中的离子平衡「实验3–1」等体积、等浓度盐酸、乙酸H+浓度大小比较「实验3–2」比较弱酸乙酸、碳酸、硼酸的相对强弱「实验3–3」沉淀的溶解--氢氧化镁中滴加水、盐酸和氯化铵溶液「实验3–4」沉淀的转化--沉淀AgCl→AgI→Ag2S「实验3–5」沉淀的转化--沉淀Mg(OH)2→Fe(OH)3科学探究实验:探究盐溶液的酸碱性科学探究实验:探究影响盐类水解程度的因素(FeCl3水解)以上两个实验作为一课时分组实验实践活动实验:测定酸碱滴定曲线(分组实验)第四章电化学基础「实验4–1」原电池的概念--盐桥的作用「实验4–2」电解CuCl2溶液科学探究实验:设计制作原电池并实验以上三个实验作为一课时分组实验「实验4–3」铁钉的锈蚀--铁的吸氧腐蚀实验科学探究实验:设计制作原电池并实验科学探究实验:设计制作一套电解饱和食盐的装置并实验科学探究实验:验证牺牲阳极的阴极保护法选修五第一章认识有机物「实验1–1」含有杂质的工业乙醇的蒸馏「实验1–2」苯甲酸的重结晶第二章烃和卤代烃「实验2–1」、乙炔的实验室制取和乙炔的性质「实验2–2」苯、甲苯与酸性高锰酸钾溶液的反应科学探究:溴乙烷在不同溶剂中与氢氧化钠的反应第三章烃的含氧衍生物「实验3–1」乙醇的消去反应「实验3–2」乙醇与重铬酸钾酸性溶液反应「实验3–3」苯酚的酸性「实验3–4」苯酚与饱和溴水反应「实验3–5」乙醛的银镜反应「实验3–6」乙醛与新制的氢氧化铜反应以上四个实验作为一课时分组实验科学探究实验:验证乙酸、碳酸、苯酚的酸性强弱科学探究实验:探究乙酸乙酯在不同环境下的水解速率以上两个实验作为一课时分组实验第四章生命中的基础有机化学物质「实验4–1」. 葡萄糖的性质实验「实验4–2」蛋白质的盐析「实验4–3」蛋白质的变性「实验4–4」蛋白质的颜色反应科学探究实验:果糖是否具有还原性科学探究实验:蔗糖和麦芽糖的性质科学探究实验:淀粉水解的条件第五章进入合成有机高分子化合物的时代「实验5–1」酚醛树脂的制备及性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学实验目录
大全(人教)
目录:···············1页
必修1···············2页~4页必修2···············5页~6页选修3···············7页
选修4···············8页~9页选修5···············10页
欢迎浏览本文档
正文
高中必修一:
第一章从实验学化学
第一节化学实验基本方法
【实验1-1】粗盐的提纯
【实验1-2】检验其他物质的存在(So42-) 【实验1-3】实验室制取蒸馏水
【实验1-4】碘的萃取
第二节化学计量在实验中的应用【实验1-5】一定物质的量浓度溶液的配置第二章化学物质及其变化
第一节物质的分类
【探究】胶体的性质
第二节离子反应
【实验2-1】离子反应的发生
【实验2-2】离子反应的现象
【实验2-3】离子反应的条件
第三节氧化还原反应
本节无实验
第三章金属及其化合物
第一节金属的化学性质
【实验3-1】钠的取用及物理性质
【实验3-2】钠与氧气的反应
【实验3-3】钠与水的反应
【探究】铁与水蒸气的反应
【实验3-4】铝与酸﹑碱的反应
第二﹑三节几种重要的金属化合物用途广泛的金属材料
【实验3-5】过氧化钠与水的反应
【探究】Na2CO3和NaHCO3的性质
【实验3-6】焰色反应
【实验3-7】Al(OH)3的生成
【实验3-8】Al(OH)3的性质
【实验3-9】Fe2+﹑Fe3+的性质
【实验3-10】铁离子的检验和转化
第四章非金属及其化合物
第一节无机非金属材料的主角——硅
【实验4-1】硅酸的性质
【实验4-2】硅酸钠的性质
第二节富集在海水中的元素——氯
【实验4-3】H2在Cl2中燃烧
【实验4-4】氯水的漂白作用
【实验4-5】干燥的氯气能否漂白物质
【实验4-6】Cl-的检验
第三节硫和氮的氧化物
【实验4-7】二氧化硫的性质
第四节氨硝酸硫酸
【实验4-8】喷泉实验
【实验4-9】浓硫酸与铜反应
~~~~~高中必修一实验完结~~~~~ 来自——引力Blu
~~~~~高中必修二实验开始~~~~~
高中必修二:
第一章物质结构元素周期律第一节元素周期表
【探究】钠﹑钾的性质比较
【实验1-1】卤素单质间的置换反应
第二节元素周期律
【探究】探究钠﹑镁﹑铝的金属性
第三节化学键
【实验1-2】钠与氯气的反应
第二章化学反应与能量
第一节化学能与热能
【实验2-1】化学反应的放热现象
【实验2-2】化学反应的吸热现象
【实验2-3】中和反应过程中能量变化
第二节化学能和电能
【实验2-4】原电池原理
第三节化学反应的速率和限度【实验2-5】温度对化学反应速率的影响
【实验2-6】催化剂对化学反应速率的影响
第三章有机化合物
第一节最简单的有机化合物——甲烷
【探究】甲烷的取代反应
第二节来自石油和煤的两种基本化工原料【实验3-1】苯的性质实验
第三节生活中两种常见的有机物
【实验3-2】乙醇与钠的反应
【实验3-3】乙醇的催化氧化
【实验3-4】乙醇的酯化反应
第四节基本营养物质
【实验3-5】糖类和蛋白质的特征反应
第四章化学与自然资源的开发利用
第一节开发利用金属矿物和海水资源【实验4-1】铝热反应
【实验4-2】海带中提碘
第二节资源综合利用环境保护
本节无实验
~~~~~高中必修二实验结束~~~~~
来自引力Blu
~~~~~高中选修三实验开始~~~~~
高中选修三:
第一章原子结构与性质
本章无实验
第二章分子结构与性质
【实验2-1】配合物的颜色
【实验2-2】配合物的生成
【实验2-3】配合物的颜色
第三章晶体结构与性质
本章无实验
~~~~~高中选修三实验结束~~~~~ 来自引力Blu
~~~~~高中选修四实验开始~~~~~
高中选修四:
第一章化学反应与能量
本章无实验
第二章化学反应速率和化学平衡
第一﹑二节化学反应速率影响化学反应速率的因素
【实验2-1】化学反应速率的测定
【实验2-2】浓度对反应速率的影响
【实验2-3】温度对反应速率的影响
【探究】温度对反应速率的影响
【实验2-4】催化剂对反应速率的影响
【探究】催化剂对反应速率的影响
第三节化学平衡化学反应进行的方向【实验2-5】浓度对化学平衡的影响
【实验2-6】浓度对化学平衡的影响
【实验2-7】温度对化学平衡的影响
第四章水溶液中的离子平衡
第一﹑二节弱电解质的电离水的电离和溶液的酸碱性
【实验3-1】电解质的强弱
【实验3-2】比较弱酸的相对强弱
【实验】酸碱中和滴定
第三节盐类的水解
本节无实验
第四节难容电解质的溶解平衡
【实验3-3】沉淀的溶解
【实验3-4】卤化银沉淀的转化
【实验3-5】氢氧化物的沉淀的转化
第四章电化学基础
第一﹑二节原电池化学能源
【实验4-1】原电池原理
第三﹑四节电解质金属的电化学腐蚀与保护
【实验4-2】电解原理
【实验4-3】铁的吸氧腐蚀
~~~~~高中选修四实验结束~~~~~
来自引力Blu
~~~~~高中选修五实验开始~~~~~ 高中选修五:
第一章认识有机化合物
本章无实验
第二章烃和卤代烃
【实验2-1】乙炔的性质
【实验2-2】苯的同系物的性质
第三章烃的含氧衍生物
【实验3-1】乙醇的消去反应
【实验3-2】乙醇的氧化反应
【实验3-3】苯酚的酸性
【实验3-4】苯酚的取代反应
【实验3-5】乙醛的氧化反应(银镜反应)
【实验3-6】乙醛与新制Cu(OH)2悬浊液的反应
第四章生命中的基础有机化学物质
【实验4-1】葡萄糖的性质
【实验4-2】蛋白质的盐析
【实验4-3】蛋白质的变性
【实验4-4】蛋白质的颜色反应
第五章进入合成有机高分子化合物时代
本章无实验
~~~~~高中选修五实验结束~~~~~ 来自引力Blu
~~~~~高中化学实验目录结束~~~~~
感谢浏览本文档。
