13分离富集的方法
分析化学中常用的分离和富集方法

分析化学中常用的分离和富集方法1.蒸馏法:蒸馏是根据溶液中各组分的沸点差异来进行分离的方法。
通过加热混合液体使其汽化,然后再冷凝收集汽化物,从而分离不同沸点的组分。
蒸馏法适用于溶液中的挥发性组分富集和纯化。
2.萃取法:萃取是利用两种或多种不相溶液体的亲和性差异将待分析的组分从混合体系中转移到单一溶剂中的分离方法。
常见的有液液萃取和固相萃取。
萃取法适用于挥发性差异较小的物质分离。
3.结晶法:结晶是根据物质在溶液中的溶解度差异来进行分离的方法。
通过逐渐降低溶解度使其中一种或几种溶质结晶出来,从而实现分离和富集。
结晶法适用于固体组分富集和纯化。
4.洗涤法:洗涤是通过溶解或稀释洗涤剂来将带有目标分子的样品与杂质分离的方法。
洗涤法适用于固态、液态和气态混合物中分离和富集。
5.离子交换法:离子交换是通过离子交换树脂的吸附作用来分离和富集组分的方法。
树脂上的离子可与溶液中的离子发生交换,从而实现目标组分的富集。
离子交换法适用于溶液中离子的分离和富集。
6.气相色谱法:气相色谱是一种利用气相色谱柱对待分析物进行分离的方法。
根据化合物在不同固定相上的吸附特性差异进行分离和富集。
气相色谱法适用于气态和挥发性物质的分离和富集。
7.液相色谱法:液相色谱是一种利用液相色谱柱对待分析物进行分离的方法。
根据待分析物在流动相和固定相之间的分配系数差异进行分离和富集。
液相色谱法适用于液态和溶液中的分离和富集。
8.电泳法:电泳是一种利用电场对待分析物进行分离和富集的方法。
根据待分析物在电场中的迁移速度差异来分离和富集。
电泳法适用于溶液中离子和带电粒子的分离和富集。
以上是常见的分离和富集方法,每一种方法在不同场合的适应性和分离效果各有差异。
在实际应用中,需要根据具体情况选择合适的方法。
不同的分析问题可能需要结合多种方法的优势来达到理想的分析结果。
第章分析化学中常用的分离富集方法

第章分析化学中常用的分离富集方法分析化学是研究物质成分和性质的科学,分析化学中常常需要进行分离和富集样品中的目标组分以便进行后续的定性与定量分析。
在分析化学中,常用的分离富集方法包括溶剂提取法、固相萃取法、离子交换法、凝胶过滤法等。
以下将对这些方法进行详细介绍。
1.溶剂提取法溶剂提取法是利用目标组分在水相和有机相之间的分配系数差异将目标组分从样品中分离出来的方法。
该方法常用于富集有机物、金属离子等。
常用的溶剂包括正己烷、乙酸乙酯、乙酸纳等。
溶剂提取法具有操作简便、富集效果好的特点,但需要注意溶剂的选择和体积比的控制。
2.固相萃取法固相萃取法是利用固态吸附剂或吸附剂包裹在固态材料上,通过吸附目标物质来实现分离和富集的方法。
该方法常用于富集挥发性有机物、农药、药物等。
常用的吸附剂有活性炭、硅胶、聚酯、聚乙烯等。
固相萃取法具有操作简便、富集效果好的特点,但需要注意吸附剂的选择和样品前处理的步骤。
3.离子交换法离子交换法是利用离子交换树脂将样品中的离子按照离子交换性质进行分离和富集的方法。
离子交换树脂是一种具有交换离子基团的吸附剂,可以选择性地吸附目标离子。
离子交换法常用于富集金属离子、阴离子、阳离子等。
常用的离子交换树脂有强阴离子交换树脂、强阳离子交换树脂、弱阴离子交换树脂等。
离子交换法具有选择性好、重现性好的特点,但需要注意树脂的选择和样品的处理方法。
4.凝胶过滤法凝胶过滤法是利用凝胶材料的孔隙大小将大分子与小分子进行分离和富集的方法。
凝胶过滤法常用于分离大分子如蛋白质、DNA等。
常用的凝胶材料有琼脂糖、聚丙烯酰胺凝胶等。
凝胶过滤法具有操作简便、选择性好的特点,但需要注意凝胶材料的选择和样品前处理的步骤。
以上是分析化学中常用的分离富集方法,不同的方法适用于不同的目标组分和样品类型。
在进行分析前,需要根据样品的特性和分析要求选择合适的分离富集方法,并进行合理的样品前处理步骤,以确保分析结果的准确性和可靠性。
分析化学中常用分离富集方法

分析化学中常用分离富集方法在分析化学中,常用的分离富集方法有溶剂萃取、吸附、离子交换、凝胶渗透层析、电动毛细管层析等。
这些方法根据分析样品的性质以及分离纯化的目的选择合适的方法。
下面将对这些方法进行详细介绍。
溶剂萃取是一种常用的分离富集方法,它基于溶液中不同物质的相溶性差异。
一般来说,溶液中的物质可以根据其分配系数(即溶于有机溶剂相对于水溶液中浓度比值)在两个不同的相中分散。
通过调整溶液的pH、温度或添加其他化学试剂,可以改变物质在两个相中的分配系数,从而实现分离富集功能。
溶剂萃取适用于分离大分子有机化合物、脂肪酸、金属离子等。
吸附是一种以吸附剂与待分离物质之间的吸附作用为基础的分离方法。
吸附剂可以是固体(如硅胶、活性炭、分子筛)或液体(如活性炭糊剂、萃取液)。
吸附分离原理包括亲和性吸附、离子交换吸附等。
亲和性吸附是通过亲和剂和待测物之间的特异性相互作用实现分离,如抗体-抗原、酶-底物、核酸-亲和基团的结合。
离子交换吸附是利用固定在吸附剂上的离子官能团与溶液中的离子发生相互作用实现分离,如阳离子交换剂、阴离子交换剂。
离子交换是利用带电荷的树脂与待分离物质之间的吸附-解吸作用,实现分离富集的方法。
树脂具有氧阴离子或聚合物等功能基团,它们可以与离子相互作用形成络合物,通过控制pH、离子浓度等参数的变化,实现离子交换和分离。
离子交换常用于水样中稀释度高的金属离子分离、无机阴阳离子的分离等。
凝胶渗透层析:是一种以凝胶为固定相进行分析的方法。
凝胶是由网状三维网络结构构成的,分子可以在凝胶孔隙中进行渗透和扩散。
样品进入凝胶后,分子的速率取决于其分子尺寸,较大的分子会被凝胶阻滞在孔隙中,而较小的分子则能够通过孔隙。
通过调节凝胶孔隙的大小和形状,可以实现对分子大小的选择性分离。
电动毛细管层析(CE)是近年来发展起来的一种高效分离富集方法。
它利用毛细管内的电细胞电动力学作用,使待分离物质在电场作用下,根据体积、电荷、形状等特性进行分离。
分析化学中的分离与富集方法

分析化学中的分离与富集方法
1.蒸馏法:根据不同物质的沸点差异进行分离和富集。
常用的蒸馏方
法有常压蒸馏、减压蒸馏、水蒸气蒸馏等。
2.萃取法:利用两种或多种溶剂相互不溶的特性,将目标物质从混合
物中转移到溶剂中,从而达到分离和富集的目的。
典型的例子有固-液萃
取和液-液萃取。
3.变温结晶法:根据不同物质溶解度随温度变化的规律,通过调节温
度使目标物质结晶,从而将其与其他组分分离。
4.气相色谱法:利用物质在固定相和流动相之间的分配系数差异,以
气态物质的流动为介质,将目标物质从混合物中分离并富集。
1.沉淀法:通过在混合物中加入沉淀剂,使得目标物质与沉淀剂反应
生成不溶性沉淀,从而分离富集目标物质。
这种方法常用于分离金属离子。
2.化学还原法:通过还原剂将目标物质转化为不溶性化合物,从而使
其与混合物分离。
例如,将有机污染物还原为不溶性沉淀。
3.化学萃取法:利用目标物质与萃取剂之间的化学反应进行分离。
例如,萃取剂选择性地与目标物质发生络合反应,形成可溶性络合物,从而
将其与其他组分分离。
4.吸附分离法:通过吸附剂对目标物质的选择性吸附将其从混合物中
分离。
主要有固相萃取、层析和磁性吸附等方法。
以上仅是分析化学中常用的一些分离与富集方法,实际应用中还有很
多其他方法,如超临界流体萃取、电分离、膜分离等。
在实际的分析过程
中,要根据混合物的性质和目标物质的特点选择合适的方法,并合理优化条件,以提高分离效果和分析结果的准确性。
分析化学中常用的分离和富集方法
3 溶于CHCl3
亲水 水合离子的正电性被中 和,亲水的水分子被疏 水有机大分子取代
疏水
8-羟基喹啉
萃取剂
CHCl3
溶剂
3.反萃取
Back extraction
萃取的反过程(将组分从有机溶液中萃取到水溶液中)
如:8-羟基喹啉铝螯合物中加入1mol/L HCl
12
4. 分配系数与分配比 分配系数 partition coefficient HA (w) HA (o)
常用分离方法
沉淀分离法 溶剂萃取分离法
Precipitation Solvent extraction Ion exchange
离子交换分离法
色谱分离法
挥发和蒸馏分离法
Chromatography
Volatilization and distillation
11.3沉淀分离与富集 ——依据溶度积分硫酸盐、卤化物、磷酸盐等 有机沉淀剂:草酸、铜铁试剂、铜试剂、丁二酮肟、苦杏仁酸等
例如常见阳离子的两酸两碱分离
分组 组试剂 Ⅰ HCl Ag Hg (I) (Pb) Ⅱ H2SO4 Ca Sr Ba Pb Ⅲ NH4Cl - NH3 Ⅳ NaOH Ⅴ 可溶组* Na K Zn NH4+
萃取分离法 在含有被分离物质的水溶液中,加入 萃取剂和与水不相混溶的有机溶剂,
震荡,利用物质在两相中的分配不同
的性质,使一些组分进入有机相中, 使另一些组分仍留在水相中,从而达
到分离的目的。
梨形分液漏斗
例:I2的萃取
11.4.1 萃取分离的基本原理
1. 萃取分离的依据 hydrophilic 物质 hydrophobic 亲水性 离子型化合物 极性
分析化学_分析化学中常用的分离和富集方法

分析化学_分析化学中常用的分离和富集方法分析化学是研究物质的组成、结构和性质的一门学科。
在分析化学中,为了检测和测定分析对象中微量或痕量的目标物质,常常需要使用分离和富集方法,以提高目标物质的检测灵敏度。
1.搅拌萃取:搅拌萃取是一种常见的分离和富集方法。
通过将样品与其中一种有机溶剂反复搅拌混合,使目标物质从水相转移到有机相中,从而实现分离和富集。
该方法适用于目标物质在水相和有机相之间有较大的分配系数差异的情况。
2.相间萃取:相间萃取是指根据目标物质在两相中的分配差异进行分离和富集的方法。
常见的相间萃取方法包括液液萃取、固相微萃取和液相萃取等。
相间萃取通常需要将样品与萃取剂反复摇匀并分离两相,以实现目标物质的富集。
3.固相萃取:固相萃取是指使用固定在固相萃取柱或固相萃取膜上的吸附剂来对目标物质进行分离和富集的方法。
固相萃取方法具有操作简单、富集效果好、适用范围广等优点,常用于分析化学中的前处理过程。
4.蒸馏:蒸馏是指通过加热使液体汽化,然后冷凝收集汽化液体的方法。
蒸馏可以实现液体的分离和富集,适用于目标物质在样品中的浓度较低且需高度富集的情况。
5.色谱分离:色谱分离是一种基于目标物质在不同相之间的分配差异进行分离的方法。
常用的色谱分离方法包括气相色谱、液相色谱、固相色谱等。
色谱分离方法具有分辨率高、重复性好、操作简便等优点,广泛应用于分析化学中。
6.气相萃取:气相萃取是指利用气相萃取装置将目标物质从固体、液体或气体中分离和富集的方法。
气相萃取主要通过溶剂的蒸发和再冷凝,将目标物质从样品中富集到溶剂中,然后通过蒸发或其他方法将溶剂去除,得到目标物质。
7.凝胶电泳:凝胶电泳是一种基于目标物质的电荷、大小或形状差异进行分离和富集的方法。
常见的凝胶电泳方法包括聚丙烯酰胺凝胶电泳、聚丙烯酰胺梯度凝胶电泳等。
凝胶电泳方法具有分辨率高、富集效果好等优点,适用于复杂样品的分析。
总之,分析化学中常用的分离和富集方法有搅拌萃取、相间萃取、固相萃取、蒸馏、色谱分离、气相萃取和凝胶电泳等。
无机化学 013分析化学中常用的分离和富集方法

镍(II) +丁二酮肟 ð 丁二酮肟-镍(II) ‖ð CHCl3
带电荷,亲水 萃取剂
电中性,疏水
萃取溶剂
2 分配定律、分配系数和分配比
分配系数: 有机溶剂从水相中萃取溶质A,若A在
两相中的存在形态相同,平衡时,在
有机相的浓度为[A]o, 水相的浓度 为[A]w 之比,用KD表示。
分配定律
KD=
[A]o [A]w
13.2 沉淀与过滤分离
1 常量组分的沉淀分离
(1) 无机沉淀剂 ① 氢氧化物沉淀 ② 硫酸盐沉淀 ③ 卤化物沉淀 ④ 硫化物沉淀 ⑤ 磷酸盐沉淀
(2) 有机沉淀剂 ① 草酸 ② 铜铁试剂 (N-亚硝基苯基羟铵) ③ 铜试剂 (二乙胺基二硫代甲酸钠, DDTC)
2 痕量组分的富集和共沉淀分离 常量: 克 微量: 毫克,10-3 痕量: 微克,10-6,ppm 超痕量: 纳克,10-9,ppb 皮克,10-12,ppt 飞克,10-15
b 溶液的酸度 酸度影响萃取剂的离解,络合物的稳定性,金属离 子的水解
c 萃取溶剂的选择 l 金属络合物在溶剂中有较大的溶解度,尽 量采用结构与络合物结构相似的溶剂, l 萃取溶剂的密度与水溶液的密度差别要大, 粘度要小,易分层, l 毒性小,最好无毒,并且挥发性小。
6 萃取方法及分析化学中的应用 萃取方法 • 单级萃取 • 连续萃取 • 多级萃取
分配比: 物质A在两相中可能存在多种形态,在两相 中的各形态浓度总和(c)之比,用D表示。
D=
cAo cAw
=
[A1]o+[A2]o+…+[An]o [A1]w+[A2]w+…+[An]w
如果用Vo (mL) 溶剂萃取含有mo (g) 溶质A的Vw (mL)试液, 一次萃取后,水相中剩余m1(g)的溶质A,进入有机相的溶质
分析化学中常用的分离和富集方法

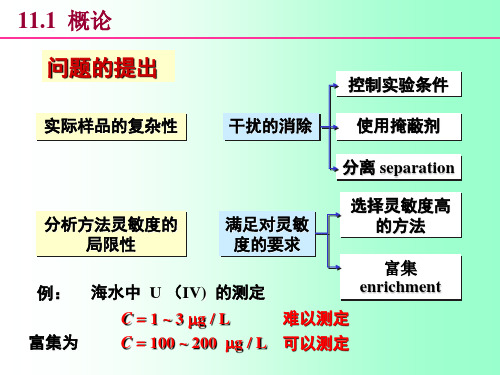
分析化学中常⽤的分离和富集⽅法第8章分析化学中常⽤的分离和富集⽅法8.1 概述分离和富集是定量分析化学的重要组成部分。
当分析对象中的共存物质对测定有⼲扰时,如果采⽤控制反应条件、掩蔽等⽅法仍不能消除其⼲扰时,就要将其分离,然后测定;当待测组分含量低、测定⽅法灵敏度不⾜够⾼时,就要先将微量待测组分富集,然后测定。
分离过程往往也是富集过程。
对分离的要求是分离必须完全,即⼲扰组分减少到不再⼲扰的程度;⽽被测组分在分离过程中的损失要⼩⾄可忽略不计的程度。
被测组分在分离过程中的损失,可⽤回收率来衡量。
1. 回收率(R )其定义为:%100?==分离前待测组分的质量分离后待测组分的质量R对质量分数为1%以上的待测组分,⼀般要求R >99.9%;对质量分数为0.01%~1%的待测组分,要求R >99%;质量分数⼩于0.01%的痕量组分要求R 为90%~95%。
例1. 含有钴与镍离⼦的混合溶液中,钴与镍的质量均为20.0mg ,⽤离⼦交换法分离钴镍后,溶液中余下的钴为0.20mg ,⽽镍为19.0mg,钴镍的回收率分别为多少?解:%0.10.2020.0 %,0.950.200.19Co Ni ====R R2. 分离因⼦S A/B分离因⼦S B/A 等于⼲扰组分B 的回收率与待测组分A 的回收率的⽐,可⽤来表⽰⼲扰组分B 与待测组分A 的分离程度。
%100/?=A B A B R R SB 的回收率越低,A 的回收率越⾼,分离因⼦越⼩,则A 与B 之间的分离就越完全,⼲扰消除越彻底。
8.2 沉淀分离法沉淀分离法是⼀种经典的分离⽅法,它是利⽤沉淀反应选择性地沉淀某些离⼦,⽽与可溶性的离⼦分离。
沉淀分离法的主要依据是溶度积原理。
沉淀分离法的主要类型如下表。
8.2.1常量组分的沉淀分离1. 氢氧化物沉淀分离⼤多数⾦属离⼦都能⽣成氢氧化物沉淀,各种氢氧化物沉淀的溶解度有很⼤的差别。
因此可以通过控制酸度,改变溶液中的[OH-],以达到选择沉淀分离的⽬的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13.5 离子交换分离法
离子交换分离法:利用离子交换剂与溶液 中的离子之间发生的交换反应进行分离的 方法。
分析化学
1.离子交换剂的种类
无机离子交换剂
有机离子交换剂 (离子交换树脂)
分析化学
强酸性阳离子交换树脂
阳离子交换树脂
R-SO3H树脂, 如国产732
弱酸性阳离子交换树脂 R-COOH, R-OH 树脂
e 萃取蒸馏(extractive distillation)
例由氢化苯(80.1℃)生成环己烷(80.8℃)时,一般的蒸馏不能分离,加入 苯胺(184℃)与苯形成络合物,在比苯高的温度沸腾,从而分离环己烷
分析化学
13.3 沉淀分离
1 常量组分的沉淀分离 氢氧化物沉淀
NaOH法
可使两性氢氧化物(Al,Ga,Zn,Be,CrO2,Mo,W,GeO32-, V, Nb,Ta ,Sn,Pb等)溶解而与其它氢氧化物(Cu, Hg, Fe, Co, Ni, Ti. Zr, Hf, Th, RE等)沉淀分离
碱性阳离子染料与络阴离子形成的缔合物,如次 甲基蓝与[BF4]-、罗丹明B与[AuCl4] -,四苯胂 [(C6H5)4As]+与WO42-; 金属大络阳离子(Cu+-新亚铜灵络阳离子与Cl-)及 季铵盐与阴离子或金属络阴离子形成的缔合物。
分析化学
c 溶剂化合物萃取体系 中性有机溶剂分子通过配位原子与金属离
分析化学
萃取体系
➢ 螯合物萃取体系 ➢ 离子缔合物萃取体系 ➢ 溶剂化合物萃取体系 ➢ 共价化合物(简单分子)萃取体系
分析化学
a 螯合萃取体系 螯合物萃取是金属离子萃取的主要方式,萃
取剂是螯合剂,形成的螯合物为中性,溶于有机 溶剂被萃取。
如双硫腙与Hg2+的络合物,8-羟基喹啉与La3+ 的络合物等属螯合物萃取体系。
分析化学
8 超临界流体萃取 原理:
超临界流体萃取:气-固萃取 萃取剂: 超临界条件下的气体 粘度低,接近零的表面张力,比很多液体容易渗透 固体颗粒,易于除去。
超临界萃取分离设备组成及流程:
分析化学
超临界流体:
1822年, Baron C.Cagnaird 发现,如果加热某气体在一 定的温度以上时,无论施加多大的压力都不能迫使该气 体成为液体,那个温度叫临界温度。在这个温度使气体 变为液体的最低压力,叫临界压力。在这个条件以上的 任意气体知道处于超临界。
lgD=lgKex-lgaM-nlgaHL+nlgc(HL)o+npHw
水溶液的pH值是影响螯合物萃取的一个很重要因素 分配比决定于萃取平衡常数、萃取剂浓度和水溶液的酸度
分析化学
b 离子缔合物萃取体系 阳离子和阴离子通过静电引力相结合而形成电中
性的化合物称为离子缔合物。该物具有疏水性,能 被有机溶剂萃取。
如果用Vo (mL) 溶剂萃取含有mo (g) 溶质A的Vw (mL)试液, 一次萃取后,水相中剩余m1(g)的溶质A,进入有机相的溶 质A为(mo-m1) (g), 此时分配比为:
D=
cAo cAw
=
(mo-m1)/Vo m1/Vw
m1=mo[Vw/(DVo + Vw)] 萃取两次后,水相中剩余物质A为m2(g) m2=mo[Vw/(DVo + Vw)]2 …
利用生成混晶进行共沉淀,选择性较好,如硫酸铅 -硫酸鋇,磷酸铵镁-砷酸铵镁等
有机共沉淀剂进行共沉淀
利用胶体的凝聚作用进行共沉淀, 如动物胶、丹宁 离子缔合共沉淀,如甲基紫与InI4-。 利用“固体萃取剂”进行共沉淀,例 1-萘酚的乙醇溶
液中,1-萘酚沉淀,并将U(VI)与1-亚硝基-2-萘酚的螯 合物共沉淀下来。
该式边取对数: lgD=lgKex+nlgc(HL)o+npH
分析化学
实际萃取过程涉及副反应,采用条件萃取常数Kex 描述萃取平衡:
Kex =
Kex aM aHLn
= [MLn]o[H+]wn [M]wc(HL)on
D
=
[MLn]o [M]w
= Kex
c(HL)on aM aHLn[H+]wn
c 减压和真空蒸馏
在大气压以下的蒸馏称为减压和真空蒸馏
分析化学
d 共沸蒸馏
例如无水乙醇的制备,水和乙醇形成共沸物(95%乙醇),b.p.=78.15℃ 加入苯形成另一共沸物(苯74%,乙醇18.5%,水7.5%) b.p.=65℃ 在65℃蒸馏, 除去水, 在68℃苯和乙醇形成共沸物(苯67.6%,乙醇32.4%) 在68℃蒸馏直到温度升高,在78.5℃能获得纯乙醇。
第13章 分析化学中的分离富集方法
分析化学
13.1 概述 13.2 气态分离法 13.3 沉淀与过滤分离 13.4 萃取分离法 13.5 离子交换分离法 13.6 色谱分离 13.7 电分离法 13.8 气浮分离法 13.9 膜分离
13.1 概述
分离 富集
回收率=
分离后所得待测组分质量 试样中原有待测组分质量
b 溶液的酸度 酸度影响萃取剂的离解,络合物的稳定性,金属 离子的水解
c 萃取溶剂的选择 金属络合物在溶剂中有较大的溶解度,尽 量采用结构与络合物结构相似的溶剂, 萃取溶剂的密度与水溶液的密度差别要大, 粘度要小,易分层, 毒性小,最好无毒,并且挥发性小。
分析化学
6 萃取方法及分析化学中的应用
两相中的存在形态相同,平衡时,在
有 机 相 的 浓 度 为 [A]o, 水 相 的 浓 度 为 [A]w 之比,用KD表示。
分配定律
KD=
[A]o [A]w
分配比: 物质A在两相中可能存在多种形态,在两相 中的各形态浓度总和(c)之比,用D表示。
分析化学
D=
cAo cAw
=
[A1]o+[A2]o+…+[An]o [A1]w+[A2]w+…+[An]w
铜试剂 (二乙胺基二硫代甲酸钠,DDTC) 沉淀Cu,Cd,Ag,Co,Ni,Hg.Pb.Bi,Zn等重金属离子,与 稀土、碱土金属离子及铝等分开
分析化学
2 痕量组分的富集和共沉淀分离
无机共沉淀剂进行共沉淀
利用表面吸附进行痕量组分的共沉淀富集, 选择性 不高。共沉淀剂为Fe(OH)3, Al(OH)3等胶状沉淀, 微 溶性的硫化物,如Al(OH)3作载体共沉淀Fe3 +,TiO2+; HgS共沉淀Pb2+
氨水-铵盐缓冲法
控制pH值8~10,使高价离子沉淀(Al, Sn等), 与一、二价 离子(碱土金属,一、二副族)分离
ZnO悬浊液法
控制pH=6, 定量沉淀pH6以下能沉淀完全的金属离子
有机碱法
六次甲基四胺,吡啶,苯胺等有机碱与其共轭酸组成溶液 控制溶液的pH值
分析化学
硫酸盐沉淀
硫酸作沉淀剂,浓度不能太高,因易形成MHSO4盐 加大溶解度, 沉淀碱土金属和Pb2+, CaSO4溶解度大,加 入乙醇降低溶解度。
分析化学
如果水溶液中仅是游离的金属离子,有机相中仅是螯合 物一种MLn形态,则:
D
=
[MLn]o [M]w
= Kex
[HL]on [H+]wn
萃取时有机相中萃取剂的量远远大于水溶液中金属离子的量,
进入水相和络合物消耗的萃取剂可以忽略不计。即是
[HL]o≈c(HL)o, 上式变为
D = Kex
c(HL)on [H+]wn
萃取方法 • 单级萃取 • 连续萃取 • 多级萃取
萃取剂比水重
分析化学
萃取剂比水轻
索氏萃取器
7 固相萃取和固相微萃取
固相萃取:液-固分离
分离载体一般为硅氧基甲烷,颗粒直径4080 mm
一般程序为: 选适宜SPE管
润湿载体
加入样品溶液到载体
分析化学
洗涤除去共存物 洗脱待分离物质
固相微萃取技术 始于1992年,(加拿大的Janusz Pawliszyn)
R2O>ROH>RCOOH>RCOOR'>RCOR'>RCHO 也有把该体系列入离子缔合萃取体系。
d 共价化合物萃取体系
也叫简单分子萃取体系,如I2,Br2,GeCl4,OsO4等不带电 荷,在水溶液中以分子形式存在,可为CCl4,C6H6等萃取
分析化学
5 萃取条件的选择
a 萃取剂的选择 螯合物稳定,疏水性强,萃取率高
卤化物沉淀
氟化稀土和与Mg(II), Ca(II), Sr(II), Th(IV)氟化物沉淀, 冰晶石法沉淀铝 在pH=4.5 Al(III)与NaF生成(NaAlF6) 沉淀分离Al(III),与Fe(III),Cr(III),Ni(II),V(V)Mo(VI)等分离
分析化学
硫化物沉淀
控制酸度,溶液中[S2-]不同,根据溶度积,在不同酸 度析出硫化物沉淀, As2S3, 12M HCl; HgS,7.5M HCl; CuS, 7.0M HCl; CdS, 0.7M HCl; PbS, 0.35M HCl; ZnS, 0.02M HCl; FeS, 0.0001M HCl; MnS,0.00008 M HCl
萃取n次后,水相中剩余物质A为mn(g) mn=mo[Vw/(DVo + Vw)]n
分析化学
3 萃取率
萃取率用于衡量萃取得总效果,用E表示
E=
溶质A在有机相中的总量 溶质A的总量
×100%
=
coVo coVo+cwVw
×100%
E=
D D+(Vw/Vo)
×100%
式中,Vw/Vo称相 当Vw/Vo=1时, E=D/(D+1)×100% 在D>10时,E>90%, D>100, E>99%
