化学经典习题
【化学】 化学方程式的计算练习题(含答案)经典

【化学】 化学方程式的计算练习题(含答案)经典一、中考化学方程式的计算1.碳酸氢钠用于焙制糕点,在270℃时分解:323222NaHCO Na C ΔO H O CO ++↑。
现取3NaHCO 16.8g ,在敞口容器中加热到质量不再改变为止,减少的质量为( ) A .4.4gB .6.2gC .8.8gD .10.6g【答案】B【解析】【分析】【详解】根据题意可知,在敞口容器中加热到质量不再改变为止,剩余物质为固体碳酸钠。
此题为固体的差量计算,设减少的质量为x 。
323222NaHCO Na CO +H O +CO 1681066216.8g x ↑△固体减少的质量16816.8g =62xx=6.2g2.铝被称为“年轻的金属”,工业上用电解氧化铝的方法制取金属铝。
反应的化学方程式为2Al 2O 3通电 4Al +3O 2↑。
请计算生成1.08t 金属铝,理论上需要氧化铝的质量是多少____?【答案】2.04t【解析】【分析】【详解】解:设生成1.08t 金属铝,理论上需要氧化铝的质量为x 2322Al O 4Al +3O 204108x 1.08t↑通电 204x =108 1.08tx=2.04t答:生成1.08t 金属铝,理论上需要氧化铝的质量为2.04t 。
3.我国科学家实现电催化高效分解硫化氢制氢技术,反应的化学方程式为H 2S 一定条件S ↓ +H 2 .请计算生产 3吨 H 2,理论上需要 H 2S 多少吨?【答案】51吨【解析】【分析】【详解】解:设理论上需要H 2S 的质量为x22S +H 342x3tH S ↓一定条件34x =23tx=51 t答:理论上需要H 2S 51吨。4.某工厂需要16kg 氧气作原料,若用电解水的方法制取这些氧气,消耗水的质量是_________?(要求写出计算过程)【答案】18kg【解析】【分析】【详解】设消耗水的质量为x2222H O2H +O 3632x 16kg↑↑通电 36x =3216kgx=18kg答:消耗水的质量是18kg 。
高三化学经典习题(含答案)

高三化学经典习题(含答案)1.我国明代《本草纲目》中收载药物1 892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。
”这里所用的“法”是指A.萃取 B.渗析 C.蒸馏 D.干馏答案:C解析:从浓酒中分离出乙醇,利用酒精与水的沸点不同,用蒸馏的方法将其分离提纯,这种方法是蒸馏。
高考中如何考查常见物质的分离和提纯?高考中常常结合分离提纯考查仪器的使用或填写仪器的名称,在选择题或大题某一项中进行考查。
2.下列气体去除杂质的方法中,不能实现目的的是( )气体(杂质) 方法A SO2(H2S) 通过酸性高锰酸钾溶液B Cl2(HCl) 通过饱和的食盐水C N2(O2) 通过灼热的铜丝网D NO(NO2) 通过氢氧化钠溶液答案:A解析:A项,SO2和H2S都具有较强的还原性,都可以被酸性高锰酸钾溶液氧化,因此在用酸性高锰酸钾溶液去除杂质H2S时,SO2也会被吸收,故不能实现除杂目的;B项,氯气中混有少量的氯化氢气体,可以用饱和的食盐水除去,饱和的食盐水在吸收氯化氢气体的同时,也会抑制氯气在水中的溶解,故能实现除杂目的;C项,氮气中混有少量氧气,在通过灼热的铜丝网时,氧气可以与之发生反应:2Cu+O22CuO,而铜与氮气不反应,因此可以采取这种方式除去杂质氧气,故能实现除杂目的;D项,NO2可以与NaOH发生反应:2NO2+2NaOH===NaNO3+NaNO2+H2O,NO与NaOH溶液不能发生反应,尽管NO可以与NO2一同跟NaOH发生反应:NO+NO2+2NaOH===2NaNO2+H2O,但由于杂质的含量一般较少,因此也不会对NO的量产生较大的影响,故能实现除杂的目的。
3.下列有关实验的说法不正确的是( )A.萃取Br2时,向盛有溴水的分液漏斗中加入CCl4,振荡、静置分层后,打开旋塞,先将水层放出B.做焰色反应前,铂丝用稀盐酸清洗并灼烧至火焰呈无色C.乙醇、苯等有机溶剂易被引燃,使用时须远离明火,用毕立即塞紧瓶塞D.可用AgNO3溶液和稀HNO3区分NaCl、NaNO2和NaNO3答案:A解析:A项,CCl4的密度比水的密度大,故萃取Br2时,向盛有溴水的分液漏斗中加入CCl4,振荡、静置分层,打开旋塞,先将CCl4层放出,A操作错误;B项,做焰色反应前,先将铂丝用稀盐酸清洗并灼烧至无色的目的是排除铂丝上粘有的其他金属元素对待检测金属元素产生的干扰,B操作正确;C项,乙醇、苯等有机溶剂属于易燃物品,故使用时必须远离明火和热源,用毕立即塞紧瓶塞,防止失火,C操作正确;D项,氯化银、亚硝酸银都是难溶于水的白色固体,所以硝酸银溶液滴入氯化钠溶液和亚硝酸钠溶液中都有白色沉淀生成,但是氯化银不溶于稀硝酸,而亚硝酸银溶于稀硝酸,硝酸银溶液滴入硝酸钠溶液中没有明显现象,D操作正确。
史上最全化学练习题

史上最全化学练习题第⼗⼀章课外练习题⼀、填空题1.已知配离⼦[Ni(NH3)4]2+的磁矩⼤于零,[Ni(CN)4]2-的磁矩等于零,则前者的空间构型是,杂化⽅式是,后者的空间构型是,杂化⽅式是。
2.根据配合物的价键理论,判断下列配合物中⼼离⼦的杂化轨道类型。
[Zn(NH3)4]2+ (µ=0) ;[Fe(H2O)6]3+ (µ=5.9B.M) ;[Ag(CN)2]-(µ=0) ;[AlF6]3-(µ=0B.M) ;3.已知[Co(CN)6]3-的µ=0,则其中⼼离⼦的杂化⽅式为,配离⼦的空间构型为;按晶体场理论,其中⼼离⼦d电⼦的排布⽅式为。
4.在电⼦构型为d1 d10的过渡⾦属离⼦中,既能形成⾼⾃旋⼜能形成低⾃旋⼋⾯体配合物的离⼦,其d 电⼦构型是。
5.在过渡⾦属离⼦的⼋⾯体配合物中,当Δo > P时,可形成⾃旋配合物,Δo < P时,可形成⾃旋配合物。
6.已知Co3+的电⼦成对能P=250kJ·mol-1,[Co(H2O)6]3+的Δo=222kJ·mol-1,[Co(NH3)6]3+的Δo=273kJ·mol -1,由晶体场理论可知,[Co(H2O)6]3+的d电⼦排布式为,晶体场稳定化能(CFSE)为,[Co(NH3)6]3+的d电⼦排布式为,晶体场稳定化能(CFSE)为,两种配合物的磁矩分别为和。
7.按晶体场理论确知[Fe(CN)6]3-,[Fe(CN)6]4-均为低⾃旋配合物,则中⼼离⼦d电⼦的排布式分别为、,按价键理论两种配合物中⼼离⼦的杂化⽅式分别为,。
8.配合物(NH4)2[FeF5(H2O)]命名为,配离⼦的电荷是,配位体是,配位原⼦是。
中⼼离⼦的配位数是。
根据晶体场理论,d电⼦的排布为(Δo < P) ,根据价键理论,中⼼原⼦的杂化轨道为,属型配合物。
9.将答案填⼊下表各空格中:配离⼦磁矩/B.M 中⼼离⼦杂化轨道配离⼦构型[Ni(NH3)4]2+ 3.2[CuCl4] 2- 2.0[Fe(CN)6] 4-0[Cr(NH3)6] 3+ 3.88[Ni(CN)4] 2-010.将答案填⼊下表各空格中:中⼼离⼦d轨道电⼦数在⼋⾯体弱场中在⼋⾯体强场中未成对电⼦数CFSE/Dq 未成对电⼦数CFSE/DqCr3+Co2+Cu2+Fe2+Mn2+11.在[CuCl2]-配离⼦中,中⼼离⼦Cu+采取杂化轨道成键,Cu+的电⼦排布式为,该配离⼦的⼏何构型为,磁矩µ= B.M。
化学式与化合价经典试题及答案

化学式与化合价中考复习习题精选习题精选(一)一、选择题,每小题有1个正确答案,将正确答案填在题后的括号里.1.下列含硫物质中,硫元素的化合价为+4价的是( )A.S B.H2S C.H2SO3 D.H2SO42.下列有关化合价的说法中,正确的是( )A.在NaCl和HCl里,氯元素均为–1价B.在H2中,氢元素显+1价C.一种元素在同一种化合物里,可能显不同的化合价D.非金属元素在化合物里,一定显负价3.下列四种物质①KClO3②Cl2③HCl④HClO,氯元素的化合价按由低到高顺序排列的是()A.①②④③ B.②③④① C.③②①④ D.③②④①4.下列各组物质中,硫元素具有相同化合价的是()A.Na2SO4和SO3 B.SO2和SO3 C.SO2和H2SO3 D.S和H2S5.某金属氧化物的组成为MO,如果在其氯化物中金属的化合价与该氧化物中的化合价相等,则该金属氯化物的组成为( )A.MCl B.MCl2 C.M2Cl D.M2Cl6.下列化学式正确的是( )A.高锰酸钾(K2MnO4) B.氧化镁(MgO2) C.氯化钾(KClO3) D.氯化亚铁(FeCl2)7.某化合物化学式为H n MO2n已知在该化合物中M的化合价为+6,则n值为()A.1 B.2 C.3 D.68.下列物质中氮元素的化合价由低到高的顺序排列一组是( )A.N2O3、NH3、NO、N2 B.NH3 N2 NO N2O3C.NH3、NO、N2、N2O3 D.NO N2 N2O3 NH39.某含氧酸的化学式为H n XO2n—1,该含氧酸受热分解生成的氧化物的化学式可能为( )A.XO B.XO2 C.X2O D.XO310.X、Y、Z三种元素的化合价分别为+1,+4,—2,则这三种元素所组成的化合物的化学式可能为( )A.XYZ B.X4YZ3 C.X2YZ3 D.X3YZ2二、填空题11.在NaNO3中N的化合价是___价;在NH4Cl中N的化合价是___价.12.某化合物的化学式为HnRO2,它的式量为M,则R元素的化合价是____,R元素的原子量是____。
《好题》人教版化学九年级第五章化学方程式经典习题(含答案)
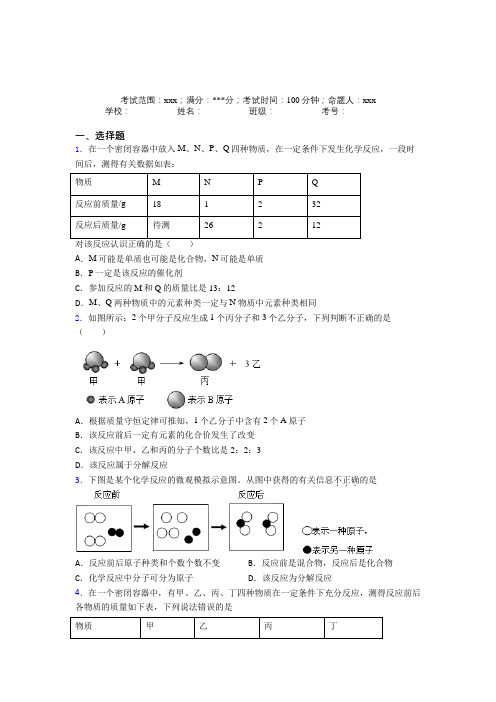
考试范围:xxx;满分:***分;考试时间:100分钟;命题人:xxx 学校:__________ 姓名:__________ 班级:__________ 考号:__________一、选择题1.在一个密闭容器中放入M、N、P、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表:物质M N P Q反应前质量/g181232反应后质量/g待测26212对该反应认识正确的是()A.M可能是单质也可能是化合物,N可能是单质B.P一定是该反应的催化剂C.参加反应的M和Q的质量比是13:12D.M、Q两种物质中的元素种类一定与N物质中元素种类相同2.如图所示:2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是()A.根据质量守恒定律可推知,1个乙分子中含有2个A原子B.该反应前后一定有元素的化合价发生了改变C.该反应中甲、乙和丙的分子个数比是2:2:3D.该反应属于分解反应3.下图是某个化学反应的微观模拟示意图。
从图中获得的有关信息不正确...的是A.反应前后原子种类和个数个数不变B.反应前是混合物,反应后是化合物C.化学反应中分子可分为原子D.该反应为分解反应4.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法错误的是物质甲乙丙丁反应前质量/g522022反应后质量/g待测11285A.该反应是分解反应B.甲可能该反应的催化剂C.乙、丙变化的质量比为9:8 D.反应后甲的质量为05.如图是乙烯和水反应生成酒精的微观模拟图。
下列说法不正确的是A.1个乙烯分子由2个碳原子和4个氢原子构成B.参加反应的两物质的分子个数比为1:1C.参加反应的乙烯和水质量比28:2D.该化学反应属于化合反应6.某化学反应(甲+乙→丙+丁)反应物和生成物的微观示意图及反应前后的质量如下表所示。
物质甲乙丙丁微观示意图反应前质量/g3220010反应后质量/g0x y z下列有关该反应的说法正确的是A.甲物质由碳原子和氢原子直接构成B.该反应属于分解反应C.参加反应的反应物分子个数比为1∶1 D.X+Y+Z=2337.如图是某反应的微观示意图,下列有关该反应的说法不正确的是A.乙属于单质B.相对分子质量最小的是NH3C.生成丙和丁的质量比为1:3D.氢元素的化合价在反应前后没有变化8.6.4g某物质在氧气中燃烧,恰好生成2.8g一氧化碳、4.4g二氧化碳和7.2g水,关于该物质有下列判断:①一定含碳元素和氧元素;②一定不含氧元素;③可能含氧元素;④一定含氧元素;⑤分子中C、H原子个数比为1:8;⑥分子中C、H、O原子个数比为1:4:1.其中正确的是A.①②⑤B.①②⑥C.①③⑥D.①④⑥9.如图两幅微观示意图揭示了化学变化的微观实质。
化学必修一物质的分类经典练习题

化学必修一物质的分类经典练习题(含答案)1. 将下列物质分类,并说明理由。
氢气、氮气、氧气、氟气、氯气、溴气、碘气、氧化铁、氢氧化钠、氨水、氯化钠、硝酸、硫酸、石灰石、苏打石、甲烷、乙烷、乙醇、氯仿、苯、葡萄糖、蛋白质。
答案:1. 纯元素:氢气、氮气、氧气、氟气、氯气、溴气、碘气、氧化铁、石灰石、苏打石、甲烷、乙烷、苯。
理由:这些物质都是由同种原子或分子组成的,不可再分。
2. 水溶液:氢氧化钠、氨水、氯化钠、硝酸、硫酸、葡萄糖、蛋白质。
理由:这些物质都是在水中溶解而成的,可以被水分解或水解。
3. 有机物:乙醇、氯仿、苯、甲烷、乙烷、葡萄糖、蛋白质。
理由:这些物质都是由碳、氢、氧等元素组成的,具有复杂的分子结构。
2. 将下列物质分类,并说明理由。
氢气、氧气、氮气、氯气、氟气、溴气、碘气、氢氧化钠、氯化钠、硝酸、硫酸、氨水、石灰石、苏打石、甲烷、乙烷、苯、乙醇、乙酸、乙酸钠、乙酸乙酯、葡萄糖、蛋白质、淀粉、纤维素。
答案:1. 纯元素:氢气、氧气、氮气、氯气、氟气、溴气、碘气。
理由:这些物质都是由同种原子或分子组成的,不可再分。
2. 无机酸:硫酸、硝酸。
理由:这些物质都是酸性物质,可以和碱反应,产生盐和水。
3. 无机碱:氢氧化钠。
理由:这是一种碱性物质,可以和酸反应,产生盐和水。
4. 盐:氯化钠、乙酸钠。
理由:这些物质都是由酸和碱反应产生的,具有结晶形态,可以溶于水。
5. 有机物:甲烷、乙烷、苯、乙醇、乙酸、乙酸乙酯、葡萄糖、蛋白质、淀粉、纤维素。
理由:这些物质都是由碳、氢、氧等元素组成的,具有复杂的分子结构。
6. 矿物:石灰石、苏打石。
理由:这些物质都是天然矿物,具有晶体结构,可以烧成石灰或苏打灰。
3. 将下列物质分类,并说明理由。
氧气、氢氧化钠、氯化铁、氯化铜、硝酸、氢氧化铝、氢氧化钙、氯气、氮气、碳酸钙、氨气、氢气、氯化钠、硫酸、碳酸钠、硫化氢、甲烷、乙烷、苯、酒精、葡萄糖、蛋白质、淀粉、纤维素。
【化学】 化学方程式练习题(含答案)经典

【答案】A
【解析】
【分析】
【详解】
由两次实验数据表,Y 的用量增加 1 倍,而生成 X2Y 的质量却没有增加 1 倍,说明第 2 次
反应时,Y 有剩余,9.6gX 完全反应,生成 12.0gX2Y,则同时参加反应的 Y 的质量为 12.0g
﹣9.6g=2.4g;故参加反应的 X 与 Y 的质量比为 9.6g:2.4g=4:1.故选 A.
4CO2 + 2X + 6H2O 可知,反应物中碳、氢、硫、氧原子个数分别
为 4、12、2、18,反应后的生成物中碳、氢、硫、氧原子个数分别为 4、12、0、14,根 据反应前后原子种类、数目不变,则 2X 中含有 2 个硫原子、4 个氧原子,则每个 X 分子由 1 个硫原子、2 个氧原子构成,则 X 是二氧化硫,化学式是 SO2。故选 D。
书写方程式正确,使用数据准确,计算过程完整。
10.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前
后各物质的质量变化见下表。下列说法错误的是( )
物质
甲
乙
丙
丁
反应前物质的质量(g) 8
32
5
4
反应后物质的质量(g) 16
X
5
24
A.该反应为分解反应 B.丙可能是该反应的催化剂 C.甲、丁两物质反应前后质量变化之比为 2:5 D.X 值为 28 【答案】D 【解析】 【分析】 根据质量守恒定律,在化学反应中,反应前参加反应的各物质的质量总和等于生成物的各 质量总和,反应后增加的是反应物,减少的是生成物。 【详解】
物质
a
b
c
d
反应前的质量
(g)
6.4
3.2
初中化学综合复习题经典大题例题

初中化学综合复习题经典大题例题单选题1、利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图。
下列说法不正确的是A.甲醛的化学式为CH2OB.生成物丙和丁中氧元素的化合价相同C.生成物丙由1个碳原子和2个氧原子构成D.参加反应的甲和生成的丁分子个数比为1:1答案:CA、根据微观示意图可知,甲醛的化学式为CH2O,A正确;B、生成物丙是二氧化碳,氧元素的化合价为-2价;丁是水,水中氧元素的化合价为-2价目,B正确;C、生成物丙是二氧化碳,每个二氧化碳分子由1个碳原子和2个氧原子构成,C不正确;D、该反应的化学方程式为CH2O+O 催化剂CO2+H2O,故参加反应的甲和生成的丁分子个数比为1:1,D正确。
故选C。
2、下列物质属于空气污染物的是A.氧气B.氮气C.水蒸气D.二氧化硫答案:D属于空气污染物的是二氧化氮、二氧化硫、一氧化碳等,氧气、氮气、水蒸气均是无毒无害的空气成分。
故选:D。
3、下列事实的微观解释中,不正确的是A.墙内开花墙外可闻到花香——分子在不断地运动B.蔗糖放入水中溶解一一蔗糖分子分解了C.氧气和液氧都能支持燃烧——物质的分子相同,其化学性质相同D.水壶中的水烧开沸腾后,壶盖被顶起——水分子间的间隔增大答案:BA、墙内开花墙外可闻到花香是因为分子在不断地运动,物质通过分子的运动挥发散发气味,选项正确;B、蔗糖放入水中溶解,蔗糖分子运动到水分子的间隔中,分子的种类不改变,选项错误;C、分子是保持物质化学性质的最小微粒,氧气和液氧都能支持燃烧,物质的分子相同,其化学性质相同,选项正确;D、水壶中的水烧开沸腾后,壶盖被顶起,是因为水分子间的间隔增大,水的总体积变大,选项正确。
故选B。
4、用下图装置可验证空气中O2的含量。
下列现象能表明O2含量的是A.集气瓶中产生大量白烟B.红磷燃烧一段时间后熄灭C.烧杯中的水倒吸进入集气瓶D.集气瓶中水面最终上升至1处答案:D红磷燃烧集气瓶中产生大量白烟,红磷燃烧一段时间后熄灭,待冷却到室温后,烧杯中的水倒吸进入集气瓶,集气瓶中水面最终上升至1处,说明空气中氧气体积约占五分之一,能表明O2含量的是,集气瓶中水面最终上升至1处,故选:D。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.下列曲线表示不同温度条件下测得的光合作用效率与光照强度的关系曲线所给出的信息正确的是()
A、当温度一定时,光合速率随光照强度的增加而增加
B、当光照强度一定时,光合速率随温度升高而增加
C、当光照强度大于Q时,温度是限制光合作用效率的因素
D、当光照强度小于P时,温度是限制光合作用效率的因素
2.为了形象展示水分解的微观过程,某同学制作了如下模型表示相应的微观粒子,其中表示水电解过程中不能再分的微
3.
4.
”分子中,若“”元素化合价为+1价,则“”元素化合价为-2价
”和“”分子的个数比为1∶2
5.
6.
7.向下表的甲物质中逐滴加入相应的乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图
所示曲线表示的是()
A.①②B.②④C.③④D.④
8.用一种试剂就能把NaCl、NH4Cl、Na2SO4三种溶液区别开,这种试剂是( )
A、AgNO3溶液
B、NaOH溶液
C、BaCl2溶液
D、Ba(OH)2溶液
9.重水的主要用途是在核反应堆中做减速剂,一个重水分子有2个重氢原子和一个氧原子构成。
重氢原子核电荷数为1,
相对原子质量为2,下列说法中正确的是()
A.重水的相对分子质量为20B.重氢原子核外有2个电子
C.重氢分子的相对分子质量为2D.重氢离子核内有2个质子
10.决定元素种类的依据是
A、质子数
B、中子数
C、核外电子数
D、原子的相对原子质量
11.从H、Cu、S九种元素中,选择适当的元素组成符合下列要求的物质,并用化
①;
②
③;
④农业上作为氮肥的是;
⑤厨房用的酸性调味品是;
⑥能作燃料的是、、。
⑦具有可燃性,可做火箭燃料的单质_____;
⑧最简单的有机物__________;
⑨导致人煤气中毒的气体______;
⑩用于配制波尔多液的盐______。
12.分子、原子、离子、质子、中子、电子都是我们学习过的粒子,试回答:
(1)水是由聚集而成的;(2)氧分子是由结合而成的;
(3)铁是由结合而成的;(4)氢原子的原子核是由构成的。
13.著名化学家侯德榜发明了联合制碱法,为我国化学工业的发展作出了杰出贡献。
联合制碱法中的“碱”属于____(填酸、
碱、盐),它的浓溶液与澄清石灰水反应的化学方程式为_______ ___________。
14.2003年12月23
造成243
2H2O
⑵写出H2S
⑶H2S与H2SO4
⑷若尾气中含有H2
15.1989
的明矾晶体作膨松剂。
在
A.铝元素B
%) 。
⑵
16.
②在放电条件下,
③NO气体不溶于水,在常温下易跟空气中的O2化合,生成红棕色NO2气体;
④NO2气体有毒,易溶于水,溶于水后生成HNO3和NO;
⑤生成的HNO3随雨水淋洒在大地上,同土壤中的矿物相作用,形成可溶性硝酸盐。
试填写下列空白:
(1)实验室制取NO气体宜用法收集(填排水法、向上或向下排空气法)
(2)写出NO2跟水作用的化学方程式。
17. 下是实验室用高锰酸钾制取氧气并用排水法收集的实验。
请按要求回答问题:
(1)描述氧气已经集满的现象________________________________
(2)用简单的方法验证收集的气体是氧气_________________________。
(3)请将下列实验步骤进行正确排序:
A、给试管加热
B、用排水法收集氧气
C、熄灭酒精灯
D、装高锰酸钾于试管
E、将导管移出水面
F、检查装置的气密性
G、把试管固定在铁架台上,且集气瓶注满水倒置在水槽中。
正确的实验顺序是(填序号)
(4
18.
数为
1)
2)
3)
19.
(1)
A应与
(2)若
___
(3
学方程式是
20. 在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色
颗粒,瓶壁上附粘附着白色物质。
【提出问题】黑色颗粒和白色物质是什么?
【进行猜想】甲认为黑色颗粒是,白色物质可能是Na2O或;乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是。
【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O + H2O = 2NaOH
【实验探究】甲同学对白色物质进行实验探究。
蓝色固体:硫酸铜晶体、氯化铜、硝酸铜,它们的溶液也是蓝色
黄色固体:氯化铁、硫酸铁、硝酸铁,它们的溶液也是黄色
蓝色沉淀:氢氧化铜,不溶于水可溶于酸
红褐色沉淀:氢氧化铁,不溶于水可溶于酸
浅绿色沉淀:氢氧化亚铁
硫磺是浅黄色固体液氧、固态氧是淡蓝色
红色固体:铜、氧化铁、红磷高锰酸钾:紫黑色固体
浅绿色:氯化亚铁、硫酸亚铁、硝酸亚铁和它们的溶液
绿色:碱式碳酸铜(俗名:铜绿)
铁离子:黄色亚铁离子:浅绿色高锰酸根离子:紫红色铜离子:绿色
⑴炭在氧气中燃烧(O
⑶磷在空气中燃烧
白磷着火点低,
⑸铁丝在氧气中燃烧
此实验必须先在集气瓶里装少量水或在瓶底铺一层细砂,防止溅落的熔化物使瓶底炸裂⑹氢气在空气中燃烧(点燃爆鸣气) 2H2 + O2点燃2H2 O
现象:纯净的氢气在空气里安静地燃烧,发出淡蓝色火焰,放出热量;
不纯的氢气点燃会爆炸
⑺蜡烛在氧气里燃烧得更旺,发出白光,放出热量,瓶壁内有水珠。
向瓶内倒入澄清的石灰水,石灰水变浑浊。
