人教版(2019)高中化学必修一第二章第三节物质的量专项巩固练习(附答案)
人教版(2019)高一 化学必修第一册 第二章第三节 《物质的量》测试(有答案)
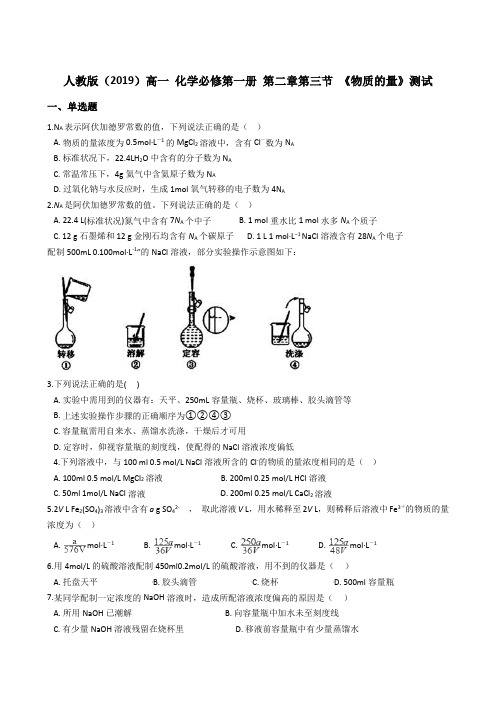
人教版(2019)高一化学必修第一册第二章第三节《物质的量》测试一、单选题1.N A表示阿伏加德罗常数的值,下列说法正确的是()A. 物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-数为N AB. 标准状况下,22.4LH2O中含有的分子数为N AC. 常温常压下,4g氦气中含氦原子数为N AD. 过氧化钠与水反应时,生成1mol氧气转移的电子数为4N A2.N A是阿伏加德罗常数的值。
下列说法正确的是()A. 22.4 L(标准状况)氮气中含有7N A个中子B. 1 mol重水比1 mol水多N A个质子C. 12 g石墨烯和12 g金刚石均含有N A个碳原子D. 1 L 1 mol·L−1 NaCl溶液含有28N A个电子配制500mL 0.100mol·L-1”的NaCl溶液,部分实验操作示意图如下:3.下列说法正确的是( )A. 实验中需用到的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等B. 上述实验操作步骤的正确顺序为①②④③C. 容量瓶需用自来水、蒸馏水洗涤,干燥后才可用D. 定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低4.下列溶液中,与100 ml 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是()A. 100ml 0.5 mol/L MgCl2溶液B. 200ml 0.25 mol/L HCl溶液C. 50ml 1mol/L NaCl溶液D. 200ml 0.25 mol/L CaCl2溶液5.2V L Fe2(SO4)3溶液中含有a g SO42-,取此溶液V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为()A. mol·L-1B. mol·L-1C. mol·L-1D. mol·L-16.用4mol/L的硫酸溶液配制450ml0.2mol/L的硫酸溶液,用不到的仪器是()A. 托盘天平B. 胶头滴管C. 烧杯D. 500ml容量瓶7.某同学配制一定浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是()A. 所用NaOH已潮解B. 向容量瓶中加水未至刻度线C. 有少量NaOH溶液残留在烧杯里D. 移液前容量瓶中有少量蒸馏水8.在AlCl3、MgCl2、MgSO4的混合溶液中,c(Al3+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.50mol/L,则c(SO42-)为A. 0.10mol/LB. 0.15mol/LC. 0.20mol/LD. 0.30mol/L9.向25mL 2mol·L-1稀硫酸中加入25mL 1mol·L-1的BaCl2溶液,充分反应后,溶液中H+物质的量浓度为(设稀溶液相混后总体积为原分体积之和)()A. 2mol·L-1B. 1mol·L-1C. 0.5mol·L-1D. 0.25mol·L-110.某气体在标准状况下的密度为1.25 g / L,该气体的相对分子质量为()A. 44B. 28C. 32D. 1611.某一Na2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.5mol/L,SO42-的物质的量浓度为0.8 mol/L,则此溶液中Na+的物质的量浓度为()A. 0.1mol/LB. 0.15 mol/LC. 0.2 mol/LD. 0.25 mol/L12.下列有关气体摩尔体积的描述正确的是()A. 通常状况下,气体摩尔体积约为22.4LB. 标准状况下,气体摩尔体积约为22.4LC. 相同物质的量的气体,摩尔体积相同D. 同温同压的气体,摩尔体积相同13.常温常压下,用等质量的He、CH4、O2、SO2分别吹出四个气球,其中气体为He的是( )A. B. C. D.14.VL Fe2(SO4)3溶液中含有a g Fe3+,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中SO42-的物质的量的浓度为( )A. B. C. D.15.固体A在一定温度下分解生成气体B、C和D:2A(s)=B(g)+2C(g)+3D(g)。
人教版高中化学必修一第二章第三节物质的量强化练习(附答案)

人教版高中化学必修一第二章第三节物质的量强化练习(附答案)一、单选题1.下列条件下,两瓶气体所含原子数一定相等的是A .同质量、不同密度的N 2和COB .同温度、同体积的H 2和N 2C .同体积、不同密度的C 2H 4和C 3H 6D .同压强、同体积的N 2O 和CO 22.将0.2 mol 2MnO 和50mL 112mol L -⋅盐酸混合后缓缓加热,反应完全后,再向溶液中加入足量3AgNO 溶液,生成AgCl 沉淀的物质的量为(不考虑盐酸的挥发且假设生成的氯气全部逸出)( )A .等于0.3molB .小于0.3molC .大于0.3mol ,小于0.6molD .以上结论都不正确 3.同温同压下由CO 2、H 2和CO 组成的混合气体与氮气的密度相同,则该混合气体中CO 2、H 2和CO 的体积之比为( )A .29:8:13B .22:1:14C .13:8:29D .26:15:574.下列溶液分别加水稀释到100 mL ,稀释后的溶液中氯离子浓度最大的是 ( )A .20mL 1mol·L −1的AlCl 3B .50mL 1mol·L −1的KClC .20mL 2mol·L −1的NH 4ClD .20mL 2mol·L −1的CaCl 25.溶液浓度是常用的物理量,下列说法正确的是( )A .将5.85gNaCl 固体溶于1L 水,所得NaCl 溶液物质的量浓度为10.1mol L -⋅B .配制480mL0.2mol/LNaOH 溶液,需称量NaOH 固体的质量为3.84gC .质量分数为98%的浓硫酸与等体积水混合后,硫酸的质量分数大于49%D .2475mL0.1mol/LNa SO 溶液和24325mL0.1mol/LA1(SO )溶液中24SO -浓度相同6.下列各组气体,不论以何种比例混合,其密度(同温同压下)都不等于氮气的密度的是( ) A .O 2和H 2 B .C 2H 2和CO 2 C .H 2和Cl 2 D .CH 4和C 2H 27.标准状况下,有:①6.72L 4CH ,②13.6g 2H S ,③0.5mol 3NH ,④231.20410⨯个HCl 分子,下列对这四种气体关系的描述不正确的是( )A .体积:④<①<②<③B .质量:①<④<③<②C .密度:④<②<③<①D .氢原子数:④<②<①<③8.向一质量为100g 的密闭容器中充满2CO 后,质量为166g ,相同条件下,向另一相同的容器中充满未知气体,测得充满未知气体后容器的总质量为142g ,则该气体可能为( )A .2OB .4CHC .COD .2H9.在标准状况下,10gCO 和CO 2的混合气体的体积为6.72L,则此混合气体中CO 和CO 2的物质的量之比是 A .2:1 B .1:2 C .1:1 D .3:410.某气体的质量为9.2g ,在标准状况下的体积为4.48L ,则该气体的摩尔质量为( )A .18.4B .118.4g mol -⋅C .46D .146g mol -⋅11.下列物质的体积一定是22.4L 的是( )A .1mol 氯气B .17g 氨气C .标准状况下44g 二氧化碳D .0℃、5210Pa ⨯时2g 氢气12.2 L 硫酸铝溶液中含2.7 g Al 3+,则该溶液中24SO -的物质的量浓度是A .0.3 mol/LB .0.1 mol/LC .0.075 mol/LD .0.05 mol/L13.在相同状况下,一个空瓶若装满O 2称其质量为36g ,若装满CO 2称其质量为42g ,若装满A 气体,称其质量为52g ,则A 的相对分子质量是A .16B .54C .64D .7214.下列有关实验的叙述正确的是( )A .配制一定物质的量浓度的Na 2CO 3溶液时,称取一定质量的Na 2CO 3固体在烧杯中溶解,所得溶液冷却至室温后,再转移至容量瓶中B .可用分液法分离水和乙醇的混合物C .定容时如果加水超过刻度线,可直接吸出多余部分D .用胶头滴管滴加液体时,为防止液滴飞溅,胶头滴管尖嘴部分应紧贴试管内壁15.向三个密闭容器中分别充入Ne 、2H 、2O ,下列有关这三种气体的叙述正确的是A .同温、同压、同体积时,三种气体的密度关系:()()22ρH >ρ(Ne)>ρOB .温度、密度相同时,三种气体的压强关系:()()22p H >p(Ne)>p OC .质量、温度、压强均相同时,三种气体的体积关系:()()22V O >V(Ne)>V HD .温度、压强、体积均相同时,三种气体的质量关系:()()22m H >m(Ne)>m O二、实验题16.如图为某学校实验室浓硫酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓硫酸的物质的量浓度为____________。
第二章第三节物质的量课后练习—— 高一化学人教版(2019)必修第一册

第二章海水中的重要元素——钠和氯第三节物质的量课后练习——高一化学人教版(2019)必修第一册一、单选题(共15题)1.“物质的量”是联系宏观世界和微观世界的桥梁。
下列说法正确的 A .“摩尔”是“物质的量”的单位 B .1 mol O 2的质量是32 g/molC .任何气体的“气体摩尔体积”均为22.4 L/molD .1 mol 任何物质都含有阿伏加德罗常数个原子 2.用N A 表示阿伏加德罗常数的值,下列判断正确的是 A .常温常压下,416g CH 分子所含原子数为5N A B .21mol Cl 所含分子数为2N AC .标准状况下,22.4L 乙醇所含分子数为N AD .-1242L 0.1mol L K SO ⋅溶液中K +离子的浓度为0.1mol/L 3.下列叙述中正确的是。
A .10.3mol L -⋅的24Na SO 溶液中含有Na +和24SO -的总物质的量为0.9molB .漂白粉的成分是()2Ca ClO ,是纯净物C .在24K SO 和NaC1的混合溶液(中性),若Na +和24SO -的物质的量浓度相等,则K +和Cl -的物质的量浓度也相同D .10℃时,10.35mol L -⋅的KCl 饱和溶液100mL 蒸发掉5g 水,恢复到10℃时,此时溶液的物质的量浓度仍然是10.35mol L -⋅4.以“物质的量”为中心的计算是化学计算的基础,下列相关的计算正确的是A .有2CO 、3O 、2O 三种气体,它们各含有1mol O ,则三种气体物质的量之比为3:2:1B .n g 2Cl 中有m 个Cl 原子,则阿伏加德罗常数A N 的数值可表示为35.5m/nC .常温下,a L 氧气和氮气的混合物含有的分子数就是()23/22.4 6.0210a ⨯⨯个D .28g CO 和22.4L 2CO 中含有的碳原子数一定相等 5.设N A 为阿伏加德罗常数的值,下列说法正确的是A.2.3 g金属钠变为钠离子时失电子数为0.1N AB.18 g水所含的原子数目为N AC.在常温下22.4 L氢气所含的原子数目为N AD.32 g氧气所含的原子数目为N A6.同温同压下,不同体积的密闭容器中分别有相同质量的甲、乙两种气体,且甲的密度大于乙的密度。
第三节物质的量 巩固练习——2021-2022学年高一上学期化学人教版(2019)必修第一册

第二章海水中的重要元素——钠和氯第三节物质的量巩固练习——2021-2022学年高一上学期化学人教版(2019)必修第一册一、综合题(共18题)1.下列物质中,摩尔质量最大的是()A. 1mol CaCO3B. 0.8mol/L H2SO4C. 54 g AlD. 10 mL H2O2.相同物质的量的各固体或液体的体积并不相同,其主要原因是( )A. 粒子质量不同B. 粒子大小不同C. 粒子间距离不同D. 粒子的数目不同3.浓度均为0.1 mol/L的下列物质的溶液中,c(Cl-)最大的是( )A. FeCl3B. CuCl2C. KClD. NaClO4.将pH=1的稀硫酸慢慢加入—定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100 mL(混合时溶液体积的变化忽略不计),且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度约为()A. 0.011 mol/LB. 0.22 mol/LC. 0.022 mol/LD. 0.11 mol/L5.用N A表示阿伏加德罗常数的值,下列说法中正确的是( )A. 1 mol KClO3所含有的氧原子数为N AB. 标准状况下,22.4 L水中含有的水分子数为N AC. 标准状况下,22.4 L NH3所含的分子数为N AD. 1L 0.2 mol/L KCl溶液中所含的K+数为2N A6.设N A为阿伏加德罗常数的值,下列有关说法正确是()A. 1L0.1mol•L-1NaNO2溶液中NO2-的数目为0.1N AB. 3.1g乙二醇中含有羟基的数目为N AC. 5.85gNa37Cl中所含质子总数为2.8N AD. 2.4g镁条在足量的由N2和O2组成的混合气体中完全燃烧时,转移的电子总数一定为0.2N A7.已知某溶液的①体积②密度③溶质和溶剂的质量比④溶质的摩尔质量,要根据溶质的溶解度计算其饱和溶液的物质的量浓度时,上述条件必不可少的是( )A. ①②③④B. ①②③C. ②④D. ①④8.如图是某溶液在稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线图,根据图中的数据分析得出V 值等于( )A. 2B. 3C. 4D. 59.设阿伏加德罗常数的值为N A。
第二章 第三节 物质的量——高一化学人教版(2019)必修第一册洞悉课后习题

第二章第三节物质的量——高一化学人教版(2019)必修第一册洞悉课后习题【教材课后习题】Na SO中含有Na+的数目约为()个。
1.在0.5mol24A.23⨯ C.0.5 D.13.01106.0210⨯ B.232.瓦斯中甲烷与氧气的质量比为1:4时极易发生爆炸,此时甲烷与氧气的体积比为()。
A.1:4B.1:2C.1:1D.2:13.将30mL0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为()。
A.0.3mol/LB.0.03mol/LC.0.05mol/LD.0.04mol/L4.阅读并分析体检报告,可以初步判断体检者的身体状况。
(1)在如图所示的体检报告中,表示葡萄糖指标的物理量是_______(填字母)。
a.质量分数b.溶解度c.摩尔质量d.物质的量浓度(2)查看自己或家人的体检报告,哪些项目的指标是用物质的量浓度表示的?(3)检测人的血液中葡萄糖(简称血糖,葡萄糖的相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL )。
以“mmol/L”表示时,人的血糖正常值为3.9~6.1mmolL 。
如果以“mg/dL”表示,血糖正常值范围是多少?若某人的血糖检测结果为92mg/dL ,他(她)的血糖正常吗?5.某同学用容量瓶配制溶液,加水时不慎超过了刻度线,他(她)把液体倒出一些,重新加水至刻度线。
这样做会造成什么结果?6.配制250mL1.0mol/L 24H SO 溶液,需要18mol/L 24H SO 溶液的体积是多少?7.成人每天从食物中摄取的几种元素的质量分别为:0.8gCa 、0.3gMg 、0.2gCu 和0.01gFe ,试求这4种元素的物质的量之比。
8.下图是某种饮用矿泉水标签的部分内容。
请阅读这种矿泉水的标签并计算:(1)2Mg +的物质的量浓度最大是多少?(2)24SO -的物质的量最大是多少?9.现有0.270kg 质量分数为10%的2CuCl 溶液。
人教版(2019)高中化学必修一第二章第三节物质的量专题练习(附答案)

人教版(2019)高中化学必修一第二章第三节物质的量专题练习(附答案)一、单选题1.在放电条件下发生下列反应:3O 2→放电2O 3。
如有30%O 2转化为O 3,则放电后混合气体对氢气的相对密度是( )A .16B .17.8C .18.4D .352.若N A 表示阿伏加德罗常数的值,下列叙述中正确的是( )A .1mol Cl 2参加化学反应,转移的电子数一定为2N AB .7.8g Na 2O 2晶体中阴阳离子总数为0.4N AC .标准状况下,32 g 氧气(O 2)和32 g 臭氧(O 3)都含有2N A 个氧原子D .14g 氮气中含有3.5N A 个电子3.设N A 为阿伏加德罗常数,下列关于0.2mol·L -1硝酸钡溶液的说法不正确的是() A .1L 溶液中所含阴、阳离子总数是0.6N AB .1L 溶液中含有0.2N A 个NO 3-C .500 mL 溶液中含有0.2N A 个NO 3-D .500 mL 溶液中Ba 2+浓度为0.2 mol·L -14.设N A 为阿伏加德罗常数的值。
下列说法正确的是( )A .6.4g Cu 与足量浓硝酸反应生成NO 2分子数目为2N AB .反应O 3+2KI+H 2O=2KOH+O 2+I 2中,每1mol O 3参与反应转移的电子数为6N AC .100g 9.8%的硫酸与磷酸的混合液中含有氧原子数为0.4N AD .标准状况下,2mol Na 2O 2与44.8L SO 2完全反应,转移的电子数目为4N A5.. 用A N 表示阿伏加德罗常数的值.下列说法中正确的是( )A .标准状况下,22.4L 酒精中含有的分子数目为A NB .常温常压下,lmol /L 盐酸中含有的氯离子数目为A NC .常温常压下,224gO 和324gO 含有的氧原子数目都为A 1.5ND .标准状况下,2.24L 氯气与足量NaOH 溶液反应转移的电子数为A 0.2N6.有一真空储气瓶质量为300 g ,在相同条件下,装满O 2时质量为304 g ,装满另一种气体甲时质量为305.5 g ,则气体甲可能是( )A .CO 2B .N 2C .HClD .H 2S7.下列有关实验用品的使用或操作的叙述中,正确的是( )A .用红色石蕊试纸检验溶液的酸性B .用容量瓶配制准确浓度的溶液,但不能作为反应容器使用C .配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释D .称量NaOH 固体时,将NaOH 放在托盘上的两张大小相等的同种纸上8.下列有关说法不正确的是( )A .向包有 Na 2O 2的脱脂棉上滴几滴水,脱脂棉剧烈燃烧,说明 Na 2O 2与H 2O 的反应是放热反应B .同温同压下,相同体积的任何气体都具有相同的原子数目C .将 4mol ⋅L −1 的盐酸 100mL ,加水稀释至 500mL ,稀释后盐酸的物质的量的浓度为0.8mol ⋅L −1D .3.2gO 2和 3.2gO 3气体中所含氧原子数均为 0.2N A9.将5mo1‧L -1的Mg(NO 3)2溶液amL 稀释至bmL ,稀释后溶液中NO 3-的物质的量浓度为( ) A .5a/bmo1·L -1 B .a/bmo1·L -1 C .b/5amo1·L -1 D .10a/bmo1·L -110.若50滴水正好是m mL,则1滴水所含的分子数是()A.m×50×18×6.02×1023B.m5018⨯×6.02×1023C.18m50×6.02×1023D.231850m6.0210⨯⨯⨯11.VmLA12(SO4)3溶液中含Al3+ag,取14VmL溶液稀释到4VmL,则稀释后溶液中2-4SO的物质的量浓度是( )A.125a9Vmol/L B.125a36Vmol/L C.125a18Vmol/L D.125a54Vmol/L12.标准状况下,某恒容密闭容器充满CH4后质量为108g,若充满O2后质量为116g,现若充满A气体则质量为113g,那么A气体的摩尔质量为()A.14g/mol B.26 g/mol C.36 g/mol D.44 g/mol13.欲使1L0.5mol/L的NaOH溶液的浓度增大一倍,可采取的合理措施是()A.加入20gNaOH固体,搅拌、溶解B.将溶液加热浓缩至0.2LC.加入1L1.5mol/L的NaOH溶液混合均匀D.加入10mol/L的NaOH溶液0.1L,再稀释至1.5L14.下列说法正确的是()A.酸性氧化物可以与金属氧化物发生氧化还原反应B.物质的摩尔质量就是该物质的相对分子质量C.发生化学反应时失电子数越多的金属原子,还原能力越强D.两个等容容器,一个盛CO,另一个盛Ar、O3混合气体,同温同压下两容器内气体分子总数一定相同,原子总数也一定相同15.配制90mL1mol·L-1Na2CO3溶液,下列操作正确的是()A.称取28.6gNa2CO3·10H2O,配成90mL溶液B.称取28.6gNa2CO3·10H2O,配成100mL溶液C.称取10.6g无水碳酸钠,加入100mL蒸馏水,搅拌、溶解D.称取10.6g无水碳酸钠,加入100mL容量瓶中,加水溶解、定容二、实验题16.人体血液里Ca2+的浓度一般采用mg/cm3来表示。
人教版化学必修一第二章第三节物质的量重点训练(含参考答案)

人教版化学必修一第二章第三节物质的量重点训练一、选择题1.【2019·河南安阳一中高一月考】下列有关物质的量和摩尔的叙述,不正确的是()A.摩尔是国际单位制中七个基本单位之一B.物质的量可用n表示,1 mol 粒子的数目约为6.02×1023C.摩尔的计量对象可以是分子、离子、原子、质子、中子、电子和原子团D.用摩尔表示物质的量时,要用化学式指明粒子种类,而不用该粒子的中文名称2.【2019·广东清远期末】下列物质中,所含分子数最多的是()A.1.806×1023个H2OB.含N A个氢原子的H2C.1.2 mol H2SO4D.11.2 g CO3.【2021·山东济南历城二中高一监测】下列叙述错误的是()A.1 mol 任何物质都含有6.02×1023个分子B.1 mol Ne中含有6.02×1024个电子C.1 mol H2O中含有2 mol H 和1 mol OD.1 mol H2O中含有3 mol 原子4.【2019·山东省实验中学高一月考】1.6g某气体中含有6.02×1022个分子,则该物质的相对分子质量为()A.16B.64C.32D.965.【2019·湖南攸县一中高一月考】常温常压下,气体体积的大小取决于()A.粒子的直径B.粒子的质量C.粒子的数目D.粒子间的平均距离6.【2019·陕西渭南中学高一质检】(双选)下列有关气体摩尔体积的叙述中正确的是()A.单位物质的量的气体所占的体积就是气体的摩尔体积B.通常情况下,1 mol 气体的体积约为22.4LC.标准状况下,气体摩尔体积约为22.4LD.相同条件下的气体,气体摩尔体积相同7.李兰娟院士说,据初步测试,在体外细胞实验中显示:达芦那韦在300 μmol·L-1浓度下,能显著抑制病毒复制,与未用药处理组比较,抑制效率达到280倍。
高一化学同步检测卷(人教版2019必修第一册): 2.3 物质的量 (解析版)

第二章 海水中的重要元素——钠和氯物质的量1.将ag 二氧化锰粉末加入bmol ·L -1的浓盐酸cL 中加热完全溶解,反应中转移电子d 个,设N A 为阿伏加德罗常数的值,下列叙述正确的是( )A .可以收集到氯气22.4bc 4LB .反应后溶液中的Cl -数目为A 2aN 87C .N A 可表示为87d 2aD .反应后溶液中的H +数目为(bc-2d)【答案】C【解析】【分析】二氧化锰与浓盐酸发生反应MnO 2+4HCl(浓) MnCl 2+Cl 2↑+2H 2O ,随反应的进行,浓盐酸变为稀盐酸,稀盐酸不与二氧化锰,且浓盐酸易挥发,因此不能使用盐酸的量进行计算。
【详解】A .根据分析,不能使用盐酸的量进行计算,且没有说明是标准状况,因此无法计算氯气的体积,A 错误;B .由于浓盐酸易挥发,挥发的浓盐酸的量无法计算,因此反应后溶液中的Cl -数目也无法计算,B 错误;C .根据方程式可知,1molMnO 2转移电子数为2mol ,反应中转移电子d 个,电子的物质的量为A d N mol ,MnO 2的物质的量为A d 2N mol ,即A d 2N =a 87,解得N A =87d 2a ,C 正确;D .由于浓盐酸易挥发,无法计算反应后溶液中H +的数目,D 错误;故选C。
2.设N A表示阿伏加德罗常数,下列说法正确的是()A.常温常压下,23 g NO2和N2O4的混合气体一定含有N A个氧原子B.1 L 0.1 mol/LNaHSO4溶液中含有0.1 N A个HSO4-C.将0.1 mol FeCl3溶于沸水制成胶体,其中含有的胶体粒子数目为0.1 N A D.0.1molNa2O2固体与足量的H2O充分反应,转移0.2N A个电子【答案】A【解析】A.若23g全是NO2,则n(NO2)=23g46g/mol=0.5mol,n(O)=1mol;若23 g全是N2O4,则n(N2O4) =2392/gg mol=0.25mol,n(O)=1mol,所以23 g NO2和N2O4的混合气体一定含有N A个氧原子,A正确;B.在水溶液中电离出三种离子,离子方程式:NaHSO4=Na++H++SO42-,因此溶液中无HSO4-,B错误;C.由于氢氧化铁胶体中,氢氧化铁胶粒为氢氧化铁的聚集体,将0.1 mol FeCl3溶于沸水制成胶体,其中含有的胶体粒子数目小于0.1 N A,故C错误;D.在 2Na2O2 + 2H2O=4NaOH+O2↑反应中,每摩尔Na2O2的充分反应,转移N A个电子,所以0.1molNa2O2固体充分反应,转移0.1N A个电子,D错误;故选A。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人教版(2019)高中化学必修一第二章第三节物质的量专项巩固练习(附
答案)
一、单选题
1.意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,下列说法正确的是()A.N4与N2的摩尔质量相等
B.N4属于一种新型的化合物
C.等质量的N4与N2所含的原子个数比为1∶1
D.等质量的N4与N2所含的分子个数比为2∶1
2.配制体积为100ml、溶质物质的量为0.2mol的NaOH溶液时,不需要用到的仪器是( ) A.B.C.D.
3.a mol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )
A.(b
4a
)mol-1B.(
b
a
)mol-1C.(
a
b
)mol-1D.(
a
4b
)mol-1
4.VLFe2(SO4)3溶液中含有ag2-
4
SO,取此溶液0.5VL,用水稀释至2VL,则稀释后的溶液中Fe3+的物质的量浓度为( )
A.
a
576V
mol·L-1B.
125a
36V
mol·L-1
C.250a
26V
mol·L-1D.
250a
48V
mol·L-1
5.下列溶液中,溶质的物质的量浓度不是1 mol·L-1的是( ) A.10g NaOH固体溶解在水中配成250mL溶液
B.将1mol SO3溶于水并配成1L的溶液
C.将0.5mo1·L-1的NaNO3溶液100mL加热蒸发掉50g水的溶液
D.标况下,将22.4L氯化氢气体溶于水配成1L溶液
6.3.6g碳在一定量的氧气中燃烧,反应后生成一氧化碳和二氧化碳混合气体的平均摩尔质量是32g·mol -1,则生成的一氧化碳的质量是( )
A.3.3g B.6.3g C.8.4g D.13.2g
7.若50滴水正好是mmL,水的密度为1g•mL-1,则1滴水所含的分子数是()
A.m×50×18×6.02×1023B.
23 m 6.0210
5018
⨯⨯
⨯
C.
23
18m 6.0210
50
⨯⨯
D.
23
m5018
6.0210
⨯⨯
⨯
8.下列说法正确的是( )
A.硫酸、磷酸的摩尔质量均为98g
B.20℃、1.0×10 5Pa时,同体积的O2与CO2含有相同的分子数
C.标准状况下,16gO2与24g Mg所占的体积相同
D.当1mol气态物质的体积为22.4L时,该气体一定处于标准状况
9.我国药学家屠呦呦因发现青蒿素开创了治疗疟疾的新方法,荣获了诺贝尔奖。
已知青蒿素的分子式为C15H22O5,下列有关说法正确的是( )
A.标准状况下,1mol青蒿素的体积约为22.4L
B.青蒿素中C、H、O的质量之比为15:22:5
C.青蒿素的摩尔质量为282g/mol
D.1mol青蒿素中含11molH2
10.某非金属单质A 和氧气发生化合反应生成B ,B 为气体,其体积是反应掉氧气体积的两倍(同温同压)。
关于B 分子组成的推测一定正确的是( )
A .有2个氧原子
B .有1个氧原子
C .有1个A 原子
D .有2个A 原子
11.下列叙述正确的是( )
①2 mol 铁原子 ②1 mol Fe 3+ ③0.5 mol 氧 ④0.5 mol 氮分子 ⑤氨的摩尔质量是17 g A .①③④ B .①②④⑤ C .①②④ D .①②③④⑤
12.在100mL 的溶液中溶有0.1molNaC1和0.lmolMgCl 2,此溶液中Cl -的浓度为( )
A .3mol·L -1
B .2mol·L -1
C .0.3mol·L -1
D .0.2mol·L -1
13.实验室用下列两种方法制氯气:①用含146gHCl 的浓盐酸与足量的MnO 2反应,②用87gMnO 2与足量浓盐酸反应。
所得的氯气( )
A .①比②多
B .②比①多
C .一样多
D .无法比较
14.下列叙述中正确的是( )
A .1mol OH -的质量为17
B .二氧化碳的摩尔质量为44g
C .铁原子的摩尔质量等于它的相对原子质量
D .一个钠原子的质量等于23
236.0210 g 15.常温常压下,等质量的CH 4、CO 2、O 2、SO 2分别吹出四个气球,其中气体为CH 4的是(
) A . B . C . D .
二、实验题
16.实验室用NaOH固体配制1
⋅的NaOH溶液。
请回答下列问题:
480mL0.2mol L-
(1)配制1
⋅的NaOH溶液
480mL0.2mol L-
(2)容量瓶上标有下列中的__________(填序号)。
①温度②浓度③规格④压强⑤刻度线
(3)配制溶液时,其正确的操作顺序是(用字母表示,每个字母只能用一次)___________;并补充横线上的内容。
A.用30mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH固体,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿__________注入容量瓶中
D.将容量瓶塞盖好,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液_________
F.往容量瓶中加水至液面距离刻度线1~2cm
(4)在配制上述溶液的过程中,下列操作引起结果(浓度)偏小的有__________(填标号)。
A.在烧杯中溶解溶质搅拌时,溅出少量溶液
B.称量NaOH固体时,天平的砝码已生镑
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溶液溅出
17...如图所示为常见仪器的部分结构。
(1)请写出下列仪器的名称:A__________,B__________,C___________。
(2)仪器B上标记有___________(填序号)。
.质量.温度.刻度线.浓度.容积
..现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL0.2mol/L的稀H2SO4。
有关操作为:.计算所需浓硫酸的体积.量取一定体积的浓硫酸.稀释、冷却.转移、洗涤.定容.摇匀。
回答下列问题
(3)应用量筒量取的浓硫酸体积是________mL,实验中所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外还有_______________。
(4)第.步中稀释浓硫酸的操作是______________________。
(5)将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。
请你分析下列哪些操作会引起所配浓度偏大(填写字母)______________________。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.烧杯未进行洗涤
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
18.某同学利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图所示,导管出口高于液面)。
⑥测量收集到的气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性____________________________________________。
(2)以下是测量收集到的气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和
量筒内的气体都冷却至室温;③读取量筒内气体的体积。
这三步操作的正确顺序是__________(请填写步骤代号)。
(3)测量收集到的气体体积时,如何使量筒内外液面的高度相同?________________。
(4)如果实验中得到的氧气体积是c L(25 .、1.01×105 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简)M(O2)=_____________________。
参考答案
1.C2.D3.A4.A5.C6.B7.B8.B9.C10.B11.C12.A13.B14.D15.D 16.4.0 500 烧杯、玻璃棒、胶头滴管 ①③⑤ BCAFED 玻璃棒 液体凹液面最低点与刻度线相切
AC
17.量筒 容量瓶 温度计 ②③⑤ 5.4 500mL 容量瓶 将浓硫酸沿烧杯内壁慢慢加入水中,边加边用玻璃棒搅拌 ACF
18.将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气 ②①③ 慢慢将量筒下移
22.4L mol 1298K (ag bg)273K cL
-⋅⨯⨯-⨯。
