pBAD22载体图谱
pAd-PL-DEST使用说明

pENTR-L1-pLac-lacZa-R5
pcDNA6/BioEase-DEST
pENTR-L1pLaclacZaL4
pcDNA6.2/N-YFP-DEST
pENTR/H1/ห้องสมุดไป่ตู้O
pcDNA6.2/N-EmGFP-DEST
pENTR-GeneBLAzer
pcDNA6.2/V5-DEST
pENTR11-Dual
Key Features Gateway Technology for efficient and rapid cloning Promoterless vector that allows gene of interest to be controlled by a promoter of choice Human Ad5 sequences (ΔE3) and Viral Inverted Terminal Repeats (ITRs) for packaging of the expression construct into virions Ampicillin selection marker
pAd-PL-DEST
编号 北京华越洋 VECT511168
载体名称 pAd-PL-DEST
pAd-PL-DEST Gateway 载体基本信息:
载体名称:
pAd-PL-DEST
质粒类型:
腺病毒表达载体;Gateway 系统
高拷贝/低拷贝:
高拷贝
启动子:
无启动子
克隆方法:
Gateway
载体大小:
34864 bp
pLenti6/TR pLenti4/V5-DEST plenti-CMV-puro-DEST plenti6/V5-Dest pcDNA6.2/V5-PL-DEST pET-DEST42 pBAD-DEST49 pENTR5'/EF1α p pENTR5'/CMVp pDEST22 pT-Rex-DEST31 pT-Rex-DEST30 pEF-DEST51 pIB/V5-His-DEST pMT-DEST48 pcDNA6.2/GW/EmGFP-miR negative pLenti4/V5-GW/LacZ pENTR-MCS1-IRES2-EGFP pENTR 2B Dual pENTR4-FLAG pENTR-MCS1-IRES2-DsRed2 pENTR-DsRed2-MCS1 miR
质粒图谱大全

(转载)之马矢奏春创作一.九种表达载体Pllp-OmpA,pllp-STII,pMBP-P,pMBP-C,pET-GST,pET-Trx,pET-His,pET-CKS,pET-DsbA 二.克隆载体pTZ19RDNApUC57DNAPMD18TPQE30pUC18pUC19pTrcHisApTrxFuspRSET-ApRSET-BpVAX1PBR322pbv220pBluescriptIIKS( )L4440pCAMBIA-1301pMAL-p2XpGD926三.PET系列表达载体ProteinExpression?ProkaryoticExpression?pETDsbFusionSyste ms39band40bProteinExpression?ProkaryoticExpression?pETExpressionSyst em33bProteinExpression?ProkaryoticExpression?pETExpressionSyst emsProteinExpression?ProkaryoticExpression?pETExpressionSyst emsplusCompetentCellsProteinExpression?ProkaryoticExpression?pETGSTFusionSyste ms41and42ProteinExpression?ProkaryoticExpression?pETNusAFusionSyst ems43.1and44ProteinExpression?ProkaryoticExpression?pETVectorDNA ProteinPurification?PurificationSystems?Strep?TactinResin sandPurificationKits四.PGEX系列表达载体TEcoR?pGEX-1I/BAP pGEX-2TpGEX-2TK pGEX-3X pGEX-4T-1 pGEX-4T-2 pGEX-4T-3 pGEX-5X-1 pGEX-5X-2 pGEX-5X-3 pGEX-6P-1 pGEX-6P-2 pGEX-6P-3 五.PTYBsystem PTYB1PTYB2PTYB11PTYB12六.真核表达载体pCDNA3.1(-) pCDNA3.1( ) pPICZalphaA pGAPZαA PYES2.0pBI121pEGFP-N1pEGFP-C1pPIC9KpPIC3.5K如何阅读分析质粒图谱载体主要有病毒和非病毒两年夜类,其中质粒DNA是一种新的非病毒转基因载体.一、一个合格质粒的组成要素复制起始位点Ori?即控制复制起始的位点.原核生物DNA分子中只有一个复制起始点.而真核生物DNA分子有多个复制起始位点.抗生素抗性基因可以便于加以检测,如Amp ?,Kan 多?克隆位点MCS 克隆携带外源基因片段P/E?启动子/增强子Terms终止信号?加poly(A)信号?可以起到稳定mRNA作用二、如何阅读质粒图谱第一步:首先看Ori的位置,了解质粒的类型(原核/真核/穿越质粒)第二步:再看筛选标识表记标帜,如抗性,决定使用什么筛选标识表记标帜.(1)Ampr水解β-内酰胺环,解除氨苄的毒性.(2)tetr可以阻止四环素进入细胞.(3)camr生成氯霉素羟乙酰基衍生物,使之失去毒性.(4)neor(kanr)氨基糖苷磷酸转移酶使G418(长那霉素衍生物)失活(5)hygr使潮霉素β失活.第三步:看多克隆位点(MCS).它具有多个限制酶的单一切点.便于外源基因的拔出.如果在这些位点外有外源基因的拔出,会招致某种标识表记标帜基因的失活,而便于筛选.决定能不能放目的基因以及如何放置目的基因.第四步:再看外源DNA拔出片段年夜小.质粒一般只能容纳小于10Kb的外源DNA片段.一般来说,外源DNA片段越长,越难拔出,越不稳定,转化效率越低.第五步:是否含有表达系统元件,即启动子-核糖体结合位点-克隆位点-转录终止信号.这是用来区别克隆载体与表达载体.克隆载体中加入一些与表达调控有关的元件即成为表达载体.选用那种载体,还是要以实验目的为准绳.启动子-核糖体结合位点-克隆位点-转录终止信号启动子-增进DNA转录的DNA顺序,这个DNA区域常在基因或操纵子编码顺序的上游,是DNA分子上可以与RNApol特异性结合并使之开始转录的部位,但启动子自己不被转录.?增强子/缄默子-为真核?基因组(包括真核病毒基因组)中的一种具有增强邻近基因转录过程的调控顺序.其作用与增强子所在的位置或方向无关.即在所调控基因上游或下游均可发挥作用./缄默子-负增强子,负调控序列.核糖体结合位点/起始密码/SD序列(Rbs/AGU/SDs):mRNA有核糖体的两个结合位点,对原核而言是AUG(起始密码)和SD序列.? 转录终止顺序(终止子)/翻译终止密码子:结构基因的最后一个外显子中有一个AATAAA的守旧序列,此位点down-stream有一段GT或T富丰区,这2部份共同构成poly(A)加尾信号.结构基因的最后一个外显子中有一个AATAAA的守旧序列,此位点down-stream有一段GT或T富丰区,这2部份共同构成poly(A)加尾信号.?回答有人之前提出的一个问题:为什么质粒图谱上有的箭头顺时针有的箭头逆时针,那其实是代表两条DNA链,即质粒是环状双链DNA,它的启动子等在其中一条链上,而它的抗性基因在另一条链上.三、介绍一下关于载体的知识(虽然课本上都有写)1. 什么是载体即要把一个有用的基因(目的基因——研究或应用基因)通过基因工程手段送到生物细胞(受体细胞),需要运载工具(交通工具)携带外源基因进入受体细胞,这种运载工具就叫做载体(vector). P.S.基因工程所用的vector实际上是DNA分子,是用来携带目的基因片段进入受体细胞的DNA2. 载体的分类―――按功能分成:(1)克隆载体都有一个松弛的复制子,能带动外源基因,在宿主细胞中复制扩增.它是用来克隆和扩增DNA片段(基因)的载体.(所以有时实验时扩增效率低下,要注意是不是使用的严谨行载体)(2)表达载体具有克隆载体的基本元件(ori,Ampr,Mcs等)还具有转录/翻译所必需的DNA顺序的载体.―――按进入受体细胞类型分:(1)原核载体(2)真核载体(3)穿越载体(sbuttlevector)指在两种宿主生物体内复制的载体分子,因而可以运载目的基因(穿越往返两种生物之间).P.S.穿越质粒含原核和真核生物2个复制子,以确保两类细胞中都能扩增.3. 基因工程载体的3个特点:(一)都能自力自主的复制:载体DNA分子中有一段不影响它们扩增的非必需区域,如MCS,插在其中的外源DNA片段,能主动的跟着载体一起复制/扩增,就像载体的正常成份一样.(二)都能便利的加以检测:如载体的药物抗性基因,多是抗生素抗性基因,将受体细胞放在含有该抗生素培养板上培养生长时,只有携带这些抗性基因的载体分子的受体细胞才华存活.(三)都能容易进入宿主细胞中去,也易从宿主细胞中分离纯化出来.4. 载体的选择和制备:选择载体主要依据构建的目的,同时要考虑载体中应有合适的限制酶切位点.如果构建的目的是要表达一个特定的基因,则要选择合适的表达载体.载体选择主要考虑下述3点:【1】构建DNA重组体的目的,克隆扩增/表达表达,选择合适的克隆载体/表达载体.【2】.载体的类型:(1)克隆载体的克隆能力-据克隆片段年夜小(年夜选年夜,小选小).如<10kb选质粒.(2)表达载体据受体细胞类型-原核/真核/穿越,E.coli/哺乳类细胞表达载体.(3)对原核表达载体应该注意3点:①选择合适的启动子及相应的受体菌;②用于表达真核卵白质时注意克服4个困难和阅读框错位;③表达天然卵白质或融合卵白作为相应载体的参考.【3】载体MCS中的酶切位点数与组成方向因载体分歧而异,适应目的基因与载体易于链接,不发生阅读框架错位.选用质粒(最经常使用)做载体的4点要求:①选分子量小的质粒,即小载体(1-1.5kb)→不容易损坏,在细菌里面拷贝数也多(也有年夜载体);②一般使用松弛型质粒在细菌里扩增不受约束,一般10个以上的拷贝,而严谨型质粒<10个.③必需具备一个以上的酶切位点,有选择的余地;④必需有易检测的标识表记标帜,多是抗生素的抗性基因,不特指多位Ampr(试一试).无论选用哪种载体,首先都要获得载体分子,然后采纳适当的限制酶将载体DNA进行切割,获得分子,以便于与目的基因片段进行连接。
pET-22b(+)大肠杆菌表达载体说明
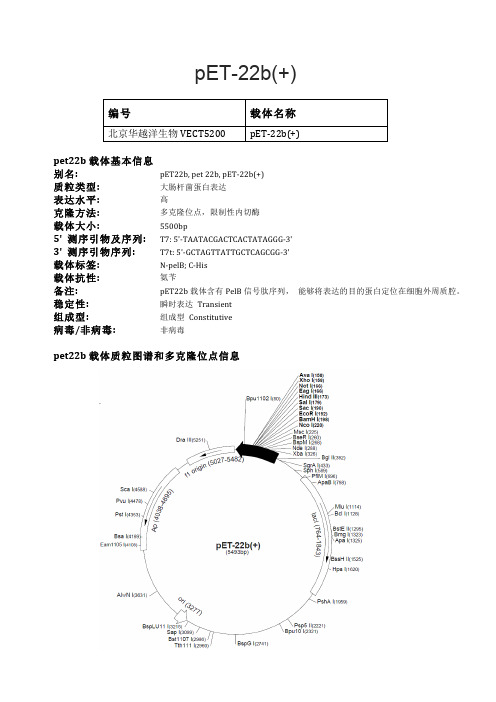
pET-22b(+)编号 载体名称北京华越洋生物VECT5200 pET-‐22b(+)pet22b载体基本信息别名: pET22b, p et 22b, p ET-‐22b(+)质粒类型: 大肠杆菌蛋白表达表达水平: 高克隆方法: 多克隆位点,限制性内切酶载体大小: 5500bp5' 测序引物及序列: T7: 5'-‐TAATACGACTCACTATAGGG-‐3'3' 测序引物序列: T7t: 5'-‐GCTAGTTATTGCTCAGCGG-‐3'载体标签: N-‐pelB; C-‐His载体抗性: 氨苄备注: pET22b载体含有PelB信号肽序列, 能够将表达的目的蛋白定位在细胞外周质腔。
稳定性: 瞬时表达 Transient组成型: 组成型 Constitutive病毒/非病毒: 非病毒pet22b载体质粒图谱和多克隆位点信息pet22b载体简介pET-‐22b(+)载体携带有一个N端的pelB信号肽序列,能够将表达的目的蛋白定位于外周质腔,同时载体含有C端His标签。
载体的单一的多克隆位点见上面的环状质粒图谱。
注意:载体序列是以pBR322质粒的编码规矩进行编码的,所以T7蛋白表达区在质粒图谱上面是反向的。
T7 RNA聚合酶启动的克隆和表达区域在质粒图谱中也被标注了出来。
质粒的F1复制子是被定向的,所以在T7噬菌体聚合酶的作用下,包含有蛋白编码序列的病毒 粒子能够产生,并启动蛋白表达,同时蛋白表达将被T7终止子序列的作用下终止蛋白翻译。
pet22b载体序列ORIGIN1 ATCCGGATAT AGTTCCTCCT TTCAGCAAAA AACCCCTCAA GACCCGTTTA GAGGCCCCAA61 GGGGTTATGC TAGTTATTGC TCAGCGGTGG CAGCAGCCAA CTCAGCTTCC TTTCGGGCTT121 TGTTAGCAGC CGGATCTCAG TGGTGGTGGT GGTGGTGCTC GAGTGCGGCC GCAAGCTTGT181 CGACGGAGCT CGAATTCGGA TCCGAATTAA TTCCGATATC CATGGCCATC GCCGGCTGGG241 CAGCGAGGAG CAGCAGACCA GCAGCAGCGG TCGGCAGCAG GTATTTCATA TGTATATCTC301 CTTCTTAAAG TTAAACAAAA TTATTTCTAG AGGGGAATTG TTATCCGCTC ACAATTCCCC361 TATAGTGAGT CGTATTAATT TCGCGGGATC GAGATCTCGA TCCTCTACGC CGGACGCATC421 GTGGCCGGCA TCACCGGCGC CACAGGTGCG GTTGCTGGCG CCTATATCGC CGACATCACC481 GATGGGGAAG ATCGGGCTCG CCACTTCGGG CTCATGAGCG CTTGTTTCGG CGTGGGTATG541 GTGGCAGGCC CCGTGGCCGG GGGACTGTTG GGCGCCATCT CCTTGCATGC ACCATTCCTT601 GCGGCGGCGG TGCTCAACGG CCTCAACCTA CTACTGGGCT GCTTCCTAAT GCAGGAGTCG661 CATAAGGGAG AGCGTCGAGA TCCCGGACAC CATCGAATGG CGCAAAACCT TTCGCGGTAT 721 GGCATGATAG CGCCCGGAAG AGAGTCAATT CAGGGTGGTG AATGTGAAAC CAGTAACGTT 781 ATACGATGTC GCAGAGTATG CCGGTGTCTC TTATCAGACC GTTTCCCGCG TGGTGAACCA 841 GGCCAGCCAC GTTTCTGCGA AAACGCGGGA AAAAGTGGAA GCGGCGATGG CGGAGCTGAA 901 TTACATTCCC AACCGCGTGG CACAACAACT GGCGGGCAAA CAGTCGTTGC TGATTGGCGT 961 TGCCACCTCC AGTCTGGCCC TGCACGCGCC GTCGCAAATT GTCGCGGCGA TTAAATCTCG 1021 CGCCGATCAA CTGGGTGCCA GCGTGGTGGT GTCGATGGTA GAACGAAGCG GCGTCGAAGC 1081 CTGTAAAGCG GCGGTGCACA ATCTTCTCGC GCAACGCGTC AGTGGGCTGA TCATTAACTA 1141 TCCGCTGGAT GACCAGGATG CCATTGCTGT GGAAGCTGCC TGCACTAATG TTCCGGCGTT 1201 ATTTCTTGAT GTCTCTGACC AGACACCCAT CAACAGTATT ATTTTCTCCC ATGAAGACGG 1261 TACGCGACTG GGCGTGGAGC ATCTGGTCGC ATTGGGTCAC CAGCAAATCG CGCTGTTAGC 1321 GGGCCCATTA AGTTCTGTCT CGGCGCGTCT GCGTCTGGCT GGCTGGCATA AATATCTCAC 1381 TCGCAATCAA ATTCAGCCGA TAGCGGAACG GGAAGGCGAC TGGAGTGCCA TGTCCGGTTT 1441 TCAACAAACC ATGCAAATGC TGAATGAGGG CATCGTTCCC ACTGCGATGC TGGTTGCCAA 1501 CGATCAGATG GCGCTGGGCG CAATGCGCGC CATTACCGAG TCCGGGCTGC GCGTTGGTGC 1561 GGATATCTCG GTAGTGGGAT ACGACGATAC CGAAGACAGC TCATGTTATA TCCCGCCGTT 1621 AACCACCATC AAACAGGATT TTCGCCTGCT GGGGCAAACC AGCGTGGACC GCTTGCTGCA 1681 ACTCTCTCAG GGCCAGGCGG TGAAGGGCAA TCAGCTGTTG CCCGTCTCAC TGGTGAAAAG 1741 AAAAACCACC CTGGCGCCCA ATACGCAAAC CGCCTCTCCC CGCGCGTTGG CCGATTCATT 1801 AATGCAGCTG GCACGACAGG TTTCCCGACT GGAAAGCGGG CAGTGAGCGC AACGCAATTA 1861 ATGTAAGTTA GCTCACTCAT TAGGCACCGG GATCTCGACC GATGCCCTTG AGAGCCTTCA 1921 ACCCAGTCAG CTCCTTCCGG TGGGCGCGGG GCATGACTAT CGTCGCCGCA CTTATGACTG 1981 TCTTCTTTAT CATGCAACTC GTAGGACAGG TGCCGGCAGC GCTCTGGGTC ATTTTCGGCG 2041 AGGACCGCTT TCGCTGGAGC GCGACGATGA TCGGCCTGTC GCTTGCGGTA TTCGGAATCT 2101 TGCACGCCCT CGCTCAAGCC TTCGTCACTG GTCCCGCCAC CAAACGTTTC GGCGAGAAGC 2161 AGGCCATTAT CGCCGGCATG GCGGCCCCAC GGGTGCGCAT GATCGTGCTC CTGTCGTTGA 2221 GGACCCGGCT AGGCTGGCGG GGTTGCCTTA CTGGTTAGCA GAATGAATCA CCGATACGCG 2281 AGCGAACGTG AAGCGACTGC TGCTGCAAAA CGTCTGCGAC CTGAGCAACA ACATGAATGG 2341 TCTTCGGTTT CCGTGTTTCG TAAAGTCTGG AAACGCGGAA GTCAGCGCCC TGCACCATTA 2401 TGTTCCGGAT CTGCATCGCA GGATGCTGCT GGCTACCCTG TGGAACACCT ACATCTGTAT 2461 TAACGAAGCG CTGGCATTGA CCCTGAGTGA TTTTTCTCTG GTCCCGCCGC ATCCATACCG 2521 CCAGTTGTTT ACCCTCACAA CGTTCCAGTA ACCGGGCATG TTCATCATCA GTAACCCGTA 2581 TCGTGAGCAT CCTCTCTCGT TTCATCGGTA TCATTACCCC CATGAACAGA AATCCCCCTT 2641 ACACGGAGGC ATCAGTGACC AAACAGGAAA AAACCGCCCT TAACATGGCC CGCTTTATCA 2701 GAAGCCAGAC ATTAACGCTT CTGGAGAAAC TCAACGAGCT GGACGCGGAT GAACAGGCAG 2761 ACATCTGTGA ATCGCTTCAC GACCACGCTG ATGAGCTTTA CCGCAGCTGC CTCGCGCGTT 2821 TCGGTGATGA CGGTGAAAAC CTCTGACACA TGCAGCTCCC GGAGACGGTC ACAGCTTGTC 2881 TGTAAGCGGA TGCCGGGAGC AGACAAGCCC GTCAGGGCGC GTCAGCGGGT GTTGGCGGGT 2941 GTCGGGGCGC AGCCATGACC CAGTCACGTA GCGATAGCGG AGTGTATACT GGCTTAACTA 3001 TGCGGCATCA GAGCAGATTG TACTGAGAGT GCACCATATA TGCGGTGTGA AATACCGCAC 3061 AGATGCGTAA GGAGAAAATA CCGCATCAGG CGCTCTTCCG CTTCCTCGCT CACTGACTCG 3121 CTGCGCTCGG TCGTTCGGCT GCGGCGAGCG GTATCAGCTC ACTCAAAGGC GGTAATACGG 3181 TTATCCACAG AATCAGGGGA TAACGCAGGA AAGAACATGT GAGCAAAAGG CCAGCAAAAG 3241 GCCAGGAACC GTAAAAAGGC CGCGTTGCTG GCGTTTTTCC ATAGGCTCCG CCCCCCTGAC3301 GAGCATCACA AAAATCGACG CTCAAGTCAG AGGTGGCGAA ACCCGACAGG ACTATAAAGA 3361 TACCAGGCGT TTCCCCCTGG AAGCTCCCTC GTGCGCTCTC CTGTTCCGAC CCTGCCGCTT 3421 ACCGGATACC TGTCCGCCTT TCTCCCTTCG GGAAGCGTGG CGCTTTCTCA TAGCTCACGC 3481 TGTAGGTATC TCAGTTCGGT GTAGGTCGTT CGCTCCAAGC TGGGCTGTGT GCACGAACCC 3541 CCCGTTCAGC CCGACCGCTG CGCCTTATCC GGTAACTATC GTCTTGAGTC CAACCCGGTA 3601 AGACACGACT TATCGCCACT GGCAGCAGCC ACTGGTAACA GGATTAGCAG AGCGAGGTAT 3661 GTAGGCGGTG CTACAGAGTT CTTGAAGTGG TGGCCTAACT ACGGCTACAC TAGAAGGACA 3721 GTATTTGGTA TCTGCGCTCT GCTGAAGCCA GTTACCTTCG GAAAAAGAGT TGGTAGCTCT 3781 TGATCCGGCA AACAAACCAC CGCTGGTAGC GGTGGTTTTT TTGTTTGCAA GCAGCAGATT 3841 ACGCGCAGAA AAAAAGGATC TCAAGAAGAT CCTTTGATCT TTTCTACGGG GTCTGACGCT 3901 CAGTGGAACG AAAACTCACG TTAAGGGATT TTGGTCATGA GATTATCAAA AAGGATCTTC 3961 ACCTAGATCC TTTTAAATTA AAAATGAAGT TTTAAATCAA TCTAAAGTAT ATATGAGTAA 4021 ACTTGGTCTG ACAGTTACCA ATGCTTAATC AGTGAGGCAC CTATCTCAGC GATCTGTCTA 4081 TTTCGTTCAT CCATAGTTGC CTGACTCCCC GTCGTGTAGA TAACTACGAT ACGGGAGGGC 4141 TTACCATCTG GCCCCAGTGC TGCAATGATA CCGCGAGACC CACGCTCACC GGCTCCAGAT 4201 TTATCAGCAA TAAACCAGCC AGCCGGAAGG GCCGAGCGCA GAAGTGGTCC TGCAACTTTA 4261 TCCGCCTCCA TCCAGTCTAT TAATTGTTGC CGGGAAGCTA GAGTAAGTAG TTCGCCAGTT 4321 AATAGTTTGC GCAACGTTGT TGCCATTGCT GCAGGCATCG TGGTGTCACG CTCGTCGTTT 4381 GGTATGGCTT CATTCAGCTC CGGTTCCCAA CGATCAAGGC GAGTTACATG ATCCCCCATG 4441 TTGTGCAAAA AAGCGGTTAG CTCCTTCGGT CCTCCGATCG TTGTCAGAAG TAAGTTGGCC 4501 GCAGTGTTAT CACTCATGGT TATGGCAGCA CTGCATAATT CTCTTACTGT CATGCCATCC 4561 GTAAGATGCT TTTCTGTGAC TGGTGAGTAC TCAACCAAGT CATTCTGAGA ATAGTGTATG 4621 CGGCGACCGA GTTGCTCTTG CCCGGCGTCA ATACGGGATA ATACCGCGCC ACATAGCAGA 4681 ACTTTAAAAG TGCTCATCAT TGGAAAACGT TCTTCGGGGC GAAAACTCTC AAGGATCTTA 4741 CCGCTGTTGA GATCCAGTTC GATGTAACCC ACTCGTGCAC CCAACTGATC TTCAGCATCT 4801 TTTACTTTCA CCAGCGTTTC TGGGTGAGCA AAAACAGGAA GGCAAAATGC CGCAAAAAAG 4861 GGAATAAGGG CGACACGGAA ATGTTGAATA CTCATACTCT TCCTTTTTCA ATATTATTGA 4921 AGCATTTATC AGGGTTATTG TCTCATGAGC GGATACATAT TTGAATGTAT TTAGAAAAAT 4981 AAACAAATAG GGGTTCCGCG CACATTTCCC CGAAAAGTGC CACCTGAAAT TGTAAACGTT 5041 AATATTTTGT TAAAATTCGC GTTAAATTTT TGTTAAATCA GCTCATTTTT TAACCAATAG 5101 GCCGAAATCG GCAAAATCCC TTATAAATCA AAAGAATAGA CCGAGATAGG GTTGAGTGTT 5161 GTTCCAGTTT GGAACAAGAG TCCACTATTA AAGAACGTGG ACTCCAACGT CAAAGGGCGA 5221 AAAACCGTCT ATCAGGGCGA TGGCCCACTA CGTGAACCAT CACCCTAATC AAGTTTTTTG 5281 GGGTCGAGGT GCCGTAAAGC ACTAAATCGG AACCCTAAAG GGAGCCCCCG ATTTAGAGCT 5341 TGACGGGGAA AGCCGGCGAA CGTGGCGAGA AAGGAAGGGA AGAAAGCGAA AGGAGCGGGC 5401 GCTAGGGCGC TGGCAAGTGT AGCGGTCACG CTGCGCGTAA CCACCACACC CGCCGCGCTT 5461 AATGCGCCGC TACAGGGCGC GTCCCATTCG CCA//其他大肠杆菌表达载体:pBV221 ptdTomato pET-52b(+) pAmCyanpDsRed-Express2 pBV220 pCold-GST pColdS-SUMOpCold TF pCold IV pCold III pCold IIpCold I pE-SUMO pCold-ProS2 pBAD102/D-TOPOpBAD202/D-TOPO pACYC184 pBAD/Thio-TOPO pBad/Myc-His C pBad/Myc-His B pBad/Myc-His A pBad/His C pBad/His B pBad/His A pBAD-TOPO pET-23b(+) pET-23a(+)pET-23c(+) pET-23(+) pET-12b(+) pET-12c(+)pET-12a(+) pET-11b(+) pET-11a(+) pET-11c(+) pBad24 pQE-82L pQE-81L pQE-80LpQE-32 pQE-9 pQE-16 pQE-31pQE-60 pQE-70 pQE-40 pET-51b(+)pET-50b(+) pET-49b(+) pET-48b(+) pET-47b(+)pET-26b(+) pET-32a(+) pET-21b(+) pET-22b(+)pET-14b pET-16b pET-15b pET-19bpET-20b(+) pET-21d(+) pET-21c(+) pET-21b(+)pET-21a(+) pET-24a(+) pET-24d(+) pET-25b(+)pET-27b(+) pET-28a(+) pET-30a(+) pET-42a(+)pET-43.1c(+) pET-43.1b(+) pET-43.1a(+) pET-44a(+)pET-44c(+) pET-46 EK/LIC pET-37b(+) pTrcHis2 C pTrcHis2 B pTrcHis2 A pET303/CT-His pET302/NT-His pRSET-CFP pRSET-EmGFP pRSET-BFP pGFPuvpET300/NT-DEST pET301/CT-DEST pGEM-T pBad43pGEX-4T-3 pGEX-5X-2 pBlueScript SK(+) pG-Tf2pG-KJE8 pGro7 pET-SUMO pSE380pET-17b pET102/D-TOPO pCDFDuet-1 pMAL-p5xpTf16 pET-28c(+) pBluescript II SK(+) pET-30b(+) pSUMO pProEX HTc pProEX HTb pProEX HTa pKD3 pKD13 pKD46 pTYB1pTYB2 pTWIN2 pBluescript II KS(-) pTYB12pMAL-p5e pACYCDuet-1 pEGM-11ZF(+) pEGM-7ZF(+) PinPoint Xa-3 PinPoint Xa-2 PinPoint Xa-1 pSP73pSP64 pTWIN1 pTYB11 pTXB1pET-5b(+) pBad/gIII C pBad/gIII B pBad/gIII A pET-5a(+) pMal-p4X pMal-p2G pkk223-3pkk232-8 pCYB1 pEZZ18 pBAD18pMAL-c5x pMal-p2E pMal-p2X pET-44 EK/LIC pET-43.1 EK/LIC pET-41 EK/LIC pMal-c4X pTrcHis BpET-31b(+) pET-3b(+) pET-41a(+) pGEX-3XpGEX-4T-2 pETDuet-1 pGEX-4T-1 pTrc99apET-28b(+) pET-His pALEX a,b,c pACYC177pBR322 pKD4 pKD20 pMXB10pEcoli-6xHN-GFPuv pKJE7 pRSET B pGEX-KGpGEX-2T pRSFDuet-1 pCOLADuet-1 pTrcHis C pTrcHis A pET-41b(+) pET-42b(+) pET-3a(+) pGEX-6P-3 pGEX-6P-2 pGEX-6P-1 pGEX-5X-3 pGEX-5X-1 pGEX-2TK pRSET A pMal-c2GpMal-c2E pMal-c2X pRSET C pQE-30pET-45b(+) pET-44b(+) pET-42c(+) pET-41c(+) pET-40b(+) pET-33b(+) pET-39b(+) pET-32 EK/LIC pET-32 Xa/LIC pET-32c(+) pET-32b(+) pET-30 Xa/LIC pET-30 EK/LIC pET-30c(+) pET-29c(+) pET-29b(+) pET-29a(+) pET-24c(+) pET-24b(+) pET-24(+)pET-23d(+) pET-11d(+) pBad33。
pAd-BLOCK-iT-DEST使用说明

pAd-BLOCK-iT-DESTpAd-BLOCK-iT-DEST Gateway载体基本信息:载体名称: pAd-BLOCK-iT-DEST质粒类型: RNAi载体;Gateway载体;腺病毒载体高拷贝/低拷贝: 低拷贝启动子: U6克隆方法: Gateway载体大小: 34864bp5' 测序引物及序列: 5′-GACTTTGACCGTTTACGTGGAGAC-3′3' 测序引物及序列: 5′-CCTTAAGCCACGCCCACACATTTC-3′RNAi类型: shRNA载体抗性: 氨苄青霉素筛选标记: --克隆菌株: ccdB阳性筛选 DB3.1感受态细胞,阴性筛选用 OmniMAX2-T1感受态细胞重组腺病毒载体的复制扩增则最好使用 Stbl3感受态细胞,使用DH5a则常常会发生质粒拷贝数降低、小提提不出质粒、质粒大小改变等现象。
备注: 对应的入门载体是 pENTR/U6腺病毒包装可以选用Invitrogen出品的293A包装细胞系,或者使用bj5183菌株。
稳定性: 稳表达组成型: 组成型病毒/非病毒: 腺病毒pAd-BLOCK-iT-DEST载体质粒图谱和多克隆位点信息:pAd-BLOCK-iT-DEST载体简介:pAd-BLOCK-iT-DEST RNAi Gateway 载体(pAd-BLOCK-iT-DEST RNAi Gateway Vector) 可用于在体内高效导入和瞬时表达来自腺病毒载体的短发夹RNA (shRNA)。
新型克隆方法将约50 bp DNA 寡核苷酸克隆到BLOCK-iT-U6 入门载体中紧随U6 polIII 启动子之后的位置。
将入门载体高效重组到pAd-BLOCK-iT-DEST 载体后进行病毒制备和转导,随后U6 启动子驱动的shRNA 可在大多数分裂或非分裂哺乳动物细胞类型中瞬时表达。
生成的shRNA 可避开宿主防御机制,将有效产生RNAi 基因抑制反应。
USP22 ShRNA慢病毒载体的构建及鉴定

USP22 ShRNA慢病毒载体的构建及鉴定目的构建并鉴定USP22基因ShRNA慢病毒载体,为进一步研究USP22基因在鼻咽癌中的作用机制奠定基础。
方法针对USP22基因的编码序列设计并合成2条特异性干扰序列,序列两端含有限制性内切酶位点HpaⅠ和XhoⅠ。
寡核苷酸链退火生成寡核苷酸双链,5′端磷酸化后将含有酶切位点的寡核苷酸双链克隆到pLL3.7慢病毒表达载体。
连接产物经转化、培养,提取其质粒,提取出来的质粒经HpaⅠ和XhoⅠ酶切电泳鉴定,鉴定正确的质粒进行测序。
构建成功的慢病毒表达载体pLL-USP22-shRNA與包装载体质粒混匀共转染于293T细胞。
通过荧光显微镜下观察绿色荧光蛋白(GFP)情况,对病毒滴度和感染效率进行检测。
结果成功构建慢病毒表达载体pLL-USP22-shRNA。
与包装载体质粒共转染293T细胞后测定慢病毒滴度为4×107 TU/ml。
结论本实验应用相关技术成功构建USP22 ShRNA慢病毒载体,为进一步研究USP22基因的生物学功能奠定了基础。
标签:USP22;慢病毒载体;构建;鉴定肿瘤细胞中基因表达具有组织特异性,USP22泛素水解酶属去泛素化酶DUB基因家族成员,其普遍表达表明其功能的保守性,因此,USP22被归类为肿瘤干细胞的标记基因而引起高度关注[1]。
国内外学者研究发现,USP22基因过表达与结直肠癌[2]、肺癌[3]、胃癌[4]、食管癌[5]、乳腺癌[6]等恶性肿瘤的浸润、转移和预后差高度相关。
沉默USP22基因表达,能显著抑制膀胱癌[7]、结直肠癌[8]细胞增殖,由此推测USP22基因可能成为肿瘤治疗的一个新靶点。
本研究通过基因工程技术构建USP22 ShRNA慢病毒载体,为进一步研究USP22基因在人鼻咽癌细胞中的作用机制提供实验基础。
1 材料与方法1.1 实验材料、试剂及仪器pLL3.7慢病毒表达载体及包装载体质粒购自广州永诺生物科技有限公司。
质粒图谱

)质粒图谱登记号:00012)质粒名称:pIRES3)来源:BD Co4)用途:真核双表达5)是否可以提供更详细资料:可以6)是否可以共享:7)联系方式:PM)质粒图谱登记号:00022)质粒名称:pECFP-C13)来源:BD Co4)用途:检测真核表达5)是否可以提供更详细资料:可以6)是否可以共享:7)联系方式:pm1)质粒图谱登记号:00032)质粒名称:pShuttle3)来源:4)用途:5)是否可以提供更详细资料:6)是否可以共享:7)联系方式:2)pShuttle MCS很多人用pEGFP-C1,我也来发一个)质粒图谱登记号:00042)质粒名称:pSBR322、pUC183)来源:4)用途:5)是否可以提供更详细资料:6)是否可以共享:7)联系方式:1)质粒图谱登记号:00052)质粒名称:pcDNA3.1(+)/CAT3)来源:invitrogen4)用途:真核表达5)是否可以提供更详细资料:可以6)是否可以共享:无偿7)联系方式:PM1)质粒图谱登记号:00062)质粒名称:pQEx3)来源:Qiagen4)用途:原核表达5)是否可以提供更详细资料:可以6)是否可以共享:交换7)联系方式:PM2)1)质粒图谱登记号:00072)质粒名称:pIVEX2.33)来源:Rocho4)用途:体外转录翻译5)是否可以提供更详细资料:可以6)是否可以共享:交换7)联系方式:PM质粒图谱登记号:0008质粒名称:pIRES-EGFP来源:用途:是否可以提供更详细资料:是否可以共享:否联系方式:1)质粒图谱登记号:00092)质粒名称:pET-28a(+)3)来源:Novagen4)用途:原核表达5)是否可以提供更详细资料:可以6)是否可以共享:交换7)联系方式:PM1)质粒图谱登记号:00112)质粒名称:pET-32a(+)3)来源:novagen4)用途:原核表达5)是否可以提供更详细资料:6)是否可以共享:7)联系方式:pm1)质粒图谱登记号:00132)质粒名称:pcDNA3.1/Zeo (+)3)来源:invitrogen4)用途:原核表达5)是否可以提供更详细资料:可以6)是否可以共享:交换7)联系方式:PM)质粒图谱登记号:00132)质粒名称:pEGFP-N33)来源:clontech4)用途:真核表达5)是否可以提供更详细资料:可以6)是否可以共享:交换7)联系方式:PM)质粒图谱登记号:00142)质粒名称:pcDNA33)来源:invitrogen4)用途:真核表达5)是否可以提供更详细资料:可以6)是否可以共享:交换7)联系方式:PM)质粒图谱登记号:00152)质粒名称:pfastbac13)来源:invitrogene4)用途:昆虫表达5)是否可以提供更详细资料:不可以6)是否可以共享:不可以7)联系方式:PM)质粒图谱登记号:00162)质粒名称:pEGFP-C33)来源:clontech4)用途:真核表达5)是否可以提供更详细资料:可以6)是否可以共享:交换7)联系方式:PMwangjun2002274 edited on 2004-06-22 00:041)质粒图谱登记号:00172)质粒名称:pSecTag23)来源:Invitrogen4)用途:真核表达5)是否可以提供更详细资料:可以6)是否可以共享:交换7)联系方式:PM)1质粒图谱登记号:00192)质粒名称:pET20b3)来源:NOVAGEN4)用途:原核表达5)是否可以提供更详细资料:可以6)是否可以共享:交换7)联系方式:PM1)质粒图谱登记号:00222)质粒名称:pThioHisA3)来源:invitrogen4)用途:原核表达5)是否可以提供更详细资料:4.365kb , HP-thioredoxin fusion proteinexpressionvector, trc promoter, Ampr, a EK cleavage site lies between HP-thioredoxin and MCS宿主菌TOP10(基因型为:F-mcrA △(mrr-hsd RMS-mcrBC)Ф80 lacZ M15 △lacX74 deoR recAl araD139 △(ara-leu)7697 galU galK rpsL endAl nupG6)是否可以共享:交换或其它7)联系方式:PM2)3)1)质粒图谱登记号:00242)质粒名称:pcDNA3.1-Myc-His-A-3)来源:invitrogen4)用途:真核核表达4))质粒图谱登记号:00252)质粒名称:pSUPER.neo3)来源:4)用途:siRNA5)是否可以提供更详细资料:可以6)是否可以共享:交换7)联系方式:PM)质粒图谱登记号:00312)质粒名称:pSilencer1.0-siRNA3)来源:Ambion4)用途:RNAi5)是否可以提供更详细资料:/techlib/Documents.html?fkResSxn=7&fkSub Sxn=236)是否可以共享:实验结束后,可提供含shRNA模板的质粒7)联系方式:pm5) )质粒图谱登记号:00322)质粒名称:pSilencer2.0-U6siRNA 3)来源:Ambion4)用途:RNAi ,与1.0相比,可以建立稳转株5)更详细资料:/techlib/prot/fm_7209.pdf 6)是否可以共享:交换 7)联系方式:pm6)会员名:mlluoE-mail:*************可提供试验资源名称和简要介绍:pSilencer 3.1-H1 neo Vector,是Ambion公司目前最高版本的shRNA 载体,为扩增此载体我已插入目的片段,如有战友需要,将此片段双酶切再连上自己的片段即可。
八氢番茄红素脱氢酶基因超表达载体的构建及表达鉴定

八氢番茄红素脱氢酶基因超表达载体的构建及表达鉴定摘要:八氢番茄红素脱氢酶(PDS)是植物类胡萝卜素生物合成途径中促进番茄红素合成的关键酶,根据番茄中该酶的编码基因序列设计一对特异引物,通过RT-PCR在番茄中扩增出一个约1 900 bp的全长cDNA片段。对这个全长片段构建了超表达载体,酶切检测表明该片段已插入植物表达载体。采用农杆菌介导的方法转化番茄获得10株转基因植株,PCR检测表明外源基因已导入番茄基因组中。转基因番茄果实的番茄红素含量分析结果表明,转基因后代株系番茄红素平均含量比对照增加了1.4倍,PDS编码基因的超表达有效促进了番茄果实中番茄红素的合成和积累。关键词:番茄;八氢番茄红素脱氢酶;超表达;载体构建;遗传转化Construction of Overexpression Vector for Phytoene Dehydrogenase Gene and Its Expression Identification in TomatoAbstract: Phytoene dehydrogenase (PDS) is a key enzyme in the carotenoid biosynthetic pathway. A 1 900 bp full-length cDNA fragment was amplified by RT-PCR from tomato using a pair of specific primers based on the coding sequence of PDS. Using the amplified fragment, the overexpression vector was constructed and identified by digestion with appropriate enzymes. The vector was transformed into tomato by Agrobacterium-mediated method and ten transgenic plants were obtained. The result of PCR revealed that the target gene was integrated into the tomato genome. The lycopene contents in the fruits of transgenic lines were 1.4 times higher than that of the control, suggesting that overexpression of PDS significantly enhanced the lycopene biosynthesis and accumulation in transgenic tomato fruits.Key words: tomato; phytoene dehydrogenase; overexpression; construction of expression vector; genetic transformation番茄红素是一种天然植物色素,是许多类胡萝卜素生物合成的中间体。番茄红素广泛存在于水果及蔬菜中,在番茄中的含量最高。近年来国内外许多研究表明,番茄红素可以猝灭活性氧类物质,清除体内自由基,活化免疫细胞,具有防癌、抗癌作用。番茄红素能消除香烟和汽车废气中的有毒物质,可以预防和治疗心脑血管疾病,保护皮肤。番茄红素的抗氧化性能是天然类胡萝卜素中最强的,其独特的生理功能正越来越受到人们的重视[1]。经过多年的研究,人们已基本清楚了植物类胡萝卜素的生物合成途径[2,3],也克隆了合成途径中的大多数关键酶基因[3-5],这使得人们可以通过基因工程的方法调控番茄红素的生物合成。在植物类胡萝卜素的生物合成途径中,八氢番茄红素脱氢酶(PDS)是促进番茄红素合成的关键酶,该研究的目的是通过RT-PCR的方法从番茄中克隆该关键酶基因,构建超表达载体并通过农杆菌介导对番茄进行遗传转化,以增加转基因后代植株中的番茄红素含量,提高番茄果实的营养价值。1 材料与方法1.1 材料番茄品种中蔬5号、大肠杆菌DH5α、植物表达载体pMV(由pBI121改造而成,即将GUS片段缺失,引入含有5′-XbaⅠ-XhoⅠ-KpnⅠ-SacⅠ-3′多酶切克隆位点的片段)由华中农业大学作物遗传改良国家重点实验室番茄组提供。TRIzol试剂盒购自Invitrogen公司,克隆载体质粒pMD18-T购自TaKaRa公司,第一链cDNA 合成试剂盒、Taq DNA聚合酶、T4 DNA连接酶、限制性内切酶购自Fermentas公司,DNA纯化回收试剂盒及其他相关试剂购自上海生工生物工程有限公司。1.2 方法1.2.1 RT-PCR扩增及基因克隆根据GenBank中番茄八氢番茄红素脱氢酶(PDS)编码基因序列(M88683)设计一对引物为F:5′-TTCAACTTCAACCCAACC-3′,R:5′-TCACCTCGCACTCTTCTT-3′。从番茄组织中抽提RNA进行反转录,获得cDNA第一链。以获得的cDNA为模板进行RT-PCR反应,反应体系为25 μL,内含1×PCR Buffer,MgCl2 1.5 mmol/L,dNTPs 0.2 mmol/L,基因特异引物0.5 μmol/L,Taq DNA聚合酶1U,模板约100 ng。反应条件:94 ℃预变性5 min;94 ℃、1 min,56 ℃、1 min,72 ℃、2 min,35个循环;最后72 ℃延伸10 min。回收RT-PCR扩增得到的cDNA片段,克隆到pMD18-T载体上,方法见文献[6]。重组克隆测序由上海英骏生物技术有限公司完成。1.2.2 超表达载体的构建将含有PDS编码基因的pMD18-T载体用SalⅠ和KpnⅠ双酶切,回收小片段克隆到经XhoⅠ和KpnⅠ双酶切的pMV载体上,构建成超表达载体(图1)。将构建的载体通过电击法导入根癌农杆菌EHA105中。1.2.3 番茄的遗传转化番茄的遗传转化参见文献[7]。当卡那霉素抗性芽长到2~3 cm后切下抗性芽,插入到生根培养基中诱导生根。当根长到3~4 cm后将小植株开瓶炼苗3~5 d,然后移栽到花盆中。1.2.4 转基因植株的检测及番茄红素含量测定提取卡那霉素抗性植株及未转化植株的总DNA,用NPTⅡ引物(F:5′-AGACAATCGGCTGCTCTGAT-3′,R:5′-TCATTTCGAACCCCAGAGTC-3′)进行PCR检测。PCR反应体系和扩增程序见文献[7]。转基因植株及对照番茄红素含量测定参照万群等[8]介绍的方法。2 结果与分析2.1 番茄PDS编码基因的克隆以番茄叶片第一链cDNA为模板,通过RT-PCR扩增出一大小在1 900 bp左右的片段(图2)。回收目的片段克隆到pMD18-T载体上。重组质粒经SalⅠ与KpnⅠ双酶切检测,可切下一大小在 1 900 bp左右的片段(图3),证明克隆成功,命名为pMDPDS。重组子测序结果表明,所克隆的片段全长1 927 bp,其序列与GenBank中M88683的序列完全一致。2.2 植物超表达载体的构建选择经测序验证的正义重组克隆子pMDPDS,先用SalⅠ和KpnⅠ双酶切,再与经XhoⅠ和KpnⅠ双酶切后的pMV载体连接,构建成超表达载体,定名为pMPDS 。pMPDS经XbaⅠ和KpnⅠ双酶切检测,可切下一大小在1 900 bp左右的片段(图4),表明所构建的超表达载体完全正确。2.3 转基因植株的获得与检测采用农杆菌介导的共培养法获得了11株卡那霉素抗性再生植株,这些抗性植株与对照相比没有明显的形态学差异。以pMPDS载体为阳性对照,未转基因植株为阴性对照,利用NPTⅡ引物对卡那霉素抗性植株进行PCR的检测结果显示,10株再生植株能扩增出预期的740 bp的电泳带,而未转基因植株则无该特异带(图5),初步表明外源基因已整合到番茄的基因组中,PCR结果阳性的植株占抗性植株的比例为90.9%。2.4 转基因植株后代番茄红素含量分析对转基因番茄植株T1代株系测定果实番茄红素含量,结果见图6。从图中可看出,转基因植株果实番茄红素含量都比对照显著增加,最高的株系6比对照增加了2.1倍,平均增加了1.4倍。3 小结与讨论植物类胡萝卜素生物合成途径是重要的色素合成途径,由于植物类胡萝卜素合成途径中几乎所有的基因均已被分离和鉴定,使得利用转基因技术提高一些主要农作物中类胡萝卜素的含量成为可能。目前,植物类胡萝卜素基因工程进展很大[9-11],转基因“金稻”的培育就是一个突出的例子[12]。本研究从番茄中克隆了植物类胡萝卜素生物合成途径中促进番茄红素合成的八氢番茄红素脱氢酶(PDS)的编码基因,并构建了该基因的超表达载体,通过农杆菌介导法获得了转基因番茄植株,转基因后代株系果实中番茄红素平均含量比对照增加了1.4倍。由此可见,超表达PDS的编码基因成功地达到了增加番茄果实中番茄红素的含量和提高番茄果实营养价值的目的。Fray等[13]的研究表明,组成型过量表达番茄PSY的编码基因导致转基因番茄植株矮化。同样,Busch等[14]的研究表明,烟草PSY的编码基因组成型过量表达,也引起转基因烟草植株矮化、叶片形态变化等不良反应。本研究中超表达载体采用的是CaMV 35S启动子,获得的10株转基因番茄植株是组成型超表达PDS的编码基因的,这些转基因植株与野生型相比没有明显的形态学差异,这与张建成等[15]的研究结果一致。在转基因研究中,人们通常选择组织或器官特异性启动子,以减少对非靶器官或组织生长的影响。Aluru等[16]利用特异性启动子,将类胡萝卜素合成途径中的3个基因PSY、PDS、ZDS同时过量表达,发现转基因玉米胚乳中积累的总的类胡萝卜素含量是对照的34倍。因此,在应用基因工程技术调控类胡萝卜素生物合成途径时,应尽量选用组织或器官特异性启动子。参考文献:[1] 李京,惠伯棣,裴凌鹏. 番茄红素——被关注的功能因子[J].食品科学,2005,26(8):461-464.[2] HIRSCHBERG J. Carotenoid biosynthesis in flowering plants[J]. Curr Opin Plant Biol,2001,4(3):210-218.[3] 朱长甫,陈星,王英典. 植物类胡萝卜素生物合成及其相关基因在基因工程中的应用[J]. 植物生理与分子生物学学报,2004,30(6):609-618.[4] 陶俊,张上隆,徐昌杰,等. 类胡萝卜素合成的相关基因及其基因工程[J]. 生物工程学报,2002,18(3):276-281.[5] CUNNINGHAM F X,GANTT E. Genes and enzymes of carotenoid biosynthesis in plants[J]. Annu Rev Plant Physiol Plant Mol Biol,1998,49:557-583. [6] 邹礼平,高和平,钟亚琴,等. 番茄八氢番茄红素合成酶基因的克隆及超量表达载体构建[J]. 孝感学院学报,2008,28(6):16-19.[7] 邹礼平. 番茄抗坏血酸生物合成与代谢途径中相关酶基因的克隆与调控[D]. 武汉:华中农业大学,2005.[8] 万群,张兴国,宋明. 果实特异性RNAi介导的Lcy基因沉默来增加番茄中番茄红素的含量[J]. 生物工程学报,2007,23(3):429-433.[9] 王玉萍,刘庆昌,翟红. 植物类胡萝卜素生物合成相关基因的表达调控及其在植物基因工程中的应用[J].分子植物育种,2006,4(1):103-110.[10] BRAMLEY P. Regulation of carotenoid formation during tomato fruit ripening and development[J]. J Exp Bot,2002,53(377):2107-2113.[11] GIULIANO G,AQUILANI R,DHARMAPURI S. Metabolic engineering ofplant carotenoids[J]. Trends Plant Sci,2000,5(10):406-409.[12] YE X,AL-BABILI S,KL?魻TI A,et al. Engineering the provitamin A (β-carotene) biosynthetic pathway into (carotenoid-free) rice endosperm[J]. Science,2000,287(5451):303-305.[13] FRAY R G,WALLACE A,FRASER P D,et al. Constitutive expression of a fruit phytoene synthase gene in transgenic tomatoes causes dwarfism by redirecting metabolites from the gibberellin pathway[J]. Plant J,1995,8(5):693-701.[14] BUSCH M,SEUTER A,HAIN R. Functional analysis of the early steps of carotenoid biosynthesis in tobacco[J]. Plant Physiol,2002,128(2):439-453.[15] 张建成,周文静,邓秀新. 超表达草生欧文氏菌crtB基因促进转基因番茄类胡萝卜素合成的研究[J].园艺学报,2010,37(3):390-396.[16] ALURU M,XU Y,GUO R,et al. Generation of transgenic maize with enhanced provitamin A content[J]. J Exp Bot,2008,59(13):3551-3562.。
质粒图谱大全

(转载)一.九种表达载体Pllp-OmpA, pllp-STII, pMBP-P, pMBP-C,pET-GST, pET-Trx, pET-His, pET-CKS, pET-DsbA二.克隆载体pTZ19RDNApUC57DNAPMD18TPQE30pUC18pUC19pTrcHisApTrxFuspRSET-ApRSET-BpVAX1PBR322pbv220pBluescriptIIKS( )L4440pCAMBIA-1301pMAL-p2XpGD926三.PET系列表达载体ProteinExpression?ProkaryoticExpression?pETDsbFusionSystems39band40b ProteinExpression?ProkaryoticExpression?pETExpressionSystem33b ProteinExpression?ProkaryoticExpression?pETExpressionSystems ProteinExpression?ProkaryoticExpression?pETExpressionSystemsplusCompetentCells ProteinExpression?ProkaryoticExpression?pETGSTFusionSystems41and42 ProteinExpression?ProkaryoticExpression?pETNusAFusionSystems43.1and44 ProteinExpression?ProkaryoticExpression?pETVectorDNAProteinPurification?PurificationSystems?Strep?TactinResinsandPurificationKits四.PGEX系列表达载体TEcoR?pGEX-1I/BAPpGEX-2TpGEX-2TKpGEX-3XpGEX-4T-1pGEX-4T-2pGEX-4T-3pGEX-5X-1pGEX-5X-2pGEX-5X-3pGEX-6P-1pGEX-6P-2pGEX-6P-3五.PTYBsystemPTYB1PTYB2PTYB11PTYB12六.真核表达载体pCDNA3.1(-)pCDNA3.1( )pPICZalphaApGAPZαAPYES2.0pBI121pEGFP-N1pEGFP-C1pPIC9KpPIC3.5K如何阅读分析质粒图谱载体主要有病毒和非病毒两大类,其中质粒DNA是一种新的非病毒转基因载体。
