单线桥和双线巧:氧化还原反应(初中化学方程式 )
双线桥和单线桥

用单线桥分析氧化还原反应 2e-
2Fe3++2I- = 2Fe2+ + I2
Fe3+ 氧化剂___________ I2 氧化产物__________
+3
-1
+2
0
I- 还原剂___________ Fe2+ 还原产物_________
2e转移的电子数____________
用双线桥和单线桥表示下列氧化 还原反应电子转移情况。
2.箭头总是从反应物指向生成物;
用双线桥分析氧化还原反应
化合价升高,失5e-,被氧化 0 +5 -1 3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O 化合价降低,得5×e-,被还原
Cl2 氧化剂___________ Cl2 还原剂___________ 还原产物_________ KCl
写出C, F, Mg 原子结构示意图
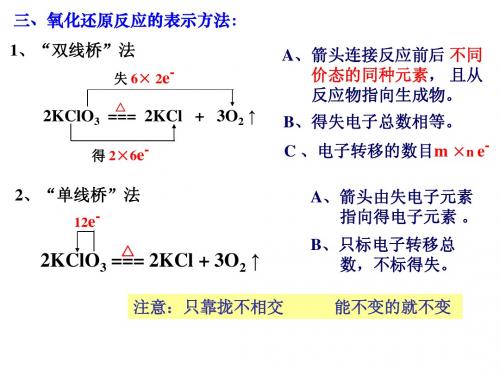
氧化还原反应的表示方法: 双线桥
用于表示反应中元素化合价变化情况的双箭头
化合价升高,失4e-,被氧化
2CuO + C == 2Cu + CO2
化合价降低,得2×2e-,被还原
+2
0高温
0
+4
1.标出变化了的元素化合价; 书写步骤: 3.箭头指向同种元素; 4.升价在上,降价在下。
KClO3 氧化产物__________
5e- 转移的电子数____________
(2)单线桥法
2Hale Waihona Puke +200+1
CuO+H2==Cu+H2O
氧化还原反应单线桥画法

氧化还原反应单线桥画法【原创版】目录1.氧化还原反应概述2.氧化还原反应单线桥画法的概念3.氧化还原反应单线桥画法的步骤4.氧化还原反应单线桥画法的应用5.总结正文一、氧化还原反应概述氧化还原反应是化学中常见的一种反应类型,它涉及到原子、离子或分子的电子转移。
在氧化还原反应中,物质失去电子的过程被称为氧化,而获得电子的过程被称为还原。
氧化还原反应在自然界和工业生产中具有广泛的应用,如金属的腐蚀、电池的工作原理等。
二、氧化还原反应单线桥画法的概念氧化还原反应单线桥画法是一种用于描述氧化还原反应中电子转移过程的图形表示方法。
通过单线桥,我们可以直观地表示出反应物和生成物之间的电子转移过程,从而更好地理解氧化还原反应的实质。
三、氧化还原反应单线桥画法的步骤1.确定反应物和生成物:根据化学方程式,找出参与反应的物质以及它们在反应中的作用。
2.分析电子转移:根据反应物和生成物的氧化态变化,确定电子的转移方向和数目。
3.绘制单线桥:从还原剂(失去电子的物质)开始,沿着电子转移的方向,用一条线表示电子的转移过程。
在线的末端,标出被氧化的物质和所获得的电子数目。
4.检查电荷守恒:检查反应物和生成物的电荷总数是否相等,以确保电子转移过程符合电荷守恒定律。
四、氧化还原反应单线桥画法的应用氧化还原反应单线桥画法在化学教育和研究中具有重要作用,它可以帮助我们更好地理解氧化还原反应的电子转移过程。
此外,单线桥画法还可以应用于电化学、材料科学等领域,为相关研究提供直观的图形表示。
五、总结氧化还原反应单线桥画法是一种直观地表示氧化还原反应电子转移过程的图形方法。
通过分析反应物和生成物的氧化态变化,我们可以绘制出单线桥,从而更好地理解氧化还原反应的实质。
氧化还原反应的单线桥、双线桥(罗路)PPT教学课件

②根据金属活动性顺序判断
单质的还原性逐渐减弱 K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ H+ Cu2+ Hg2+ Ag+
阳离子的氧化性逐渐增强
2020/12/10
9
【课堂小结】 双线桥、单线桥
Thank You For Watching
2020/12/10
13
⑤必须标明电子转移的数目并指明“得”、“失”,
且得失数目要相等。 2020/12/10
5
2.氧化剂和还原剂
失去1×2e-,化合价升高,被氧化
0 +2
+2
0
Fe + CuSO4 = FeSO4 + Cu
还原剂
得到1×2e-,化合价降低,被还原
氧化剂 氧化产物 还原产物
还原剂:所含元素 化合价升高 的 物质
1.双线桥法
2.单线桥法
3.氧化还原反应规律
(1)守恒律:电荷守恒 (2)强弱律:氧化剂>氧化产物,还原剂>还原 产物
2020/12/10
10
当堂检测
练规范、练技能、练速度
2020/12/10
11
Let’s check the answers!
当堂检测
2020/12/10
12
PPT教学课件
谢谢观看
氧化剂:所含元素 化合价降低 的 物质
2020/12/10
口诀:升失氧化还原剂
氧Hale Waihona Puke 产物 还原产物63.单线桥法
氧化还原反应与化学方程式

氧化还原反应编辑氧化-还原反应 (oxidation-reduction reaction, 也作redox reaction)是化学反应前后,元素的氧化数有变化的一类反应。
[1]氧化还原反应的实质是电子的得失或共用电子对的偏移。
氧化还原反应是化学反应中的三大基本反应之一(另外两个为(路易斯)酸碱反应与自由基反应)[2]。
自然界中的燃烧,呼吸作用,光合作用,生产生活中的化学电池,金属冶炼,火箭发射等等都与氧化还原反应息息相关。
研究氧化还原反应,对人类的进步具有极其重要的意义。
目录1理论发展2反应历程3氧化-还原平衡4判别5类型分子间分子内6规律7表示方法双线桥法单线桥法氧化-还原半反应式8举例燃烧酒精测试工业炼铁复分解反应9配平方法得失电子守恒法氧化数升降法离子/电子法待定系数法10应用与意义氧化还原性的强弱判定现实意义11与电化学的关系1理论发展18世纪末,化学家在总结许多物质与氧的反应后,发现这类反应具有一些相似特征,提出了氧化还原反应的概念:与氧化合的反应,称为氧化反应;从含氧化合物中夺取氧的反应,称为还原反应。
随着化学的发展,人们发现许多反应与经典定义上的氧化还原反应有类似特征,19世纪发展化合价的概念后,化合价升高的一类反应并入氧化反应,化合价降低的一类反应并入还原反应。
20世纪初,成键的电子理论被建立,于是又将失电子的半反应称为氧化反应,得电子的反应称为还原反应。
[2]1948年,在价键理论和电负性的基础上,氧化数的概念被提出,1970年IUPAC 对氧化数作出严格定义[1],氧化还原反应也得到了正式的定义:化学反应前后,元素的氧化数有变化的一类反应称作氧化还原反应。
注:氧化数又可以叫做氧化态,本词条使用前者。
氧化数即高中所说的化合价,这两者仅是叫法不同,部分表示方法有差别,其他并无区别,本词条中视为可以混用。
2反应历程氧化还原反应的实例——钠与氯气的反应[3]氧化还原反应前后,元素的氧化数发生变化。
氧化还原反应教程文件

Mn2+ (可氧化Cl-)
MnO4-(碱)
Mn2+或Mn4+
(不可氧化Cl-)
MnO4-(酸) ﹥ MnO4-(碱)
4.配平
⑴普通配平
△
C+2H2SO4(浓) = CO2↑+ 2SO2 ↑ + H22O
0
C
+4
CO2
↑4 ×1
+6
S
+4
SO2
↓2 ×2
⑵部分氧化还原
3Cu+8HNO3=3Cu(NO3)2+2NO↑+ 4H2O
5
2
练习:某反应体系有:NaOH Au2O3 Na2S4O6 Na2S2O3 Au2O H2O
请完成 Au2O3+——+——
——+——+——
Au2O3+4 Na2S2O3 +2 H2O= Au2O+2 Na2S4O6+4 NaOH
此课件下载可自行编辑修改,仅供参考! 感谢您的支持,我们努力做得更好!谢谢
产物配:
0
Cu
+5
8N
+2
Cu ↑2 ×3
+2
NO
↓3 ×2
3Cu+2HNO3=3Cu(NO3)2+2NO↑+4H2O
反应物配
暂定系数法
练习:KMnO4+HCl(浓)——
⑶整体配平法(3个或多个化合价变化的元素)
4 FeS2+11O2= 2Fe2O3+ 8 SO2
+2
+3
Fe
Fe ↑1
-1
4三、氧化还原反应的表示方法715
(2)向Na2S溶液中加入Na2O2
Na2O2+S2-+2H2O==4OH-+S↓+2Na+
讨论2: 某一反应体系中有反应物和生成物共6种物质:
NaOH、Au2O3、Na2S4O6、 Na2S2O3 、Au2O、H2O。 如果Au2O3 在反应物中出现,写出此反应的化学方程式 ______________________________________________________ 当1mol 氧化剂完全反应时,反应中转移的电子数是_________
总结: FeBr2 ------ Cl2
Fe(NO3)3溶液------HI
(四)守恒规律:有关氧化还原反应的计算
讨论:(2013· 四川)1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、 质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属 离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是( ) A.该合金中铜与镁的物质的量之比是2 ︰1 B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L C. NO2和N2O4 的混合气体中,NO2 的体积分数是80% D. 得到2.54g沉淀时,加入NaOH溶液的体积是600mL
熟记常见元素的化合价:步步高P41
强制弱 四、氧化还原反应发生的条件:
当,氧化性:氧化剂 > 氧化产物 反应易于发生 或还原性:还原剂 > 还原产物
讨论: 步步高P42 3题
五、氧化还原反应的重要规律
高氧低还中兼有 (一)性质规律:
金属单质只有还原性,非金属单质二者皆有
处于最低价和最高价的物质还原性、氧化性不一定强
第三讲 氧化还原反应
3. 已知H2SeO3 + 2SO2 + H2O的知识判断下 列强弱关系正确的是( BC ) A. 还原性: TeO2 >SeO2>SO2 B. 氧化性: TeO2 >SeO2>SO2 C. 还原性: H2Te>H2Se>H2S D. 酸性:H2SeO3>H2SO3 4. 某FeCl2溶液中有FeI2,根据已知反应① 2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2;② 2FeCl2 + Cl2 = 2FeCl3 ③F2 + 2KI(熔融) = 2KF + I2中 的一些有关事实.要除去其中的FeI2,应选用的试剂是( C ) A. F2 B. 过量的Cl2 C. FeCl3 D. FeCl2
6、5NH4NO3 = 4N2 + 2HNO3 + 9H2O
例、向含a mol FeI2和b mol FeBr2的混合液中逐渐通入c mol Cl2,试分别填写不同c值范围内被氧化的离子及其物 质的量。
c值范围 0<c≤a 被氧化的离子符号
I-
Fe2+ Br-
被氧化离子的物质的量 /mol
2c
2c-2a 2c-3a-b
1、根据下列反应: Cu + 2FeCl3 === 2FeCl2 + CuCl2 2KMnO4+16HCl == 2KCl + 2MnCl2 + 5Cl2+8H2O 2FeCl2 + Cl2 === 2FeCl3 判断以下各组物质的氧化性由强到弱顺序正确的是 C A.KMnO4、FeCl3、Cl2、CuCl2 B.Cl2、FeCl3、KMnO4、CuCl2 C.KMnO4、Cl2、FeCl3、CuCl2 D.CuCl2、FeCl3、Cl2、KMnO4
2.3 氧化还原反应 单双线桥法及氧化还原反应的配平 课件 35PPT
得到2×3 e-
练习1-1 用双线桥表示电子转移情况
失去2×1 e-
+2
0 +3 -1
2FeCl2 + Cl2 = 2FeCl3
得到2×1 e-
失去1 e-
0
-1 +1
Cl2 + H2O = HCl + HClO
得到1 e-
失去2 e-
0
+5
+2
+4
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑ + 2H2O
得到2×3e-,化合价降低,被还原 6e3C0u+8H+N5O3(稀)=3+C2u+(N5 O3)2+2+N2O↑+4H2O
失去ne-,化合价升高,被氧化 (发生氧化反应)
氧化剂+还原剂 = 还原产物+氧化产物
(氧化性) (还原性 )
得到ne-,化合价降低,被还 原(发生还原反应)
失去2e-,化合价升高,被氧化
失去10×1 e-
D:
2 e-
Cu + 2H2SO4(浓) = CuSO4 + SO2↑ + 2H2O
深度拓展 单线桥标注歧化反应
e-
Cl2 + H2O = HCl + HClO
0
-1 +1
请用双线桥法和单线桥法分别表示电子的转移情况:
得到2×6e-,化合价降低,被还原
+5 -2
(1)2KClO3
↓1×1=1 ↑5×1=5
0
-1
+5
3 Cl2 + 6 NaOH = 5 NaCl + 1 NaClO3 + 3 H2O
氧化还原反应单线桥法例子
氧化还原反应单线桥法例子
嘿,朋友们!今天咱就来好好唠唠氧化还原反应单线桥法例子。
咱先来说说氢气还原氧化铜这个例子啊。
氢气和氧化铜在一定条件下发生反应,氢气把氧化铜里的铜给还原出来啦,自己却变成了水。
这不就是一场精彩的“电子转移大战”嘛!用单线桥法来表示,哇塞,那可真是一目了然。
你看,从氢气这里画个箭头指向氧化铜,清楚地表明了电子是怎么从氢气转移到氧化铜的。
就好像是一场接力赛,氢气把“电子接力棒”传给了氧化铜!(氢气与氧化铜反应:H₂ + CuO → Cu + H₂O)
再想想铁和硫酸铜的反应吧!铁那么厉害,把硫酸铜里的铜离子给抢过来啦,自己变成了亚铁离子,硫酸铜变成了硫酸亚铁。
用单线桥法一表示,哎呀,明明白白的。
就像一场激烈的抢夺战,铁勇猛无比地抢走了属于铜的东西。
(铁与硫酸铜反应:Fe + CuSO₄ → FeSO₄ + Cu)
还有碳还原氧化铜呢!碳多牛啊,把氧化铜里的铜给弄出来了,自己变成了二氧化碳。
这单线桥法往上一用,电子的转移路径清晰得很呢!就像是碳这个勇士,一路披荆斩棘,成功夺得“宝藏”铜。
(碳与氧化铜反应:C + 2CuO → 2Cu + CO₂↑)
这些例子不都生动有趣吗?氧化还原反应单线桥法就是这么神奇,能让我们那么清楚地看到电子的“行动轨迹”。
是不是很有意思呀?我觉得啊,通过这些例子,我们能更好地理解氧化还原反应,更好地掌握单线桥法呢!所以呀,大家可得好好研究研究这些例子,把单线桥法玩转起来!。
优质课件人教版高一化学必修一氧化还原反应第二课时单线桥双线桥讲解
+2 0 高温 0 +4 2CuO + C ==== 2Cu + CO2
用双线桥法标出下列反应电子转移的方向和数目:
(1) Mg+H2SO4 ===MgSO4+H2↑
(2)
高温 Fe2O3+3CO===2Fe+3CO2
(3)Cl2+2NaOH===NaCl+NaClO+H2O
0 +1
+2
0
Mg + H2SO4 === MgSO4+H2↑
失去1×e-,化合价升高,被氧化
2、单线桥法
4e+2 0 高温 0 +4 2CuO + C ==== 2Cu + CO2
用单线桥法标出下列反应电子转移的方向和数目:
(1) Mg+H2SO4 ===MgSO4+H2↑
(2)
高温 Fe2O3+3CO===2Fe+3CO2
(3)Cl2+2NaOH===NaCl+NaClO+H2O-20S
S
+4 +6
S
S
-2 +6 0 +4
如:H2S+H2SO4=S+SO2+2H2O 价态靠近
0 +6
+4
S+2H2SO4(浓)=3SO2↑+2H2O
价态归中
失6 ×e-
+5
-1
-1 0
(A) KClO3+6HCl====KCl+3Cl2 +3H2O
得1 ×6e-
√ 失5 ×e-
不交叉
+5
-1
