极限摩尔电导率
电导率

1 G R
U R , I
I G U
电导可以用来表示导体的导电能力。
电导率(electrolytic conductivity)
电导率()也就是电阻率的倒数,单位为S·m-1或 -1·m-1。
A G l
F R1 R2 A
G M R3
Rx
B C I
交流电源
电导测定注意事项
(1)使用适当频率的交流电源。 直流电通过电解质溶液时,由于电解使电解质 溶液的浓度发生变化,并会在电极上析出产物而改 变电极的特性。 (2)采用检零计(耳机或示波器)检测电桥是否达到 平衡。 (3)与电导池相对应的电路中的电阻需并联一个可 变电容用以抵消电解池电容的影响。 (4)电导池中的电极一般采用镀铂黑的铂电极以增 大电极表面积,降低电流密度,减少电极极化。
电解质电导率与浓度的关系
/(S.m-1)
90 80 HCl 70 60 50 40 30 20 10 HAc 0 2 4 6 c/(mol.dm-3) 8 10 KCl LiCl KOH
摩尔电导率与浓度的关系 由于溶液中物质的量已给定,都为 1mol。当浓度变化时,溶液的摩尔电导 率的变化与以下两种因素有关。 ①导电离子数目的变化 ②离子间的作用力的变化 不同的电解质,其摩尔电导率随浓 度变化的规律也不相同。
科尔劳乌施(Kohlrausch)离子独立移动定律
• 科尔劳乌施:在无限稀释溶液中,每一种离子是独 立移动的,不受其它离子的影响。某种电解质的 Λm∞可认为是正、负离子极限摩尔电导率之和。 • 用公式表示为:
m
m
m,
第二章 电导分析法

在无限稀释的溶液中,离子淌度用UA,0 表 示,称为离子的极限淌度。 在电解质完全电离的情况下,离子淌度和 摩尔电导率的之间有如下关系:
m U U F
,m U F
(F为法拉第常数)
和
,m U F
---摩尔电导率随浓度的变化,是由离子淌度的 变化引起的; --- 正、负离子摩尔电导率之差,是 由离子淌度的差异引起的。
摩尔电导率为正离子和负离子的摩尔电
导率之和。
即:
o ,
0, m
0 , 0 ,-
式中, 、 分别代表无限稀释的溶液
o ,-
中正离子和负离子的摩尔电导率。
在无限稀释的溶液中,正、负离子的电导率只取决 于离子的本性,不受其他共存离子的影响。
例如:已知离子极限摩尔电导率可计 算弱电解质的λNO3Λ
则
c G m 22 . 7 10
3
53
4
( 349 . 82 71 . 44 ) 10
28 . 6
mol· -3 m
即c = 0.0286mol· -1 L
例4:在25℃时,用面积为1.11cm2,相距 1.00cm的两个平行的铂黑电极来测定纯 水的电导,其理论值为多少?
解:纯水的极限摩尔电导率; Λm=λH+ +λOH-=547.42×10-4S· 2· -1 m mol 纯水中氢离子、氢氧根离子的浓度均为 10-7mol· -1,即c=10-4mol· -3 L m 由纯水的电导率为k=cΛm=5.4742×10-6S· -1 m 所以纯水电导为G=kA/l=5.4742×10-6×1.11×10-2 =6.08×10-8S
强电解质极限摩尔电导率的测定.思考题答案

本实验应该注意的事项是什么?1、本实验所用溶液全部用电导水配制,如果用蒸馏水配制,应先测得蒸馏水的电导,并在测得溶液的电导中扣除此值。
2、如果在测量时,预先不知道被测溶液电导率的大小,应先把量程开关置于最大电导率测量档,然后逐档下降。
3、为了提高测量精度,当使用“×103”“×104”这两档时,“校正”必须电导池接妥(电极插头应插入插孔,电极需侵入待测溶液中)的情况下进行。
4、处理数据时,注意电导率单位的换算(电导率仪上单位为μS/cm,计算过程需要换算为S/m)。
5、每次测定后,必须用下一个待测溶液充分荡洗电极和烧杯。
6、在设置温度补偿旋纽时,注意欲测25度下的溶液的电导率值时,温度补偿旋纽指向待测溶液的实际温度,如果要测实际温度下的电导率值,温度补偿旋纽指向25度。
7、电导率仪再使用前,要预热半个小时,使仪器稳定,并且电源线插入电源插座,仪器必须要良好接地。
弱电解质能否如此测定?为什么?若想通过此法求醋酸的∧m∞值,应如何求?不能,弱电解质溶液电导率随浓度变化不明显,因浓度增加使其电离度减小,溶液中真正起导电作用的粒子数目变化不大。
有因为对弱电解质,稀释时导电粒子数目大增加,因此 m大大增加,其无限稀释摩尔电导率Λm ∞不可用实验外推法得到。
摩尔率随浓度的关系服从 Ostwald 稀释定律。
浓度的平方根与摩尔电导率成直线关系。
测定方法溶液电导率的测定在化学领域中都有那些应用? (1)检验水的纯度在半导体工业中或涉及使用电导测定的科研中,常需要使用高纯度的水,利用电导测定来检验水的纯度非常方便。
水本身有微弱的解离,H +和OH -的浓度近似为10-7mol ·dm-3,因为这样,纯水的电导率应为5.5×10-6S ·m-1 (25 OC)。
普通蒸馏水的电导率约为1×10-4S ·m-1 ,重蒸馏水的电导率小于1×10-4S ·m-1 (2)计算弱电解质的解离度和解离常数 Λm ,Λm ∞和电离度α近似有: 对1-1型弱电解质AB :上式还可写作:m 2mmm 11()c c K ∞∞Λ=+ΛΛΛ m m=α∞ΛΛ+AB A B0 0 (1) c c c c a a a-+-ƒ起始平衡时 22mm m m 1()ooc ccc c K αα∞∞Λ==-ΛΛ-Λ m2mmm 11()oc cc K ∞∞Λ=+ΛΛΛ这就是德籍俄国物理化学家Ostwald (1853-1932)提出的定律,称为Ostwald 稀释定律(Ostwald ’s dilution law )。
硫酸钡的极限摩尔电导率

硫酸钡的极限摩尔电导率硫酸钡是一种无机化合物,其化学式为BaSO4。
它在水中几乎不溶解,因此被广泛应用于医药、化学、环境等领域。
本文将从硫酸钡的极限摩尔电导率角度,探讨其在溶液中的电导性质。
电导率是描述溶液导电性质的一个重要参数,它表示单位长度、单位截面积的溶液中,单位浓度的电解质的电导能力。
对于硫酸钡溶液,我们可以通过测定其极限摩尔电导率来了解其导电性能。
硫酸钡的极限摩尔电导率是指在无限稀释下,硫酸钡溶液的电导率。
由于硫酸钡在水中几乎不溶解,所以硫酸钡溶液的电导率非常低。
硫酸钡的极限摩尔电导率可以通过测定硫酸钡溶液的电导率,然后根据浓度和溶液的电导率计算得出。
硫酸钡溶液的电导率与其浓度成正比,即随着溶液浓度的增加,电导率也会增加。
这是因为溶液中溶解的硫酸钡粒子越多,导电能力也就越强。
但是随着浓度的增加,硫酸钡溶液的电导率增加速度逐渐减小,最终趋于一个极限值。
这是因为在无限稀释下,硫酸钡溶液中的硫酸钡粒子已经足够稀少,不再影响电导率的变化。
硫酸钡的极限摩尔电导率与温度也有关系。
一般情况下,随着温度的升高,硫酸钡溶液的电导率会增加。
这是因为温度升高会增加溶液中硫酸钡粒子的运动速度,从而增加了电导能力。
除了浓度和温度,硫酸钡溶液的电导率还受到其他因素的影响,例如溶剂的性质、溶液的酸碱度等。
在酸性溶液中,硫酸钡溶液的电导率会降低,因为酸性溶液中的氢离子会与硫酸钡离子结合,减少了硫酸钡离子的数量。
而在碱性溶液中,硫酸钡的电导率也会降低,因为碱性溶液中的氢氧根离子会与硫酸钡离子结合,减少了硫酸钡离子的数量。
硫酸钡溶液的极限摩尔电导率非常低,这是由于硫酸钡在水中的溶解度极低。
硫酸钡的电导率受到溶液浓度、温度和溶剂性质等因素的影响。
通过了解硫酸钡的电导性质,我们可以更好地理解其在化学、医药等领域的应用。
强电解质的极限摩尔电导率的测定

BUCT
强电解质的极限摩尔电导率的测定
大学化学实验
BUCT
实验目的 • 1.理解溶液的电导、电导率和摩尔电 .理解溶液的电导、 导率的概念。 导率的概念。 • 2.掌握由强电解质稀溶液的电导率测 . 定极限摩尔电导率的方法。 定极限摩尔电导率的方法。 • 3.用电导仪测定 溶液的摩尔电导率, .用电导仪测定KCl溶液的摩尔电导率, 溶液的摩尔电导率 并用作图外推求其极限摩尔电导。 并用作图外推求其极限摩尔电导。
大学化学实验 实验仪器图
BUCT
大学化学实验
BUCT
实验难点 1 2 3 电导率仪的校准 电导率仪工作原理的理解 数据的处理、分析
大学化学实验
BUCT
注意事项 (1)本实验所用溶液全部用电导水配制,如果用蒸馏水配制,应先测 )本实验所用溶液全部用电导水配制,如果用蒸馏水配制,
得蒸馏水的电导,并在测得溶液的电导中扣除此值。 得蒸馏水的电导,并在测得溶液的电导中扣除此值。
(2)如果在测量时,预先不知道被测溶液电导率的大小,应先把量程 )如果在测量时,预先不知道被测溶液电导率的大小,
开关置于最大电导率测量档,然后逐档下降。 开关置于最大电导率测量档,然后逐档下降。
(3)为了提高测量精度,当使用 “×103” “×104”这两档时,“校正” 这两档时, 校正” )为了提高测量精度, × 这两档时
大学化学实验
BUCT
Λ m = Λ (1 − β c )
∞ m
Λ
∞ :极限摩尔电导率 m
对弱电解质,稀释时导电粒子数目大增加, 对弱电解质,稀释时导电粒子数目大增加,因此 大大增加,其无限稀释摩尔电导率Λ Λm大大增加,其无限稀释摩尔电导率Λm∞不可用实验 外推法得到。 外推法得到。摩尔率随浓度的关系服从 Ostwald稀释 稀释 定律。 定律。
极限摩尔电导率符号

极限摩尔电导率符号
符号: \(\Lambda^{\circ}\)
极限摩尔电导率表示物质在无限稀释时的电导率。
它是指物质在标准条件下(摩尔浓度为
1mol/L,温度为298K,压强为1atm)下的电导率。
这个值可以用来比较不同物质的导电能力,越大表示物质的电导性越好。
极限摩尔电导率可以通过测量电导率和浓度的关系来计算。
一般情况下,较强的电解质会有较高的极限摩尔电导率,因为它们能够产生更多的离子。
而对于非电解质,由于其不会产生离子,所以其极限摩尔电导率一般较低。
需要注意的是,极限摩尔电导率的符号是\(\Lambda^{\circ}\),而不同于浓度相关的摩尔电导率\(\lambda\)。
极限摩尔电导率在化学中是一个重要的测量参数,它能够帮助我们理解物质的电导性质,并对其进行分类和比较。
电解质溶液的电导率和摩尔电导率

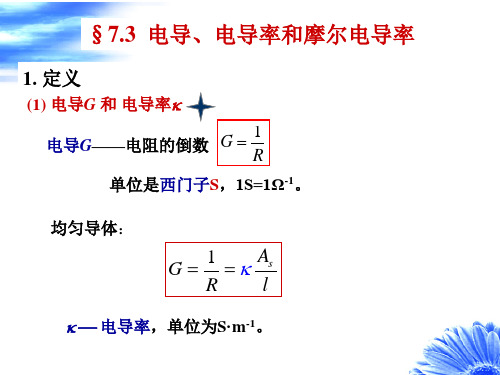
§7.2 电解质溶液的电导率和摩尔电导率1. 电导和电导率通过溶液的电流强度I 与溶液电阻R 和外加电压V 服从欧姆定律R =V/I ;而溶液的电阻率ρ可根据(/)R A l ρ=计算。
通过测量电阻(resistance, R )和电阻率(resistivity, ρ)即可评价电解质溶液的导电能力,不同的是l 为两电极间的距离,而A 则取浸入溶液的电极面积。
习惯上多用电导(conductance ,G )和电导率(conductivity, κ)来表示溶液的导电能力,定义:G =1/R κ=1/ρ电导G 的单位是Ω-1,也记为S(西门子),κ的单位是S·m -1。
电导和电导率间的关系:l G A κ⎛⎫=⎪⎝⎭(7.3)2. 电导的测量通常采用电导率仪(conductometer )来测量电解质溶液的电导,其原理如图7.2。
测量时将电导电极(conductance electrode )插入待测溶液或将待测溶液充入具有两个固定Pt 电极的电导池(conductance cell )M 中,而后将M 连入惠斯登(Wheatstone)电桥的一臂。
测量方法与测定金属的电阻相同但技术上需做一些改进,如测量时不用直流电源而改用1000 Hz 的高频交流电源S ;以耳机或示波器T 来指示桥中零电流;在电桥另一臂的可变电阻R 1上需串联一个可变电容器K 以补偿电导池的电容。
电桥平衡时有314R R R R = 3141R G R R R ==(7.4) 溶液的电导率可按(7.3)式求算。
式中(l /A)称为电导池常数(conductance cell constant )。
不同的电导池具有不同的电导池常数,即使是同一电导池,其电导池常数也会随时间而改变。
实际测量时多用标准溶液(standard solution )法,即先将一精确已知电导率(κs )的标准溶液充入电导池,在指定温度下测定其电导(G s ),而后再将待测溶液充入该电导池测量其电导(G ),分别带入(7.3)式比较可得:ssGG κκ= (7.5) 式中不再出现电导池常数。
7-2电导、电导率和摩尔电导率
HCl 0.966 0.930 0.906 0.833 0.798 0.769 0.811 1.011
KCl 0.966 0.927 0.902 0.816 0.770 0.652 0.607 0.577
CaCl2 0.888 0.798 0.732 0.584 0.524 0.510 0.725
-
400
HCl
增大而减小,但减小情况不同。
m/(Scm2 mol-1)
300
NaOH
200
AgNO3
(ii):强电解质:在溶液很稀时,Λm与 电解质的 c成直线关系,
m m A c
100
将直线外推至c =0时,截距为无限稀释
CH3COOH
的摩尔电导率—极限摩尔电导率
0
0.5
1.0
1.5
cB/mol dm3
例: m (NaCl) m (Na ) m (Cl)
m (BaCl2)
m (Ba2 ) 2 m (Cl )
2
m
(1 2
Ba2
)
2 m (Cl )
m (CH3COOH) m (H ) m (CH3COO)
在表示离子的无限稀释摩尔电导率时,应标明离子的基本单元
如:
m (12 Ba2 ), m (Ba2 ), m (12 SO42 ), m (Ba2 ) 2 m (12 Ba2 )
aB
a
a
a
例: 已知0.1molkg1HCl溶液的平均离子活度因子
γ±=0.795,试计算此溶液中HCl的活度及平均离子活度。
分析:利用 a b / b
a a
b
( b
b
)1/
b b
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
八. 文献数据
九. 创新性启示 影响电导率(DDS-11A)测量准确度的综合因素 1、 电导率仪自身的设计较早出现的平衡电导率仪结构笨重粗略。 以 DDS-11为代表的指针式电导率仪,形体小、重量轻,但与集成电路型 比较其稳定性较差,漂移大,测量结果线性不好,读数不便,因此在 每次使用之前必须调零、校满,读数需通过刻度与旋钮倍乘计算获得, 同时电容分量影响较大;高纯水时人体感应较严重;一般不具有自动 温度补偿,所以存在较多缺陷。继后发展起来的集成电路数字式是电 导率仪,其测量结果线性、准确度、分辨率大幅度提高,并设有随机 温度补偿,直接读取基准温度条件下的电导率值#大大方便了使用人 员。现今以单片机为代表的智能型电导率仪,将电导率测量技术推向 高峰。它具有菜单式设置,动量程,可选电极常数,浮点式数字直读 多项目同时显示,计算式自动温度补偿;电极常数自动校正,电导率 超限报警#多种数据接口,在线实时分析和追忆记录等功能,更加完 善了电导测量技术。使振幅像直流恒压源一样稳定是相对不容易的。
式中 Vm 为含有1mol 电解质的溶液的体积(单位为 m ·mol ),c 为电解质 溶液的物质的量浓度(单位为 mol ·m ),所以 的单位为 S ·m2·mol-1 。
注意:在使用摩尔电导率 时,要注明所取的基本单元。如以1mol 元 电荷的量为基本单元,
则 (1/2CuSO4)=7.17×10S ·m2·mol-1。 2. 强电解质溶液的摩尔电导率与浓度的关系
低离子浓度溶液选用亮铂电极、不锈钢电极、钛金属电极,常数 分度常见1.0、0.1、0.05、0.01cm-1 。一般用于工业用水、纯净水和超纯 水测量。高离子浓度电导池选用镀铂黑的铂片或不锈钢电极,带有强 腐蚀性的溶液选用石墨电极,常数分度常用1.0、5、10、20。 一般应 用于工业用水、污水或浓缩液的测量。配套不同常数的电极是为测量 电计获得相匹配溶液等效电阻和响应度而设计的。 (2)电导池绝缘支架离子玷污或裂痕引入的误差
柯尔劳施(Kohlrausch)根据实验结果得出结论: 在很稀的溶液中,强电解质的摩尔电导率与其浓度的平方根成直线关 系,即
Λ∞ —无限稀释时的摩尔电导率 m
A —常数
下图为几种电解质的摩尔电导率对浓度的平方根 的图。由图可见,
无论是强电解质,还是弱电解质,其摩尔电导率均随 c→0 而增大。
对于强电解质,c→0 ,离子间引力减小,离子运动速度增加,所以
6
Cl
(S/m)
0 0 0 0 0
( S /
(S.m2.mol-1)
m )
0
0
0
0
0
0
0
0
0
0
3.依据∧m = ∧m∞ ( 1 - β 图,求∧m∞。
),以 ∧m 对 作
4.将测量值与文献值比较。若显著的偏差,应说明原因。
七.实验注意事项: 1、本实验所用溶液全部用电导水配制,如果用蒸馏水配制,应先测 得蒸馏水的电导,并在测得溶液的电导中扣除此值。 2、如果在测量时,预先不知道被测溶液电导率的大小,应先把量程 开关置于最大电导率测量档,然后逐档下降。
版社,1990.10 [3]孙振范.关于摩尔电导率的数学定义式[J]大学化学.第15卷 第3期,
(2000.05)
三. 仪器试剂
1.仪器 :电导率仪(附:电导电极)
1套;
超
级恒温槽
1套;
容量瓶(100mL):
7只;
移液管(1mL,5mL,10mL) 各1只;
2.药品 :KCl 0.1000mol/L 溶液; 电导水(κ < 1x10-4S.m-1);蒸馏
3)、调节超级恒温槽的温度,上述配制 KCl 溶液以及电导水,置于恒 温槽中恒温20min。 4)、从手册中查得0.1000mol/LKCl 溶液在实验温度下的电导率值,通过 测量其电导率值对电导率仪进行校正(或依据电导电极上的电极常数
值,对电导率仪进行校正),然后测量电导水的 κ 值。 5)、用室温电导水冲洗电导电极到测得的电导水的电导率值恒定为
一、电导池间经常测量含胶体浓的电解质溶液,使用后不及时用 纯水洗净会在两极板之间的绝缘支架表面发生离子附着,而存在漏电 阻桥,电阻桥的并联作用是无法从读数中消除的。二、电极导线老化 破损漏电、使用不合格电缆;导线加长时引起的绝缘不良,插头、插 座接线端子之间脏污受潮,测量中会出现并联作用而导致误报。 (3)电导池两极板表面污着造成的误差
摩尔电导
增加。在低浓度时成为一条直线,将直线外推到 ,
得到的截距即是无限稀释摩尔电导率 Λ∞ ,也称为极限摩尔电导 m
率。
注:[1]陈平初 李武客.为什么要引入摩尔电导率[J]华中师范大学化学学院 武汉
430079 (2005.10) [2]物理化学(第四版)下册 第七章7.3南京大学物理化学教研室.高等教育出
较低频率交流电势作用于低离子浓度的溶液中极化作用表现较 轻, 但是高离子浓度溶液中表现尤为突出,因此除选择镀石墨或铂 黑的电导池外,合理选择测量电势的交变频率尤为重要。很多电导率 仪低离子浓度选择700-100Hz;高离子浓度选择700-1000Hz。 也有的采 用随离子浓度增大频率逐渐上升的方法。工作频率并非越高越好,电 导池两极板和两条平行的电导池电缆导线构成的分布电容引入的误 差分量会增加, 尽管选用了相敏检波电导率仪能分离电容分量, 但 较长导线引入的电容分量会导致放大器趋向饱和限幅,高周频率测量 低电导电容分量尤为突出, 但低波频率测量高电导水质极化是突出 矛盾。 (3)电路漂移引入的误差
1、实验数据记录
室温:
℃ 大气压力:
电导水的电导率值:κ(水)=
2.将数据列表。
pa
μS
序C κ 溶 κ
κ
κ 溶液(平)
∧m
号 (mo 液(测) 溶
K
l·m-
液
3)
(平)
( (μS/c
μS/
m)
cm)
1 0 000 0 0 2 0 000 0 0 3 0 000 0 0 4 0 000 0 0 5 0 000 0 0
第144,314页,高等教育出版社(1991)。 [2]吴肇亮、斓五正、杨国华,《物理化学实验》,第123,314,
340页,石油大学出版社(1990) [3]广西师范大学、南冲师范大学、陕西师范大学,《物理化学
实验》,第163,333页,广西师范大学出版社(1986.5) [4]郭子成、杨建一、罗青枝,《物理化学实验》,第117页,北
实验室电导率仪每次使用前需要重新调校,而工业在线电导率仪 不具备此条件,也不允许出现较大的漂移, 所以要选用高性能的集 成电路和温度系数小的元件以及稳定的供电电源, 以减少电路的零 点漂移和时间漂移。 (4)温度补偿引入的误差
电解质溶液中带电离子,随溶液温度的降低,离子的水化作用增 强,离子间的运动阻力增大,溶液的电导率随之降低。溶液温度升高, 离子活度增强,电导率随之增大,由于各厂家的温度补偿系数选用不 太一致,经常出现过补偿或欠补偿。 3.电导池引入的误差 (1)电导池选用不当造成的误差
其它型号的电导率仪
数字电导率仪 DDS-309+ CON-2A 数字电导率计(电导率仪)
十 提问思考
1)本实验应该注意的事项是什么? 2)弱电解质能否如此测定?为什么?若想通过此法求醋酸的∧m∞ 值,应如何求? 3)溶液电导率的测定在化学领域中都有那些应用?
参考文献 [1]傅献彩、沈文霞、姚天扬编,《物理化学》,上册,第四版,
能通过重新标定电极常数才能消除误差。
(5)电导池表面严重腐蚀造成常数改变而引入误差
在一些腐蚀性工艺中安置的在线电导电极,由于受强电解质的
长期侵蚀, 电极材料表面会出现较深蚀痕,改变了电极常数。可以
使用耐腐蚀材料制造的电极,如钛铂金属或石墨材料构成的电极。
4.外部因素引入的测量误差 (1) 器皿不洁引入的测量误差 (2) 纯水离线测量引入的误差 (3) 安装不当引入的误差 (4) 串模干扰信号引入的误差 (5) 流速对在线电导率仪表测量准确度的影响
京理工大学出版社(2005.1)
3、为了提高测量精度,当使用 “×103” “×104”这两档时,“校正”必须 电导池接妥(电极插头应插入插孔,电极需侵入待
测溶液中)的情况下进行。 4、处理数据时,注意电导率单位的换算(电导率仪上单位为 μS/cm, 计算过程需要换算为 S/m)。 5、每次测定后,必须用下一个待测溶液充分荡洗电极和烧杯。 6、在设置温度补偿旋纽时,注意欲测25度下的溶液的电导率值时, 温度补偿旋纽指向待测溶液的实际温度,如果要测
一. 实验目的及要求 1、理解溶液的电导、电导率和摩尔电导率的概念。 2、掌握由强电解质稀溶液的电导率测定极限摩尔电导率的方法。 3、用电导仪测定 KCl 溶液的摩尔电导率,并用作图外推求其极限摩尔 电导。 二. 实验原理 1.电导、电导率与摩尔电导率 (1)电导:(conductance) 物体导电的能力可用电阻 R (resistance,单位 为欧姆,用符号 Ω 表示)或电导 G 来表示。G 为电阻 R 的倒数,即 G =1/R, 单位为西门子(siemens),用 S 或 Ω -1表示。 (2)电导率( conductivity ): 电导率 κ 为电阻率 ρ 的倒数,即
交流电势振幅的稳定性会直接影响到测量的准确度以及所使用运算 放大器组成的电导测量电路。 2、 电计引入的误差 (1)测量电势的稳定性引起的误差
为消弱两极板间的极化作用,几乎所有电导率仪均使用交流信号 作为测量信号源。交流信号源要使振幅像直流恒压源一样稳定是相对 不容易的。交流电势振幅的稳定性会直接影响到测量的准确度以及所 使用运算放大器组成的电导测量电路。 (2)测量频率的影响
