一些链烷烃和环烷烃的物理常数(不全)
有机化学知识点24-链烷烃的物理性质

有机化学知识点24-链烷烃的物理性质
烷烃中C原子(2.5)、H原子(2.2)电负性差别很小,C-C、C-H均为非极性共价键,烷烃分子基本是非极性分子。
实验室中可作为非极性溶剂,比如石油醚(主要是C5\C6烷烃的混合物)即是如此。
烷烃的物理性质主要有以下几点:
①bp随分子量增加而增加。
这是由于分子间色散力变大,分子间作用力增强的缘故。
如正丁烷(bp=0℃)而正戊烷(bp=36℃)。
同碳数的支链烃的沸点比直链烃要低,如正丁烷(bp=0℃)而异丁烷(bp=-12℃);且支链越多沸点越低,如正戊烷的两个构造异构体异戊烷(bp=28℃)而新戊烷(bp=9℃)。
原因是支链越多分子越趋向球体,导致分子表面积减小、分子间作用力减小,沸点就会降低。
②mp随碳原子数的增加而增加,如正丁烷(mp=-138℃)和正戊烷(mp=-129℃);且碳链为偶数的比奇数的直链烷烃熔点要高一点(碳链越长两者的区别越小),如正戊烷(mp=-129℃)和正己烷(mp=-95℃)。
支链烷烃的熔点比同碳数的直链烷烃低,如正已烷(mp=-95 ℃)而其构造异构体2-甲基戊烷(mp=-154℃)。
原因是支链的存在使得分子间引力降低,但支链的存在使得分子结构呈现较高对称性时,则熔点反而会升高,如2,2-二甲基丁烷(mp=-100 ℃)而2-甲基戊烷(mp=-154℃)。
③烷烃一般都比水轻,鉴于此汽油着火时是不能用水灭火的。
④烷烃是亲油性的,因为其分子中缺少亲水性的基团,所以它们在非极性溶剂中的溶解度比在极性溶剂中的要大,也即“相似(结构和性质)相溶”的经验规律,对于选择反应溶剂、后处理和纯化溶剂等有很重要且现实的意义。
烷烃的结构与性质

烷烃的结构与性质烷烃是一类基本有机化合物,由碳和氢原子构成。
它们的分子由碳原子构成的链或环连接而成,具有特定的结构和性质。
本文将探讨烷烃的结构以及与其相关的性质。
一、直链烷烃直链烷烃是最简单的烷烃类别,分子由一条直线状的碳链构成。
举个例子,正丁烷(CH3-CH2-CH2-CH3)是一种直链烷烃,其分子中包含四个碳原子。
直链烷烃的化学式可用CnH2n+2表示,其中n代表烷烃分子中碳原子的数量。
直链烷烃的物理性质包括沸点、熔点和密度等。
随着碳原子数量的增加,直链烷烃的沸点和熔点逐渐增加。
这是因为随着分子量的增加,分子间的范德华力也增强,使得分子间相互作用加强,需要更高的温度来克服这种相互作用。
此外,随着分子量的增加,直链烷烃的密度也逐渐增加。
二、支链烷烃支链烷烃的分子由一条或多条侧链连接到主链上,与直链烷烃相比,支链烷烃具有更多的碳原子连接方式。
举个例子,2-甲基丁烷(CH3-CH(CH3)-CH2-CH3)是一种支链烷烃,其中有一个甲基基团连接在主链上。
支链烷烃与直链烷烃在物理性质上有所不同。
由于支链的存在,支链烷烃分子具有更大的隔离度,分子间相互作用减少,从而导致其沸点和熔点相对较低。
支链烷烃的密度也较低,因为支链的存在减少了分子的紧密排列。
三、环烷烃环烷烃是由碳原子构成的环连接而成的分子结构。
与直链烷烃和支链烷烃相比,环烷烃的分子形状呈环状,因此具有特殊的性质。
环烷烃的一个例子是环己烷(C6H12),其中六个碳原子形成一个环状结构。
环烷烃的性质与其分子结构有密切关系。
由于环状结构的存在,环烷烃分子内部有较大的张力,导致其相对不稳定。
此外,由于环烷烃中碳原子的取向限制,它们往往比相应的直链烷烃熔点和沸点更高。
环烷烃还表现出一些特殊的化学反应,如环开裂和环化等。
总结起来,烷烃是一类碳和氢原子构成的有机化合物,根据其分子结构和性质,可以分为直链烷烃、支链烷烃和环烷烃。
直链烷烃由一条直线状的碳链构成,而支链烷烃则具有侧链连接到主链上的结构。
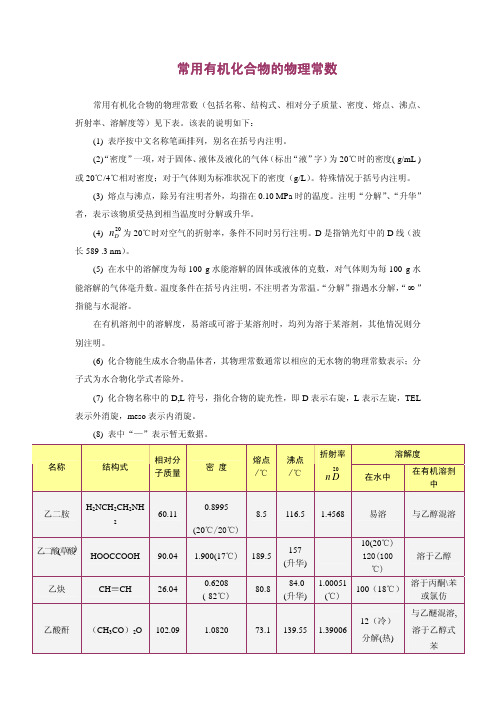
常用有机化合物的物理常数
144.19 1.0989 96
288
折射率
20
nD
在水中
—
02.(冷)
—
3.3(20℃)
1.3714 ∞
1.3288 ∞
1.4214 不溶
1.484 100(17℃) (1.602) ∞(热)
—
0.06(热)
1.42662 不溶
1.4507 溶
1.4641 3.6(20℃)
1.5011 0.07(22℃)
常用有机化合物的物理常数
常用有机化合物的物理常数(包括名称、结构式、相对分子质量、密度、熔点、沸点、
折射率、溶解度等)见下表。该表的说明如下:
(1) 表序按中文名称笔画排列,别名在括号内注明。
(2)“密度”一项,对于固体、液体及液化的气体(标出“液”字)为 20℃时的密度( g/mL )
或 20℃/4℃相对密度;对于气体则为标准状况下的密度(g/L)。特殊情况于括号内注明。
顺式:— 反式 1.203
(162.14)n —
123.11 1.2037
62.50
0.9104
64.52
0.8978
157.02 1.4950
熔点 /℃
123~124
71 68.5 分解 5.7 -153.8 -136.4
-30.82
沸点 /℃
295
— 293 — 210.8 -13.37 12.37
表示外消旋,meso 表示内消旋。
(8) 表中“—”表示暂无数据。
名称
结构式
相对分 子质量
密度
熔点 /℃
沸点 /℃
折射率
20
nD
溶解度
在水中
链烃物性烷烯炔化性

第二步,X-与碳正离子结合,生成卤代
烷
整个反应是加成反应,又由于决定反应速度的一步
是由亲电试剂发动进攻的,故叫做亲电加成反应。
有机化学
马氏规则(p44药学院化学教研室 )
乙烯是对称烯烃,它和不对称试剂加成产物只有一种。 不对称烯烃:双键两端基团不一样 不对称试剂和不对称烯烃发生加成反应时,加成方式就 有两种可能:
有机化学
1 卤代反应 药学院化学教研室
卤代反应:烷烃的氢原子被卤素原子取代。 卤代反应主要指氯代和溴代反应。 甲烷的氯代反应,光照或高温条件下,可以得 到一氯甲烷、二氯甲烷、三氯甲烷(氯仿)和 四氯化碳的混合物
有机化学
药学院化学教研室 2 反应机理(历程) (自由基取代反应) reaction mechanism
b 、诱导效应将随着传递距离的增加而迅速地减弱 一般经过3~4个键后,可以忽略。
有机化学
药学院化学教研室 根据实验结果,一些原子或原子团电负性大小的 次序如下:
有机化学
用诱导效应解 碳双键上电子云分布不均匀:
π键电子云转移方向与诱导效应一致
活泼的氯游离基引起连锁反应
有机化学
链终止
药学院化学教研室
生成稳定的化合物,反应终止
有机化学
反应活性
药学院化学教研室
卤素:F2(活泼)>Cl2>Br2>I2(不反应) H反应活性: 3ºH >2ºH> 1ºH > CH3 _H
与解离能有关,解离能越低,越易裂解
游离基的稳定性:3º R· >2º R· > 1º R·> CH3 · 游离基所属的C上取代基越多,游离基越稳定。 有机化学
其他无机酸和有机弱酸的反应与烯烃也可发 生亲电加成反应(不作要求) 有机化学
一张图搞定有机化学推断题

IUPAC 有机物命名法是一种有系统命名有机化合物的方法。该命名法是由国际纯粹与应用化学联合会 (IUPAC)规定的,最近一次修订是在 1993 年。其前身是 1892 年日内瓦国际化学会的“系统命名法”。最理想 的情况是,每一种有清楚的结构式的有机化合物都可以用一个确定的名称来描述它。它其实并不是严格的系统命 名法,因为它同时接受一些物质和基团的惯用普通命名。
C10H22
174.0
-29.7
0.7298
C11H24
195.8
-25.6
0.7404
C12H26
216.3
-9.6
0.7493
C13H28
(230)
-6
0.7568
C14H30
251
5.5
0.7636
C15H32
268
10
0.7688
C16H34
280
18.1
0.7749
C17H36
303
22.0
68.7(80.7) -94.0(6.6)
Hale Waihona Puke 0.6594(0.7786)C7H16(C7H14)
98.4(118.5) -90.5(-12.0)
0.6837(0.8098)
C8H18(C8H16) 125.6(150) -56.8(14.3)
0.7028(0.8349)
C9H20
150.7
-53.7
0.7179
CH4+Cl2→(光照)CH3Cl(气体)+HCl CH3Cl+Cl2→(光照)CH2Cl2(油状物)+HCl CH2Cl2+Cl2→(光照)CHCl3(油状物)+HCl CHCl3+Cl2→(光照)CCl4(油状物)+HCl 试管中液面上升,食盐水中白色晶体析出,这是反应中生成的氯化氢溶于水的缘故。因为氯化氢极易溶于水, 溶于水后增加了水中氯离子的浓度,使氯化钠晶体析出。用大拇指按住试管管口,提出液面,管口向上,向试管 中滴入紫色石蕊试液或锌粒,可验证它是稀盐酸。 如果控制氯的用量,用大量甲烷,主要得到氯甲烷;如用大量氯气,主要得到四氯化碳。工业上通过精馏, 使混合物一一分开。以上几个氯化产物,均是重要的溶剂与试剂。 特点:①在室温暗处不发生反应;②髙于 250℃发生反应;③在室温有光作用下能发生反应;④用光引发反 应,吸收一个光子就能产生几千个氯甲烷分子; 实验室制法 无水醋酸钠(CH3COONa)和碱石灰(NaOH 和 CaO 做干燥剂) 反应方程式:CH3 COONa+NaOH===Na2CO3+CH4↑ 收集:排水法 特点与注意事项: 必须用无水醋酸钠跟干燥的碱石灰反应来制取甲烷,若用醋酸钠晶体或石灰不干燥则均几乎不能产生甲烷气 体。 该实验的操作注意事项与收集方法与氧气的完全相同。
烷烃知识点总结高二

烷烃知识点总结高二一、直链烷烃直链烷烃由一条永不分叉的直链构成,其通用式为CnH2n+2。
最简单的直链烷烃是甲烷,也就是天然气的主要成分,其分子结构为CH4。
直链烷烃的物理性质随着分子量的增大而逐渐变化,其沸点、密度、熔点等物理性质都呈现规律性的变化。
直链烷烃主要用作燃料和化工原料,可以通过催化裂化和裂解等方法制备,也可以通过天然气和石油提炼得到。
二、支链烷烃支链烷烃是一类分子中含有支链结构的烷烃,其通用式为CnH2n+2。
支链烷烃与直链烷烃相比,具有更高的辛烷值和辛烷数,可以提高汽油的抗爆性能,被广泛应用于汽车和航空发动机燃料中。
支链烷烃可以通过裂化和异构化等化学方法制备,也可以通过石油脱氢和裂化得到。
三、环烷烃环烷烃是一类由环状碳链构成的烃类化合物,其通用式为CnH2n。
最简单的环烷烃是环丙烷,其分子结构为C3H6。
环烷烃具有环状结构,因此其分子结构要比直链和支链烷烃更加稳定,不容易发生化学反应。
环烷烃通常被用作有机溶剂和润滑油的主要成分,也可以被用作燃料和燃料添加剂。
四、烷烃的应用烷烃是一类重要的化工原料,广泛应用于石油化工、化学工业、制药工业、合成橡胶等领域。
此外,在能源和燃料领域,烷烃也被广泛应用于燃料、润滑油和合成润滑油等领域。
随着科学技术的不断发展,烷烃的应用领域也不断扩大,成为人们生活中不可或缺的化工产品之一。
五、烷烃的制备方法烷烃可以通过催化裂化、裂解和异构化等方法制备。
其中,催化裂化是一种将长链烷烃转化为短链烷烃和烯烃的方法,通过加热和压力的作用,将长链烷烃转化为短链烷烃和烯烃。
裂解是一种将有机化合物加热至高温,并在特定条件下将其分解为较小分子的化学反应。
异构化是通过改变分子结构,使得分子结构变得更加稳定和具有更高的性能。
六、烷烃的性质烷烃具有一些特有的性质,如不溶于水、易挥发、易燃、不稳定等。
其物理性质和化学性质与有机化合物的分子结构、功能团有关,因此对烷烃的性质进行分析和研究,可以更好地了解其在工业和生活中的应用和作用。
烷烃环烷烃的物理化学性质

F2 :反应过分剧烈、较难控制 Cl2 :正常(常温下可发生反应) Br2 :稍慢(加热下可发生反应) I2 :不反应。即使反应, 其逆反应易进行
主要讨论的内容
甲烷的卤代反应机理(反应机制,反应历程) (Reaction Machanism)
什么是反应机理: 反应机理是对反应过程的详细描述,应解释以下问题:
自由基的稳定性与不同类型H的反应活性
考虑反应的决速步骤
自由基生成的相对速度决定反应的选择性
自由基稳定性:
自由基的相对稳定性决定反应的选择性
R-H的键离解能(DH)
01
2o 自由基
02
较易生成
03
3o 自由基
04
较易生成
05
自由基的相对稳定性:3o > 2o > 1o
06
1o 自由基
07
较难生成
08
1o 自由基
09
较难生成
10
键离解能(DH)
不同类型自由基的相对稳定性
溴代反应的选择性
选择性:2o H : 1o H = 82 : 1
选择性:3o H : 1o H = 1600 : 1
溴代选择性(127oC): 3o H : 2o H : 1o H = 1600 : 82 : 1
由下列指定的化合物制备相应的卤代物,用Cl2还是Br2?为什么?
04
烷烃溶于有机溶剂中,不溶于水。
05
"相似者相溶"--普遍适用的经验规律。
06
是极性分子,烷烃是非极性分子,很难溶于水中。
07
折光率nD20 又称折光指数、折射率,是光在空气中速度与在液体中速度之比: nD20=C光空气/C光液体>1 ,它反映了分子中电子对光传播干扰的程度,或者电子被光极化的程度。
烷烃与环烷烃的物理性质及反应

烷烃与环烷烃的物理性质及反应2023年了,烷烃和环烷烃作为有机化合物的两类重要代表,其物理性质和反应特点也得到广泛研究和应用。
下面我们就来了解一下关于烷烃和环烷烃的物理性质和反应特点。
一、烷烃和环烷烃的物理性质烷烃是指由碳和氢元素组成的链状无环分子,比如甲烷、乙烷、丙烷等。
而环烷烃则是由碳元素组成的环状分子,比如环已烷(环丁烷)、环己烷、环庚烷等。
烷烃和环烷烃的物理性质有以下几个方面:1. 相对密度相对密度是指物质的密度与水的密度比值。
烷烃和环烷烃的密度都比空气大,因此它们通常被称为“重油”。
其中,相对密度大于1的成分比较常见,比如烷烃中的正戊烷,相对密度为0.63;环烷烃中的环已烷,相对密度为0.68。
2. 熔点和沸点熔点和沸点是反映物质固体和液体状态转变的温度参数。
烷烃和环烷烃的熔点和沸点都较低,因此它们通常被称为“轻油”。
比如,正己烷(烷烃)的沸点为69℃,环己烷(环烷烃)的沸点为80℃。
3. 溶解度溶解度是指物质在某一温度下在一定量溶剂中溶解的最大量。
烷烃和环烷烃在水中一般难以溶解,但在烃溶剂中溶解度较高,且多数易溶于氯仿、甲醇、乙醇等有机溶剂中。
二、烷烃和环烷烃的反应特点烷烃和环烷烃的反应特点主要表现在以下几个方面:1. 燃烧反应烷烃和环烷烃可以在有效氧气和足够高温下燃烧产生水和二氧化碳。
烷烃燃烧时会产生更多的热量,而环烷烃在燃烧时则会产生更多的二氧化碳。
2. 卤素硝化反应烷烃和环烷烃可以通过卤素反应(如氯化、溴化)引入烷基或环基上的卤素原子。
此外,以烷烃为原料,经过硝化反应也可以得到硝基烷或硝基环烷。
3. 氧化反应烷烃和环烷烃可以在氧化剂存在下发生氧化反应,产生羰基化合物。
此类反应通常需要高温和高压反应条件。
此外,一些贵金属催化剂可以有效加速烷烃或环烷烃发生氧化反应。
4. 加成反应烷烃和环烷烃可以发生加成反应,即两个分子发生共价键的形成。
一些非常有代表性的方法包括烯烃加成、醇酸加成、醛酮加成等等。
