2015高考(江苏用)化学一轮配套课件:热点专题课(2)专题5 元素推断题的突破策略
【优化探究】高考化学一轮复习 专题讲座5 有关元素推断的解题技巧课时演练 苏教版

【优化探究】2015届高考化学一轮复习专题讲座5 有关元素推断的解题技巧课时演练苏教版1.(2014年南京模拟)短周期元素X、Y、Z在元素周期表中的位置如右图所示,下列说法正确的是( )A.X、Y、Z三种元素中,X的非金属性最强B.X的单质的熔点比Z的低C.Y的最高正化合价为+7价D.Y的氢化物的稳定性比Z的氢化物的稳定性弱解析:由短周期可确定X是He,Y是F,Z是S。
答案:B2.(2014年西安名校联考)X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第3周期连续的三种元素,其中只有一种是非金属元素,且原子半径Z>W>M。
下列叙述正确的是( )A.Z是海水中含量最高的金属元素,W是地壳中含量最多的金属元素B.X、M两元素氢化物的稳定性:X<MC.X和W的氧化物均可作耐高温材料,M的氧化物可用于制作太阳能电池D.X、W组成的化合物水解生成一种可净水的化合物解析:由X的氢化物与最高价氧化物的水化物能生成离子化合物,知X是N元素,Y是P元素,Z、W、M三种连续元素且只有一种是非金属元素依次是Mg、Al、Si。
海水中含量最高的金属元素应是Na(海水中含大量NaCl),A不正确;氢化物稳定性NH3>SiH4,B不正确;氮的氧化物不能作耐火材料,SiO2制光导纤维。
晶体硅制太阳能电池,C不正确。
答案:D3.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。
下列说法正确的是( )A.Y元素最高价氧化物对应的水化物化学式H2YO4B.原子半径由小到大的顺序为:X<Z<YC.Y、Z两种元素气态氢化物中,Z的气态氢化物更稳定D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1∶2解析:由题干知X、Y、Z、W四种元素依次是O、Cl、S、Na,在Na2O和Na2O2中阴阳离子个数之比均为1∶2。
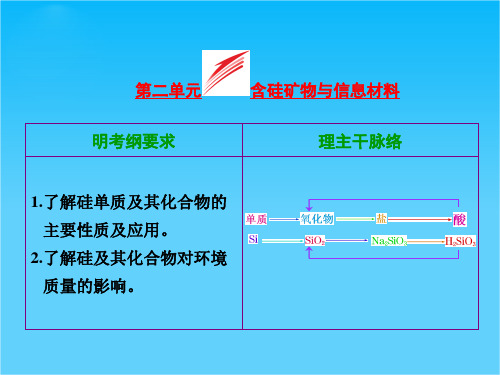
【三维设计】2015高考(江苏用)化学一轮配套课件专题2 第2单元 含硅矿物与信息材料
硅酸盐改写成氧化物形式的方法 (1)氧化物的书写顺序:活泼金属氧化物―→较活泼金属氧
化物―→二氧化硅―→水。
(2)氧化物前计量数的配置原则:除氧元素外,其他元素按 配置前后原子个数守恒原则配置计量数,且不同氧化物间以 “· ”隔开。 (3) 当计量数配置出现分数时应化为整数。如正长石:
KAlSi3O8 1 1 不 能 写 成 K O· Al2O3· 3SiO2 , 应 写 成 2 2 2
2. (2013· 上海高考)SiO2 是硅酸盐玻璃(Na2CaSi6O14)的主要成分, Na2CaSi6O14 也可写成 Na2O· CaO· 6SiO2。盛放 NaOH 溶液的 试剂瓶若用玻璃塞容易形成瓶体与瓶塞粘连,而无法打开,发 生反应的化学方程式为________________________。 长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。 由钠长石化学式 NaAlSi3O8 可推知钙长石的化学式为______。
③用途:黏合剂(矿物胶),耐火阻燃材料。
3.传统硅酸盐材料
水泥、玻璃、陶瓷等都是常见的硅酸盐材料
水泥 生产原料 石灰石、黏土
玻璃 纯碱 、 石灰石 、 石英
陶瓷 黏土
主要设备
生产条件
水泥回转窑
玻璃熔窑
高温
陶瓷窑
1.判断下列描述的正误(正确的打“√”,错误的打“×”)。
(1)(2012· 新课( × )
(2)(2010· 江苏高考)水玻璃可用于生产黏合剂和防火剂。 ( √ )
(3)(2009· 广东高考)陶瓷是人类应用很早的硅酸盐材料。 ( √ )
(4)(2009· 广东高考)水泥、玻璃、水晶饰物都是硅酸盐制品。( × )
2.将下列材料与主要化学成分用短线连接起来。 ①刚玉 ②大理石、 B.硅酸盐 石灰石 ③普通玻璃 ④石英、水晶 C.二氧化硅 D.三氧化二铝 A.碳酸钙
3-1氯、溴、碘及其化合物2015届高考化学(苏教版)一轮复习PPT优质课件

实验 思维 探究
课时 演练 探究
(2)置换——萃取法
菜 单 隐藏
高考总复习 SJ 化学
山 东 金 太 阳 书 业 有 限 公 司
高考总复习 SJ 化学
课前 基础 探究
课堂
优化
探究 实验
有 关 反 应 的 离 子 方 程 式 为 : 2Br-+Cl2===Br2+2Cl- ,
专题三 非金属及其化合物
高考总复习 SJ 化学
课前 基础 探究
课堂 优化 探究
实验 思维
第一单元 氯、溴、碘及其化合物
探究
课时
演练
探究
[考纲展示] 1.了解氯、溴、碘的单质及其重要化合物的主要
性质及应用。 2.了解氯单质及其重要化合物对环境质量的影响。 3.
掌握氯气的实验室制法(包括所用试剂、仪器,反应原理和收集方 山
(1)海水中提取溴
思维
探究
课时 演练 探究
(2)海水中提取碘
菜 单 隐藏
高考总复习 SJ 化学
山 东 金 太 阳 书 业 有 限 公 司
高考总复习 SJ 化学
课前 基础 探究
课堂 优化 探究
实验 思维 探究
课时 演练 探究
(3)写出离子提取溴、提取碘过程中的相关离子反应:
① Cl2+2Br-===2Cl-+Br2 ;
山
东
(1)烟和雾的异同点?
金 太
(2)实验室制Cl2的反应中浓盐酸表现哪些性质?
阳 书
提示:(1)烟和雾都是气溶胶,烟是固体小颗粒分散在空气中形成 业
有
的,雾是液体小颗粒分散在空气中形成的。
限
(2)浓盐酸表现还原性和酸性。
公 司
菜 单 隐藏
1-2离子反应-2015届高考化学(苏教版)一轮复习配套精品PPT教学课件

CH3COONH4 :C_H__3C__O_O__N_H__4_=_=_=_C_H__3_C_O__O_-_+__N_H__+ 4_ ; NH3·H2O :
演练
探 究 _N_H__3_·H__2O_____N_H__4+_+__O_H__-_。
(2)多元弱酸的电离分步书写,多元弱碱的电离一步写完。如:
荷的多少,稀的强电解质溶液导电性很弱,浓度较大的弱电解质溶液 山
东
导电性可能很强。
金
太
阳
书
业
有
限
公
司
菜 单 隐藏
高考总复习 SJ 化学
课前 基础 探究
课堂
优化
二、离子反应和离子方程式
探究
实验 思维
1.离子反应的本质:反应物中某些离子的浓度 减小 。
探究
课时
2.离子反应发生的条件
演练
探究
(1)复分解反应类型
①生成难溶 的物质,如Al(OH)3、BaSO4等。
②生成 难电离 的物质,如弱酸、弱碱、水等。
山
③生成 挥发性 的物质,如CO2、SO2、NH3等。
东 金
(2)氧化还原反应类型
太
强氧化性物质+强还原性物质―→弱氧化性物质+弱还原性物质
阳 书
如FeCl3溶液与Cu反应的离子方程式为:
业 有
2Fe3++Cu===2Fe2++Cu2+。
-
4
拆写为H++SO
2- 4
,HCO
-
3
、HSO
-
3
、HS-、HPO
2- 4
、
太 阳
H2PO4-等不能拆。
书 业
有
限
公
司
2015江苏高考试卷解析版(化学部分)

江苏高考(2015江苏,1,2分)答案:D解析:本题考查有关环境保护知识。
低碳节俭的生活方式能减少化石燃料的利用,A正确;对废弃物进行分类放置,对可回收的的物质进行回收再利用,有利于保护环境,B 正确;多数的农村人对环境保护意识差,造成资源浪费和对环境造成污染,加强宣传有利于提高保护环境的意识,C正确;一次性筷子、纸杯等都是消耗大量的木材,故应禁止使用,D错误。
(2015江苏,2,2分)答案:C解析:本题考查常用化学用语。
A项中原子的质量数为37,A错误;Cl-最外层有8个电子,B错误;Cl2分子中的两个Cl原子之间为共价单键,C正确;氯乙烯分子中应该含有碳碳双键,D错误。
(2015江苏,3,2分)答案:C解析:本题考查同分异构体、盖斯定律、电子守恒以及原子守恒。
分子式为C2H6O 的有机物有两种,乙醇和甲醚,两者性质不同,A错误;由于C最终都转变为CO2,根据盖斯定律可知两者放出的热量相同,B错误;C项描述的是氧化还原反应中的电子守恒,C 正确;根据元素守恒定律可知,水无论如何也不能转变成油,D错误。
(2015江苏,4,2分)答案:C解析:本题考查依据Mg在CO2中的燃烧,考查碳的同素异形体、微粒半径的比较、还原性强弱的比较以及能量的转化。
碳单质还包括C60、碳纳米管、无定形碳等,A错误;Mg2+是由Mg失去2个电子后得到,故半径Mg原子半径大,B错误;根据氧化还原反应规律可知,还原性Mg比C强,C正确;燃烧过程中还有产生光能等,D错误。
(2015江苏,5,2分)答案:A解析:本题考查元素的推断及其性质。
根据元素的描述可知四种元素分别为O、F、Al、Si,最外层电子数由多到少的顺序为F、O、Si、Al,A正确;原子半径由大到小的顺序为Al、Si、O、F,B错误;元素非金属性有强到弱的顺序为F、O、Si,C错误;简单气态氢化物的稳定性顺序与非金属性顺序一致,D错误。
(2015江苏,6,2分)答案:B解析:本题考查溶液中的离子共存。
高考化学大一轮复习 专题五 专题讲座六 元素推断题的知识贮备和解题方法课件 苏教版

第七页,共32页。
[知识(zhī shi)贮备]
2.根据元素周期表结构与原子电子层结构的关系
(1)几个重要关系式
①核外电子层数=周期数(对于大部分元素来说);
②主族序数=最外层电子数=最高正价=8-|最低负价|
③|最高正价|-|最低负价|= 0——第ⅠA族中的H和第ⅣA族 2——第ⅤA族 4——第ⅥA族 6——第ⅦA族 (2)熟悉主族元素在周期表中的特殊位置
①族序数等于周期数的元素:H、Be、Al。 第八页,共32页。
②族序数等于周期数 2 倍的元素:C、S。 ③族序数等于周期数 3 倍的元素:O。 ④周期数是族序数 2 倍的元素:Li、Ca。 ⑤周期数是族序数 3 倍的元素:Na、Ba。 ⑥最高正价与最低负价代数和为零的短周期元素:H、C、Si。 ⑦最高正价是最低负价绝对值 3 倍的短周期元素:S。 ⑧除 H 外,原子半径最小的元素:F。 ⑨最高正价不等于族序数的短周期元素:O(F 无正价)。
氮的氢化物有 NH3、N2H4,故 D 错。
答案(dáàn) C
第二十一页,共32页。
【例 8】 下表是元素周期表中的一部分,表中所列字母分别代 表一种化学元素,请回答下列问题:
(1)写出 j 在周期表中的位置__________。
(2)o、i、p 三种元素之间能以原子个数之比 1∶1 两两形成互化
(1)若已知三元素的核外电子数(原子序数)之和 经验公式:三种元素原子序数之和±8≈其中某元素的原子序数
3 注意:若整除则无解。
(2)若已知相邻三元素的最外层电子数之和 ①能被 3 整除,则三种元素的位置关系只能为同周期相邻或同主族 相邻;
②同时不能被 3 和 2 整除,则必有两元素在同一偶数族,另一元素 为相邻奇数族;
【一轮精品】2015高考新课标化学总复习配套课件:第5章 强化1节 元素推断题的解题策略
A.原子半径的大小顺序:rZ>rW>rY>rX
B.元素Y的简单气态氢化物的热稳定性比W的弱 C .化合物 Z2Y2 与 X2Y 反应时, Z2Y2 是氧化剂, X2Y 为还
原剂
D.由X、Y、Z、W四种元素组成的化合物其水溶液一定 显酸性
服/务/教/师 免/费/馈/赠
化学 【解析】 X是形成化合物最多的元素且常见化合价为+
+
服/务/教/师
免/费/馈/赠
化学
(2)18电子微粒 ①分子:SiH4、PH3、H2S、HCl、Ar、F2、H2O2、 C2H6、N2H4、CH3OH、CH3F等
- ②阴离子:S2-、HS-、Cl-、O2 2 等
③阳离子:K+、Ca2+等
服/务/教/师
免/费/馈/赠
化学
2.特殊的分子形状 (1)V形分子:H2O、H2S (2)直线形:CO2、CS2 (3)三角锥形:NH3、NCl3、H3O+ (4)四面体形:CH4、NH+ 4
1和- 1,则X为H;Y的最外层电子数是次外层的 3倍,则 Y为 O;Z与X同一主族且原子序数大于O,则Z为Na;W的原子序 数为Y的2倍,即W为S。B项,O的非金属性大于S,则气态氢 化物的热稳定性:H2O>H2S,B错;C项,Na2O2与H2O反应中
Na2O2既作氧化剂又作还原剂; D项,NaHSO3溶液呈碱性,D
B.A与C可形成CA2和CA3两种化合物
C.A、B形成的化合物与 B、D形成的化合物化学键类型 一定完全相同 D.气态氢化物的稳定性:C>D
服/务/教/师 免/费/馈/赠
化学 【解析】 由题给信息可推出 A为氧元素,B为钠元素,
C为硫元素,D为氯元素。A项,原子半径大小关系应为 A<D<C, A错; C项, A、 B形成的化合物可能是 Na2O,也可 能是 Na2O2,而 B、 D形成的化合物为 NaCl , NaCl 中只有离子 键,而 Na2O2 中既有离子键,又有共价键, C 错; D 项,气态
高考化学一轮复习精品课件:热点专题课 元素推断题的解题策略

解析:R 的单质是一种常见的半导体材料,R 应是硅元素,则 L 是碳元素,M 为氮元素,T 为硫元素,W 为氯元素。 (3)中 b 项, 通常元素的非金属性越强, 其对应单质的氧化性越强, 而该反应中碳所表现出的是还原性。
答案:(1) ⅦA ∶N⋮⋮N∶
(2)SiO2+2NaOH===Na2SiO3+H2O (3)acd 高温 (4)2Cl2+SiO2+2C=====SiCl4+2CO
金属性 L 强于 R c.W 的核电荷数比 T 多,原子半径比 T 小,得电子能力强, 则非金属性 W 强于 T d.同温、同物质的量浓度的 Na2LO3 和 Na2TO4 溶液的 pH: Na2LO3>Na2TO4,则非金属性 T 强于 L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备 RW4,该 反应中除 RW4 外的另一种产物可用于工业炼铁。制备 RW4 的化 学方程式为__________________________。
(1)规律: ①同一周期中元素的原子序数一般比左边元素原子序数大 1,比右边元素的原子序数小 1。
②同主族上下周期元素的原子序数关系
(2)应用举例:
①条件: 短周期元素 A、B、C 在元素周期表中的相对位 置如图所示。已知 B、C 两种元素所在族序数之和 是 A 元素所在族序数的 2 倍,B、C 两种元素的原 子序数之和是 A 元素的原子序数的 4 倍。
答案:C
3.(2013· 北京海淀期中)L、M、R、T、W 是原子序 数依次增大的短周期主族元素,M、T 在周期表 中的相对位置如右表;L 与 R 原子的最外层电子 数相同, R 的单质是一种常见的半导体材料。 请回答下列问题:
(1)T 原子的结构示意图为________,元素 W 在周期表中位于第 ________族,M 单质分子的电子式为________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
18.氢化物的沸点最高的元素或氢化物在通常情况下呈液态 的元素:O。
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
19.在空气中含量最多的元素或气态氢化物的水溶液呈碱性的元 素:N。 20.特殊的实验现象有:a.钠元素焰色反应为黄色,钾元素焰色反
热点专题课 元素推断题的突破策略
结束
热点专题课
一、推断元素的方法思路
元素推断题的突破策略
根据原子结构、元素周期表的知识及相关已知条件,可 推算原子序数,判断元素在元素周期表中的位置等,基本思 路如下图所示:
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
3.把文字信息转化为周期表片段的应用 (1)文图转化:
题中文字信息
推断出元素 应用
转化 图表中固定位置 ――→
周期表片段
(2)应用举例:
①条件:
短周期元素形成的简单离子 X 、Y 、M2 、N2 核外均含电
+ + + -
子,且离子半径的大小关系为:N2->Y+,Y+>X+,Y+>M2+, M2 >X 。
3.1~20 号元素中,周期数是族序数 2 倍的元素是 Li 和 Ca;周期数是族序数 3 倍的元素是 Na。
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
4.最轻的金属是 Li,其次是 Be。熔点最低的金属是 Hg, 其次是 Ca;熔点最高的金属是 W,熔点最高的非金属单质是 石墨,其次是金刚石。
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
11.非金属单质晶体中能导电的是石墨和单晶硅。Si 是构 成地壳岩石骨架的主要元素,能跟强碱溶液反应,还能被氢氟 酸溶解。
12.单质在常温下能与水反应放出气体的短周期元素: Li、Na、F。常见的能形成同素异形体的元素:O、C、S、P。
13.常温下唯一呈液态的金属是 Hg,呈液态的非金属单 质是 Br2。
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
8.上一周期元素所形成的阴离子和下一周期主族元素的 最高价阳离子的电子层结构相同。
9.C 元素可组成多种单质,其中金刚石的硬度最大,石 墨的熔点最高,C60 的熔点较低;C 是构成有机物的骨架元素, 所形成的化合物最多。
10.常温下能跟 H2O 反应放出 O2 的单质是 F2,化合物一 般是 Na2O2;常温下与 H2O 反应放出 H2 的有碱金属和 Mg、 Ca、Sr、Ba。
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
②元素推断: 由图可知,A 为第 2 周期元素,B、C 为第 3 周期元素。设 B、C 之间的元素原子序数为 x,则 A 的原子序数为 x-8,B 的 原子序数为 x-1,C 的原子序数为 x+1,依题意有 x+1+x-1 =4(x-8),则 x=16,为 S 元素,可以推出 A 为 O、B 为 P、C 为 Cl。
(1)规律: ①同一周期中元素的原子序数一般比左边元素原子序数大 1,比右边元素的原子序数小 1。
②同主族上下周期元素的原子序数关系
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
(2)应用举例:
①条件: 短周期元素 A、B、C 在元素周期表中的相对位 置如图所示。已知 B、C 两种元素所在族序数之和 是 A 元素所在族序数的 2 倍,B、C 两种元素的原 子序数之和是 A 元素的原子序数的 4 倍。
结束
二、利用周期表的片断进行推断
1.元素周期表中短周期的特殊结构的应用
(1)特殊结构:
①元素周期表中第一周期只有两种元素H和He,H元素所在的 第Ⅰ A族为元素周期表的左侧边界,第Ⅰ A族左侧无元素分布;
②He 为 0 族元素,0 族元素为元素周期表的右侧边界,0 族元 素右侧没有元素分布。
利用这个关系可以确定元素所在的周期和族。
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
三、推断元素及物质的“题眼”总结
1 1.质量最轻的元素是1 H,其次是 He。质量数相差 1 倍或 2 2 3 倍的同位素是氢元素的 3 种核素(1 1H、1H、1H)。
2.1~20 号元素中,族序数与周期数相同的元素是 H、Be、 Al;族序数是周期数 2 倍的元素是 C、S;族序数是周期数 3 倍 的元素是 O;族序数是周期数 3 倍多 1 的元素是 F。
5.地壳中含量最多(丰度最大)的元素是 O,其次是 Si; 地壳中含量最多的金属元素是 Al,其次是 Fe。
6.既难得到电子,又难失去电子,且为单原子分子的气 态单质是稀有气体。 7.短周期元素中,最高正价与最低负价绝对值之差为 4
的元素是 S;最高正价与最低负价绝对值之差为 0 的元素是 C 和 Si。
14.S 是很脆的黄色晶体,它的氢化物可与其最高价氧化 物对应的水化物的浓溶液发生氧化还原反应。
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
15.既能在 CO2 中燃烧,又能在 N2 中燃烧的金属是 Mg;即 能与酸反应又能与碱反应放出气体的金属是 Al、Zn;能跟强碱溶 液反应放出 H2 的非金属是 Si。 16.同一元素的气态氢化物和氧化物反应,生成该元素的单
+ +
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
②元素推断: 由于四种元素都是短周期元素,N 为非金属,应位于元素周 期表的右边,由 X、Y、M、N 的离子半径关系,则可以推知四种 元素在元素周期表中位置关系,转化为周期表片段:
则 N 可能和 Y 不在同一周期,也可能和 Y、M 在同一周期。
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
(2)应用举例: 已知 X、Y、Z、W 四种短周期元素的位置关系如图:
则可以推出 X 为 He,再依次推知 Y 为 F、Z 为 O、W 为 P。
化学
首页
上一页
下一页
末页
热点专题课 元素推断题的突破策略
结束
2.元素的位置关系和原子序数关系的应用
