无机化学经典课件分子结构
合集下载
无机化学_化学键与分子结构 PPT课件

主要以晶体形式存在
较高熔点和沸点
无 机
熔融或水溶解后能导电 ?
化 学
4.1.1
离子键的形成
电 子(1)离子键理论 1916 年德国科学家 Kossel ( 科塞尔 ) 提出
教 ① 当活泼金属的原子与活泼的非金属原子相互化合时,均有通
案 过得失电子而达到稳定电子构型的倾向;
对主族元素,稳定结构是指具有稀有气体的电子结构,如钠
时 ,配位数为 3 。
AB型化合物离子半径比与配位数和晶体类型的关系
r +/ r-
配位数 晶体类型
实例
无 机
0.225~0.414
化
学
电 子
0.414~0.732
教
案
4
ZnS型
ZnS, ZnO,
BeS, BeO,
CuCl, CuBr
6
NaCl型 NaCl, KCl, NaBr,
LiF, CaO, MgO,
无 机 化 学 电 子 教 案
4.1.3 离子的特征
(1)离子的电荷 ——相应原子的得失电子数
电荷高,离子键强。 +1, +2, +3, +4
无 机(2)离子的电子层构型
化
简单负离子的电子层构型一般都具有稳定的8电子结构如F-
学 电
正离子的电子层构型大致有 5 种
子
① 2电子构型,如 Li , Be 2 (1s2 )
无机化学
无
机 第四章 化学键与分子结构
化
学
电 Chapter 4 Chemical bond and
子
教 案
molecular structure
基本内容和重点要求
大学无机化学课件分子结构
π对称:绕 x 轴旋转180°,形状不变,ψ符号改变。例如:原子轨道pz,py,dxy,dxz,dyz为π对称。
(3) 原子轨道线性组合的类型
例如: A+B→AB
Ⅱ
Ⅱ
Ⅰ
-成键 -反键
① s – s 重叠
1s 原子轨道
1s 原子轨道
分子轨道
s1s *
s1s
②s – p 重叠
p – p 重 叠
③具有方向性:轨道最大重叠的方向。
8.2.2 共价键的类型
(1)σ键:两原子的成键轨道沿键轴(或两核间的连线)的方向,以“头碰头”的方式发生轨道重叠,轨道重叠部分是沿着键轴呈圆柱型对称,这样形成的共价键叫σ键。
+
+
x
+
+
x
—
+
+
x
—
—
s-s
px-s
px- px
(2)π键:两个原子轨道沿键轴的方向,通过键轴的一个平面侧面,以“肩并肩”的方式发生轨道重叠,轨道重叠部分垂直于键轴呈镜面反对称,在键轴上下对称的电子云密度最大,这样形成的共价键叫π键。
价键理论
01
共价键的类型
02
杂化轨道理论
03
价层电子互斥理论(自学)
04
分子轨道理论
05
键参数
06
8.2 共价键
共价键: 分子中原子间通过共用电子对结合而成 的化学键
H· + ·H = H:H
:Cl· + ·Cl: = :Cl:Cl:
:N· + ·N: = :N N:
④ 杂化轨道成键时,满足原子轨道最大重叠原理
⑤杂化轨道成键时,满足化学键间最小排斥原理。
(4) 小结:p226,表9-5
无机化学课件9-分子结构
分子轨道理论(20世纪20年代末)
§9.1 Lewis理论
电子配对理论——共用电子对成键。 • 八隅体规则
• Lewis结构式
H—H
: Cl : C
: Cl
Cl :
O = C= O
:N N:
: Cl :
违背八隅体规则的例子:BF3,PCl5,SF6等。
_ 109 28’ _ _ _ + +
+
轨道重叠
杂化轨道与其它原子轨道重叠 形成化学键时,要满足原子轨道最
H
大重叠原理。原子轨道重叠越多,
形成的化学键越稳定。由于杂化轨 道的电子云分布更集中,所以杂化 轨道成键能力比未杂化的各原子轨 道的成键能力强。化合物的空间构 型是由满足原子轨道最大重叠的方 向决定的。
NH3分子形成时的轨道杂化。
H2O:几何构型为V型。 键角为:104.5 © O: 2s22p4
2p 2s
sp3杂化
sp3不等性杂化
两个杂化轨道 能量较低,被两对 孤对电子占据。
小结:杂化轨道的类型与分子的空间构型
杂化轨道类型 杂化轨道数 分子空间构型
直线形 三角形 四面体 三角锥 V型
sp
sp2
C
2
CO
2
O
2s 2p
2 4
2s 2p
HF
HBF4
BF3
价键理论的局限性
价键理论能较好地说明一些双原子分子价键的 形成 为解决价键理论的局限性,鲍林在价键理 不能很好地说明多原子分子的价键形成和几何 论中引入了杂化轨道的概念 构型
如 CH4 实际测定→
按价键理论
C 2s
无机化学 第六章 分子结构

随堂练习:
2.请应用现代价键理论合理地解释乙炔的成键情况,有几个σ
键?几个π 键?
HC≡CH
乙炔
随堂练习:
3.试用杂化轨道理论解释下面问题: (1) NH3、H2O 的键角为什么比 CH4 小?CO2 的键角为何是
180°?乙烯为何取120 °的键角?
(2)在 sp2 和 sp 杂化轨道中,是否也存在不等性杂化? 各举一例! 例如 SO2 和 CO
新轨道叫杂化轨道。
(线性组合)
(2)杂化轨道的数目等于参加杂化的原子轨道的数(遵循原则)
二、杂化轨道理论
1.杂化轨道理论基本要点
(3)杂化轨道在空间的伸展方向是尽可能取最大夹角,一般取对称
形,这样排斥力最小,形成的分子体才系稳定(数学理想建模)
杂化轨道的数目 理想模型 空间的最佳排布
直线型 正三角型 正四面体
一、价键理论(电子配对理论)VB法 3.共价键的特征 a.饱和性
基态原子的未成对电子数是一定的,因此它能形成的共价 键数 也是一定的。 3p 例如:N : 1S22S22P3
N: 1s 2s
3个单电子
2Px
2Py 2Pz
NH3分子的成键过程
一、价键理论(电子配对理论)VB法 3.共价键的特征: b.方向性
bonds (C).The hybride orbital considered were sp,sp2,sp3.
Bonds where the electron density is symmetrical about the bond axis are called sigma (σ) bonds; bonds in which the electron density is not symmetrical about the bond axis are called pi(π)bonds .
无机化学分子结构课件

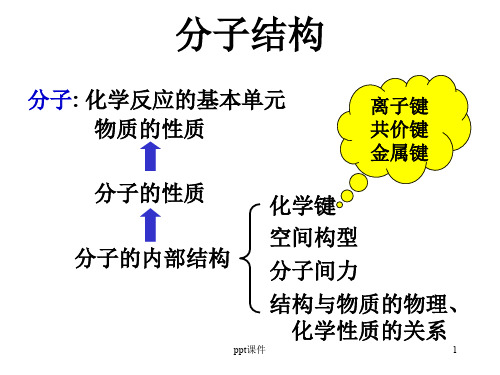
根据物质的原子结构可以解释物质的一些宏观性质,如元 素金属性、非金属性及其递变规律。原子结构还无法解释物 质的同素异性、同分异构现象。这是因为物质的性质不仅与 原子的结构有关,还与物质的分子结构或晶体结构有关。
所谓分子结构,通常包括两个方面:
(1)分子的空间构型 实验证实,分子中的原子不是杂乱 无章地堆积在一起,而是按照一定的规律结合成整体的, 使分子在空间呈现出一定的几何形状(即几何构型)。
我国物理化学家唐敖庆等曾于1953年统一处理了s—p— d—f轨道杂化, 提出了杂化轨道的一般方法,进一步丰富 了杂化理论的内容。
1、轨道杂化理论的基本要点
轨道杂化理论认为,在同一个原子中能量相近的不同类 型的几个原子轨道(即波函数)可以相互叠加,而重新组成 同等数目的能量完全相同的杂化原子轨道。在原子形成分 子的过程中,通常存在着激发、杂化和轨道重叠等几个过 程,这就是轨道杂化理论的基本要点。
例如:
Hale Waihona Puke 在生成F3BNH3时,NH3分子中的N原予提供一对未成键的 电子,与B原子共用形成配位键,N原子为给予体,B原子 为接受体,F3BNH3的结构式表示为通常用“→”表示配位 键,箭头方向表示由给予体供给接受体电子对的方向,以区 别于正常共价键。
但应该注意,正常共价键和配位键的差别,仅仅表现在键 的形成过程中,虽然共用电子对的电子来源不同,但在键形 成后,二者并无任何差别。如在NH4+中的4个N—H键是完全 等同的。
因为共价键的本质是原子轨道的重叠和共用电子对的形 成,每个原子的未成对的单电子数是一定的,所以形成共 用电子对的数目也就一定。
例如,氯原子最外层有一个不成对电子,它与另一个 氯原子3p轨道上的一个电子配对形成双原子分子Cl2后, 每个氯原子即不再有未成对的电子了,若再有第三个氯 原子与Cl2靠近,不可能再形成键产生Cl3。
所谓分子结构,通常包括两个方面:
(1)分子的空间构型 实验证实,分子中的原子不是杂乱 无章地堆积在一起,而是按照一定的规律结合成整体的, 使分子在空间呈现出一定的几何形状(即几何构型)。
我国物理化学家唐敖庆等曾于1953年统一处理了s—p— d—f轨道杂化, 提出了杂化轨道的一般方法,进一步丰富 了杂化理论的内容。
1、轨道杂化理论的基本要点
轨道杂化理论认为,在同一个原子中能量相近的不同类 型的几个原子轨道(即波函数)可以相互叠加,而重新组成 同等数目的能量完全相同的杂化原子轨道。在原子形成分 子的过程中,通常存在着激发、杂化和轨道重叠等几个过 程,这就是轨道杂化理论的基本要点。
例如:
Hale Waihona Puke 在生成F3BNH3时,NH3分子中的N原予提供一对未成键的 电子,与B原子共用形成配位键,N原子为给予体,B原子 为接受体,F3BNH3的结构式表示为通常用“→”表示配位 键,箭头方向表示由给予体供给接受体电子对的方向,以区 别于正常共价键。
但应该注意,正常共价键和配位键的差别,仅仅表现在键 的形成过程中,虽然共用电子对的电子来源不同,但在键形 成后,二者并无任何差别。如在NH4+中的4个N—H键是完全 等同的。
因为共价键的本质是原子轨道的重叠和共用电子对的形 成,每个原子的未成对的单电子数是一定的,所以形成共 用电子对的数目也就一定。
例如,氯原子最外层有一个不成对电子,它与另一个 氯原子3p轨道上的一个电子配对形成双原子分子Cl2后, 每个氯原子即不再有未成对的电子了,若再有第三个氯 原子与Cl2靠近,不可能再形成键产生Cl3。
无机化学 分子结构PPT课件

●原子轨道为什么需要杂化?
●如何求得杂化轨道的对称轴间的夹角?
28
1.基本要点
(1)杂化 (Hybrid) 能量相近,类型不同的同一中心原
子轨道可以混合起来,重新组成一组新 的能量相同,类型相同的轨道。
(2)杂化轨道 (Hybrid Orbital)
n个能量相近,类型不同的原子轨道 可以组成n个能量相同,类型相同的杂化
范畴: pz-pz 重叠 py-py 重叠
25
特征:原子轨道以“肩并肩”的形式发生轨道重叠。
特点:电子云没有集中在两核间连线,所以,
π键重叠程度小于σ键, π键不及σ键
稳定。 举例:N2: 1s22s22p3
1s22s22p3
2px12py12pz1 2px12py12pz1
结论:(1)共价单键为σ键,π键几乎总是与σ键
● 具有饱和性(是指每种元素的原子能提供用于形成 共价键的轨道数是一定的)
例如: H Cl H OH NN
● 具有方向性(是因为每种元素的原子能提供用于形 成共价键的轨道是具有一定的方向)
18
共价键的类型
1. σ键
定义:两原子轨道沿键轴(两核间联 线)进行同号重叠而形成的共 价键称σ键。
范畴:
s~s
第二章 分子结构
(Structure of Molecule) 价键理论
价层电子对互斥理论
分子轨道理论
键参数
1
2-1路易斯结构式
路易斯用元素符号之间的小黑点表示分子中各原子 的键合关系,代表一对键电子的一对小黑点亦可用“- ”代替。路易斯结构式能够简洁地表达单质和化合物的 成键状况,其基本书写步骤如下:
空间构型:平面三角形 键 角:120
38
●如何求得杂化轨道的对称轴间的夹角?
28
1.基本要点
(1)杂化 (Hybrid) 能量相近,类型不同的同一中心原
子轨道可以混合起来,重新组成一组新 的能量相同,类型相同的轨道。
(2)杂化轨道 (Hybrid Orbital)
n个能量相近,类型不同的原子轨道 可以组成n个能量相同,类型相同的杂化
范畴: pz-pz 重叠 py-py 重叠
25
特征:原子轨道以“肩并肩”的形式发生轨道重叠。
特点:电子云没有集中在两核间连线,所以,
π键重叠程度小于σ键, π键不及σ键
稳定。 举例:N2: 1s22s22p3
1s22s22p3
2px12py12pz1 2px12py12pz1
结论:(1)共价单键为σ键,π键几乎总是与σ键
● 具有饱和性(是指每种元素的原子能提供用于形成 共价键的轨道数是一定的)
例如: H Cl H OH NN
● 具有方向性(是因为每种元素的原子能提供用于形 成共价键的轨道是具有一定的方向)
18
共价键的类型
1. σ键
定义:两原子轨道沿键轴(两核间联 线)进行同号重叠而形成的共 价键称σ键。
范畴:
s~s
第二章 分子结构
(Structure of Molecule) 价键理论
价层电子对互斥理论
分子轨道理论
键参数
1
2-1路易斯结构式
路易斯用元素符号之间的小黑点表示分子中各原子 的键合关系,代表一对键电子的一对小黑点亦可用“- ”代替。路易斯结构式能够简洁地表达单质和化合物的 成键状况,其基本书写步骤如下:
空间构型:平面三角形 键 角:120
38
无机化学diwuzhang 23页PPT文档

1.自由电子及形成:金属原子的价电子易电离成为自由电子, 这些电子能自由地从一个原子“跑”向另一个原子。 2.金属键形成:金属原子通过“共用”“自由电子”相互作 用(静电吸引)结合在一起 2.金属键本质及特征: ①电性力 ②无方向性和饱和性 形象化:金属原子间有电子气自由流动;金属原子沉浸在电子 的“海洋”中。 二、金属晶体、特性及理解 结构特点:倾向最紧密堆积 特性: 较高密度 良好加工性 良好导电热性 金属光泽
四、分子轨道理论
立论:原子轨道重新“组合” 要点: 1.能量相近、对称性匹配的不同原子的原子轨道可以“组合”成数
目相等的分子轨道,能级将发生变化。 2.分子轨道类型
成键分子轨道:能量低于原子轨道,有σ、π 反键分子轨道:能量高于原子轨道,有σ*、π* 3.电子排布遵循原子结构电子排布原理。 4.分子能级顺序 5.电子在成键轨道上,体系能量降低,形成化学键; 电子在反键轨道上,体系能量升高,不利于形成化学键 小结:MO法计算复杂,描述分子几何构型不够直观。
2.等性、不等性杂化
等性杂化:每个杂化轨道完全等同
不等性杂化:每个杂化轨道不完全等同,即杂化轨道中有不参与 成键的孤电子对。
3.满足轨道最大重叠原理
4.满足化学键之间最小排斥原理
(二)杂化类型与分子空间构型:
SP
SP2
SP3
dSP2 dSP3(SP3d) d2SP3(SP3d2)
直线 三角型 四面体 四边形 三角双锥 八面体
二、极化规律及影响因素: ①变形性:离子半径越大,变形性越大; ②极化能力:外加电场或离子自身的电场强弱 离子半径小、电荷多,电场强度越大,极化能力越大 ③结构影响: 离子的结构对其极化能力和变形性影响较大
当半径和电荷相近时,极化能力和变形性与结构关系: 18e、18+2e>9~17e>8e
四、分子轨道理论
立论:原子轨道重新“组合” 要点: 1.能量相近、对称性匹配的不同原子的原子轨道可以“组合”成数
目相等的分子轨道,能级将发生变化。 2.分子轨道类型
成键分子轨道:能量低于原子轨道,有σ、π 反键分子轨道:能量高于原子轨道,有σ*、π* 3.电子排布遵循原子结构电子排布原理。 4.分子能级顺序 5.电子在成键轨道上,体系能量降低,形成化学键; 电子在反键轨道上,体系能量升高,不利于形成化学键 小结:MO法计算复杂,描述分子几何构型不够直观。
2.等性、不等性杂化
等性杂化:每个杂化轨道完全等同
不等性杂化:每个杂化轨道不完全等同,即杂化轨道中有不参与 成键的孤电子对。
3.满足轨道最大重叠原理
4.满足化学键之间最小排斥原理
(二)杂化类型与分子空间构型:
SP
SP2
SP3
dSP2 dSP3(SP3d) d2SP3(SP3d2)
直线 三角型 四面体 四边形 三角双锥 八面体
二、极化规律及影响因素: ①变形性:离子半径越大,变形性越大; ②极化能力:外加电场或离子自身的电场强弱 离子半径小、电荷多,电场强度越大,极化能力越大 ③结构影响: 离子的结构对其极化能力和变形性影响较大
当半径和电荷相近时,极化能力和变形性与结构关系: 18e、18+2e>9~17e>8e
大学无机化学《分子结构》 ppt课件
19
sp3杂化轨道示意图
CH4分子的空间结构
ppt课件
20
④ sp3d2杂化 1 ns + 3 np + 2 nd 6 sp3d2 六个sp3d2杂化轨道指向正八面体的六个顶点 sp3d2杂化轨道间的夹角 = 180或90
ppt课件
21
3p 3s
激发态
激发
SF6分子形成
杂化
3d
sp3d2杂化态
② 杂化前后轨道数目不变。
③ 杂化轨道可分为等性和不等性杂化轨道。 采用sp3杂化轨道成键的分子,其空间构型可 能为四面体型,V型或者三角锥型。
③ 单电子键 (如 H2+p)p,t课O件 2具有磁性
6
1927年, Heitler 和 London 应用量子力学研究 H2分子结构, 初步解答了共价键的本质.
1930年, Pauling 和 Slater 等发展出现代价键 理论(电子配对理论)、杂化轨道理论、 价层电子对互斥理论
1932年, 美国化学家密立根和德国化学家洪特 提出分子轨道理论
ppt课件
10
8.2.2 共价键的类型
(1)σ键:两原子的成键轨道沿键轴(或两 核间的连线)的方向,以“头碰头”的方式 发生轨道重叠,轨道重叠部分是沿着键轴呈 圆柱型对称,这样形成的共价键叫σ键。
++
x
s-s
—
++
x
px-s
—
++
—
x
ppt课件
px- px
11
(2)π键:两个原子轨道沿键轴的方向,通过键轴的
另一方有空轨道。
例:NH
4
H
HNH
H
BF4
CO
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子型化合物在通常状态下是以阴、阳离子聚集在一 起形成的巨分子的形式存在,所以离子化合物的化学结合 力不是简单的两个阴、阳离子之间的结合,而是整块晶体 之内的整个结合力。因此用晶格能描述离子键的强度经常 比离子键的键能更好。
32
晶格能的定义:在标准状态下将1mol离子型 晶体 (如 NaC1) 拆散为 1 mol 气态阳离子 (Na+) 和 1 mol 气态阴离子 (C1-) 所需要的能量,符号为 U, 单位为 kJmol-1。
一般把元素电负性差值大于 1.7 的 化合物看作是离子型化合物
28
2 离子半径
d = r+ + r核间距 d 可以用 X 射线衍射方法通过实验测定
1926 年,Goldchmidt 用光学法测得 F- 离子 半径为 133 pm 和 O2- 离子半径为 132 pm。 以此为基础,他利用式 d = r+ + r推出 80 多种离子的半径
(6)( 18 + 2 ) 电子构型 如 Pb2+、Sn2+、Bi3+ 等。
36
离子的电子构型与离子键的强度有关,对离子化合物 的性质有影响。
例如,IA 族的碱金属与 IB 族的铜分族,都能形成 +1 价离子,电子构型分别为 8 电子构型和 18 电子构型,导 致离子化合物的性质有较大差别。如 Na+ 和Cu+ 的离子半 径分别为 97 pm 和 96 pm,但 NaCl 易溶于水,而 CuCl 不溶于水。
以“肩并肩”重叠的原子轨道,其 重叠部分对通过键轴的一个节面具有反 对称性,但重叠程度要比 键轨道的小 因此, 键的键能小于 键的键能,稳 定性低于 键,但 键的电子比 键 的电子活泼,容易参与化学反应。16
z
z
x
y
y
σ键, π键的总结
固氮原理:使N2活化,削弱N原子间的牢固三 重健,使它容易发生化学反应。
如果把孤电子对 L 也写入分子式,既把分子式改写成 ABnLm,就可以根据 VSEPR 理论,把各种共价分子 ABnLm 的结构与价层电子对总数、成键电子对数及孤电 子对数的关系。
55
ABnLm 分子的中心原子的价电子对排布方式和分子 的几何构型
谢谢观赏
四个sp3杂化轨道
46
4 . NH3 三角锥形 N 2s22p3
不等性sp3杂化
48
5 . H2O “ V” 字形
O 2s22p4
不等性sp3杂化
不等性杂化: 由于孤电子对的存在,造成不完全等同 的杂化,如H2O , NH3 , PCl3 中的 O,N,P
C-C杂化
50
在一个平面形的多原子分子中,如果相邻原子中有垂 直于分子平面的、对称性一致的、未参与杂化的原子轨道, 那么这些轨道可以互相重叠,形成多中心 键,又称为 “共轭 键”或“非定域 键”,简称大 键。
固氮酶中含有过渡金属与氮分子形成的配合 物,此配合物使N2活化,易于被还原。
实验证明,氮分子与过渡金属形成的化学键 ,不仅有经典的σ配位键,还有π反馈键,导致 氮分子的三键被削弱,氮分子被活化
18
δ键:一个原子的d轨道与另一个原子相 匹配的d轨道以“面对面”的方式重叠
(通过键轴有两个节面)
19
σ
37
1.2.3 分子的几何构型
一 杂化轨道理论 杂化: 形成分子时,由于原子的相互影响,若
干不同类型,能量相近的原子轨道混合 起来,重新 组称一组新轨道
38
基本要点: 1. 成键时能级相近的价电子轨道混合杂化, 2. 2.形成新的价电子轨道——杂化轨道, 杂化
前 后轨道数目不变。 3.杂化后轨道伸展方向,形状发生改变。
26
离子键是靠静电引力而形成的化学键, 电负性相差大的元素之间才能形成离子键 特征: 1. 无方向性 2. 无饱和性
27
离子键是活泼金属元素的原子和活泼非金属元素的原子之 间形成的,其形成的重要条件就是原子之间的电负性差值 较大。一般来说,元素的电负性差越大,形成的离子键越 强。 即使是电负性最小的铯与电负性最大的氟所形成的氟化铯, 也不纯粹是静电作用,仍有部分原子轨道的重叠,即仍有 部分共价键的性质。一般用离子性百分数来表示键的离子 性的相对大小,实验证明,在氟化铯中,离子性占 92%, 也就是说铯离子与氟离子之间的键仍有 8% 的共价性。
无机化学经典课件分子结构
键能(E):气体分子每断裂单位物质的量 的某键时的焓变, KJ/mol
如:标态下 HCl(g)
H(g) + Cl(g)
△H θ = 431 KJ/mol
E θ(H-Cl) = 431 KJ/mol
对双原子分子:E = 键离解能D
D:将处于基态的双原子分子AB拆开成也处于基态 的A原子和B原子时,所需能量即为AB分子的
39
1 BeCl2 直线型
Cl —— Be —— Cl
Be 2s2
激发
sp 杂化轨道 ½ s ½p
杂化轨道的形状
两 个 sp 杂 化 轨 道
2. BF3 平面三角形 B 2s22p1
激发
1/3 s Sp2 杂化
2/3 p
三个sp2杂化轨道
3. CCl4 正四面体 C 2s23p2
Sp3杂化 ¼ s ¾p
π
键 , 键 的 不 同
20
3 配位共价键:共用电子对是由一个原子单
4
方面提供而形成的
形成配位键的必备条件: 1)一个原子价电子层有孤对电子 2)另一原子价电子层有空轨道。
如:CO分子
21
4 . 键的极性
非极性:同种原子形成的 如 H2 ,N2 , O2 极性 : 不同原子形成的
H-I H-Br H-Cl H-F
最大重叠原理:共价键尽可能沿着原子 轨道最大重叠的方向形成
9
特征:具有饱和性,方向性
HH
NN
+
2 共价键的键型—— σ键,π键,δ键 σ键 : 原子轨道沿键轴方向,“头碰头”重叠
13
π键: 原子轨道沿键轴“肩并肩”重叠 如 N2 2s22p3 一个σ键,两个π键
N2 分子结构示意图
15
沿着键轴方向以“头碰头” 重叠的原子轨道能够发生最大 程度重叠,重叠部分沿键轴呈 圆柱形对称,键能大、稳定性 高。
对多原子分子: E = 逐级离解能的平均值
2
键长: 分子内成键两原子核间的平衡距离 键角反映分子空间构型: 如CO2 , 键角=1800 ,直线型
3
1.2.1 价键理论
共价键 离子键 金属键
4
一 共价键
价键理论 杂化轨道理论 分子轨道理论 1. 价键理论
5
6
7
8
成键的条件:具有未成对的、自旋方 向相反的电子
晶格能是表达离子晶体内部强度的重 要指标,是影响离子化合物一系列性质如 熔点、硬度和溶解度等的主要因素。
33
反应的波恩-哈伯循环可以表示如下:
f Hm
Na ( s ) +
1 2
C12 ( g )
NaC1 ( s )
H1 Na ( g )
H2 解离 C1 ( g )
H3
H4
Na+( g ) + C1-( g )
极性增强
22
二 离子键
1916 年,德国化学家 W. Kossel 根据大多数化 合物具有稀有气体稳定结构的事实,提出了离 子键的概念。
1. 形成和特征
燃烧 2 Na + Cl2 ===== 2NaCl
3s1
3s23p5
24
这类化合物之所以导电,是因为它们在熔融状 态或水溶液中能够产生带电荷的粒子,即离子。 Kossel 认为电离能小的活泼金属元素的原子和电子 亲和能大的活泼非金属元素的原子相互接近时,金 属原子上的电子转移到非金属原子上,分别形成具 有稀有气体稳定电子结构的正负离子。正离子和负 离子之间通过静电引力结合在一起,形成离子化合 物。这种正负离子间的静电吸引力就叫做离子键。
52
1 价层电子对互斥理论要点
(1)当一个中心原子 A 和 n 个配位原子或原子团 B 形成 ABn 型分子时,分子的空间构型取决于中心原子 A 的价电子层中电子对的排斥作用,分子的构型总是采取电 子对相互排斥力作用最小的结构。价电子层中电子对指的 是成键电了减少价电子对之间的斥力,电子对间应尽 量互相远离。
H5
(-U)
34
影响晶格能的主要因素是离子的电荷、半径和 电子构型。这三个因素也是单原子离子的三个 重要的特征,它们决定了离子化合物的性质。
离子的电子构型
35
(1)0 电子构型 最外层没有电子的离子,如 H+。
(2)2 电子构型(1s2) 如 Li+,Be2+ 等。 (3)8 电子构型(ns2 np6) 如Na+,K+,Ca2+等。 (4)917 电子构型(ns2 np6 nd1-9 ) 也称为不饱和电 子构型,如 Fe2+,Cr3+ 等。 (5)18 电子构型(ns2 np6 nd10 ) 如 Ag+,Cd2+ 等。
价电子对排布方式为:当价电子对的数目为 2 时,呈 直线形;当价电子对的数目为 3 时,呈平面三角形;当价 电子对的数目为 4 时,呈正四面体形;当价电子对的数目 为 5 时,呈三角双锥形;当价电子对的数目为 6 时,呈八 面体形。
54
(3)对于只含共价单键的 ABn 型分子,若中心原子 的价层中有 m 个孤电子对,则其价层电子对总数是 n + m 对。
在 NO2 分子中,丁二炔(HCC-CCH)分子中,以 及 CO2 分子中,都有大 键。
51
二 价层电子对互斥理论
(VSEPR,valence-shell electron-pair repulsion) 理论要点:
32
晶格能的定义:在标准状态下将1mol离子型 晶体 (如 NaC1) 拆散为 1 mol 气态阳离子 (Na+) 和 1 mol 气态阴离子 (C1-) 所需要的能量,符号为 U, 单位为 kJmol-1。
一般把元素电负性差值大于 1.7 的 化合物看作是离子型化合物
28
2 离子半径
d = r+ + r核间距 d 可以用 X 射线衍射方法通过实验测定
1926 年,Goldchmidt 用光学法测得 F- 离子 半径为 133 pm 和 O2- 离子半径为 132 pm。 以此为基础,他利用式 d = r+ + r推出 80 多种离子的半径
(6)( 18 + 2 ) 电子构型 如 Pb2+、Sn2+、Bi3+ 等。
36
离子的电子构型与离子键的强度有关,对离子化合物 的性质有影响。
例如,IA 族的碱金属与 IB 族的铜分族,都能形成 +1 价离子,电子构型分别为 8 电子构型和 18 电子构型,导 致离子化合物的性质有较大差别。如 Na+ 和Cu+ 的离子半 径分别为 97 pm 和 96 pm,但 NaCl 易溶于水,而 CuCl 不溶于水。
以“肩并肩”重叠的原子轨道,其 重叠部分对通过键轴的一个节面具有反 对称性,但重叠程度要比 键轨道的小 因此, 键的键能小于 键的键能,稳 定性低于 键,但 键的电子比 键 的电子活泼,容易参与化学反应。16
z
z
x
y
y
σ键, π键的总结
固氮原理:使N2活化,削弱N原子间的牢固三 重健,使它容易发生化学反应。
如果把孤电子对 L 也写入分子式,既把分子式改写成 ABnLm,就可以根据 VSEPR 理论,把各种共价分子 ABnLm 的结构与价层电子对总数、成键电子对数及孤电 子对数的关系。
55
ABnLm 分子的中心原子的价电子对排布方式和分子 的几何构型
谢谢观赏
四个sp3杂化轨道
46
4 . NH3 三角锥形 N 2s22p3
不等性sp3杂化
48
5 . H2O “ V” 字形
O 2s22p4
不等性sp3杂化
不等性杂化: 由于孤电子对的存在,造成不完全等同 的杂化,如H2O , NH3 , PCl3 中的 O,N,P
C-C杂化
50
在一个平面形的多原子分子中,如果相邻原子中有垂 直于分子平面的、对称性一致的、未参与杂化的原子轨道, 那么这些轨道可以互相重叠,形成多中心 键,又称为 “共轭 键”或“非定域 键”,简称大 键。
固氮酶中含有过渡金属与氮分子形成的配合 物,此配合物使N2活化,易于被还原。
实验证明,氮分子与过渡金属形成的化学键 ,不仅有经典的σ配位键,还有π反馈键,导致 氮分子的三键被削弱,氮分子被活化
18
δ键:一个原子的d轨道与另一个原子相 匹配的d轨道以“面对面”的方式重叠
(通过键轴有两个节面)
19
σ
37
1.2.3 分子的几何构型
一 杂化轨道理论 杂化: 形成分子时,由于原子的相互影响,若
干不同类型,能量相近的原子轨道混合 起来,重新 组称一组新轨道
38
基本要点: 1. 成键时能级相近的价电子轨道混合杂化, 2. 2.形成新的价电子轨道——杂化轨道, 杂化
前 后轨道数目不变。 3.杂化后轨道伸展方向,形状发生改变。
26
离子键是靠静电引力而形成的化学键, 电负性相差大的元素之间才能形成离子键 特征: 1. 无方向性 2. 无饱和性
27
离子键是活泼金属元素的原子和活泼非金属元素的原子之 间形成的,其形成的重要条件就是原子之间的电负性差值 较大。一般来说,元素的电负性差越大,形成的离子键越 强。 即使是电负性最小的铯与电负性最大的氟所形成的氟化铯, 也不纯粹是静电作用,仍有部分原子轨道的重叠,即仍有 部分共价键的性质。一般用离子性百分数来表示键的离子 性的相对大小,实验证明,在氟化铯中,离子性占 92%, 也就是说铯离子与氟离子之间的键仍有 8% 的共价性。
无机化学经典课件分子结构
键能(E):气体分子每断裂单位物质的量 的某键时的焓变, KJ/mol
如:标态下 HCl(g)
H(g) + Cl(g)
△H θ = 431 KJ/mol
E θ(H-Cl) = 431 KJ/mol
对双原子分子:E = 键离解能D
D:将处于基态的双原子分子AB拆开成也处于基态 的A原子和B原子时,所需能量即为AB分子的
39
1 BeCl2 直线型
Cl —— Be —— Cl
Be 2s2
激发
sp 杂化轨道 ½ s ½p
杂化轨道的形状
两 个 sp 杂 化 轨 道
2. BF3 平面三角形 B 2s22p1
激发
1/3 s Sp2 杂化
2/3 p
三个sp2杂化轨道
3. CCl4 正四面体 C 2s23p2
Sp3杂化 ¼ s ¾p
π
键 , 键 的 不 同
20
3 配位共价键:共用电子对是由一个原子单
4
方面提供而形成的
形成配位键的必备条件: 1)一个原子价电子层有孤对电子 2)另一原子价电子层有空轨道。
如:CO分子
21
4 . 键的极性
非极性:同种原子形成的 如 H2 ,N2 , O2 极性 : 不同原子形成的
H-I H-Br H-Cl H-F
最大重叠原理:共价键尽可能沿着原子 轨道最大重叠的方向形成
9
特征:具有饱和性,方向性
HH
NN
+
2 共价键的键型—— σ键,π键,δ键 σ键 : 原子轨道沿键轴方向,“头碰头”重叠
13
π键: 原子轨道沿键轴“肩并肩”重叠 如 N2 2s22p3 一个σ键,两个π键
N2 分子结构示意图
15
沿着键轴方向以“头碰头” 重叠的原子轨道能够发生最大 程度重叠,重叠部分沿键轴呈 圆柱形对称,键能大、稳定性 高。
对多原子分子: E = 逐级离解能的平均值
2
键长: 分子内成键两原子核间的平衡距离 键角反映分子空间构型: 如CO2 , 键角=1800 ,直线型
3
1.2.1 价键理论
共价键 离子键 金属键
4
一 共价键
价键理论 杂化轨道理论 分子轨道理论 1. 价键理论
5
6
7
8
成键的条件:具有未成对的、自旋方 向相反的电子
晶格能是表达离子晶体内部强度的重 要指标,是影响离子化合物一系列性质如 熔点、硬度和溶解度等的主要因素。
33
反应的波恩-哈伯循环可以表示如下:
f Hm
Na ( s ) +
1 2
C12 ( g )
NaC1 ( s )
H1 Na ( g )
H2 解离 C1 ( g )
H3
H4
Na+( g ) + C1-( g )
极性增强
22
二 离子键
1916 年,德国化学家 W. Kossel 根据大多数化 合物具有稀有气体稳定结构的事实,提出了离 子键的概念。
1. 形成和特征
燃烧 2 Na + Cl2 ===== 2NaCl
3s1
3s23p5
24
这类化合物之所以导电,是因为它们在熔融状 态或水溶液中能够产生带电荷的粒子,即离子。 Kossel 认为电离能小的活泼金属元素的原子和电子 亲和能大的活泼非金属元素的原子相互接近时,金 属原子上的电子转移到非金属原子上,分别形成具 有稀有气体稳定电子结构的正负离子。正离子和负 离子之间通过静电引力结合在一起,形成离子化合 物。这种正负离子间的静电吸引力就叫做离子键。
52
1 价层电子对互斥理论要点
(1)当一个中心原子 A 和 n 个配位原子或原子团 B 形成 ABn 型分子时,分子的空间构型取决于中心原子 A 的价电子层中电子对的排斥作用,分子的构型总是采取电 子对相互排斥力作用最小的结构。价电子层中电子对指的 是成键电了减少价电子对之间的斥力,电子对间应尽 量互相远离。
H5
(-U)
34
影响晶格能的主要因素是离子的电荷、半径和 电子构型。这三个因素也是单原子离子的三个 重要的特征,它们决定了离子化合物的性质。
离子的电子构型
35
(1)0 电子构型 最外层没有电子的离子,如 H+。
(2)2 电子构型(1s2) 如 Li+,Be2+ 等。 (3)8 电子构型(ns2 np6) 如Na+,K+,Ca2+等。 (4)917 电子构型(ns2 np6 nd1-9 ) 也称为不饱和电 子构型,如 Fe2+,Cr3+ 等。 (5)18 电子构型(ns2 np6 nd10 ) 如 Ag+,Cd2+ 等。
价电子对排布方式为:当价电子对的数目为 2 时,呈 直线形;当价电子对的数目为 3 时,呈平面三角形;当价 电子对的数目为 4 时,呈正四面体形;当价电子对的数目 为 5 时,呈三角双锥形;当价电子对的数目为 6 时,呈八 面体形。
54
(3)对于只含共价单键的 ABn 型分子,若中心原子 的价层中有 m 个孤电子对,则其价层电子对总数是 n + m 对。
在 NO2 分子中,丁二炔(HCC-CCH)分子中,以 及 CO2 分子中,都有大 键。
51
二 价层电子对互斥理论
(VSEPR,valence-shell electron-pair repulsion) 理论要点:
