人教版化学必修1:第三章 章末综合检测
2022-2023学年高一化学综合测试卷(人教版2019必修一第1-3章)

B.该反应中N2是氧化产物,NO2是还原产物
C.该反应中被氧化和被还原的N原子数之比为1∶1
D.每生成0.3NA个N2分子,转移1.2mol电子
10.下列关于钠及其化合物说法中正确的是
A.将金属钠投入到硫酸铜溶液中,现象可概括为“浮、溶、游、响、红”
B.将一小块钠投入稀盐酸中,钠与水反应生成NaOH和H2,生成的NaOH再与HCl反应生成NaCl和H2O
A.1:1B.8:9C.9:8D.7:3
23.铁元素是人体重要微量元素,参与人体血红蛋白的形成,人体内的铁大部分是+2价的铁,Fe2+易被人体吸收,下列有关铁及其化合物的说法正确的是
A.缺铁性贫血症可以服用维生素C将难吸收的Fe3+氧化为Fe2+,促进铁元素的吸收
B.向溶液中通入Cl2,然后加入KSCN溶液,溶液变为红色,说明原溶液中一定含有Fe2+
2022-2023学年高一化学综合测试卷(人教版2019必修一第1-3章)
学校:___________姓名:___________班级:___________考号:___________
一、单选题(共0分)
1.下列常见物质的俗名与化学式对应正确的是
A.胆矾——CuSO4B.烧碱——NaOH
C.石灰石——Ca(OH)2D.小苏打——Na2CO3
6.下列指定反应的离子方程式正确的是
A.Cl2与水的反应:Cl2+H2O=2H++Cl-+ClO-
B.AlCl3溶液与氨水反应:Al3++3OH-=Al(OH)3↓
C.Cu与稀硝酸反应:3Cu+8H++2NO =3Cu2++2NO↑+4H2O
D.醋酸与CaCO3反应:2CH3COOH+CO =2CH3COO-+H2O+CO2↑
高中化学必修一 第三章 章末检测 解析版)

第三章铁金属材料单元测试卷时间:90分钟满分:100分一、选择题(本题共14小题,每小题3分,共42分。
每小题只有一个选项符合题意)1.天然氧化铝晶体俗称刚玉,常因含有杂质而呈各种色彩。
下列叙述不正确的()A.刚玉中混入微量的铬元素称为红宝石B.刚玉中混入微量的钛元素或铁元素称为蓝宝石C.蓝宝石和红宝石都是制作名贵首饰的材料D.蓝宝石和红宝石都只能从自然界中来获得2.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是A.①②③B.①②④C.①②③④D.②③④3.关于合金的叙述:①合金中至少含两种金属;②合金中的元素以化合物的形式存在;③合金中一定含金属;④合金一定是混合物。
其中正确的是A.①②③④B.①③④C.②③④D.③④4.电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制作印刷电路板。
下列说法正确的是A.该反应为置换反应B.用KSCN溶液可检验废液中的Fe2+C.可用置换法回收废液中的铜D.Fe3+能溶解Cu说明Cu比Fe金属性强5.下列物质的鉴别方法是运用化学方法且正确的是A.用NaOH 溶液鉴别Na2CO3 溶液和NaHCO3 溶液B.用KSCN 溶液鉴别FeCl3 溶液和FeCl2溶液C.用澄清石灰水鉴别SO2和CO2两种气体D.利用丁达尔效应鉴别Fe(OH)3 胶体和FeCl3溶液6.向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不.正确..的是()A.氧化性强弱:Br2 > Fe3+B.由图可知,该FeBr2溶液的浓度为1 mol·L-lC.n(Cl2)=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8D.n(FeBr2)∶n(Cl2)=1∶1时,反应的离子方程式为:2Fe2++2Br-+ 2Cl2=2Fe3++Br2 + 4Cl-7.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。
人教版高中化学选择性必修第1册 课后习题 综合检测卷(A)

综合检测卷(A)(时间:90分钟满分:100分)一、选择题(本题共15小题,每小题3分,共45分。
每小题只有一个选项符合题意)1.下列有关能量的叙述错误的是( )。
A.化石能源物质内部蕴涵着大量的能量B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来C.吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值D.物质的化学能可以在一定条件下转化为热能、电能为人类所用答案:C解析:常见的吸热反应,如水的电解、制水煤气等均有一定的利用价值。
2.下列关于原电池的叙述中,不正确的是( )。
A.原电池的负极发生的反应是氧化反应B.原电池的电极只能由两种不同的金属构成C.原电池能将化学能转变为电能D.原电池中电子流入的一极是正极答案:B解析:原电池中通常是活泼金属作负极,不活泼金属(或非金属导体,如石墨)作正极,B项错误。
3.某温度下反应C(s)+2H2(g)CH4(g)的K=8.28×107,当各气体物质的量浓度分别为c(H2)=0.7 mol·L-1、c(CH4)=0.2 mol·L-1时,上述反应( )。
A.正向移动B.逆向移动C.达到平衡D.不一定达到平衡答案:A≈0.408<K,说明该反应没达到平衡,v正>v逆,平衡正向移动。
解析:Q=c(CH4)c2(H2)4.室温下,等体积的pH=2的盐酸和CH3COOH溶液,以下说法正确的是( )。
A.两溶液浓度前者大于后者B.两溶液分别与足量的锌反应,生成氢气的体积相等C.两溶液分别与相同颗粒大小的锌反应,生成氢气的起始速率相等D.两溶液分别与体积相等的pH=12的NaOH溶液混合后,都呈中性答案:C解析:A项,两溶液pH相同,即c(H+)相同,但CH3COOH是弱电解质,部分电离,故浓度比盐酸大;B项,CH3COOH的物质的量大于HCl的物质的量,与足量锌反应,醋酸生成氢气的体积较大;C项,两溶液的c(H+)相同,与相同颗粒大小的锌反应时,生成氢气的起始速率相等;D项,pH=2的醋酸与pH=12的NaOH溶液等体积混合后,CH3COOH有剩余,所得溶液呈酸性。
22人教版高中化学新教材选择性必修1--第三章 水溶液中的离子反应与平衡-章末总结

−
NaH2 PO4 溶液中存在水解平衡: H2 PO−
+
H
O
⇋
H
PO
+
OH
,
H
PO
2
3
4
2
4
4 的
水解平衡常数: ℎ =
W
1
=
10−14
7.6×10−3
≈ 1.3 × 10−12 <2 (H3 PO4 ) = 6.3 ×
10−8 ,故 H2 PO−
4 的电离程度大于其水解程度,溶液呈酸性, NaH2 PO4 溶液
小吗?会引起碱中毒吗?
[答案] 某病人在静脉滴注大量生理盐水后,血液被稀释,会导致 (H + ) 显
著减小,但是 pH 不会显著增大,所以不会造成碱中毒。
(二)人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系 (H2 CO3 /HCO−
3),
+
它维持血液的 pH 稳定。已知在人体正常体温时,反应 H2 CO3 ⇋ HCO−
(二) 为证实 NaHCO3 溶液和 CaCl2 溶液混合是否产生沉淀。某学生设计了
如下实验:向 10.00 mL0.50 mol ⋅ L−1 NaHCO3 溶液中滴加不同浓度的 CaCl2
溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实
验现象。结合实验回答下列问题:
实验
序
(CaCl2 )/(mol ⋅
3 )> (CaCO3 ) ,所以产生了沉淀。
2. 写出未加热前①和②中发生的生成沉淀的离子反应方程式。
2+ = CaCO ↓ +H CO 。
[答案] 2 HCO−
+
Ca
2021-2022学年人教版高中化学必修一:章末检测(三) Word版含答案

章末检测(三)(时间:90分钟满分:100分)一、选择题(本题包括15小题,每小题3分,共45分。
每小题只有一个选项符合题意)1.将固体X投入过量的Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y 分别可能是( )A.钠和氯化铝溶液B.铝和烧碱溶液C.过氧化钠和氯化亚铁D.锌和稀硫酸答案 A解析Na与水反应生成NaOH和H2,NaOH与过量的AlCl3溶液反应生成白色沉淀Al(OH)3,A正确;2Al+2NaOH +2H2O===2NaAlO2+3H2↑,无沉淀生成,B错误;2Na2O2+2H2O===4NaOH+O2↑,NaOH与过量FeCl2溶液反应,生成Fe(OH)2白色沉淀,然后快速变成灰绿色,最终变为红褐色沉淀,C错误;Zn+H2SO4===ZnSO4+H2↑,无沉淀生成,D错误。
2.下列说法错误的是( )A.钠在空气中燃烧最终所得生成物为Na2O2B.镁因在空气中形成了一薄层致密的氧化膜,爱护了里面的镁,故镁不需要像钠似的进行特殊爱护C.铝制品在生活中格外普遍,这是由于铝不活泼D.铁在潮湿的空气中因生成的氧化物很疏松,不能爱护内层金属,故铁制品往往需涂爱护层答案 C解析铝因易与O2反应生成致密的氧化物爱护膜而耐腐蚀,我们日常用的铝制品常接受特殊工艺将氧化膜变厚,爱护作用更好,并不是铝不活泼。
3.下列反应,其生成物的颜色按红色、红褐色、淡黄色、蓝色挨次排列的是( )①金属钠在纯氧中燃烧②FeSO4溶液中滴入NaOH溶液并在空气中放置一段时间③FeCl3溶液中滴入KSCN 溶液④无水硫酸铜放入医用酒精中A.②③①④B.③②①④C.③①②④D.①②③④答案 B解析Na2O2、Fe(OH)3、Fe(SCN)3、CuSO4·5H2O的颜色分别是淡黄色、红褐色、红色、蓝色。
4.某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开头时是白色絮状沉淀,后快速变为灰绿色,最终变成红褐色。
人教版高中化学必修第一册第3章《铁 金属材料》综合素养测评【含答案】

综合素养测评(三)(时间:45分钟 )一、选择题(本题包括12小题,每小题4分,共48分,每小题只有一个选项符合题意。
)1.“神八”与“天宫”一号的成功对接,标志着中国的航空铝材处于世界领先行列。
下面关于铝合金的说法中,错误的是( )A.铝合金是一种混合物,它比纯铝的熔点低B.高温铝液易被氧化,铝合金应在熔剂层覆盖下熔炼C.镁铝合金耐腐蚀,但能被烧碱(NaOH)腐蚀D.镁铝合金在盐酸中无法溶解2.下列关于铝的叙述中,不正确的是( )A.铝是地壳里含量最多的金属元素B.在常温下,铝不能与氧气反应C.铝是一种比较活泼的金属D.在化学反应中,铝容易失去电子,是还原剂3.下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是( )A.K B.NaC.Fe D.Al4.Mg、Al、Fe三种金属分别与同浓度、同体积的稀盐酸反应时,放出H2的质量相等,则下列说法中正确的是( )A.三种金属的物质的量相等B.三种金属均过量C.三种金属的质量相等D.盐酸均过量5.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是( )A.NaOH B.KMnO4C.KSCN D.H2O26.把铁粉、铜粉置于FeCl3溶液中,充分反应后加入KSCN不显红色,下列情况不能成立的是( )A.铁不剩余,Cu剩余B.铁、铜均剩余C.铁剩余,含Cu2+D.铜剩余,含Fe2+7.下列各种物质既能与强酸反应,又能与强碱反应的是( )①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3A.①③⑤ B.②③④C.①③④D.①④⑤8.等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生H2的体积(同温同压)与反应时间的关系如图所示,则下列说法正确的是( )A.三种金属的活动性顺序为甲>乙>丙B.反应时消耗H2SO4的质量一定相同C.三种金属的相对原子质量大小关系是甲>乙>丙D.反应速率最快的是甲,最慢的是乙9.将1.12 g铁粉加入25 mL 2 mol/L的FeCl3溶液中,充分发生反应后,其结果是( ) A.往溶液中滴入无色的KSCN溶液,不显红色B.Fe2+和Fe3+的物质的量比为6:1C.反应中氧化产物和还原产物的物质的量比为2:1D.铁粉有剩余,溶液呈浅绿色,Cl-的浓度基本保持不变10.将5.4 g Al投入到200 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余,该溶液可能为( )A.NaOH溶液B.Ba(OH)2溶液C.H2SO4溶液D.HCl溶液11.某500 mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )A.0.4 mol·L-1B.0.6 mol·L-1C.0.8 mol·L-1D.1.0 mol·L-112.经研究发现,含有95%的铝和5%的镓、铟及锡组成的新型合金与水能快速反应制得氢气,整个反应中只消耗铝,而反应生成的Al2O3可回收再利用,这样不仅降低了制氢气的成本,而且方便快捷,这一发现将燃氢汽车的研发推向新的里程碑。
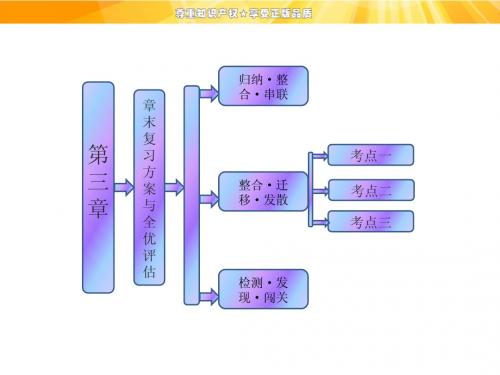
人教版化学必修1第3章《金属及其化合物》章末复习方案与全优评估
返回
解析: 冒气泡的原因是 Al 与 NaOH 溶液发生了反应,
- 方程式为: 2Al+2OH-+2H2O===2AlO2 +3H2↑; 使
AlO2 生成沉淀,最好是通入 CO2,加 HNO3 的话,沉 淀容易溶解。
- 答案:2Al+2OH-+2H2O===2AlO2 +3H2↑
-
B
返回
铁及其化合物的相互转化
H+===H2O+CO2↑,则开始产生 CO2 时消耗的 n(HCl) 0.4 1.06 =n(NaOH)+n(Na2CO3)= + =0.02(mol),V(HCl) 40 106 0.02 mol = =0.2 L,产生 CO2 的最大物质的量为 n(CO2) 0.1 mol/L 1.06 =n(Na2CO3)= =0.01(mol),当 NaOH、Na2CO3 完全 106
KI+I2
KI3
返回
(1)某学习小组对加碘盐进行了如下实验:取一定量
某加碘盐(可能含有 KIO3、KI、Mg2+、Fe3+),用适量
蒸馏水溶解,并加稀盐酸酸化,将所得试液分为 3 份, 第一份试液中滴加 KSCN 溶液后显红色;第二份试液中 加足量 KI 固体,溶液显淡黄色,用 CCl4 萃取,下层溶 液显紫红色;第三份试液中加入适量 KIO3固体后,滴加
- 答案:(1)Al(OH)3+OH-===AlO2 +2H2O 或
-
Al(OH)3+OH-===[Al(OH)4]- (2)通入 CO2 气体有白色沉淀生成;加入盐酸有气体产生, 沉淀溶解
返回
4.(2010· 山东高考节选)对金属制品进行抗腐蚀处理, 可延长其使用寿命。
以下为铝材表面处理的一种方法:
返回
解析:据框图转化可知,溶液D与硝酸酸化的硝酸银反应
人教版(2019)高中化学选择性必修1第三章 水溶液中的离子反应与平衡章末检测含完整解析

第三章 水溶液中的离子反应与平衡章末检测本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
第Ⅰ卷45分,第Ⅱ卷55分,共100分。
第Ⅰ卷 (选择题 共45分)一、选择题(本大题共15小题,每小题3分,共45分。
每小题只有1个选项符合题意,不选、多选、错选均不给分)1.[2022·新疆石河子一中阶段考] 已知25 ℃时有关弱酸的电离平衡常数如下表:弱酸化学式 HX HY H 2CO 3 电离平衡常数 7.8×10-53.7×10-9K a1=4.4×10-7 K a2=4.7×10-11下列推断正确的是( )A.pH 相同的HX 、HY 两种弱酸溶液,其物质的量浓度:HX>HYB.相同浓度下溶液的pH:HX>HY>H 2CO 3C.向Na 2CO 3溶液中加入足量HY,反应的离子方程式:HY+C O 32-HC O 3-+Y -D.H 2CO 3的电离常数表达式:K a1=c 2(H +)c (CO 32-)c (H 2CO 3)2.[2022·广东深圳期中] 将pH=13的两种碱溶液M 、N 各10 mL 分别稀释至100 mL,其pH 与溶液体积(V )的关系如图D3-1所示,下列说法不正确的是 ( )图D3-1A.若a =12时,M 为强碱B.若M 、N 都是弱碱,则a 大于12,且N 的碱性弱于MC.稀释后M 溶液中水的电离程度比N 的大D.稀释后的两种碱溶液与同浓度的盐酸反应至中性,消耗盐酸的体积V (M)>V (N)3.[2022·上海行知中学期中] 水的电离平衡曲线如图D3-2所示,下列说法正确的是 ( )图D3-2A.图中对应点的温度关系为a>bB.水的电离常数K W数值大小关系为b>dC.温度不变,加入少量NaOH可使溶液从c点变到a点D.纯水仅降低温度可由b点到d点4.[2022·湖南长沙实验中学期中] 在水电离出的c(H+)=1×10-14 mol·L-1的溶液中,一定能大量共存的离子组是()A.K+、Na+、HC O3-、Cl-B.K+、Si O32-、Br-、Cl-C.Na+、Cl-、N O3-、S O42-D.Al3+、N H4+、Cl-、S O42-5.[2022·浙江舟山中学期中] 下列说法错误的是()A.除去CuCl2溶液中少量的FeCl3,可选用CuO固体B.配制一定浓度的FeSO4溶液时,将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度C.在NaHS溶液中,滴入少量CuCl2溶液,产生黑色沉淀,HS-的水解程度增大,pH增大D.用饱和氯化铵溶液可以清洗钢铁表面的锈迹6.[2023·江苏盐城期中] 乙二酸(用H2A表示)为二元弱酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(时间:90分钟,满分:100分)一、选择题(本题包括15小题,每小题3分,共45分)1.每看到绽放的美丽焰火,很容易联想到化学中的焰色反应,下列关于焰色反应的说法中不.正确的是()A.焰色反应是金属元素在灼烧时火焰所呈现的颜色B.并不是所有的金属元素都存在焰色反应C.K2CO3在酒精灯上灼烧时能直接观察到紫色火焰D.应该用稀盐酸清洗做过焰色反应实验的铂丝解析:选C。
在观察钾元素的焰色反应时,应透过蓝色钴玻璃才能观察到紫色火焰。
2.为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是()A.Na+B.Ca2+C.Mg2+D.Fe3+解析:选A。
人体汗液中含有大量的Na+,故大量出汗后应补充Na+。
3.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是()①金属钠在纯氧中燃烧②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间③FeCl3溶液中滴入KSCN溶液④无水硫酸铜放入医用酒精中A.②③①④B.③②①④C.③①②④D.①②③④解析:选B。
钠在纯氧中燃烧,产物为淡黄色;FeSO4溶液与NaOH溶液反应,放置空气中,最终生成红褐色Fe(OH)3;FeCl3遇KSCN溶液变红;无水CuSO4放入医用酒精中形成Cu2+显蓝色。
4.下列反应的离子方程式正确的是()A.铜片加入三氯化铁溶液中:Cu+2Fe3+=====2Fe2++Cu2+B.盐酸中加入碳酸钙:CO2-3+2H+===== H2O+CO2↑C.AlCl3溶液中加入足量的氨水:Al3++3OH-=====Al(OH)3↓D.NaHCO3溶液中加入盐酸:CO2-3+2H+=====H2O+CO2↑解析:选A。
B选项中CaCO3不能拆开,C选项中氨水应写成NH3·H2O;D选项中HCO-3不能拆。
5.合金是不同种金属(也包括非金属)在熔化状态下形成的一种具有金属特性的熔合物,下表中金属难与表中其他金属形成二元合金的元素是()A.Fe B.CuC.Ag D.W解析:选D。
形成合金的两种金属必须在某一温度范围时都呈液态,这是熔合的基本条件。
表中锌的沸点低于其他金属的熔点,在其他金属熔化时,锌已成气态。
而金属W的熔点比其他金属的沸点都高,当W熔化时,其他金属也已成为气态。
6.铁是人类较早使用的金属之一。
据有关报道,目前已经能冶炼出纯度较高的铁。
你估计这种“纯铁”不.会具有的性质是()A.硬度比生铁低B.熔沸点比生铁高C.能与Fe2(SO4)3溶液反应D.不能与盐酸反应解析:选D。
生铁是铁的一种合金,它的硬度高于其成分金属铁,而熔沸点低于纯铁,A、B正确;纯铁能够与Fe2(SO4)3、盐酸分别发生以下反应:Fe2(SO4)3+Fe=====3FeSO4,Fe+2HCl===== FeCl2+H2↑,C正确、D错误。
7.某溶液由相同物质的量的CuCl2、FeCl3、AlCl3混合而成,向该溶液中加入铁粉,充分搅拌后振荡,铁粉仍有剩余,则溶液中存在较多的阳离子是()A.Fe3+、Cu2+B.Fe3+、Al3+C.Fe2+、Al3+D.Fe2+、Fe3+解析:选C。
因为Fe可以与Fe3+和Cu2+发生如下反应:Fe+2Fe3+=====3Fe2+,Fe+Cu2+===== Fe2++Cu,所以溶液中铁粉有剩余时,Fe3+、Cu2+一定不存在。
8.下列各组溶液中,只用试管和胶头滴管,不用其他任何试剂就能鉴别的是()A.AlCl3和NaOH B.FeCl3和NaOHC.NaCl和AgNO3D.Na2CO3和Ba(OH)2解析:选A。
采用溶液互滴法进行鉴别。
将AlCl3滴入NaOH开始无沉淀,而将少量NaOH 滴入AlCl3中出现白色沉淀,可鉴别出二者。
B、C、D三项中互滴现象均相同,无法进行鉴别。
9.据最新报道,科学家最近开发出一种生物活性吸附剂,可以吸附水中大部分的微生物和噬菌体。
这种新的吸附剂由成本低廉、利于环保的棉纤维素和主要成分为氢氧化铝的勃姆石制造而成。
下列有关说法中不.正确的是()A.Al(OH)3既能够与盐酸反应又能够与NaOH溶液反应B.这种吸附剂也能吸附色素C.向Al2(SO4)3溶液中加入过量的NaOH溶液也能得到Al(OH)3D.实验室中Al(OH)3可以由可溶性铝盐溶液与足量的氨水反应制得解析:选C。
Al2(SO4)3与过量NaOH溶液反应方程式为:Al2(SO4)3+6NaOH=====2Al(OH)3↓+3Na2SO4,Al(OH)3+NaOH=====NaAlO2+2H2O,故不能得到Al(OH)3沉淀。
10.由锌、铁、铝、镁四种金属中的两种组成的混合物10 g,与足量的盐酸反应产生的氢气在标准状况下的体积为11.2 L,则混合物中一定含有的金属是()A.锌B.铁C.铝D.镁解析:选C。
设四种金属均为+2价金属,平均相对原子质量为x,则R~H2↑x g22.4 L10 g11.2 L解得x=20锌、铁、镁的相对原子质量均大于20,只有铝,若转化为二价金属,其相对原子质量(18)小于20,所以混合物中一定含有的金属是铝。
11.下列说法不.正确的是()A.Na2O2可用于呼吸面具中氧气的来源B.Na2O和Na2O2投入水中都能生成NaOH,都是氧化还原反应,它们都是碱性氧化物C.Na2CO3可用于制玻璃、肥皂、造纸、纺织等工业,而NaHCO3可用于治疗胃酸过多,制造发酵粉等D.NaCl的性质稳定,可用作调味品解析:选B。
Na2O与H2O的反应不是氧化还原反应,碱性氧化物是指能够与酸反应生成盐和水的氧化物,Na2O2和盐酸反应为:2Na2O2+4HCl=====4NaCl+2H2O+O2↑,还生成了O2,故Na2O2不属于碱性氧化物,它属于过氧化物,B错误。
12.把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为()A.70% B.52.4%C.47.6% D.30%解析:选A。
反应前a g固体成分是铁、铝混合物,反应后a g固体成分为Fe2O3,可见Fe2O3中铁的含量就是原混合物中铁的含量。
13.如图表示金属X、Y及它们的合金Z分别与足量盐酸反应放出H2量的情况。
横坐标表示消耗金属的物质的量,纵坐标表示在标准状况下产生H2的体积。
下列有关合金组成的判断正确的是()A.n(Na)∶n(Fe)=2∶1B.n(Mg)∶n(K)=1∶2C.n(Na)∶n(Al)=1∶3D.n(K)∶n(Al)=1∶1解析:选D。
据X的图像知,X为一价金属;据Y的图像知Y为三价金属,由合金Z与酸反应图像可知,2 mol合金能生成2 mol H2则有n(X)+n(Y)=2 mol,n(X)2+3n(Y)22mol,得n(X)∶n(Y)=1∶1。
14.有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2 g,把它们溶于足量的水中,充分反应后,溶液中Ca2+、CO2-3、HCO-3均转化为沉淀,将反应容器内水分蒸干,最后得白色固体物质共29 g,则原混合物中含Na2CO3的质量是()A.10.6 g B.5.3 gC.15.9 g D.无法确定解析:选A。
由Ca2+、CO2-3、HCO-3全转化为沉淀可得反应式:CaO+NaHCO3=====CaCO3↓+NaOH;CaO+Na2CO3+H2O=====CaCO3↓+2NaOH,固体的质量增重29-27.2=1.8 g,即后一反应消耗的水的质量,由此反应即可求出Na2CO3的质量。
15.已知某无色溶液只由Fe3+、Mg2+、Cu2+、Al3+、NH+4、Cl-、OH-中的几种组成,向此溶液中加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。
继续加入淡黄色粉末时,产生无刺激性气味的气体,白色沉淀只能部分溶解,则此溶液中一定大量含有的离子()A.Mg2+、Al3+、NH+4、Cl-B.Mg2+、Al3+、NH+4、Fe3+C.Mg2+、Cu2+、NH+4、OH-D.Mg2+、Cu2+、NH+4、Cl-解析:选A。
由溶液无色知没有Fe3+、Cu2+,由产生刺激性气体知有NH+4,由先产生白色沉淀后部分溶解知有Mg2+、Al3+,由共存关系知没有OH-,由电中性原理知有Cl-。
二、非选择题(本题包括5小题,共55分)16.(10分)含有下列离子的五种溶液①Ag+②Mg2+③Fe2+④Al3+⑤Fe3+试回答下列问题:(1)既能被氧化又能被还原的离子是________(填离子符号,下同)。
(2)向③中加入NaOH溶液,现象是__________________________________________,有关方程式(是离子反应的写离子方程式)为____________________________________________________________________________________________________________。
(3)加入过量NaOH溶液无沉淀的是________________________________________。
(4)加铁粉溶液质量增重的是________,溶液质量减轻的是____________________。
(5)遇KSCN溶液呈红色的是______________________________________________。
(6)能用来鉴别Cl-存在的离子是_____________________________________________。
解析:(1)五种离子中只有Fe2+处于中间价态,处于中间价态的离子既有氧化性又有还原性。
(3)五种离子都可以与OH-反应生成沉淀,只有Al3+生成的Al(OH)3可以溶于过量的NaOH 溶液中。
(4)五种离子中,只有Ag+、Fe3+与Fe发生反应:2Ag++Fe=====Fe2++2Ag(使溶液质量减轻),2Fe3++Fe=====3Fe2+(使溶液质量增加)。
答案:(1)Fe2+(2)出现白色沉淀,迅速变灰绿色最后变为红褐色Fe2++2OH-===== Fe(OH)2↓,4Fe(OH)2+O2+2H2O=====4Fe(OH)3(3)Al3+(4)Fe3+Ag+(5)Fe3+(6)Ag+17.(12分)如图所示图像中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,按试题将相应图的字母填入下列空格中,并写出所发生反应的离子方程式。
(1)表示向饱和AlCl3溶液中滴加氨水至过量的是______________,离子方程式:________________________________________________________________________________________________________________________________________________。
