范德华方程计算容器内气体的压力
范德华方程常数

范德华方程常数范德华方程常数是描述非理想气体行为的重要参数之一。
它是根据实验数据拟合得到的,可以用来衡量气体分子间的相互作用程度。
范德华方程常数包括范德华吸引常数(a)和范德华斥力常数(b),它们对应了气体分子间的吸引力和斥力。
范德华方程常数的引入是为了修正理想气体方程,使其更加适用于实际气体的行为。
理想气体方程假设气体分子之间没有相互作用,而实际气体分子之间存在吸引力和斥力,因此需要引入修正项。
范德华方程可以写为:P = (nRT)/(V - nb) - a(n/V)^2其中,P表示气体的压强,n表示气体的物质的量,R表示气体常数,T表示气体的温度,V表示气体的体积。
范德华方程常数a和b可以根据实验数据进行拟合得到。
范德华吸引常数a表示气体分子之间的吸引力,它的值越大,吸引力越强。
范德华斥力常数b表示气体分子之间的斥力,它的值越大,斥力越强。
范德华方程常数的值与气体的性质有关。
不同气体的分子间相互作用不同,因此它们的范德华方程常数也不同。
例如,极性分子之间的相互作用较强,其范德华方程常数的值较大;而非极性分子之间的相互作用较弱,其范德华方程常数的值较小。
范德华方程常数的应用非常广泛。
在化学工程领域,它常被用来描述气体的物理性质,如压力、密度、温度等。
在化学反应工程中,范德华方程常数的值可以用来预测气体的行为,从而优化反应条件和改进工艺。
范德华方程常数还可以用来计算气体的偏差因子(压缩因子),从而更准确地描述气体的行为。
偏差因子是实际气体与理想气体之间的差异,它的值与范德华方程常数密切相关。
范德华方程常数是描述气体分子间相互作用的重要参数。
通过引入范德华方程常数,可以修正理想气体方程,使其更适用于实际气体的行为。
范德华方程常数的值与气体的性质有关,不同气体的范德华方程常数不同。
范德华方程常数在化学工程和化学反应工程中有着广泛的应用,可以用来描述气体的物理性质,预测气体的行为,以及计算偏差因子等。
van der Waals状态方程及其对科学的贡献

2van der Waals 状态方程及其对科学的贡献19世纪初,在Boyle(玻义耳)、Gay -Lussac(盖-吕萨克)和Avogadro(阿伏伽德罗)等学者的努力下,一个能够描述低密度气体pVT 行为的经验方程pV m =RT (2-1)已被确立,式中R 是一个普适的常数,称为摩尔气体常数,V m 为气体的摩尔体积。
但是,要说发展成一个理论,应当归功于德国物理学家R J E Clausius(克劳修斯),他在1857年首先用气体分子运动论导得了这个方程。
在推导中,他为低密度气体设想了如下微观模型:①气体是大量分子的集合体。
②分子在容器中作无规则运动,它们的运动遵守牛顿运动定律。
③分子本身的大小可以忽略不计。
④除了碰撞外,分子间没有相互作用。
⑤分子间和分子与器壁间的碰撞是弹性碰撞。
显而易见,这是一个十分粗放的理想模型。
完全符合这种模型的气体称为理想气体。
故式(2-1)称为理想气体状态方程。
理想气体状态方程的一个显著特征是:它的等温线总是一些双曲线。
无论温度多么低,压力多么高,都不可能使其液化,故理想气体是一种永久气体。
显然,这与人们的经验很不相符。
经验表明,任何物质都能够气液相变,在一定的温度下都有确定的饱和蒸气压,温度愈高,饱和蒸气压愈大。
然而,这种平衡关系是否会随温度的升高而无限地保持下去呢?这个看似简单的问题,却让不少著名物理学家困惑了近50年,直到1869年才得出了明确的结论。
这归功于英国物理学家T Andrews(安德鲁斯),他用了将近十年的时间,对气体的压缩性做了一系列实验,特别是二氧化碳。
他发现随着温度的升高,平衡的气液两相密度差逐渐缩小,到了31℃时,两者差别消失,蒸发焓变为零,即气液平衡到此终止。
Andrews 称此为“临界点”,意即以此为界,当温度超过31℃时,无论压力多高,都不可能使气体液化。
当Andrews 将这些实验结果在英国皇家学会作了题为“论物质液态和气态的连续性”报告后,立即引起了世界各国学者的关注。
范德瓦尔斯方程

荷兰物理学家范德瓦耳斯(Johannes Diderik Van der Waals,1837—1923)改进了气体的状态方程,把分子间的作用力和分子的有限体积放进方程中去。他论证了,分子间距离较远时,它们间必定存在吸引力,这一作用附加到容器壁施加的压强上去。他进一步提供论据,假设附加产生的压强反比于气体比容的平方。还有,由于分子占有体积,它们可利用的空间必须减少,或者说得更明白些,减少的总体积就正比于分子在相互接触时所占有的体积。于是一摩尔真实气体的状态方程变成(p+an2/V2)(V-nb)=RT。 这简单方程包含两个常数,即a和b,对于每一种物质它们可由实验确定。R是普适气体数学。1873 年在博士论文《论气态和液态的连续性》中考虑了分子体积和分子间吸力的影响,推出了著名的物态方程:(p+a/V2)(V-b)=RT 后来人们称之为范德瓦耳斯方程。他还导出了b 是分子体积的4 倍。这个方程不仅能解释安德纽斯的实验结果及J.汤姆生的见解,而且能从常数a、b 值计算出临界参数,这对“永久气体”液化的理论起了指导作用。
范德华方程是范德瓦耳斯方程的另一种翻译,简称范氏方程,是荷兰物理学家范德瓦耳斯(van der Waals,又译“范德华”、“凡德瓦耳”)于1873年提出的一种实际气体状态方程。范氏方程是对理想气体状态方程的一种改进,特点在于将被理想气体模型所忽略的的气体分子自身大小和分子之间的相互作用力考虑进来,以便更好地描述气体的宏观物理性质。
式中A* 为每个分子的亥姆霍兹自由能。由此得到,引力使压强减小的量正比于1/v2。记该比例常数为a,可得...这便是范氏方程。(注:由于笔者自身水平有限,“。。。”处笔者这样的:先由范德瓦耳斯提出假设,再通过计算证明假设的成立,因此当初方程的产生并不是由于数学推导,而是一种经验性的假设,通过计算,符合事实,便成为一个结论。更简单的理解是:根据理想气体状态方程pV=nRT,由于真是气体压强和体积的测定相对于真实气体存在误差,因此要对压强和体积进行修正。体积上的修正很容易理解,就是理想气体体积减去分子占有体积就是真实气体运动所占有的体积,而对于压强的修正,理解是这样的:分子间的吸引力会对气体对外表现出的压强产生减弱,因此在真实气体的基础上加上由于吸引减弱的压力才是理想气体表现出的压力。而这个分子间的吸引力的大小,是与分子的密度有关的。而在分子间吸引力相同的情况下,分子密度越大,吸引力对压力的削减也越强,因此在压强出的修正方面,是加上分子密度平方的正比。
气体状态方程及其应用

气体状态方程及其应用气体是物质的一种常见形态,广泛存在于自然界和工业生产中。
了解气体的状态方程对于理解和应用气体的性质和行为非常重要。
本文将介绍气体的状态方程以及它在科学和工程领域的应用。
一、气体状态方程气体状态方程描述了气体的性质和行为,它是通过实验和理论推导得到的。
目前最常用的气体状态方程有理想气体状态方程和范德华气体状态方程。
理想气体状态方程是最简单和最常用的气体方程,它建立在以下假设基础上:1. 气体分子之间没有相互作用力;2. 气体分子之间体积可忽略不计。
根据这些假设,理想气体状态方程可以表示为:PV = nRT其中,P为气体的压强,V为气体的体积,n为气体的摩尔数,R为气体常量,T为气体的温度。
该方程可以用来计算气体在不同条件下的状态。
另一个常用的气体状态方程是范德华气体状态方程,它考虑了气体分子间的相互作用力对气体性质的影响。
范德华气体状态方程可以表示为:(P + an^2/V^2)(V - nb) = nRT其中,a和b是范德华常数,与气体的性质有关。
该方程在高压和低温条件下更精确地描述了气体的状态。
二、气体状态方程的应用1. 气体的状态计算气体状态方程可以用于计算气体在不同条件下的状态,例如计算气体的压力、体积、温度等。
通过对气体状态方程进行适当的变换和计算,可以得到所需的气体性质数据。
2. 气体混合物的性质分析在实际应用中,往往会遇到多个气体混合在一起的情况。
气体状态方程可以帮助我们分析和计算气体混合物的性质,例如气体的总压力、分压力以及摩尔分数等。
3. 气体反应的计算在化学反应中,气体常常作为反应物或生成物参与其中。
通过气体状态方程,可以计算气体反应的平衡常数、反应速率等重要参数,从而对反应过程进行研究和优化。
4. 气体的密度和摩尔质量计算气体状态方程可以通过变换和计算,得到气体的密度和摩尔质量。
这对于工程设计、分析和实验中的气体计量非常重要,例如在空气污染监测中的应用。
5. 气体的溶解度和扩散率研究气体溶解度和扩散率是气体在液体中的重要性质。
理想气体

RT p Vm b
上页 下页 返回 帮助
1.1
气体
由于真实气体分子间有作用力,且以吸引力为主,因此 其压力为
p RT a 2 Vm b Vm
分离变量,整理即得式(1-13)。 【任务1-5解答】(1)用理想气体状态方程计算:
p n 10.0 RT 8.314 300 =5.13MPa 3 V 4.86 10
(2)用范德华方程计算:
nRT an2 10.0 8.314 300 0.5562 10.02 p= 2 - =3.55MPa 3 3 3 V nb V 4.86 10 10.0 6.380 10 4.86 10
显然用范德华方程计算结果与实测值比较接近。
上页 下页 返回 帮助
1.1
气体
实验表明,对于中压范围(1.6MPa≤P<10MPa)的气
体,用范德华方程计算结果更为准确。
分别用理想气体状态方程和范德华方程计算1mol CH3OH气体在400K,101325Pa的体积,并比较两者有和差 别,为什么?
上页
下页
返回
帮助
an2 p V nb nRT V
(1-12)
(1-13)
a p Vm b RT Vm
a、b为范德华常数(见表1-1)。通常,容易液化的气体, 气体分子间引力越大,a越大;分子越大,b越大。
上页 下页 返回 帮助
1.1
1.1.2 真实气体
任务1-5:10.0 mol C2H6气体在300K充入4.86×10-3m3 的容器中,计算容器内气体压力(实测压力为3.445 MPa)。
1.真实气体的p、V、T性质
真实气体只有在高温、低压条件下,才遵守理想气体状 态方程,否则将偏离理想气体行为,产生偏差(图1-3)。
1.3真实气体与范德华方程
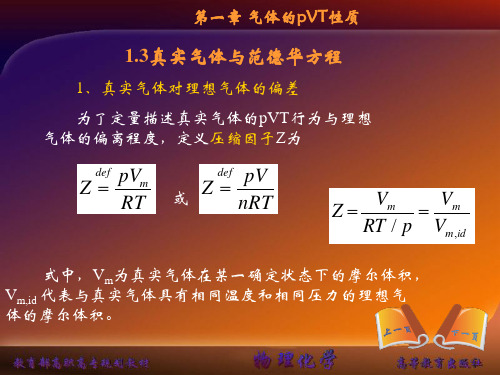
1.3真实气体与范德华方程
1、真实气体对理想气体的偏差
为了定量描述真实气体的pVT行为与理想 气体的偏离程度,定义压缩因子Z为
Z
def
pV m RT
或
Z
def
pV nRT
Z
Vm RT / p
Байду номын сангаас
Vm V m , id
式中,Vm为真实气体在某一确定状态下的摩尔体积, Vm,id 代表与真实气体具有相同温度和相同压力的理想气 体的摩尔体积。
第一章气体的pvt性质13真实气体与范德华方程1真实气体对理想气体的偏差为了定量描述真实气体的pvt行为与理想气体的偏离程度定义压缩因子z为pvzz?mdefpvzz?def?或rtnrtidmmmvvprtvz??式中vm为真实气体在某一确定状态下的摩尔体积vmid代表与真实气体具有相同温度和相同压力的理想气体的摩尔体积
第一章 气体的pVT性质
真实气体 1、低温低压:分子本身体积忽 略,分子间引力不忽略 2、高压:分子间距小,分子本 身体积不能忽略,分子间作用 力中斥力占主导 3、高温:分子热运动加剧,引 力作用可忽略,体积成为主导 因素 易压缩,Z<1
难压缩,Z>1
第一章 气体的pVT性质
范德华方程 为了能够比较准确地定量描述真实气体的 pVT行为,自19世纪以来,人们在大量实验的基 础上,提出了许多形式各异的真实气体状态方程, 它们的适用对象及精确程度也有所不同。 在众多的探索真实气体状态方程的科学家 中,荷兰科学家范德华(van der Waals J D)于1871 年首先从理论上建立了真实气体的微观模型,并 在此基础上对理想气体方程进行了修正,提出了 一个与实验结果比较一致的真实气体状态方程。 范德华提出:
物理化学1.2 实际气体状态方程

a Vm2
(Vm
b)
RT
p
n2a V2
(V
nb)
nRT
(1) a和b:Van der Waals常数,可查表(见附录)。
a 是物质的特性常数,单位:Pa·m6·mol-2 b为1 mol 分子自身所占体积,单位:m3·mol-1
某些气体的范德华常数
(2) 范德华气体:任何温度、压力条件下均符合范德华
3
(2) 一个分子应扣除 1 4 (2r)3 的体积;
23
(3)
1
mol分子应扣除的体积为:
1 2
4 3
(2r)3
L
4
4 3
r3
L
b
1 mol 真实气体自由活动空间=(Vm-b) b:1 mol 分子自身所占体积
van der Waals(范德华)方程式
p
实际气体的状态方程
van der Waals 方程式
问题提出:如何描述实际气体的PVT之间的关系?
理想气体状态方程 pVm=RT
实质为: (分子间无相互作用力时气体的压力)× (1 mol 气体分子的自由活动空间)=RT
J.D范德瓦尔斯 荷兰物理学家
1837-1923
思想:对实际气体进行两项修正
1) 实际气体分子间有相互作用力
分子间相互作用减弱了分子对器壁的碰撞,降低了气体压力。
p= p理-p内
p内 2 1 Vm2
p内 a Vm2
故:p理= p + p内= p &小有关。
2) 实际气体分子本身占有体积
无机化学题库及答案

普化无机试卷(气体一)一、选择题1. (0101)较多偏离理想气体行为的气体, 其分子具有----------------------------------------( )(A) 较高的分子速率(B) 较小的相对分子质量(C) 较大的分子体积(D) 较弱的分子间作用力2. (0102)按SI 制气体常数R的取值是------------------------------------------------------------( )(A) 82.06 dm3·atm·K-1·mol-1(B) 8.314 J·K-1·mol-1(C) 1.987 cal·atm·K-1·mol-1(D) 0.082 cal·K-1·mol-13. (0103)现有1 mol 理想气体, 若它的摩尔质量为M,密度为d,在温度T下体积为V,下述关系正确的是----------------------------------------------------------------------------------------( )(A) pV=(M/d)RT(B) pVd = RT(C) pV=(d/n)RT(D) pM/d = RT4. (0104)相同的温度、压力条件下, 1 g 下列各种物质, 占体积最大的是-------------------( ) (相对原子质量:H 1, C 12, O 16, Ne 20, S 32)(A) 乙烷(B) 氖(C) 氧(D) 硫化氢5. (0105)用Meyer 法测定0.15 g 挥发性液体, 在标准温度和压力下, 其体积为20 cm3,该化合物的相对分子质量约为-------------------------------------------------------------------------( )(A) 85 (B) 168 (C) 340 (D) 456. (0106)在T,p 相同下,气体A充满烧瓶时,测得A为0.34 g , 而充满O3时, 测得其为0.48 g , 则气体A是-------------------------------------------------------------------------------------------( )(A) O2(B) SO2(C) H2S (D) 无法判断7. (0108)某气体AB,在高温下建立下列平衡:AB(g) +B(g). 若把1.00 mol 此气体在T= 300 K,p= 101 kPa 下放在某密闭容器中, 加热到600 K时, 有25.0 %解离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
=3.55MPa
结论:对于中压范围的气体范德华方程计算结果更准确。
3
上页 下页 返回 帮助
§2–1 气 体
第二章气体和分散系统
3.压缩因子
以临界常数作为衡量各真实气体p、V、T的对比
尺 度,引入 对比参数。
pr
p pc
Vr
V Vc
Tr
T Tc
经长期探索,人们在理想气体状态方程中引入一
个校正Z因子nZpR,VT即可应用Z 于 真pRcT实Vcc气 体pTrV。r r 方程如下
§2–1 气 体
第二章气体和分散系统
•真实气体
不遵守理想气体状态方程的气体
1.真实气体的p、V、T 性质
理想即气体,当温度T恒定时,pVm为一定值(RT),
pVm不随p而变化,但对 真实气体而言,pVm却
并非如此,如图
图2-1 一些真实气体的pVm – p定温线
2.真实气体状态an方2 程:范德华方程式
( p )(V nb) nRT
V2
上页 下页 返回 帮助
§2–1 气 体
例题:
第二章气体和分散系统
10.0 mol C2H6气体在300K充入4.86×10-3m3的容器中,测 得其压力为3.445 MPa。分别用(1)理气状态方程(2)范
德华方程计算容器内气体的压力(已知a=0.5562 Pa·m3/mol2; b=6.380×10-3 m3/mol)。
2
上页 下页 返回 帮助
§2–1 气 体
第二章气体和分散系统
例题解:
(1)
p n RT V
=10.0×8.314×300/(4.86×10-3)=5.13MPa
(2)
p= nRT V nb
an2 V2
=
10.0 8.314 300
- 0.556210.02
4.86103 10.0 6.380103 4.86103
4
临界压缩因子
上页 下页 返回 帮助
