小专题 化学用语
化学用语宝典

化学用语宝典1. 嘿,宝子们!化学用语就像魔法咒语一样,能让你在化学世界里畅通无阻。
比如说化学式,就像人的名字一样,是物质的独特标识。
H₂O,这不就是水嘛,简单又好记。
要是不懂化学用语,就像到了外国却不懂当地语言,只能干瞪眼。
2. 化学用语可是打开化学大门的金钥匙呀!你看化学方程式,那简直就是一场化学物质的“舞蹈编排”。
像2H₂+ O₂= 2H₂O,氢气和氧气就像两个小伙伴,在特定条件下欢快地结合成了水这个新伙伴。
如果不掌握化学用语,就好比厨师不知道菜谱上的菜名,咋做菜呢?3. 哇塞,化学用语是化学世界的密码本呢!离子符号就很神奇。
比如Na⁺,这小小的符号代表着钠离子,它在溶液里就像一个个小战士,带着正电荷,到处游走。
要是不明白这些化学用语,就如同在迷宫里乱撞,根本找不到方向。
4. 哟呵,化学用语里的元素符号是基石中的基石。
像C代表碳,碳可是个超级明星元素。
从钻石到石墨,都是它的变身。
要是不知道元素符号,就像你认识一堆明星,却不知道他们的名字,多尴尬啊。
5. 天哪,化学用语中的化合价就像商品的价格标签。
例如在氧化铁Fe₂O₃里,铁是 +3价,氧是 -2价,这就像规定好了每个元素在这个化合物里的“价值”。
要是搞不懂化合价,就像在市场上乱花钱,根本不知道东西值不值。
6. 嘿,你知道吗?化学用语的结构就像建筑蓝图。
像有机化学里的结构简式,以乙醇CH₃CH₂OH为例,它清楚地告诉我们原子是怎么排列组合的。
要是不懂化学用语,就像建筑工人没有蓝图就盖房子,肯定盖得乱七八糟。
7. 哎呀,化学用语中的化学计量数也很有趣呢。
在反应式3Fe + 2O₂= Fe₃O₄里,3、2、1这些数字就像指挥棒,指挥着反应物和生成物的量。
要是不理解这个,就像乐队里的乐手不看指挥,肯定乱成一锅粥。
8. 哟,化学用语中的官能团就像人的特殊技能。
以-OH(羟基)为例,它让醇类物质有了独特的性质。
要是不知道官能团,就像不知道一个人的特长,无法真正了解这个物质的个性。
化学用语汇总范文

化学用语汇总范文下面是一些化学用语的汇总:1. 元素(Element):指的是一种由相同类型的原子组成的物质,例如氧气(O2)。
3. 分子(Molecule):由两个或更多原子通过共享或连接的化学键结合而成的化合物。
4. 原子(Atom):由质子(正电荷)和中子(中性)构成核心,围绕核心运动的带有电子(负电荷)的基本粒子。
5. 化学键(Chemical bond):将原子结合在一起的力量。
常见的化学键包括共价键、离子键和金属键。
6. 共价键(Covalent bond):通过共享电子对而形成的化学键,常见于非金属元素之间。
7. 离子键(Ionic bond):由正负电荷之间的吸引力形成的化学键,常见于金属和非金属元素之间。
8. 金属键(Metallic bond):由金属原子之间的电子云形成的化学键,常见于金属元素之间。
9. 反应(Reaction):化学物质之间发生的变化,包括反应物转化为产物和能量的转化。
10. 催化剂(Catalyst):可以加速化学反应速率的物质,但本身在反应过程中不被消耗。
11. 中和反应(Neutralization reaction):酸和碱反应生成盐和水的化学反应。
12. 氧化还原反应(Redox reaction):涉及电子转移的化学反应,包括氧化剂和还原剂的反应。
13. 酸(Acid):以释放氢离子(H+)为特征的化合物,常常具有酸性和呈酸味。
14. 碱(Base):以释放氢氧根离子(OH-)为特征的化合物,常常具有碱性和呈苦味。
15.pH值:用来表示溶液酸碱性的指标。
pH值小于7表示酸性,大于7表示碱性,等于7表示中性。
16. 摩尔质量(Molar mass):一个化学物质的摩尔质量是以克/摩尔(g/mol)来表示的,等于该物质的质量除以摩尔数。
17. 摩尔数(Mole):化学反应中物质的计量单位,表示化学物质的数量。
18. 反应速率(Reaction rate):化学反应中物质转化的速度。
初中化学用语(全)
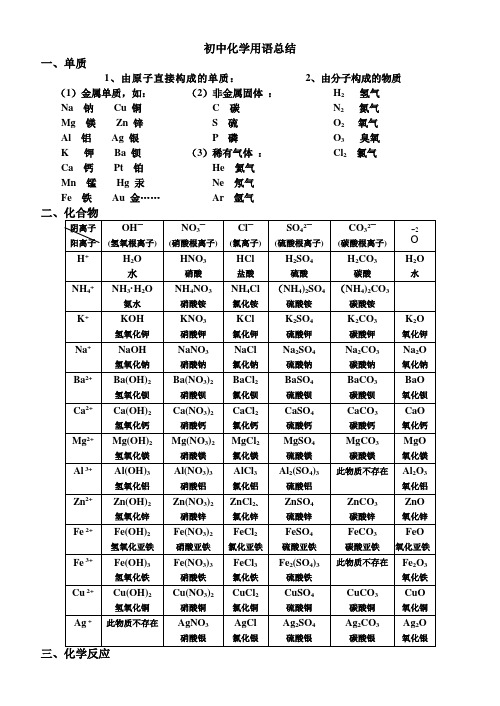
初中化学用语总结一、单质1、由原子直接构成的单质:2、由分子构成的物质(1)金属单质,如:Na 钠Cu 铜Mg 镁Zn 锌Al 铝Ag 银K 钾Ba 钡Ca 钙Pt 铂Mn 锰Hg 汞Fe 铁Au 金……(2)非金属固体:C 碳S 硫P 磷(3)稀有气体:He 氦气Ne 氖气Ar 氩气H2氢气N2氮气O2 氧气O3臭氧Cl2氯气(一)、化合反应:“多变一”1、氯化氢和氨气反应:氯化铵氨气氯化氢−→−+ Cl NH NH HCl 43===+2、红磷燃烧: 五氧化二磷氧气磷点燃−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧: 二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+ 4、铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+5、镁的燃烧: 氧化镁氧气镁点燃−−→−+ O Mg 2O 2Mg 2点燃+ 6、铝的燃烧: 氧化铝氧气铝点燃−−→−+ 322O Al 2O 34Al 点燃+7、铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+8、氢气的燃烧: 水氧气氢气点燃−−→−+ O H 2O 2H 222点燃+ 9、木炭燃烧: 二氧化碳氧气碳点燃−−→−+ 22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃−−→−+ CO 2O C 22点燃+ 11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃−−→−+ 22CO 2O CO 2点燃+12、二氧化碳溶于水:碳酸水二氧化碳→+13、生石灰遇水反应:氢氧化钙水氧化钙→+(二)、分解反应:“一变多”1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2Og H 2△2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 23、高锰酸钾加热分解:氧气二氧化锰锰酸钾高锰酸钾加热++−−→−4、氯酸钾与二氧化锰混合加热:5、电解水: 氢气氧气水通电+−−→− ↑+↑222O H 2O2H 通电6、碳酸分解: 二氧化碳水碳酸+→7、碱式碳酸铜(孔雀石)热分解:水二氧化碳氧化铜碱式碳酸铜加热++−−→−8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→− ↑+232O 3Al 4O l A 2通电9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+23CO O a C aCO C 高温(三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”1、 氢气还原氧化铜:铜水氧化铜氢气加热+−−→−+2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温+−−→−+ 金属活动顺序:3、 镁与稀盐酸反应:氢气氯化镁盐酸镁+→+4、 铝与稀盐酸反应:氢气氯化铝盐酸铝+→+5、 锌与稀盐酸反应:氢气氯化锌盐酸锌+→+6、 铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+7、 镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+8、 锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+ 9、 铝与稀硫酸反应:氢气硫酸铝稀硫酸铝+→+10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁+→+11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝+→+12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁+→+13、铁与氯化铜反应:铜氯化亚铁氯化铜铁+→+(四)、复分解反应:1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾+→+2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸+→+3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜+→+4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁+→+5、氧化铁与盐酸反应:水氯化铁盐酸氧化铁+→+6、盐酸与氢氧化钠反应:水氯化钠氢氧化钠盐酸+→+7、硫酸与氢氧化钠反应:水硫酸钠氢氧化钠硫酸+→+ 8、硝酸与氢氧化铜反应:水硝酸铜氢氧化铜硝酸+→+9、氯化钡与硫酸反应:水硫酸钡硫酸氯化钡+→+ 9、氯化钡与碳酸钠反应:氯化钠碳酸钡碳酸钠氯化钡+→+10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠+→+11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+(五)、其他反应: 1、汽车尾气催化转换:氮气二氧化碳一氧化氮一氧化碳+−−→−+铂、钯22dP t P N CO 2NO2CO 2++,2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):水碳酸钙氢氧化钙二氧化碳+→+3、大理石与盐酸反应:二氧化碳水氯化钙盐酸碳酸钙++→+4、甲烷(天然气的主要成分)燃烧:水二氧化碳氧气甲烷点燃+−→−+O H 2CO O 2CH 2224++点燃5、一氧化碳还原氧化铁:二氧化碳铁一氧化碳氧化铁高温+−−→−+ 232CO 32Fe COO e F ++高温6、一氧化碳还原氧化铜:二氧化碳铜一氧化碳氧化铜加热+−−→−+ 2CO u C COCuO ++加热10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵++→+11、硫酸铵与氢氧化钠溶液混合加热:氨气水硫酸钠氢氧化钠硫酸铵△++−→−+(NH 4)2SO 4+2NaOH Na 2SO 4+ H 2O + NH 3·H 2O7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶+−→−+。
常见的化学用语

1、金属活动性越强,越易与酸反应,反应 速度越快,即单位时间内生成的氢气质量 H2 质 越多。 量 2、等质量的不同金属分别与足量的酸反应, 生成氢气质量的多少可由“金属的化合价/ 相对原子质量”比值大小来确定。比值大 的生成氢气多,比值小的生成氢气少。 3、足量的不同金属与等质量的等质量分数 的同种酸反应,生成氢气的质量相等。
5、盐+盐——新盐+新盐 NaCl+AgNO3=AgCl↓+NaNO3 Na2SO4+BaCl2=BaSO4↓+2NaCl
判断下列反应能否发生
①BaCl2 + H2SO4 ②Na2CO3 +HCl ③FeCl3+NaOH ④CuCO3+Ba(OH)2
× ×
⑤K2SO4+ Ba(NO3)2
⑥Na2CO3+ K2SO4
化合物化学式:氯酸钾 KClO3 氯化钾 KCl 锰 酸钾 K2MnO4 硫酸锌 ZnSO4 硫酸 H2SO4 硫酸镁 MgSO4 氢氧化钙 Ca(OH)2 硫酸铜CuSO4 碳酸钙 CaCO3 碳酸 H2CO3 盐酸 HCl 高锰酸钾 KMnO4 酒精C2H5OH 甲烷CH4 氯化钙 CaCl2
13.设问: 氧化钙能和水反应生成氢氧化钙, 那么氧化铜能否和水反应得到氢氧化铜 呢。如不能则怎样设计实验使氧化铜变 成氢氧化铜,写出有关反应的图示式。 方案一: CuO CuCl2 Cu(OH)2
方案二 :
CuO
CuSO4
Cu(OH)2
14.讨论:1.怎样从氧化铁制得氢氧化铁?
2.从氧化铜制取铜可以用几种方法?
“四不像”反应 它不符合四种基本反应类型中任意一种的特征,故不 属于四种基本反应类型: 点燃 1、有机化合物的燃烧 点燃 CH4+2O2 CO2+2H2O C2H5OH+3O2 2CO2+3H2O 高温 2、一氧化碳与金属氧化物的反应 CO+CuO 高温Cu+CO2 3CO+Fe2O3 2Fe+3CO2 3、酸性氧化物与碱的反应 CO2+Ca(OH)2=CaCO3 ↓ +H2O SO2+2NaOH=Na2SO3+H2O
小专题(七) 化学用语-2024-2025学年九年级化学人教版上册
B )
A. 硫元素的质量比为1∶1
B. 氧元素的质量比为5∶6
C. SO2和SO3的分子个数比为5∶8
D. 氧原子的个数比为2∶3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15. (2024·平顶山汝州期中)如图为高效消毒剂过氧乙酸的分子结构
模型,下列有关过氧乙酸的说法,正确的是(
8
9
10
11
12
13
14
15
16
12. (2023·西安一模)当下主流的电动汽车所使用的电池有三元锂电
池和磷酸亚铁锂电池。如图是组成电池的几种元素的相关信息。
第12题
(1) A~D属于不同种元素,它们的本质区别是 质子数(或核电荷
数) 不同。
(2) D是铁原子的结构示意图,则 n = 14 。
(3) 由B和C组成的化合物的化学式为 P2O5 。
A )
A. 过氧乙酸的化学式为C2H4O3
B. 过氧乙酸的相对分子质量为76g
第15题
C. 过氧乙酸中碳元素的质量分数最小
D. 过氧乙酸由2个碳原子、4个氢原子、3个氧原子
构成
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16. (2024·张家口桥西期中)某生产化肥硫酸铵[(NH4)2SO4]的企
)
A. 1
B. 2
C. 3
D. 4
8. 下列化合物中,原子团的化合价为-2的是( C
初三化学化学用语专题复习

初三化学化学用语专题一、基本概念:【概念复习】1、分子:是的最小粒子。
2、原子:是的最小粒子。
分子和原子的本质区别是在中,。
构成原子的三种粒子是、和;其中带正电,带负电荷,不带电荷;在原子中,数= = 。
在原子中,相对原子质量= 数+ 数。
3、离子:带电的原子或原子团叫离子。
常见的原子团有、、、、。
【同步练习】1、下列微粒中,能保持水化学性质的粒子是()A、H2B、O2C、2HD、H2O2、分子和原子的本质区别是()A、分子能构成物质,原子不能构成物质B、分子比原子运动速度慢C、分子在化学变化中可以再分,原子不能D、分子大,原子小3、构成物质的三种基本粒子是、和;例如:二氧化碳是由许多的构成的,钙是由许多的构成的,厨房内的调味品食盐(主要成分氯化钠)则是由和构成的。
【基本概念】4、元素:是具有相同的即的同一类原子总称为元素。
由此可见,元素的种类决定于原子的核电荷数即核内质子数。
【同步练习】4、每个人都有自己独特的气味,训练有素的警犬可以根据人体气味识别犯罪嫌疑人。
请从微观角度分析警犬能闻到犯罪嫌疑人气味的原因是 ( )A.分子的质量小 B.分子不断运动C.分子间有间隔 D.在化学变化中,分子可以再分,原子不能5、元素的化学性质决定于()A、中子数相同B、电子数相同C、最外层电子数相同D、质子数相同6、某矿泉水标签上印有水质成分如下(mg/L):硒:0.013;锶:0.596;锌:0.00162;钠:18.4;钙:4.69。
这里的硒、锶、锌、钠、钙是指()A、原子B、分子C、元素D、电子二、数字的表示意义1、前面的数字:表示微粒(包括分子、原子、离子的个数)▼▼▼化学式、元素符号、离子符号【同步练习】8、用元素符号或化学式及数字表示下列粒子:(1)两个氮分子;(2)三个钙原子;(3)两个水分子;(4)两个铁离子。
(5)两个五氧化二磷分子;(6)三个硫酸根离子。
(7)两个氢氧根离子;(8)两个硫离子。
100个化学用语

100个化学用语1. 元素 (element)2. 化合物 (compound)3. 反应 (reaction)4. 摩尔质量 (molar mass)5. 离子 (ion)6. 氧化还原反应 (redox reaction)7. 酸 (acid)8. 碱 (base)9. pH值 (pH)10. 比例 (proportion)11. 溶解度 (solubility)12. 摩尔浓度 (molar concentration)13. 反应速率 (reaction rate)14. 电子 (electron)15. 原子 (atom)16. 分子 (molecule)17. 质子 (proton)18. 中子 (neutron)19. 原子核 (atomic nucleus)20. 化学键 (chemical bond)21. 氧化物 (oxide)22. 同位素 (isotope)23. 共价键 (covalent bond)24. 电离 (ionization)25. 酸碱中和反应 (acid-base neutralization)26. 氧化剂 (oxidizing agent)27. 还原剂 (reducing agent)28. 化学平衡 (chemical equilibrium)29. 气体 (gas)30. 液体 (liquid)31. 固体 (solid)32. 晶体 (crystal)33. 溶液 (solution)34. 溶剂 (solvent)35. 溶质 (solute)36. 气相反应 (gas phase reaction)37. 液相反应 (liquid phase reaction)38. 固相反应 (solid phase reaction)39. 热力学 (thermodynamics)40. 热化学 (thermochemistry)41. 反应热 (heat of reaction)42. 反应速率常数 (rate constant)43. 化学平衡常数 (equilibrium constant)44. 摩尔吸光度 (molar absorptivity)45. 粒子 (particle)46. 势能 (potential energy)47. 动能 (kinetic energy)48. 熵 (entropy)49. 热力学第一定律 (first law of thermodynamics)50. 热力学第二定律 (second law of thermodynamics)51. 热力学第三定律 (third law of thermodynamics)52. 混合物 (mixture)53. 纯净物 (pure substance)54. 气压 (pressure)55. 温度 (temperature)56. 焓 (enthalpy)57. 熵变 (entropy change)58. 反应机制 (reaction mechanism)59. 活化能 (activation energy)60. 化学反应速率方程式 (chemical reaction rate equation)61. 反应物 (reactant)62. 生成物 (product)63. 离子键 (ionic bond)64. 配位化合物 (coordination compound)65. 配位数 (coordination number)66. 配位键 (coordination bond)67. 有机化合物 (organic compound)68. 脂肪酸 (fatty acid)69. 酶 (enzyme)70. 催化剂 (catalyst)71. 氧化数 (oxidation number)72. 核磁共振 (nuclear magnetic resonance)73. 质谱 (mass spectrometry)74. 紫外可见光谱 (UV-Visible spectroscopy)75. 傅里叶变换红外光谱 (Fourier-transform infrared spectroscopy)76. 光谱学 (spectroscopy)77. 色谱法 (chromatography)78. 离子交换 (ion exchange)79. 电解质 (electrolyte)80. 燃烧 (combustion)81. 氧化 (oxidation)82. 还原 (reduction)83. 烷烃 (alkane)84. 烯烃 (alkene)85. 炔烃 (alkyne)86. 醇 (alcohol)87. 酮 (ketone)88. 醛 (aldehyde)89. 酯 (ester)90. 脂肪 (fat)91. 蛋白质 (protein)92. 糖 (sugar)93. 碳水化合物 (carbohydrate)94. 脂质 (lipid)95. 核酸 (nucleic acid)96. 聚合物 (polymer)97. 合成 (synthesis)98. 分解 (decomposition)99. 双键 (double bond) 100. 三键 (triple bond)。
化学用语集锦

化学用语1.无机转化= △ 点燃高温放电通电电解光照催化剂MnO 2微热撞击引爆煅烧△催化剂△MnO 2△铂 通电熔融 催化剂△25△催化剂催化剂500℃ 30MPa△催化剂光TiO 2Clhv充电放电充电通电冰晶石正反应2细菌紫外线△加( )2.有机转化→ △光照 点燃 高温 水浴 催化剂 FeBr 3CCl 4KMnO 4/H +△Ni △Cu△水△乙醇H +△催化剂△△浓硫酸浓硫酸170℃△ △加热 加压催化剂Cl 2光照Ni /△H 2CCl 4Br 22FeBr 3Cu /△O 2水/△NaOH乙醇/△NaOH催化剂/△2 催化剂/△2浓硫酸/△3①②③ⅠⅡⅢNaOH/H 2O-H +3.离子符号24SO - 23SO - 23CO - 3HCO - 4NH + 3NO -4MnO - 2AlO - NH 3·H 2O2AlO - 4Al(OH)- 23CO - 3HCO - 224C O - 24HC O - 3ClO - ClO - 4ClO - 2ClO - 227Cr O - 24CrO - CN - 24FeO - 3IO - 4MnO - 4NH + 3NO - 2NO - 34PO - 24HPO - 24H PO - 3IO - 24SO - 23SO - 3HSO - 223S O - 23SiO - SCN - 3I - 22C - 22O - 22S - 24S - 246S O - 228S O - 3H O + 2O - 2NH -32Ag(NH )+ 4Al(OH)- 36AlF - 234Cu(NH )+ 24CuCl - 2Fe(SCN)+32[Ag(NH )]+ 4[Al(OH)]- 36[AlF ]- 234[Cu(NH )]+ 24[CuCl ]- 226[Co(H O)]+ 24[CoCl ]- 36[Fe(SCN)]- 24[Zn(OH)]-4.电子式HNOF NaMgAlSClH HCl ClN N H Cl H O H H N H HO C O H O O H H O ClH C H H H H C H H C H HHH CH C H HH CC H H N H N H HCl C Cl ClClF B F FH Si H HHClNaO H NaO2NaNa NaO O2Na2ClMgClCl H N H HHCl+H Cl Cl+ClNaNa 2MgO25.结构式H H Cl Cl N N H O H H S H H O O H H O Cl O C O S C S C N HH N H H H N N H H H H C H H H Cl C Cl ClCl H C Cl Cl H Cl C Cl H H H O H H N H H F B F F H C H H H Cr O O O O OCH 3CH CH 3CH 3 CH 2CHCH 3CH 3CH 3 CH C CH 3CH 3CH 3CH 3CH 3 CH 2C CH 3C 2H 5CH 3CH CH 3CH 3CH 2C CH CH 3CH 2 CH 2C C CH 3CHCH 2CH 2Br Br CH 2CH 2OH OH CHO CHO COOH COOH C C OO OO CH 2CH 2 C H 2C H 2COOH COOH C H C H COOH COOH CH 2CH COOH COOH O HO CH 3C O CH 3C OCH 2CH 2CH 2OHCH 2ClH C O H CH 3C O H H C O OH CH 3C O OH C C O OH O O H CH 3C O CH 3 CH CH 3COOH OHCH C O H CH 2OH CH 2OH CHO COOH COOHOHCOOH O COOH C CH 3O O CH 3C CH OCHCH 3 6.原子示意图1122 3126427528629721082118211282213823 14824158251682617827188287.结构模型8.特殊方程【氧 还】Cu +HNO 3-Cu(NO 3)2+NO ↑+C + 4HNO 3(浓)CO 2 + 4NO 2 + 2H 2O 4e -△MnO 2 + 4HCl(浓)△--MnCl 2 + Cl 2 + 2H 2OFe 2O 3 + 3C O2Fe + 3CO 2-得2×3e -△Fe + CuSO 4--FeSO 4+ Cu【电化学】 Zn -2e -=Zn 2+ 2H ++2e -=H 2↑ H 2-2e -+2OH ―=2H 2O O 2+2H 2O +4e -=4OH -H 2-2e -=2H +O 2+4H ++4e -=2H 2O2Cl ――2e -=Cl 2↑ Li -e -=Li +C 6Li -x e -=C 6Li 1-x +x Li +【电解】2H ++2e -=H 2↑ 2H 2O +2e -=H 2↑+2OH ―4OH ――4e -=O 2↑+2H 2O 2H 2O ―4e -=O 2↑+4H +【热化学】 2H 2(g)+O 2(g)=2H 2O(l);△H =-592 kJ/mol H 2(g)+12O 2(g)=2H 2O(l);△H =-286 kJ/molCH 4(g)+2O 2(g)=CO 2(g)+2H 2O(l);△H =-893 kJ/mol 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小专题化学用语
(1)化学用语包括的内容:
①化学用语包括:元素符号、离子符号、化学式、化合价、化学方程式、离子反应方程式及用来说明元素符号、离子符号、化学式、化学方程式、离子反应方程式含义的语言,都称为化学用语。
②用来表示微粒结构的图形、图示;如表示分子结构模型、原子结构示意图都属于化学用语。
(2)通常所指的化学用语,主要是指元素符号、离子符号、化学式、化学反应方程式。
元素符号:以H和Fe为例说明元素符号的意义
元素
符号
宏观微观
含义
数量
注意
H 氢元素一个氢原子 2 /
Fe
①铁
②铁元素
一个铁原子 3 / 2H / 两个氢原子1当元素符号的前面
有化学计量数时,
只有微观意义,而
无宏观意义,且涵
义数量为1 2Fe / 两个铁原子 1
化学式
1.以H2和H2O为例说明化学式的意义
化学式宏观微观
含义
数量
注意
H2氢气一个氢分子 2 /
H2O
①水
②由氢元素和
氧元素组成
①一个水分子
②一个水分子由两个
氢原子和一个氧原子
构成
4 /
2H2/
①两个氢分子
②每个氢分子由两个
氢原子构成
2
当化学式的前面
有化学计量数
时,只有微观意
义而无宏观意义2H2O /
①两个水分子
②每个水分子由两个
氢原子和一个氧原子
构成
2
2.化学式中数字表示的意义(以水为例)
离子符号的意义(以Mg2+、SO2-4为例)
结构图、图示、模型和相关意义(常考点) 1.原子结构示意图(以镁原子为例)
2.图示元素周期表中表格(以镁为例)
化学方程式(必考点)。
