金属的防护和回收1
金属的回收以及金属资源的保护

金属的回收以及金属资源的保护
展开全文
金属资源可以说是人类生产生活中非常宝贵的资源,金属的回收已经成为了一种金属再利用的方式之一,今天我们就来学习金属资源的回收以及保护措施。
【金属保护定义】
金属回收是指从废旧金属中分离出来的有用物质经过物理或机械加工成为再生利用的制品。
是从回收、拆解、到再生利用的一条产业链。
【金属资源的保护措施】
1.减缓或防止金属的腐蚀;常用的方法有:
(1)用完铁制品后及时擦洗干净,置于干燥的环境,保持其表面的洁净、干燥.
(2)在铁制品表面涂上一层保护膜.例如,机械零件等表面涂油,家用电器、自行车车架、钢窗等表面刷漆,等等.
(3)在铁制品表面进行烤蓝、煮黑等处理(使其表面形成一层致密的四氧化三铁薄膜).例如,锯条、链条等.
(4)在铁制品表面镀上一层其它金属.例如,自行车车把、钢圈以及门把手和水龙头等表面上,经常镀锌、锡或铬等.
(5)改变铁制品的内部结构,将其制成不锈钢等合金.
2.回收利用废旧金属,这样不仅可以节约金属资源,而且还可以减少对环境的污染.
3.有计划、合理地开采矿物,严禁不顾国家利益的乱采矿.
4.寻找金属的代用品,例如,现在经常用塑料来代替钢和其它合金制造管道、齿轮和汽车外壳等.
【金属回收优点】
金属资源面临枯竭,保护金属资源的有效途径之一就是回收再利用,其中回收废旧金属的好处有节约金属资源、减少环境污染、节约能源
【金属回收意义】
资源再利用,减少金属对污染环境。
通过这篇文章我们可以知道金属资源保护的必要性和可行性,我们在平常生活中就可以做到这些金属保护,同时,我们在生活中可以将金属保护这部分的知识加以学习和掌握。
九年级化学金属的防护和回收1

九年级化学金属的防护和回收1

第三节 金属的防护和废金属回收(课件1)

铝的“自我保护”
铝在空气中与氧气反应,在铝的表面 生成一层致密而结实的氧化铝膜,阻 止铝继续与氧气反应,从而起到“自 我保护”的作用。
P129
废金属的回收利用
1、废金属 废金属主要是指冶金工业、金属加工业形成的 金属碎屑、碎块,日常生活中锈蚀和报废的金 属器具。 2、废金属的危害 (1)造成资源浪费; (2)污染环境。如:废旧电池中的镉、汞等 有毒金属会污染环境。
我会做
1、通过实验回答,铁钉在下列哪些情况下容易生锈?
(1)在干燥的空气中 (2)在潮湿的空气中 (2)、(3)、
(3)部分浸入食盐水中
(4)浸没有植物油中 2、下列做法能防止铁制品生锈的是( A、自行车脏了用清水冲洗 B、用废酸液冲洗铁制污水管道 C、在铁制篮球架上刷一层油漆 D、切完咸菜后,尽快将菜刀洗净擦干 C、D )
二、金属资源保护
(1)防止金属腐蚀
(2)回收和利用废旧金属
你知道吗?
据估算,回收一个铝制饮料罐比制造一个新饮料罐 要便宜20%,而且还可节约金属资源和95%的能源。1t废 钢铁回炉冶炼可炼成近1t的钢,跟用铁矿石冶炼比,能 节约11t煤和铁矿石,减少污染空气的悬浮微粒11kg。 目前世界上已有50%以上的铁的90%以上的金属得到了回 收利用。 废旧金属的回收利用还可以减少对环境的污染。例 如,废旧电池中含有汞等,如果废旧电池随意丢弃,汞 等渗出会造成地下水和土壤的污染,威胁人类健康。如 果将汞等回收利用,不仅可以节约金属资源,而且还可 以减少对环境的污染。
讨论
废弃金属的回收有什么意义?
可节约金属资源 由于金属冶炼需在高温下进行,回收废
弃金属并再利用可节约能源
降低金属制品的生产成本,可方便人们
金属的防护与回收
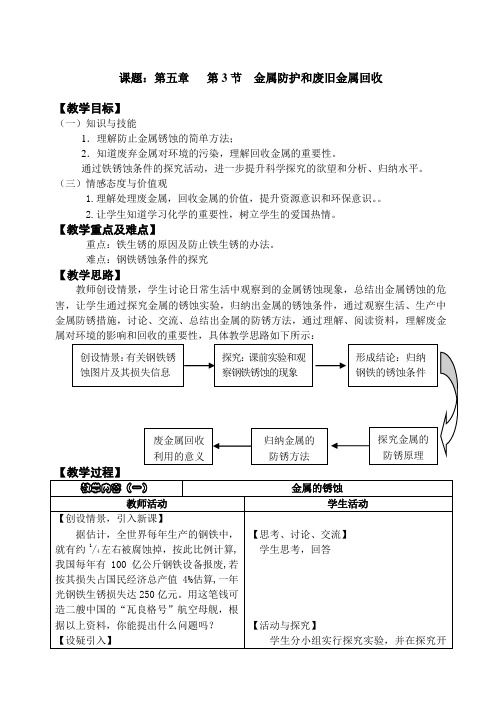
课题:第五章第3节金属防护和废旧金属回收【教学目标】(一)知识与技能1.理解防止金属锈蚀的简单方法;2.知道废弃金属对环境的污染,理解回收金属的重要性。
通过铁锈蚀条件的探究活动,进一步提升科学探究的欲望和分析、归纳水平。
(三)情感态度与价值观1.理解处理废金属,回收金属的价值,提升资源意识和环保意识。
2.让学生知道学习化学的重要性,树立学生的爱国热情。
【教学重点及难点】重点:铁生锈的原因及防止铁生锈的办法。
难点:钢铁锈蚀条件的探究【教学思路】教师创设情景,学生讨论日常生活中观察到的金属锈蚀现象,总结出金属锈蚀的危害,让学生通过探究金属的锈蚀实验,归纳出金属的锈蚀条件,通过观察生活、生产中金属防锈措施,讨论、交流、总结出金属的防锈方法,通过理解、阅读资料,理解废金属对环境的影响和回收的重要性,具体教学思路如下所示:教学内容(二)防止金属锈蚀的方法教师活动学生活动【演示实验、激发兴趣】在切过咸菜的铁质菜刀同一面上选相近三处实行以下实验:一处(a处)用湿棉球润湿另一处(b处)用干布擦干。
第三处(c处)用干布擦干后,涂上一层食用油。
放置一昼夜,猜猜菜刀三处表面有何变化?然后展示菜刀【提出问题】根据以上实验,并结合日常生活中观察,你能总结出防止铁生锈的办法吗?【小结并板书】钢铁的防锈方法。
【创新应用】1、自行车是人们常用的交通工具,请按以下要求,回答以下问题。
(1)自行车的主要零件是由 (填“生铁”或“钢”)制造的。
(2)请写出自行车上各部分零件都采用了什么防锈方法?(3)被雨水淋湿的自行车能否直接用带油的布擦?为什么?2、如下图,取一团光亮无锈的铁丝绒,放入一支洁净试管底部,将试管倒放在盛水的烧杯里。
数天后,能观察到的现象是。
【交流、思考、讨论】学生通过观察实验现象,思考、讨论,分析原因。
【交流、讨论】分组交流、讨论,然后小组汇报同学们讨论的结果。
钢铁的防锈方法:(1)“洁身自好”:保持铁制品表面的干燥和洁净。
金属的防护和回收PPT课件1

开后发现袋里有板结的铁锈。试推测粉
末状物质是什么?其作用原理是什么?
二、废金属的回收和利用
废金属,一般是指废钢铁、废有色金属,废稀有、贵 重金属和报废的汽车、锅炉、机电产品及设备等。 废金属弃置不用,不仅是资源的极大浪费,而且占用土地, 污染环境。 回收废旧金属,不仅可以 节约矿产资源、节约能源,还 能防止污染环境。 另外,寻找金属的替代品也 可节约金属资源。
交流自己对钢铁锈蚀的主要因素的猜想,
并尝试设计实验方案来证明你的猜想。
的实验方案
铁放在干燥空气中 铁浸没在冷却的沸水中
可能与O2 、水 铁一半浸在水中 共同作用 可能与氯化钠等 铁一半浸在食盐水中 反应 可能与酸反应 附硫酸的铁在空气中
具体操作
稀H2SO4中 食盐水中 一半在水中 全浸在水中 干燥空气中
避免钢铁与氧 气、水接触
改变钢铁的内部结构
钢 铁 防 锈 的 方 法
提问: 氧化铁能像铝壶表面的氧化
铝膜一样阻止铁继续生锈吗?
氧化铝 (Fe2O3) (Al2O3)
结构特点
若不除去结果 疏松多孔 完全锈蚀 致密结实 使铝“自我 保护”
铁锈
铁生锈的应用:
食品包装盒中常放有一小袋粉末状物 质,该物质对食品同时具有防潮和防氧 化作用。玲玲同学从超市购买的食品包 装盒中取出装有粉末状物质的小袋,撕
§5-3金属的防护和回收
北京新东方程传功
全世界每年被腐蚀损耗的钢铁材料大 约占年产量 十分之一
我国每年因为金属腐蚀所造成的经济损
失约占国内生产总值的3~4%,如1995年
我国的金属损失约为1500亿元。那么 如何防止钢铁腐蚀显然是一个意义十分重大 的课题。
一、钢铁的锈蚀及其防护
九年级化学《金属的防护和回收》课件_1

第十三页,共二十二页。
思考题
自行车是常用的代步工具,因为长期在室外使用,容易生锈,现在就这个问题 进行探讨.
(1)工厂(gōngchǎng)在设计和生产过程中,已经考虑过防止生锈的问题,做了许多特别
设计,请你指出两例:
.
(2)自行车链条是最容易生锈的部件,工厂在生产链条时,已经在其表面做
了烤蓝(在表面生成一层致密的氧化膜四氧化三铁),而在使用时,还是最易
Ag Sn Au Pb Zn Cu 16年 17年 26年 26年 27年 42年
Fe Al
195年 257 年
另据估算,回收一个铝制饮料(yǐnliào)灌比制造一个饮料(yǐnliào) 灌要便宜20ห้องสมุดไป่ตู้,节约能源95%;而随意丢弃废旧电池会使其
中的汞、镉、铅等金属造成水土污染,威胁人类健康。合理 开采使用金属资源是人类面临的共同问题。
探究实验(shíyàn)一:铁生锈的条
件 一半在水中
全浸在水中
干燥空气中
第六页,共二十二页。
三天 后 (sān tiān)
一半在水中
全浸在水中
干燥空气中
铁在空气 、水 (kōngqì) 的界面处生
铁未生锈
铁未生锈
(shēnɡ xiù)
锈
结论: 铁生锈的条件:与水和氧气同时接触
第七页,共二十二页。
探究 实验二: (tànjiū)
稀H2SO4中
食盐水中
一半在水中
第八页,共二十二页。
三天 后 (sān tiān)
稀H2SO4中
食盐水中
一半在水中
铁钉严重 (yánzhòng)锈蚀
浸没在食盐 水中的铁钉 几乎(jīhū)完 全锈蚀
5.3 金属的防护和回收 PPT课件1

病情分析
这种病不仅在铁,而且在 金属家庭中都普遍存在, 这种病叫“生锈”。
我查了资料: 可铁为什么会“生衣”呢? 锈,铁生衣也 ——《集韵》
大家来看我的实验吧!
现在你们知道铁为什么会 生锈了吧!
铁生锈是铁、氧气和水相互 作用,发生一系列的复杂的 化学反应。 是一个缓慢氧化的过程
铁 铁 锈
(1)实验较长时间后,发现 试管中的光亮铜 片最先生锈(填字母编号)。 (2)从优化实验的角度考虑,A实验是多余的,他 只考虑了水这个单一条件。C试管中除光亮铜片 、蒸馏水外,还有的另外一种物质为 。 (3)D试管中除光亮铜片外,还有的另外两种物质 ,为 ;从D试管的实验中,获得的结论 是 。
[评价与改进]我认为以上设计的“铜片锈蚀条件 的探究”实验不够完善,要得出正确结论,还要 补充的一个实验是(可图示) 。 [反思与小结]通过铜片锈蚀条件的探究实验,我 获得的番了 ,再见!
通过小铁钉的故事, 我学到了很多知识, 同学们,你们呢?
1、铁生锈的因素 2、铁的防锈措施 3、废金属的回收利用
考考你
水中的铁管哪一处最先生锈?
c
b
a
考考你
懒羊羊,你吃的一些食品包装袋 中常放一袋粉末状物质,该物质 对食品有防潮和防氧化的作用。 你知道这些粉末状物质是什么? 它的作用是什么吗?
这些废金属如果不回收利用,有可能 真的变成废品,还会带来危害:
1.造成资源浪费; 2.污染环境
废金属的回收利用
据报道:目前全球钢产量的45%是通过 对废钢的冶炼来完成的,全球铜产量的 40%是通过对废铜的冶炼完成的。“九 五”期间,我国累计回收利用废钢铁1.6 亿吨,相当于节约成品铁矿石3.2亿吨, 节约标准煤6400万吨,目前我国金属产 品三分之一以上的原料来自再生资源。 1.节约资源 2.减少污染,保护环境
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
※钢铁有什么用途
※上节课我们学习了
工业炼铁和炼钢的原 理,请同学们回忆一 下有关的知识。
面临钢铁的最大问 题是什么呢?
第三节
金属的防护和回收
据估计,全世界每年被腐蚀损耗的钢铁 材料,约占全年钢铁产量的十分之一
金属锈蚀给人类带 来了巨大的损失。
我国每年因为金属腐蚀所造成的经济损 失约占国内生产总值的3~4%,如1995年 我国的金属损失约为1500亿元。那么 如何防止钢铁腐蚀显然是一个意义十分重大 的课题。
1、在潮湿的空气中铜与氧气、 水、 二氧化碳等作用生成了 铜绿。 推理依据是按铜绿的 化学式可知:铜绿含C、H、 O、Cu四种元素, 若无空气 中的O2、H2O、CO2 等对铜 发生作用则铜绿中不可能含O、 C、H等元素。用白醋浸泡可 除去铜锈。 2、不能。钢丝球会破坏铝锅表 面的致密氧化物保护膜,会加 速铝锅腐损。应改用洗洁精浸 洗等方法
怎样才能防止钢铁锈蚀?请说出你的看 法和你所知道的各种防锈方法,并跟同学们 交流、讨论,然后尝试对这些方法进行分类
铝比铁更容易跟氧气和其他物质发生化学反应。铝在空气中与 氧气反应,生成的氧化铝形成一层致密而结实的膜覆盖在铝的表面, 防止铝继续与氧气反应,从而起来“自我保护”的作用
所谓“电化铝”是指用特殊 方法十铝表面形成加厚的氧 化铝保护层的铝材料。
铁锈成分复杂,主要是氧化铁 它是一种疏松多孔的物质
铁锈这种多孔性的物质,能让水分和空气穿过
它的空隙,不断向里层渗透,继续跟铁反应,直至铁 被完全锈蚀。
钢铁还会被环境中的其他物质锈蚀
在切过咸菜的铁质菜刀同一面上选相 近的三处进行下列实验
一处:用湿棉球湿润;
一处:用干布檫干 一处:用干布檫干后,涂上一层食油;
据估算,回收一个铝制饮料罐比制造一个新 饮料罐要便宜20%,而且还可节约金属资源和 95%的能源。1t废钢铁回炉冶炼可炼成近1t的钢, 跟用铁矿石冶炼比,能节约11t煤和铁矿石,减少 污染空气的悬浮微粒11kg。目前世界上已有50% 以上的铁的90%以上的金得到了回收利用。
讨 论
废弃金属的回收有什么意义?
改变钢铁的内部结构
提问: 氧化铁能像铝壶表面的氧化
铝膜一样阻止铁继续生锈吗?
氧化铝 (Fe2O3) (Al2O3)
结构特点
若不除去结果 疏松多孔 完全锈蚀 致密结实 使铝“自我 保护”
铁锈
铁生锈的应用:
食品包装盒中常放有一小袋粉末状物 质,该物质对食品同时具有防潮和防氧 化作用。玲玲同学从超市购买的食品包 装盒中取出装有粉末状物质的小袋,撕
课堂小结
一、钢铁的锈蚀及其防护 1、钢铁锈蚀的原因: (1)主要是铁与水、氧气、二氧化碳等物质的作用 (2)铁还会被环境中的其他物质锈蚀 2、防止钢铁生锈的常见做法: (1)在钢铁表面覆盖保护层。(例如:喷涂油漆、涂防锈油、烧涂搪等。) (2)镀上其他金属作为保护层。(例如:镀锡、镀锌、镀铬等) (3)其他方法。{例如:防锈纸、表面发黑(发蓝)处理、改变金属成分 (如不锈钢)等等。} 二、废金属的回收和利用: 1、废弃金属的危害 (1)极大的资源浪费 (2)严重的环境污染 2、回收金属的重要意义 节约矿产资源、节约能源等。
诊断补偿,点击中考
课堂评价练习
1、下列家庭生活垃圾:①废旧书刊报纸 ② 废电池 ③废弃橡胶、塑料制品 ④易拉罐饮 料瓶 ⑤废弃电线 ⑥破旧铁锅、铝壶 ⑦变质 剩饭菜 ⑧瓜皮果壳 ⑨废弃玻璃物品等,其 ①②③④⑤⑥⑨ 中可回收利用的有________。回收 ②④⑤⑥ 利用与保护金属资源的相关联的是___。
怎么防止钢铁的生绣呢? 镀铜
在 车 船 的 表 面 喷 油 漆
在机械表面涂防锈油
此外,还可以在钢 铁表面镀上一层能 起保护作用的其他 金属。 如:在钢铁表面镀 锡、镀锌、和镀铬
在面盆、杯子、 等表面烧涂搪瓷
人们通常采用在钢铁的表面覆盖保护层的方法来 防止钢铁生锈。
防锈方法
⑴. 加上油漆、塑胶层 或涂油等
金属资源保护 矿物的储量有限,而且不能再生。根据已探明的一些矿物的 怎样保护金属资源? 储藏量,并根据目前这些金属的消耗速度,有人估计一些矿物可 (1)防止金属腐蚀 供开采的年限如下图所示(不包括今后新探明的矿物储量、一些 国家的金属储备量和金属的回收利用等)。 (2)回收和利用废旧金属
你知道吗?
铁钉沾了酸液: 铁钉严重锈蚀
铁钉浸没一半的在食盐水中:浸没在食盐水中的铁钉几乎全部生锈
铁钉浸没一半在水中: 铁在空气、水的界面处生锈 铁钉完全浸没在煮沸的水中: 铁未生锈 铁钉放在干燥的空气中: 铁未生锈
在空气中锈蚀,实际上是铁跟氧气、 水等物质相互作用,发生一系列复 杂的化学变化,使铁转化为铁的化 合物的过程
探究性学习作业 丽江的交通栅栏是铁条焊接在一起的,但使用一段时间后 就会生锈,为了使它有比较长的使用寿命,需要采取防锈 措施。你的假设:铁栅栏生锈的 原因、 、 。 你的方案:针对这些原因,可采取下列措施。 第一步: 。 第二步: 。 第三步: 。
1、在下列情况下,埋在地下的铸铁管道腐蚀最快的是( C)
A、在潮湿、致密的土壤中 B、在干燥、致密的土壤中 C、在潮湿、疏松的土壤中 D、在干燥、疏松的土壤中 2、下列物品需采用防锈措施的是( A ) A铁制防盗网 B不锈钢菜刀 C铝合金窗 D、金戒指 3、日常生活中的一些铁制品经常会被锈蚀。下列做法不能起防锈 作用的是 ( B) ①在铁制品表面镀锌。②在铁制品表面涂油脂。③保留铁件表 面的铁锈作保护层④在铁制品表面刷油漆⑤自行车脏了用清水洗 ⑥用废酸液冲洗铁制污水管道⑦切完咸菜后,尽快将菜刀洗净擦 干。 A、②⑤ B、③⑤⑥ C、①③⑦ D、②⑥⑦
⑵.镀上耐磨或耐腐蚀的金 属, 如镀镍、铬或锡等
⑶. 通过化学反应在铁制 品表面生成一层致密的 氧化物薄膜(如烤蓝)
⑷.在铁中加入其它金属 改变其内部结构,制成 铁合金(如不锈钢)
自行车支架、链条、钢 圈分别采用了什么 防锈措施?
支架除了防锈还需要美观,一般用喷漆的方法。 链条最易磨损,常常涂上润滑油的方法来防锈。 钢圈要求美观耐磨,常镀上耐磨的金属铬。Biblioteka 铁轨的锈蚀铁钉的生锈
各种铁制品的锈蚀
如何防锈
为了减少损失, 需要探究金属锈 蚀的原因、防护 的方法和废金属 的回收利用
关于钢铁锈蚀,你可能看到 过一些事实,做过一些实验,把 你知道的钢铁锈蚀的主要因素跟 同学们交流
研究性学习:铁的生锈过程
看看课本的活动与探究
探索求真
我的猜测
可能与O2反应 可能与水反应
量的不断增加,再生利用废旧金属对于缓解资源短
缺具有重要作用,意义深远。
(1)防止金属腐蚀 (2)回收和利用废旧金属 (3)计划、合理开采矿物 (4)寻找金属的代用品
通过调查或查阅有关资料,了解: 1、废金属会对环境产生那些危害? 2、调查当地(或你家中)有那些废金属。 估算一下在一年内当地(或你家中)大约可产生多少废金 属?并了解废金属的回收和利用的情况(或提出回收利用 的方案与建议)
我设计的实验方案
铁放在干燥空气中 铁浸没在冷却的沸水中
可能与O2 、水 铁一半浸在水中 共同作用 可能与氯化钠等 铁一半浸在食盐水中 反应 可能与酸反应 附硫酸的铁在空气中
具体操作
稀H2SO4中 食盐水中 一半在水中 全浸在水中 干燥空气中
一周后
稀H2SO4中 食盐水中 一半在水中 全浸在水中 干燥空气中
金属的防护
(1)隔绝开空气或氧气
钢 铁 防 锈 的 方 法
(2)隔绝与水接触 具体方法:
通过学习, 我知道了。 我开小结 防止钢铁 生锈方法
1.“穿外衣”——加一层保护 膜(如:刷油漆、涂油、电 镀、致密的氧化膜)
2.“打强心针”——在铁中加 入其它金属改变其内部结构, (如:制成不锈钢) ①隔绝空气 防止铁生锈的原理 ②隔绝水 --就是破坏铁生 锈的条件
加快铁生锈速率的情况
离子化合物的存在 (氯化钠) 酸性污染物的存在 (酸雨) 高溫 (加快化学反应速度) 经刮擦或凹凸扭曲 表面(增加接触面) 与活泼性较低金属 接触(置换反应)
加快生锈 速度
想一想
阅读教材P18页,回答下列问题: 1、试管Ⅱ中为什么要用煮沸过的蒸馏水,且要 加入植物油? 是为了防止蒸馏水中溶有氧气。 2、铝与氧气反应生成的氧化铝能起到保护里层 铝的作用。铁锈是否也能保护里层的铁呢? 不能,因为铁锈是疏松的。 3、你能否根据铁生锈的条件提出防止铁制品生 锈的原理吗?
课堂练习
1、 小明发现家里的铜器表面 生了一层绿色物质,用小刀刮 去后见到原来红色的铜。 小 明去问老师,老师告诉他这是 铜生了, 这层绿色物质叫 “铜绿”, 学名叫“碱式碳酸 铜”, 化学式为 : Cu2(OH) 2CO3。据此你能帮助小明分析 铜器生锈的原因吗?你的推理 依据是什么?你如何帮助小明 将铜器上的锈除去? 2、家用铝锅内的脏物能用 钢丝球擦洗吗?为什么?
放置一昼 夜,观察 菜刀三处 表面发生 的变化
与空气(氧气)接触 与水接触
结
论:
1 .铁生锈是铁与氧气、水等物质相互 作用。(缓慢氧化,放热)
2.在有盐和酸性条件下会加快生锈速率
3 .铁锈(混合物)的主要成分是氧化 铁Fe2O3,红棕色.
在水、氧气同时存在的环境中铁能锈蚀。
铁锈-------混合物 (主要成分Fe2O3 · xH2O)
③隔绝水和空气 ④ 改变内部结构
合作探究
观察家庭小实验的现象,合作讨论防止金 属腐蚀的方法,并对这些方法进行分类。 1.保持钢铁制品 避免钢铁与水接触 表面洁净、干燥 2.在钢铁表面覆盖保护 层:涂防锈油、喷涂油漆、 烧涂搪瓷、镀一层起保 护作用的其他属。 3.在钢铁中加入铬、 镍等(不锈钢)
避免钢铁与氧 气、水接触
开后发现袋里有板结的铁锈。试推测粉
