物质溶解性大小的比较方法和规律
溶解性
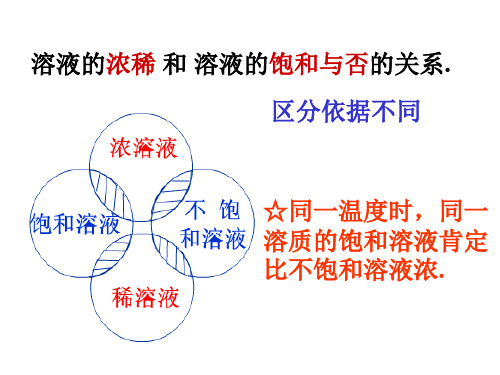
三定状态——达到饱和
四定单位——克(g)[溶质的质量]
判断下列说法是否正确?说明理由。
1、20℃时,10克氯化钠可溶解在100克水中,所以 20℃时,氯化钠的溶解度是10克。 2、 20℃时,把10克氯化钠溶解在水中制成了饱和 溶液,所以20℃时,氯化钠的溶解度是10克。 3、把20克某物质溶解在100克水里,恰好制成了饱 和溶液,这种物质的溶解度就是20克。
1、下列关于饱和溶液的叙述正确的是:
A 浓溶液不一定是饱和溶液,但饱和溶液 一定是浓溶液 B 固体物质的饱和溶液, 加入少量溶质 后,其质量不变
C 在一定温度下,某物质的饱和溶液溶解 该物质的量达到饱和 D 饱和溶液升温时一定变成不饱和溶液
2、20℃时,向50克硝酸钾溶液中加入5克硝 酸钾晶体,充分搅拌后,尚有部分晶体未溶 解。稍加热后,晶体全部溶解。下列说法正 确的是: A 搅拌加热前一定是饱和溶液 B 搅拌加热前一定是不饱和溶液 C 加热后一定是饱和溶液 D 加热后一定不是饱和溶液
5、两条曲线相交,交点的含义为在该点所对 应的温度条件下,两种物质具有相同的溶解 度。
6、从溶解度曲线的走势可以看出:
A 大多数固体物质的溶解度随温度的升高而 增大 (硝酸钾、氯化铵) B 少数固体物质的溶解度受温度变化的影响 很小 (氯化钠) C 极少数固体物质的溶解度随温度的升高 而减小 (熟石灰)
6、夏天,养鱼的池塘里,经常会有鱼浮上 来(浮头),这是因为什么? 7、喝汽水以后,为什么会打嗝? 8、“开水不响、响水不开”是什么道理?
2、横坐标是60、纵坐标是110的点表示意义
3、70℃时,100g水中最多能溶解多少g的氯 化铵?得到多少的饱和溶液? 4、氯化钾在20℃时的溶解度?90 ℃时的溶 解度?增加了多少?说明了温度升高对氯化 钾的溶解度有什么影响?
溶解度大小比较规律

溶解度大小比较规律
化学中溶解度是指溶剂中加入某一特定物质以后,可以完全溶解,而产生的溶液的浓度.可以把溶解度定义为将1克的溶质在特定温度、特定的溶剂中完全溶解,且溶液浓度无太
大变化的所需溶剂的量.通常说的溶解度,是指在特定温度和溶剂条件下,将1克溶质放
入100毫升溶剂中,做出之间完全溶解而得到溶液的浓度。
根据溶质的性质不同,溶解度是可以有区别的。
首先,溶质的电荷特性是影响溶解度
的主要因素。
以氯化钠(NaCl)为例,氯化钠分子中的阴离子氯和阳离子钠使溶质产生
了有机整体,它们之间相互作用,会造成溶质更容易溶解。
而非阳离子性溶质,例如脂肪,会比较难被溶解。
其次,温度也会影响到溶解度。
一般来说,随着温度的升高,溶解度也会随之增加,
这是因为温度升高时,溶质分子所受的粘附力因子会减弱,溶质往往会更容易溶解。
总的
来说,在给定的温度下,溶质的溶解度会随着溶质的官能团的电荷量变化而变化。
此外,有些溶质和溶剂之间可能有化学反应,也会影响溶解度。
这是因为有些溶剂和
溶质在溶解过程中可能会发生反应,产物可以维持一定的稳定性和溶解度,使溶质的溶解
度受到影响。
总的来说,各种溶质的溶解度大小规律是:电荷越大,溶解度越高;官能团的电荷量大,溶解度越高;如果溶剂中有可以与溶质发生反应的物质,则溶质的溶解度会发生变化,反应后可能会提高或降低溶解度;随着温度升高,溶解度会增加。
物质溶解性大小的比较方法和规律

物质溶解性大小的比较方法和规律陕西吴亚南主编物质的溶解性大小到底和什么有关,存在什么样的规律可循,有什么好的方法来区分和记忆,作为一个中学生是迫切想知道的,现就此问题总结如下。
一、常见酸碱盐在水溶液中的溶解性(口歌)钾,钠,铵,硝酸,醋酸,碳酸氢盐都是可熔盐,硫酸盐里除去Ba,Ag,Ca和Pb碳酸盐里除去钾钠铵其它都是不熔盐氯化物中只有银沉淀可溶碱有4种钾,钠,钡和铵二、相似相溶原理:溶质与溶剂在结构上相似。
可理解为极性相同的物质间一般易于相溶。
有机物质易溶于有机溶剂,通常难溶于水。
无机物在有机溶剂中一般难溶。
如:氯化钠在水中易溶,但在酒精中却能形成胶体三、物质的分子可与水分子间形成氢键时加大其溶解性。
如:NH3,C2H5OH,CH3OH四、常温常压下在1体积水中氨气可溶700体积;氯化氢气体可溶500体积;硫化氢气体可溶40体积;氯气可溶2体积;二氧化碳可溶1体积五、有机化合物中低级醇,多羟基物质可溶于水,有机酸多溶于水但也不绝对。
(个别例外)六、无机酸中只有原硅酸,硅酸不溶于水。
一般碳酸盐的溶解度小于碳酸氢盐。
如:碳酸钙的小于碳酸氢钙的;碳酸镁的小于碳酸氢镁的;碳酸锂的小于碳酸氢锂的;但碳酸钠的却大于碳酸氢钠的(碳酸氢根离子的反极化作用)七、物质间能发生反应时也可溶。
如说铜能溶于硝酸,金可溶于王水八、溶质和溶剂间能形成配位化合物时也能溶。
如:氯化银可溶于氨水,溴化银可溶于浓氨水,而碘化银不溶于氨水,氢氧化铜可溶于氨水。
九、都是难溶物谁的溶解度更小,要在同类型分子的基础上在相同条件下比溶度积常数的大小。
如:相同条件时氯化银,硫化铅和碳酸钙谁更难溶。
十、物质若与溶剂反应可增加容量,相对溶解的多些。
如:I2在KI溶液中的溶解度大于在纯水中的溶解度。
是因为I2和I-反应生成I3-从而溶解度增大。
十一、物质的溶解性与物质和溶剂有关外,还与外界的压强,温度等有关。
通常固体物质的溶解性随着温度的升高而加大,但也有反例如:氢氧化钙;气体的溶解性随温度的升高而减小,随压强的增大而增大。
溶解度的影响因素与测定方法

溶解度的影响因素与测定方法溶解度是指在一定温度条件下,单位容积的溶剂中能溶解最多溶质的质量。
溶解度的大小决定了溶质在溶液中的浓度以及晶体的生长形态。
理解溶解度的影响因素以及测定方法对于化学、物理领域的研究非常重要。
本文将探讨影响溶解度的几个主要因素以及常见的测定方法。
一、影响溶解度的因素1. 温度温度是影响溶解度的重要因素之一。
一般情况下,溶解度随着温度的升高而增加。
这是因为升温会增加溶质与溶剂之间的分子热运动,使溶质更易于克服吸引力进入溶剂中。
但是,并非所有物质的溶解度都随温度的升高而增加,有些物质的溶解度在一定温度范围内反而会随温度的升高而降低。
2. 压力压力对溶解度的影响一般比较小,主要针对气体溶质和液体溶剂的体系。
在高压下,气体溶质的溶解度会增加,因为增加的压力可以迫使更多的溶质分子进入溶剂中。
而对于液体溶剂,压力的变化对溶解度的影响较小。
3. 溶剂性质溶剂的极性、溶解能力和溶液的表面张力等性质也会影响溶解度。
一般来说,极性溶剂对极性物质的溶解度较高,而非极性溶剂对非极性物质的溶解度较高。
此外,溶剂中其他溶质的存在或者溶剂的饱和度等因素也会对溶解度产生影响。
4. 溶质性质溶质的性质对其溶解度也有影响。
例如,溶质的分子结构、化学键性质、相对分子质量等都会影响其溶解度。
一般而言,枝链状分子结构的溶质溶解度较小,而分子间作用力较强的物质溶解度较大。
二、测定溶解度的方法1. 重量法重量法是测定溶解度最常用的方法之一。
该方法通过将溶剂加入已知质量的溶质中,并在恒定温度下搅拌溶液,直到溶质完全溶解为止。
然后,测定溶剂的质量,计算出溶解度。
2. 透明度法透明度法是一种通过测定溶液的透明度来间接推断溶解度的方法。
通过比较标准溶液和待测溶液的透明度,可以判断溶液中溶质的溶解度高低。
这种方法主要适用于颜色较浅、浓度较低的溶液。
3. 密度法密度法是一种通过测定溶液的密度来计算溶解度的方法。
该方法根据溶质和溶剂的密度差异,结合添加适量溶质后溶液的密度变化,计算出溶解度。
化学分子的溶解性分析

化学分子的溶解性分析溶解性是指物质在某种溶剂中能否溶解的性质,它通常与溶剂的属性和与溶剂相互作用的分子间相互作用力有关。
溶解性的分析对于理解物质的溶解过程以及预测其在不同溶剂中的溶解性起着至关重要的作用。
本文将介绍化学分子的溶解性分析方法及其应用。
一、溶解性的确定方法要确定化学分子的溶解性,可以采用实验室实际测试或者计算机模拟方法。
实验方法:1. 晶体溶解性测试:将分子溶解于特定溶剂中,观察溶解过程中溶液的透明度和溶解度是否发生变化。
通过改变溶剂的性质和条件,如温度、压力等,可以进一步研究不同因素对溶解性的影响。
2. 比较溶解度法:将不同化学分子置于相同溶剂中,通过观察物质的溶解程度来比较它们的溶解性。
可以在实验室中进行溶解度曲线的绘制,进一步分析物质的溶解规律。
计算机模拟方法:1. 分子动力学模拟:通过计算机模拟分子在溶剂中的运动和相互作用,预测溶解过程的能量变化和分子间相互作用力的变化,从而分析溶解性。
这种方法常用于溶剂的筛选以及分子设计过程中。
2. 量子力学计算:基于量子力学理论,通过计算分子的电子结构和能量,预测物质在溶剂中的溶解性。
这种方法在溶解机制的研究以及新材料的设计中具有重要应用价值。
二、影响化学分子溶解性的因素化学分子的溶解性受多种因素影响,包括:1. 分子结构:化学分子的结构决定了分子间相互作用力的类型和强度,从而直接影响溶解性。
分子间作用力主要包括范德华力、极性相互作用、氢键等,这些作用力的差异导致了不同化学分子在溶剂中的不同溶解度。
2. 溶剂性质:溶剂的极性、介电常数、溶解度等性质直接影响分子与溶剂之间的相互作用。
溶剂的选择不仅要考虑其与待溶物质的相互作用,还要考虑实际应用场景以及可用性。
3. 温度和压力:温度和压力的变化会改变溶液中的分子间距离和能量,进而影响化学分子的溶解度。
通常情况下,温度升高和压力降低有利于提高分子的溶解度。
三、溶解性分析的应用溶解性分析在化学研究和工业生产中具有重要的应用价值:1. 药物研发:溶解性是药物吸收、代谢和释放等过程的重要指标之一。
溶解度和溶解性的关系

2.溶解度和溶解性的关系:
溶解性只是一般地说明某种物质在某种溶剂里溶解能 力的大小,是物质的一种物理性质。通常用易溶、可溶、 微溶、难溶或不溶等粗略的概念表示。我们一般根据物质 在20℃时的溶解度来判断物质的溶解性,如下表所示: 溶解度 大于10g 1g—10g 0.01g— 1g 小于0.01g
不饱和溶液饱和溶液增加溶质或降低温度度或减少溶剂增加溶剂或升高温度文档仅供参考如有不当之处请联系本人改正
最多能溶解多少氯化钠
一、物质的溶解性
通常把一种物质溶解在另一种物质 里的能力叫做溶解性。
溶解性的大小跟溶质和溶剂的性质有关。 同一种物质在不同溶剂里的溶解性也不相同。
探究活动1(物质能否无限地溶解在
5g。加了几次后才能使烧杯中硝酸钾固体有剩余而不再继 续溶解?然后加热烧杯,观察剩余固体有什么变化。再加 入5g硝酸钾,搅拌,观察现象。待溶液冷却后,又有什么 现象发生?将现象填入以下表格:
二、饱和溶液
在一定温度下,向一定量溶剂 里加入某溶质,当溶质不能继续溶 解时,所பைடு நூலகம்到的溶液叫做饱和溶液; 还能继续溶解的的溶液,叫做不饱 和溶液。
探究活动4(温度、压强对气体溶解 度的影响)
(1) 打开汽水盖时,汽水会自动喷出来。 引导学生分析气体在水中的溶解度与压强有关。 (2) 喝了汽水以后,常常会打嗝。 引导学生分析气体在水中的溶解度与温度有关。 (3) 指导学生设计方案:检验汽水中溶解的气体 是二氧化碳。
物质的溶解性

一、影响物质溶解性的因素 二、溶解度 三、溶解度曲线
四、结晶
影响物质溶解性的因素 在两支试管中各加入2mL~3mL水,分别加入1 少量碘或氯化钠;另取两支试管各加入2mL~ 3mL酒精,再分别加入少量小粒碘和氯化钠。 振荡,观察现象。
加 加 NaCl1g NaCl1g Na 加 加氯化钠 Cl1g
溶 200 解 度 190
180 170 160 150 140 130 120 110 100
g
硝 酸 铵
固体的溶解度曲线: 练习:
/
A.
硝 酸 钾 氯化铵 氯化钾 氯化钠
硝 酸 钠
1、横坐标60,纵坐标110 的交点 表示什么意义? 2、40℃时氯化铵的溶解度为
90
80 70 60 50 40 30 20 10 0 10 20 30
现象 KNO3不能全部溶解 不能溶解的KNO3又溶解了
影响物质溶解性的因素 1、不同的物质在同一溶剂中的溶解性不同 2、同一种物质在不同溶剂中的溶解性不同
3、同一种物质在同一溶剂中的溶解性与 温度有关
2、影响物质溶解性的因素 (1)内因:主要受溶质和溶剂的性质影响; (2)外因:主要受温度影响; 气体的溶解性还受压强影响;
如:KNO3
2、蒸发溶剂法 氯化钠 适用于溶解度受 温度影响不大的 物质如:NaCl
50 40 30 20 10
0
10 20 30 40 50 60 70 80 90 100
温度(t)
硝酸钾固体中含有少量氯化钠,如何提纯硝酸钾?
溶 解 度 ( 克 )
200 190 180 170 160 150 140 130 120 110 100 90 80 70
物质的溶解性(23)-----溶解度1

2、影响气体溶解度的因素:
气体溶解度一般随压强增大而增大,压强减小而减小。
气体溶解度一般随温度升高而减小,温度降低而增大。
固体溶解度与气体溶解度的比较:
固体溶解度
气体溶解度 体积(L)
温度(t)和压强(P)
温度越高,溶解度越小;温度越 低,溶解度越大 压强越高,溶解度越大;压强越 低,溶解度越小
0
温度(℃)
溶 200 解 度 190
g
180 170 160 150 140 130 120 110 100 90 80 70 60 50
硝 酸 铵
固体的溶解度曲线:练习(1)
1、横坐标60,纵坐标110 的A点 表示什么意义? 表示60℃时,硝酸钾的溶解度 为110g。
/
40
30 20 10 0
拓 展 提 高
1、甲、乙两种固体的溶解度曲线如下图。现 将两试管分别装入甲、乙两种物质的饱和溶液 (试管底部均有未溶解的固体),再放进盛有 冰水的烧杯里, 则下列说法正确的是( B ) A、甲溶液中溶质的质量分数增大 B、乙溶液中剩余的固体减少 C、试管里甲、乙物质的溶解度都增大 D、试管里甲、乙两溶液中的溶质都减少
20º C时,NaCl的溶解度为36.0g。将这句话 含义里的关系填入下表:
温度 20℃ 溶质的质量 36.0g 溶剂的质量 100g
溶液的质量 136.0g
( 20℃时的溶解度S ) 2、溶解度与溶解性的关系:
易溶物质
可溶物质
微溶物质
难(不)溶物质
10g
难 溶
1g~10g 0.01g~1g
微 溶 可 溶 易 溶
60
3、固体溶解度曲线及意义
硝酸铵 硝酸钾
硝酸钠 a 氯化铵
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质溶解性大小的比较方法和规律
陕西吴亚南主编
物质的溶解性大小到底和什么有关,存在什么样的规律可循,有什么好的方法来区分和记忆,作为一个中学生是迫切想知道的,现就此问题总结如下。
一、常见酸碱盐在水溶液中的溶解性(口歌)
钾,钠,铵,硝酸,醋酸,碳酸氢盐都是可熔盐,
硫酸盐里除去Ba,Ag,Ca和Pb
碳酸盐里除去钾钠铵其它都是不熔盐
氯化物中只有银沉淀
可溶碱有4种钾,钠,钡和铵
二、相似相溶原理:溶质与溶剂在结构上相似。
可理解为极
性相同的物质间一般易于相溶。
有机物质易溶于有机溶
剂,通常难溶于水。
无机物在有机溶剂中一般难溶。
如:氯化钠在水中易溶,但在酒精中却能形成胶体
三、物质的分子可与水分子间形成氢键时加大其溶解性。
如:NH3,C2H5OH,CH3OH
四、常温常压下在1体积水中氨气可溶700体积;氯化氢气
体可溶500体积;硫化氢气体可溶40体积;氯气可溶
2体积;二氧化碳可溶1体积
五、有机化合物中低级醇,多羟基物质可溶于水,有机酸多
溶于水但也不绝对。
(个别例外)
六、无机酸中只有原硅酸,硅酸不溶于水。
一般碳酸盐的溶解度小于碳酸氢盐。
如:碳酸钙的小于碳酸氢钙的;碳酸镁的小于碳酸氢镁的;碳酸锂的小于碳酸氢锂的;但碳酸钠的却大于碳酸氢钠的(碳酸氢根离子的反极化作用)
七、物质间能发生反应时也可溶。
如说铜能溶于硝酸,金可溶于王水
八、溶质和溶剂间能形成配位化合物时也能溶。
如:氯化银可溶于氨水,溴化银可溶于浓氨水,而碘化银不溶于氨水,氢氧化铜可溶于氨水。
九、都是难溶物谁的溶解度更小,要在同类型分子的基础上在相同条件下比溶度积常数的大小。
如:相同条件时氯化银,硫化铅和碳酸钙谁更难溶。
十、物质若与溶剂反应可增加容量,相对溶解的多些。
如:I2在KI溶液中的溶解度大于在纯水中的溶解度。
是因为I2和I-反应生成I3-从而溶解度增大。
十一、物质的溶解性与物质和溶剂有关外,还与外界的压强,温度等有关。
通常固体物质的溶解性随着温度的升高而加大,但也有反例如:氢氧化钙;气体的溶解性随温度的升高而减小,随压强的增大而增大。
欢迎您的下载,
资料仅供参考!
致力为企业和个人提供合同协议,策划案计划书,学习资料等等
打造全网一站式需求。
