分析化学-酸碱滴定的应用共33页
合集下载
分析化学第七节 酸碱滴定的应用
d
)
2. 在分析工作中要减小测定的偶然误差可采取……(
c
)
a.校准仪器 b.对照试验 c.多次平行试验 d.空白试验 e.回收试验
3.定量分析中,精密度与准确度之间的关系是 ( C ) (A)精密度高,准确度必然高 (B)准确度高,精密度也就高 (C)精密度是保证准确度的前提 (D)准确度是保证精密度的前提 4.滴定管可估读到±0.01mL, 若要求滴定的相对误差小于0.1%, 至少应耗用滴定剂体积( B )mL (A) 10 (B) 20 (C) 30
M B2O3 M 硼砂
100% 93.44%
硼砂% 34 .11 %
MB B% 硼砂% M 硼砂
综合习题:
选择题: 1. 对某(NH4)2SO4试样进行多次平行测定, 获得样品中氨含量的平均值为21.98%, 若其中某个测定值为21.95%, 则21.94%-21.98%=-0.03%为该次测定的………( a.绝对误差 d. 绝对偏差 b.相对误差 e.相对偏差 c.系统误差
练习
7.有工业硼砂1.0000 g,用0.2000 mol/L的HCl 滴定至甲基橙变色,消耗24.50 mL,计算试 样中Na2B4O7· 10H2O的百分含量和以 B2O3和 B 表示的百分含量。
解: 因为化学计量数之比1:2
硼砂%
B 2 OS 2000
1.酸标准溶液
配制方法:间接法(HCl易挥发,H2SO4易吸湿) 标定方法
基准物:
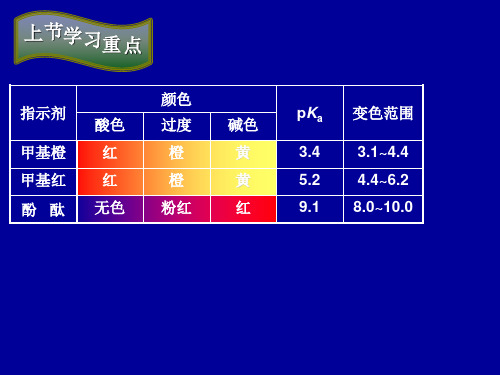
无水碳酸钠 易吸湿,3000C干燥1小时,干燥器中冷却 1:2反应 **pH 3.9 硼砂 易风化失水,湿度为60%密闭容器保存 1:2反应 **pH 5.1 指示剂:甲基橙,甲基红
2.碱标准溶液
分析化学经典课件酸碱滴定法PPT

1)双色指示剂:甲基橙
Kin
H
In
HIn
变色点pH取决于酸、碱式体浓度的比值,与CHIn无关
2)单色指示剂:酚酞
Kin [In ] a [H ] [HIn] C a
变色点pH取决于C ;C↑ 则pH↓,变色点酸移
✓ 例:50~100ml溶液中加入酚酞 2~3滴,pH=9变色 15~20滴,pH=8变色
➢ 形成的多元共轭酸碱对中最强酸的解离常数 Ka1对应最弱共轭碱的解离常数Kb3
Ka1 Kb3 Ka2 Kb2 Ka3 Kb1 KW 1.0 1014
例:计算HS-的pKb值
解: HS- + H2O
H2S + OH-
pKb2 = pKw -pKa1 = 14.00-7.02 = 6.98
2.温度的影响
T → Kin → 变色范围 !注意:如加热,须冷却后滴定
3.溶剂的影响
电解质→离子强度→Kin → 变色范围
4.滴定次序
无色→有色,浅色→有色 ✓ 例: 酸滴定碱 → 选甲基橙
碱滴定酸 → 酚酞
➢ 组成
1.指示剂+惰性染料 例:甲基橙+靛蓝(紫色→绿色) 2.两种指示剂混合而成 例:溴甲酚绿+甲基红(酒红色→绿色)
1.滴定过程中pH值的变化 2.滴定曲线的形状 3.影响滴定突跃的因素和指示剂的选择 4.弱酸被准确滴定的判别式
1.滴定过程中pH值的变化 (1)滴定开始之前
[H ] Ca K a 1.810 5 0.1000 1.34 10 3 mol / L pH 2.88
(2)滴定开始至化学计量点之前
➢ 共轭酸碱对HA和A- 有如下关 系
Ka Kb Kw
Ka Kb Ks
分析化学-酸碱滴定

2
HCl
Ka≥10-7才能准 确滴定.
位
0
50
100
150
200 即cKa≥10-8
影响滴定突跃的因素
滴定突跃:pKa+3 ~-lg[Kw/cNaOH(剩余)]
➢ 浓度: 增大10倍,突跃增加1个pH单位(上限)
➢ Ka:增大10倍,突跃增加1个pH单位(下限) 弱酸准确滴定条件:cKa≥10-8 对于0.1000mol·L-1 的HA, Ka≥10-7才能准确滴定
d. 化学计量点后 (After stoichiometric point)
加入滴定剂体积 20.02 mL
[OH-]=(0.10000.02)/(20.00+20.02)=5.010-5
pOH=4.30, pH=14.00-4.30=9.70 滴加体积:0~19.98 mL; pH=7.74-2.87=4.87 滴加体积:19.98~20.02 mL; pH=9.70-7.70= 2.00 滴定开始点pH抬高,滴定突跃范围变小。
c. 化学计量点(stoichiometric point)
生成HAc的共轭碱NaAc(弱碱),浓度为: cb=20.000.1000/(20.00+20.00)=5.0010-2 mol/L, 此时溶液呈碱性,需要用 pKb (Ac ) 进行计算
pKb 14.00 - pKa = 14.00-4.74 = 9.26 [OH-] = (cb Kb)1/2 = (5.0010-2 10-9.26 )1/2 = 5.2410-6 溶液 pOH=5.28, pH=14.00-5.28=8.72
0
0
100
200%
滴定百分数,T%
不同浓度的强碱滴定强酸的滴定曲线
酸碱滴定法应用

食品中蛋白质的测定
总结词
食品中蛋白质的测定是酸碱滴定法的又一应 用实例,通过滴定法可以快速、准确地了解 食品中蛋白质的含量。
详细描述
食品中蛋白质的测定采用酸碱滴定法,利用 蛋白质中的肽键与碱发生反应,再加入酸进 行滴定。在滴定过程中,加入酚酞指示剂, 当溶液由黄色变为浅红色时即为滴定终点。 通过消耗的酸的体积和浓度,可以计算出食
04 酸碱滴定法的优缺点
优点
准确度高
酸碱滴定法是一种相对准确的方 法,可用于测定物质的质量分数、
浓度等。
操作简便
酸碱滴定法操作简单,不需要复杂 的仪器和设备,成本较低。
应用广泛
酸碱滴定法可应用于多种无机物和 有机物的分析,如酸、碱、盐等。
缺点
局限性
酸碱滴定法只适用于可滴定的物 质,对于一些不反应或反应不完 全的物质无法使用。
误差较大
由于操作过程中的人为误差和反 应的不完全性,酸碱滴定法的误 差较大。
对条件要求高
酸碱滴定法对温度、浓度等条件 要求较高,不同条件下可能得到 不同的结果。
改进方向
发展自动化滴定仪
通过自动化滴定仪的研发和应用,减少人为误差, 提高准确度。
深入研究反应机理
深入研究和了解酸碱反应机理,提高反应的完全 性和准确性。
酸碱滴定法
利用酸和碱的中和反应进行滴定,常用的酸有盐酸、硫酸、硝酸等,常
用的碱有氢氧化钠、氢氧化钾等。
02
络合滴定法
利用络合物反应进行滴定,常用的络合剂有EDTA等,主要用于测定金
属离子含量。
03
氧化还原滴定法
利用氧化还原反应进行滴定,常用的氧化剂有高锰酸钾、重铬酸钾等,
常用的还原剂有亚铁盐、溴酸钾等,主要用于测定具有氧化还原性质的
《分析化学》课件——3 酸碱滴定法

30
缓冲溶液
[H ]
Ka
c HA cA
取负对数,得:
最简式
pH
pKa
lg
cA cHA
可见,当cHA cA时,pH pKa
31
例6
计算 0.10 mol·L-1 NH4Cl 和 0.20 mol·L-1 NH3缓冲溶液的 pH?
解:Kb=1.8×10-5,Ka=5.6×10-10,浓度较大, 用最简式计算得:
24
例3
计算 0.10 mol·L-1 NH3 溶液的 pH?
解: Kb = 1.80×10-5,用最简式计算:
弱碱
[OH ] cKb 1.3 103 mol L1 pOH 2.89 pH 11.11
25
3. 多元酸(碱)溶液
二元酸 H2B 质子条件:
[H+] = [HB-] + 2[B2-] + [OH-]
PBE不含原始物质,质子转移多个时存在系数
17
例1
HAc NaCN
[H+] = [Ac-] + [OH-] [H+] + [HCN] = [OH-]]
H2O作零 水准
Na2S
[H+] + [HS-] + 2[H2S] = [OH-]
NaHCO3 [H+] + [H2CO3] = [CO32-] + [OH-]
NaH2PO4 [H+] + [H3PO4] = [HPO42-] + 2[PO43-] + [OH-]
(NH4)2HPO4 [H+]+[H2PO4-]+2[H3PO4]=[NH3]+[PO43-]+[OH-]
缓冲溶液
[H ]
Ka
c HA cA
取负对数,得:
最简式
pH
pKa
lg
cA cHA
可见,当cHA cA时,pH pKa
31
例6
计算 0.10 mol·L-1 NH4Cl 和 0.20 mol·L-1 NH3缓冲溶液的 pH?
解:Kb=1.8×10-5,Ka=5.6×10-10,浓度较大, 用最简式计算得:
24
例3
计算 0.10 mol·L-1 NH3 溶液的 pH?
解: Kb = 1.80×10-5,用最简式计算:
弱碱
[OH ] cKb 1.3 103 mol L1 pOH 2.89 pH 11.11
25
3. 多元酸(碱)溶液
二元酸 H2B 质子条件:
[H+] = [HB-] + 2[B2-] + [OH-]
PBE不含原始物质,质子转移多个时存在系数
17
例1
HAc NaCN
[H+] = [Ac-] + [OH-] [H+] + [HCN] = [OH-]]
H2O作零 水准
Na2S
[H+] + [HS-] + 2[H2S] = [OH-]
NaHCO3 [H+] + [H2CO3] = [CO32-] + [OH-]
NaH2PO4 [H+] + [H3PO4] = [HPO42-] + 2[PO43-] + [OH-]
(NH4)2HPO4 [H+]+[H2PO4-]+2[H3PO4]=[NH3]+[PO43-]+[OH-]
酸碱滴定法的应用

H3PO4 + HCl H2PO4- + H3PO4 HPO42- + H2PO4-
……
Na3PO4 + NaOH
……
含氮量的测定、磷的测定、硅的测定等
2005-10
GXQ 分析化学 2019-2019学年
2
化学化工学院
Analytical Chemistry 分析化学
1、混合碱分析的方法:
双指示剂法
化学化工学院
Analytical Chemistry 分析化学
3.9 酸碱滴定法的应用
3.9.1 3.9.2
酸碱标准溶液的配制与标定(自学) 酸碱滴定法的应用实例
混合碱的测定(双指示剂法) 混合碱的测定(BaCl2 法) 纯碱的测定 未知成分混合碱的测定 混合酸的测定 氮含量的测定 磷的测定(自学) 硅的测定 (自学 )
wp
( cV ) HC AlN6.25100 ms1000
0 .10 2.0 2 1 1 0 0 .0 4 6 1 .25
w P
1 0 7.2 0 4 % 5 0 .25 10 00 00
2005-10
GXQ 分析化学 2019-2019学年
11
化学化工学院
4、磷的测定(自学)
2005-10
GXQ 分析化学 2019-2019学年
红色 V2 无色
nHC,l2 nNaOH
4
(2)纯碱中NaH化学C化O工3学和院 Na2CO3 的测定 (3)未知成分混合碱 的测定
由A同nal学ytica们l C自hem己istr分y 分析析化学
设已知一混合碱可能含有NaOH、或NaHCO3 、 或Na2CO3 、
取二份试样以双指示剂法平行滴定naohna2co3或nahco3h酚酞v1第一份naohna2co3或nahco3h甲基橙v2第二份由同学们自己分析22混合酸分析的方法双指示剂法混合酸分析的方法双指示剂法hclh3po4hpoh2po4oh甲基橙h2oh2po4hpoh2po4oh酚酞hpo42无色红色v2红色黄色v1由同学们自己分析33氮含量的测定试样nh4处理蒸馏法甲醛法参见实验蒸馏法nh4nh3oh蒸馏hcl标准溶液吸收经典h3bo3溶液吸收改进hcl标液吸收hclhcl强酸与弱酸强酸与弱酸混合体系凯氏定氮法nh3nh4clhcl过量naohh2onh4?4?4??nhnhphckasph?5指示剂
分析化学-酸碱滴定的应用
去(pH≈8)。
生成的: 2NH3 + 2H+ = 2NH4+ PO43- + H+ = HPO42-
所以,1mol (NH4)2HPO4•12MoO3•H2O 要消耗24mol的碱, 计量关系:1P ≎ 24OH据此求出试样中的含量:
1 [(cV ) NaOH (cV ) HCl ] M P P % 24 ms
1、蒸馏法
(1) 往铵盐试样溶液中加入过量的浓碱溶液,并加热使NH3释放出来。
NH4++OH-=NH3↑+H2O (2) 释放出来的NH3吸收于H3BO3溶液中。NH3+ H3BO3= NH4+ + H2BO3(3) 然后用酸标准溶液滴定H3BO3吸收液。 滴定反应 H+ + H2BO3- = H3BO3 (对于0.1mol/L,pHsp=5.1)
2、碱度的测定及种类
⑴ 碱度种类:
氢氧化物碱度:其离子状态为OH-离子。
碳酸盐碱度:CO32-存在,主要是强碱的碳酸盐。
重碳酸盐碱度: HCO3-。
⑵ 测定碱度:双指示剂法
双指示剂法:是利用两种指示剂在不同化学计量点的颜
色变化,得到两个终点,分别根据各终点时所消耗的酸标准 溶液的体积,计算各碱性成分的含量。 测定原理:可用甲基橙和酚酞两种指示剂,以酸标准溶 液连续滴定。
醛、酮的测定
醛类化合物既非酸又非碱,当然不能用酸碱滴定 法直接测定。但醛类化合物可通过某些化学反应,释 放出相当量的酸或碱,便可间接地测定其含量。
用酸碱滴定法测醛酮常用盐酸羟胺法和亚硫酸钠
法。
例如:丙烯醛与盐酸羟胺在醇溶液中起反应,释放出相当量
的盐酸(HCl):
分析化学课件 第四章 酸碱滴定法
[OH-]=(0.1000×0.02)/(20.00+20.02)
= 5.0×10-5 mol·L-1 pOH=4.30, pH=14-4.30= 9.70
2020年11月7日星期六3时
37分22秒
上一页 下一页 返回
讨论:强碱滴定强酸的滴定曲线
1)滴定前加入18mL,溶液pH变化仅 为:2.28-1=1.28;而化学计量点前 后共0.04 mL(约1滴),溶液pH 变化 为:9.70-4.30=5.40 (突跃)。
碱式色
2020年11月7日星期六3时 37分22秒
上一页 下一页 返回
→甲基橙(methyl orange,MO)-双色
pH≤ 3.1,酸式色,红色; pH 4.4, 碱式色,黄色; pH 3.1-4.4,两种形式共存,为混合色,橙色。
2020年11月7日星期六3时 37分22秒
上一页 下一页 返回
上一页 下一页 返回
若±0.1%误差范围内突跃范围为 4.30~9.70
酚酞(8.0 ~ 10.0):半滴溶液, 无色变粉红。
甲基红(4.4 ~6.2):半滴溶液, 红变橙;
甲基橙(3.1 ~ 4.4):半滴溶液, 橙变黄;
3)选择指示剂的原则:
1.变色范围全部或部分在突跃范围内的指示剂指示
终点,即可保证终点误差在允许的范围。
02.00.102000 1050..130 ~9.87.070
上一页 下一页 返回
5)影响强酸强碱滴定突跃范围大小的因素
酸碱的浓度:浓度变为原1/10,则计量点前后H+、OH-的浓度均 为原来的1/10,所以突跃范围约减小2个pH单位。 故:酸碱滴定中,滴定剂和被测物溶液的浓度不低于~ 0.1mol/L
分析化学:酸碱滴定之应用
2、0.1mol/L H3PO4 与0.2mol/L HPO42中和 0.2mol/L H2PO4-与0.1mol/L HPO42-; 主要型体浓度:c (H2PO4-)=0.4,c(HPO42-)=0.1
考虑体积变化,浓度降低一半,则
(1)以甲基红为指示剂,用0.100mol/LHCl溶液滴定至 终点, HPO42-被滴定(H2PO4- 的碱常数为10-11.88, 不能被滴定),需消耗 HCl 溶液 50.0 毫升。
V2
甲基橙
(动画)
混合碱的滴 定曲线
V1>V2 : NaOH Na2CO3
V1=V2 :Na2CO3 V1<V2 : Na2CO3
NaHCO3 V1=0 : NaHCO3 V2=0 : NaOH
例:将0.300mol/L H3PO4溶液50.0mL与0.200mol/L Na3PO4溶液50.0mL混合。
解:分析组成:V2(47.70-20.10)>V1(20.10),说明 组成为:NaHCO3和Na2CO3。
Na2CO3% = 20.10×0.1060×106/(0.3010×1000 ) N=aH0C.O735%03=75.03 %
= (47.702×20.10)×0.1060×84/(0.3010×1000 )
(1) 以甲基红为指示剂,用0.100mol/LHCl溶液滴 定至终点,需消耗HCl溶液多少毫升?
(2) 若改用0.400mol/LNaOH溶液滴定至百里酚酞 为终点,需消耗NaOH溶液多少毫升?
解:分析此时溶液中的主要型体的浓度:
1、0.300mol/L H3PO4与0.200mol/L Na3PO4中和 0.1mol/L H3PO4、0.2mol/L H2PO4-与0.2mol/L HPO42-;
考虑体积变化,浓度降低一半,则
(1)以甲基红为指示剂,用0.100mol/LHCl溶液滴定至 终点, HPO42-被滴定(H2PO4- 的碱常数为10-11.88, 不能被滴定),需消耗 HCl 溶液 50.0 毫升。
V2
甲基橙
(动画)
混合碱的滴 定曲线
V1>V2 : NaOH Na2CO3
V1=V2 :Na2CO3 V1<V2 : Na2CO3
NaHCO3 V1=0 : NaHCO3 V2=0 : NaOH
例:将0.300mol/L H3PO4溶液50.0mL与0.200mol/L Na3PO4溶液50.0mL混合。
解:分析组成:V2(47.70-20.10)>V1(20.10),说明 组成为:NaHCO3和Na2CO3。
Na2CO3% = 20.10×0.1060×106/(0.3010×1000 ) N=aH0C.O735%03=75.03 %
= (47.702×20.10)×0.1060×84/(0.3010×1000 )
(1) 以甲基红为指示剂,用0.100mol/LHCl溶液滴 定至终点,需消耗HCl溶液多少毫升?
(2) 若改用0.400mol/LNaOH溶液滴定至百里酚酞 为终点,需消耗NaOH溶液多少毫升?
解:分析此时溶液中的主要型体的浓度:
1、0.300mol/L H3PO4与0.200mol/L Na3PO4中和 0.1mol/L H3PO4、0.2mol/L H2PO4-与0.2mol/L HPO42-;
第6节 酸碱滴定法的应用
则标定所得的浓度偏高,偏低,还是准确?为什么?
5.用蒸馏法测定NH4+含量,可用过量H2SO4吸收, 也可用H3BO3吸收,试对这两种分析方法进行比较。
6.试拟出测定下列混合物中的各个组分的方案
(l)H3BO3 + 硼砂;
(2)HCl + NH4Cl
(3)NH3·H2O + NH4Cl; (4)NaH2PO4 +
解:这种方法的测定原理,实质上就是前面提到的 甲醛法测定铵盐中含氮量的逆过程。
n (H3BO3) = n (NaOH)
2020年8月5日10时50 分
故
w(H3BO3) = c(NaOH)V (NaOH) M (H3BO3)
ms
= 0.2501 32.16 10 3 61.83
0.5004
=0.9938 = 99.38 %
wNa3PO4 = 0.4917 = 49.17% 甲基橙指示终点时, 用去的HCl消耗在两部分:中和
Na3PO4和试样中原有的Na2HPO4所需的HCl量,后者 用去的HCl溶液体积为:
32.00 mL-2×12.00 mL = 8.00 mL
0.5000mol L1 8.00 103 L 2.000g wNa2HPO4 142.0g mol 1
Na2HPO4 (2分0250)年8月N5日a1H0时25P0 O4 + H3PO4; (6)NaOH+Na3PO4
思考题:
7 . 有 一 碱 液 , 可 能 是 NaOH、Na2CO3、NaHCO3 或 它们的混合物,如何判断其组分,并测定其含量? 8.有一溶液,可能是Na3PO4、Na2HPO4、NaH2PO4 或它们的混合物,如何判断其组分,并测定各组分的 含量?说明理由。
