实训x:直接碘量法测定维生素C片的含量
直接碘量法测定Vc片含量献给考技能证的学生

直接法测定Vc 片的含量测定方法:直接碘量法I 2是弱氧化剂,E I 2/I=0.535,电位比E I 2/I 小的还原性物质,可直接用I 2标准溶液滴定,这种方法叫做直接碘量法,可用I 2标准溶液直接滴定的是强还原剂,如S 2O 32-、As(Ⅲ)、Sn(Ⅱ)、维生素C 等。
不是直接用I 2标准溶液滴定,这种方法叫做间接碘量法。
实验原理:维生素C(C 6H 8O 6,E=0.18),分子结构中的烯二醇基具有还原性,能被I 2定量地氧化成二酮基,抗坏血酸分子中的二烯醇基被I 2完全氧化后,则I 2与淀粉指示剂作用而使溶液变蓝,所以当滴定到溶液出现蓝色时即为终点。
由于维生素C 的还原性很强,即使在弱酸性条件下,上述反应也进行得相当完全。
维生素C 在空气中极易被氧化,尤其在碱性介质中更甚,故该滴定反应在稀HAc 中进行,以减少维生素C 的副反应。
I 2标准溶液采用间接配制法获得,用Na 2S 2O 3标准溶液标定,反应如下:2S 2O 32-+I 2=S 4O 62-+2I -器材和药品1.器材:天平(0.1mg ),酸式滴定管(50mL ),碘量瓶(250mL ),移液管(20mL )锥形瓶(250ml )、量筒、棕色瓶(250mL )。
2.药品:K 2Cr 2O 7(基准试剂),Na 2S 2O 3(0.1mol/L ),I 2(0.05mol/L ),KI (20%)、HCl (6mol/L ),HAc (2mol/L ),淀粉指示剂(0.5%)。
Na 2CO 3固体。
所需试剂的用量及配制方法:1、0.1mol/LNa 2S 2O 3标准溶液的配制称取25gNa 2S 2O 3·5H 2O ,溶于1000mL 新煮沸并冷却的蒸馏水中,加入0.2gNa 2CO 3使溶液呈碱性,以防止Na 2S 2O 3的分解,保存于棕色瓶中,放置10天后过滤,再标定.放置长时间后,再用前应重新标定。
维生素C药片中Vc含量的测定

维生素C 药片中含量的测定(碘量法)一、实验目的1、 掌握直接碘量法测定的原理及其操作。
2、 掌握碘标准溶液的配制及标定。
3、 掌握维生素C 的测定方法。
二、实验原理 (一)碘量法碘量法是以I 2的氧化性和I -的还原性为基础的滴定分析方法。
在一定条件下,用碘离子来还原,定量的析出碘单质,然后用2S 2O 3 标准溶液来滴定析出的I 2。
这种方法叫做间接碘量法。
本实验采用间接碘量法测碘的浓度。
以淀粉为指示剂,2S 2O 3 标准溶液来滴定析出的I 2,以蓝色消失为终点,即可算出碘的浓度。
维生素C 又称抗坏血酸,分子式C 6H 8O 6。
具有还原性,可被I 2定量氧化,因而可用I 2标准溶液直接测定。
其滴定反应式:(二)碘溶液的配制与标定OHOOHO CH OH CH 2OH +I 2OOOO C H OH CH 2OH +2HIHOAcI 2微溶于水而易溶于溶液,但在稀的溶液中溶解得很慢,所以配制I 2溶液时不能过早加水稀释,应先将I 2和混合,用少量水充分研磨,溶解完全后再加水稀释。
I 2 溶液的标定可以用2O 3或2S 2O 3标定,因为2O 3是剧毒物质,我们用2S 2O 3来标定。
(三)硫代硫酸钠溶液的配制与标定2S 2O 3一般含有少量杂质,在9-10间稳定,所以在2S 2O 3溶液中加入少量的23,2S 2O 3见光易分解可用棕色瓶储于暗处,经一周后,用K 2C 2O 7做基准物间接碘量法标定2S 2O 3溶液的浓度。
根据K 2C 2O 7标准溶液的物质的量浓度和滴定消耗的体积,就可计算出溶液中2S 2O 3的浓度。
其过程为:K 2C 2O 7与先反应析出I 2:析出的I 2再用标准的2S 2O 3溶液滴定:从而求得2S 2O 3的浓度。
这个标定2S 2O 3的方法为间接碘量法。
碘量法的基本反应式:2S 2O 32-+I 24O 62-+2I - 标定2S 2O 3溶液时有:6I -+2O 72-+14H +=23++3I 2+7H 2O 2S 2O 32-+I 24O 62-+2I -2S 2O 3标定时有(K 2C 2O 7): n(2S 2O 3)=1:6三、实验药品及仪器 实验药品和试剂:I 2分析纯 溶液100g ·1 2S 2O 3·5H 2O 溶液 0.01701K 2C 2O 7溶液 淀粉指示剂5 g ·1 23 固体 溶液 6 1 冰醋酸 维生素C 药片 主要仪器:分析天平、天平、量筒、烧杯、酸式碱式滴定管、表面皿、容量瓶(250)、锥形瓶(250)、碘量瓶(250)、移液管(25)、洗瓶等常规分析仪器 四、实验步骤(一)、2S 2O 3 溶液的配制及标定1、配制0.10 2S 2O 3溶液500 称取132S 2O 3·5H 2O ,溶于500新煮沸的蒸馏水中,加入0.123,保存于棕色瓶中,放置一周后进行标定。
直接碘量法测定维生素C含量

一.真验手段之阳早格格创做1.掌握碘尺度溶液的配造战标定要领;2.相识曲交碘量法测定维死素C 的本理战要领. 两.真验本理维死素C (Vc )又称抗坏血酸,分子式686O H C ,分子量1mol •176.1232/g -.Vc具备还本性,可被2I 定量氧化,果而可用2I 尺度溶液曲交滴定.其滴定反应式为:.由于Vc 的还本性很强,较易被溶液战气氛中的氧氧化,正在碱性介量中那种氧化效率更强,果此滴定宜正在酸性介量中举止,以缩小副反应的爆收.思量到-I 正在强酸性溶液中也易被氧化,故普遍选正在pH=3~4的强酸性溶液中举止滴定. 三.主要试剂1.2I 溶液(约1L •0.05mol -):称与2I 战5g KI ,置于研钵中,加少量火,正在透气橱中研磨.待2I 局部溶解后,将溶液转进棕色试剂瓶中,加火密释至250mL ,充分摇匀,搁暗淡处保存.2.322O S Na 尺度溶液(1L •0.1127mol -) 3.HAc (1L •2mol -) 4.淀粉溶液 5.维死素C 片剂 6.KI 溶液 四.真验步调 1.2I 溶液的标定322O S Na 尺度溶液于250mL 锥形瓶中,加40mL 蒸馏火,4mL 淀粉溶液,而后用2I 溶液滴定至溶液呈浅蓝色,30s 内没有褪色即为末面.仄止标定3份,估计12L •)/m ol (I -c .2.维死素C 片剂中Vc 含量的测定准确称与2片维死素C 药片,置于250mL 锥形瓶中,加进100mL 新煮沸过并热却的蒸馏火,10mLHAc 溶液战5mL 淀粉溶液,坐时用2I 尺度溶液滴定至出现宁静的浅蓝色,且正在30s 内没有褪色即为末面,记下消耗的)/m L (I 2V .仄止滴定3份,估计试样中的Vc 的品量分数.五.数据记录与处理 1.2I 溶液的标定2.维死素C 片剂中Vc 含量的测定六.真验归纳标定得)L •04825(mol .0)(I 12-=c ,测得%52.84)Vc (=ω.七.分解计划1.KI I 2-溶液呈深棕色,正在滴定管中较易辨别凸液里,但是液里最下面较领会,所以常读与液里最下面,读时应安排眼睛的位子,使之与液里最下面前后正在共一火仄位子上.2.使用碘量法时,该当用碘量瓶,预防2I 、322O S Na 、Vc 被氧化,效率真验截止的准确性.3.由于真验中没有克没有及预防天摇动锥形瓶,果此气氛中的氧会将Vc 氧化,使截止偏偏矮. 八.思索题1.溶解2I 时,加进过量KI 的效率是什么?问:查得,碘正在火中的溶解度为O)00gH g/(02.02 .果此,溶解度很矮.加进过量的KI ,可减少2I 正在火中的溶解度,反应式如下:2.维死素C 固体试样溶解时为何要加进新煮沸并热却的蒸馏火? 问:Vc 有强还本性,为预防火中溶解的氧氧化Vc ,果此要将蒸馏火煮沸,以与消火中溶解的氧;为预防Vc 的结构被损害,果此要将煮沸的蒸馏火热却.3.碘量法的缺面根源有哪些?应采与哪些步伐缩小缺面?问:(1)读数缺面,由于碘尺度溶液颜色较深,溶液凸液里易以辨别;但是液里最下面较领会,所以常读数液里最下面,读时应安排眼睛的位子,使之与液里最下面前后正在共一火仄位子上.(2)反应物简单被气氛中的氧氧化;滴定历程中用碘量瓶,而没有必锥形瓶,预防剧烈天摇动.。
维生素C的含量测定(直接碘量法)
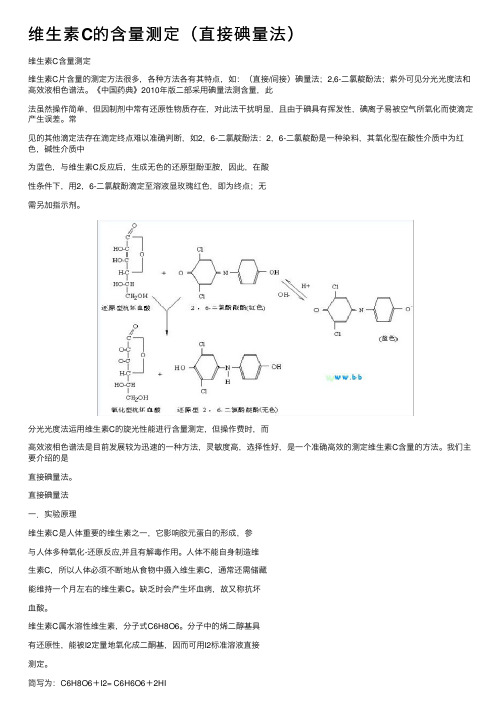
维⽣素C的含量测定(直接碘量法)维⽣素C含量测定维⽣素C⽚含量的测定⽅法很多,各种⽅法各有其特点,如:(直接/间接)碘量法;2,6-⼆氯靛酚法;紫外可见分光光度法和⾼效液相⾊谱法。
《中国药典》2010年版⼆部采⽤碘量法测含量,此法虽然操作简单,但因制剂中常有还原性物质存在,对此法⼲扰明显,且由于碘具有挥发性,碘离⼦易被空⽓所氧化⽽使滴定产⽣误差。
常见的其他滴定法存在滴定终点难以准确判断,如2,6-⼆氯靛酚法:2,6-⼆氯靛酚是⼀种染料,其氧化型在酸性介质中为红⾊,碱性介质中为蓝⾊,与维⽣素C反应后,⽣成⽆⾊的还原型酚亚胺,因此,在酸性条件下,⽤2,6-⼆氯靛酚滴定⾄溶液显玫瑰红⾊,即为终点;⽆需另加指⽰剂。
分光光度法运⽤维⽣素C的旋光性能进⾏含量测定,但操作费时,⽽⾼效液相⾊谱法是⽬前发展较为迅速的⼀种⽅法,灵敏度⾼,选择性好,是⼀个准确⾼效的测定维⽣素C含量的⽅法。
我们主要介绍的是直接碘量法。
直接碘量法⼀.实验原理维⽣素C是⼈体重要的维⽣素之⼀,它影响胶元蛋⽩的形成,参与⼈体多种氧化-还原反应,并且有解毒作⽤。
⼈体不能⾃⾝制造维⽣素C,所以⼈体必须不断地从⾷物中摄⼊维⽣素C,通常还需储藏能维持⼀个⽉左右的维⽣素C。
缺乏时会产⽣坏⾎病,故⼜称抗坏⾎酸。
维⽣素C属⽔溶性维⽣素,分⼦式C6H8O6。
分⼦中的烯⼆醇基具有还原性,能被I2定量地氧化成⼆酮基,因⽽可⽤I2标准溶液直接测定。
简写为:C6H8O6+I2= C6H6O6+2HI使⽤淀粉作为指⽰剂,⽤直接碘量法可测定药⽚、注射液、饮料、蔬菜、⽔果中维⽣素C的含量。
由于维⽣素C的还原性很强,较容易被溶液和空⽓中的氧氧化,在碱性介质中这种氧化作⽤更强,因此滴定宜在酸性介质中进⾏,以减少副反应的发⽣。
考虑到I - 在强酸性中也易被氧化,故⼀般选在pH为3~4的弱酸性溶液中进⾏滴定。
由于碘具有挥发性,碘离⼦易被空⽓所氧化⽽使滴定产⽣误差;⼜由于碘的挥发性和腐蚀性,使碘标准滴定溶液的配制及标定⽐较⿇烦。
直接碘量法测定维生素c含量

直接碘量法测定维生素c含量
维生素C,也被称为抗坏血酸,是一种水溶性维生素。
它在许多生物体内起着重要的生理作用,并且对人体有益。
维生素C含量测定是基于一种叫做碘量法的化学方法。
该方法利用碘酸钾溶液与维生素C反应的化学性质,通过了解反应后剩余的碘酸钾的含量来测定维生素C含量。
碘量法测定维生素C的过程如下:
准备样品:将要测定的样品加入到3%的浓磷酸中,并将其加热到约80℃,然后再冷却。
制备碘酸钾溶液:将20克的碘酸钾加入到1000毫升的蒸馏水中,并充分搅拌,以制备出0.1N的碘酸钾溶液。
测定过程:将取出的样品加入到定容瓶中,加入足够的蒸馏水,直至瓶子充满为止。
然后取出1毫升的样品溶液,并将其加入到滴定瓶中。
加入几滴淀粉溶液。
此时,溶液会变成淡蓝色。
准备滴定剂:将制备好的碘酸钾溶液滴加到另一个滴定瓶中,并加入适量的酒精。
通过滴加,将滴定剂加入到样品溶液中,直至溶液变成深蓝色。
读取数据:记录滴定剂滴入样品溶液的次数,并且根据已知的滴定剂浓度计算出维生素C的含量。
利用碘量法可以准确地测定含有维生素C的食物以及药品的维生素C含量。
然而,由于该测量方法需要使用化学试剂和复杂的实验过程,所以在实践中不太实用。
为了更加方便测量维生素C的含量,也出现了其他测量方法,例如高效液相色谱法和光谱法。
无论使用哪种方法测量维生素C的含量,都可以帮助人们了解他们摄入的营养成分,以及制定更加健康的膳食计划。
维生素c含量测定碘量法实验报告

维生素c含量测定碘量法实验报告
实验目的:
本实验旨在通过维生素c含量测定碘量法,掌握测定维生素c的方法和技能,同时加深对维生素c的认识。
实验原理:
碘量法是一种常用的测定维生素c含量的方法。
其原理是利用维生素c在氯化亚铁和碘酸钾的存在下,被氧化为脱氢抗坏血酸,然后用碘量法测定反应结束时残余的碘量,从而计算出维生素c的含量。
实验步骤:
1.将维生素c样品溶解于少量水中,加入5%的氯化亚铁溶液,使其完全还原。
2.加入2ml的碘酸钾溶液,并用0.1mol/L的氢氧化钠溶液调节溶液pH值为2-3。
3.用0.1mol/L的硫酸滴定溶液滴定反应液,直至溶液呈浅黄色,再加入几滴淀粉指示剂,继续滴定至溶液呈蓝色。
4.测量反应液的体积,计算出维生素c的含量。
实验结果:
在本实验中,我们测定了三个不同维生素c含量的样品,分别为0.1g、0.2g和0.3g。
在滴定过程中,我们发现反应液颜色会在滴定末几滴发生明显变化,这时需谨慎滴加滴定液,避免过度滴定。
最终的实验结果表明,三个样品的维生素c含量分别为0.096g、0.192g和0.284g。
实验结论:
通过本实验,我们掌握了维生素c含量测定碘量法的方法和技能,同时加深了对维生素c的认识。
实验结果表明,维生素c含量与样品添加量成正比,可以通过碘量法准确测定。
实验注意事项:
1.在实验过程中,应注意安全,避免溶液溅出,避免接触皮肤和眼睛。
2.在滴定时,应注意滴定液的速度,避免过度滴定。
3.实验前应检查所用试剂的质量和纯度,避免影响实验结果。
4.实验后应及时清洗实验器材,保持实验室卫生。
碘量法测定Vc的含量

一、实验目的 1.了解用碘量法测定维生素 C 含量的原理。 2.进一步熟悉电子天平的使用和滴定操作。 二、实验原理: 氧化还原法是利用氧化还原反应为基础的容量分析方法。 几乎所有元素和许多有机化合 物的含量,都能直接或间接地利用氧化还原法进行测定,因此它的应用范围极为广泛。根据 所用氧化剂种类的不同,氧化还原法可以分成高锰酸钾法、重铬酸钾法、碘量法和溴酸钾法 等。 I2/I-电对的标准电极电势为 0.535V,因此 I2 是较弱的氧化剂,只能与较强的还原剂作 用;而 I-是中等强度的还原剂,能与许多强氧化剂及一般中等强度的氧化剂作用。由于这些 特点,碘量法在生产实践中获得了广泛的应用。 维生素 C 又名抗坏血酸,分子式为 C6H8O6,通常用于防治坏血病及各种慢性传染病的 辅助治疗。市售维生素 C 药片含淀粉等添加剂。由于维生素 C 分子中的烯二醇基具有较强 的还原性,故能被 I2 定量地氧化成二酮基:
O C O C OH O C O C O C O C H C OH C H H C OH H C OH OH CH H OH CH H+I2+
2HI
维生素 C 的半反应为 C6H8O6 = C6H6O6 + 2H+ + 2e φθ= +0.18V - 1mol 维生素 C 与 1mol I2 定量反应,维生素 C 的摩尔质量为 176.12g·mol 1。 维生素 C 的还原性很强,在空气中极易被氧化,尤其在碱性介质中更甚,所以测定时 加入 HAc 使溶液呈弱酸性,减少维生素 C 的副反应,避免引起实验误差。 I2 溶液的浓度可以由已知浓度的 Na2S2O3 标准溶液滴定,以淀粉溶液为指示剂,滴定至 蓝色刚好消失即为终点,它们之间发生如下反应: - - - 2S2O32 + I2 = S4O62 + 2I 根据以上反应,可计算出药片中维生素 C 的含量:
维生素C药片中Vc含量的测定(碘量法)

1、配制2mol/L醋酸溶液。量取6mL冰醋酸稀释至50mL
2、维生素C的提取。取10片药剂,准确称量其质量。研成细粉末并混均匀,准确称取粉末约0.6g(三份)。置于锥形瓶中,操作一定要快,加50mL蒸馏水稀释,马上进行下一步滴定。(若颜色太深可加蒸馏水稀释)
3、维生素C的测定。向锥形瓶中加入10mL2mol/LHAc溶液,2mL淀粉溶液,立即用标准碘液(酸式滴定管)进行滴定至溶液刚好呈现蓝色,30s内不褪色即为终点.记下体积,平行滴定三次,,计算Vc的含量。
C% %
M(药片)=176.13g/mol
六、注意事项
1、实验中所用指示剂为淀粉溶液。I2与淀粉形成蓝色的加合物,灵敏度很高。温度升高,灵敏度反而下降。淀粉指示剂要在接近终点时加入。
2、用心煮沸并冷却的蒸馏水:否则Na2S2O3因氧气和二氧化碳和微生物的作用而分解,使滴定时消耗Na2S2O3溶液的体积偏大。
2
3
V(I2) / mL
V(Na2S2O3) 初读数/ mL
V(Na2S2O3) 终读数/ mL
V(Na2S2O3) / mL
c (I2)=0.5×C(Na2S2O3)×25.00/V(I2)
表三:维生素C药片Vc含量的测定
1
2
3
m(药片)/ g
V(I2) 初读数/ mL
V(I2) 终读数/ mL
V(I2) / mL
Na2S2O3标定时有:n(K2C2O7): n(Na2S2O3)=1:6
三、实验药品及仪器
实验药品和试剂:
I2分析纯KI溶液100g·L-1Na2S2O3·5H2O溶液0.0170mol.L-1K2C2O7溶液淀粉指示剂5 g·L-1Na2CO3固体 HCl溶液 6mol.L-1冰醋酸维生素C药片
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实训x :直接碘量法测定维生素C 片的含量
一、目的要求:
通过实训掌握直接碘量法测定Vc 片含量的原理及其操作。
熟悉片剂通过滴定分析测定含量时的处理方法。
二、原理:
维生素C(C 6H 8O 6),分子结构中的烯二醇基具有还原性,能被I 2定量地氧化成二酮基,抗坏血酸分子中的二烯醇基被I 2完全氧化后,则I 2与淀粉指示剂作用而使溶液变蓝,因此当滴定到溶液出现蓝色时即为终点。
维生素C 在空气中极易被氧化,尤其在碱性介质中更甚,故该滴定反应在稀HAc 中进行,以减少维生素C 的副反应。
该反应产物HI 为酸性,醋酸酸性条件下不利于反应向右进行,但由于维生素C 的还原性很强,即使在弱酸性条件下,上述反应也进行得相当完全。
三、操作步骤:
直接碘量法:取本品10片,精密称定,研细,精密称取适量(约相当于维生素C0.2g ),置100ml 锥形瓶中,加新沸过的冷水100ml 与稀醋酸10ml 的混合液适量,振摇使维生素C溶解并稀释至刻度,迅速滤过,精密量取续滤液50ml ,加淀粉指示液1ml ,立即用碘滴定液(0.05mol ·L -1)滴定,至溶液显蓝色并持续30秒钟不褪。
每1ml 碘 滴定液(0.05mol ·L -1)相当于8.806mg 的C 6H 8C 6。
平行测定3份,计算含量。
四、计算:
维生素C 含量以标示量来计算,按下式计算: F (I 2)×V (I 2)×T (C 6H 8O 6)×W 平
%(C 6H 8O 6)=—————————————————×100% m ×规格
F-----滴定液浓度有效因数
V-----供试品消耗碘滴定液的体积 T-----滴定度
W 平-----平均片重g m------供试品取用量g 五、注意点:
1、在稀醋酸酸性介质中,维生素C 受空气中氧的氧化速度减慢,但供试品溶于稀醋酸后仍应立即进行滴定。
2、溶剂使用新沸过的冷水以减少水中溶解氧对测定的影响。
3、预处理:测定维生素C 制剂时,为消除辅料的干扰,滴定前要进行必要的处理。
如测定片剂时,片剂溶解后应滤过,取续滤液测定;测定注射液前应加丙酮,
O HO OH O C H
OH CH 2OH +I 2
O O O O C H OH CH 2OH +2HI HOAc
以消除注射液中抗氧剂亚硫酸氢钠的干扰。
X器材和药品
器材:分析天平(0.1mg),酸式滴定管(50mL)、锥形瓶(250ml)、量筒、棕色瓶(250mL)、漏斗、滤纸。
2.材料:I2(0.05mol·L-1),KI(20%)、HAc(2mol·L-1),淀粉指示剂(0.5%)。
学生实验报告:
实训x:直接碘量法测定维生素C的含量
一、目的要求:
二、原理:
四、数据处理及结果计算:
五、思考题
1. 在将维生素c片研成的粉末加溶剂制备溶液时,如果没有经过充分振摇就进行过滤并测定含量,对实验结果有什么影响?。
