无机化学习题解答第五章
无机化学最新第四版第五章思考题与习题

思考题1. “原子” 为什么不像过去那样定义为组成的基本粒子 ?2. 量子力学的轨道概念与波尔原子模型的轨道有什么区别和联系 ?3. 波函数与原子轨道有何关系 ? 与电子云有何关系 ?4. .量子力学原子模型是如何描述核外电子运动状态的 ?解 :用四个量子数 :主量子数 --------描述原子轨道的能级副量子数 ------ 描述原子轨道的形状角量子数 -------描述原子轨道的伸张方向自旋量子数 ---------描述电子的自旋方向 .5. 下列各组量子数哪些是不合理的 ? 为什么 ?n l m(1 2 1 0(2 2 2 -1(3 3 0 +1解:(2 , (3不合理。
当 n=2时, l 只能是 0, 1,而(2中的 l =2,当 l =0时, m 只能是 0,而(3中的 m 却为 +16. 为什么任何原子的最外层最多只能有 8个电子 , 次外层最多只能有 18个电子 ?7. 为什么周期表中各周期的元素数目并不一定等于原子中相应电子层的电子最大容量数 (2n2?因为存在能级交错现象8. 量子数 n=3,l=1的原子轨道的符号是怎样的 ? 该类原子轨道的形状如何 ? 有几种空间取向 ? 共有几个轨道 ? 可容纳多少个电子 ?9. 在下列各组电子分布中哪种属于原子的基态 ? 哪种属于原子的激发态 ? 哪种纯属错误 ?(1 1s22s 1 (21s22s 22d 1(31s22s 22p 43s 1 (41s22s 42p 2 (1属于原子的基态; (3属于原子的激发态; (2 , (4纯属错误。
10.(1 试写出 s 区 ,p 区 ,d 区及 ds 区元素的价层电子构型 .(2 具有下列价层电子构型的元素位于周期表中哪一个区 ? 它们各是金属还是非金属 ?ns 2 ns 2np 5 (n-1d2ns 2 (n-1d10ns 2解:(1 所在区价层电子构型s ns 1-2p ns 2np 1-6d (n-1d1-10ns 1-2ds (n-1d10ns 1-2(2 价层电子构型 ns 2 ns 2np 5 (n-1d2ns 2 (n-1d10ns 2所在区 s p d ds金属或非金属金属非金属金属金属11. 已知某副元素的 A 原子 , 电子最后填入 3d, 最高氧化数为 +4,元素 B 的原子 , 电子最后填入 4p, 最高氧化数为 +5.回答下列问题 : (1 写出 A,B 元素原子的电子分布式 ;(2 根据电子分布 , 指出它们周期表中的位置 (周期 , 区 , 族 . 解:(1 A :1s 22s 22p 63s 23p 63d 24s 2B: 1s 22s 22p 63s 23p 63d 104s 24p 3 (2 A: 四周期, d 区, IVB 族元素 B :四周期, p 区, VA 族元素12. 不参看周期表 , 试推测下列每一对原子中哪一个原子具有较高的第一电离能和较大的电负性值 ?(1 19和 29号元素原子 (2 37和 55号元素原子(3 37和 38号元素原子解:(1 电子分布式周期族 19 [Ar]4s1 四 IA29 [Ar]3d104s 1四 IB故 29号元素具有较高的第一电离能和较大的电负性; (2 电子分布式周期族 37 [Kr]5s1 五 IA 55 [Xe]6s1 六 IA故 37号元素具有较高的第一电离能和较大的电负性 (3 电子分布式周期族 37 [Kr]5s1 五 IA38 [Kr]5s2 五 IIA故 38号元素具有较高的第一电离能和较大的电负性。
张祖德《无机化学习题》及答案第五章

第五章答案1. (1) 3.8×10−17 mol·dm−3(2) 3.58×10−2 mol·dm−3(3) 3.3×10−3 mol·dm−32. 2.90×10−703. (1) 1.34×10−4 mol·dm−3(2) 1.8×10−7 mol·dm−3(3) 1.8×10−5 mol·dm−34. FeS能溶于1.00 mol·dm−3的盐酸中,HgS则不溶。
5. 1.19×10−46. [Ag+]=[Cl−]=1.3×10−5 mol·dm−3[Ba2+]=[SO42−]=1.3×10−5 mol·dm−37. 4.9×10−108. 无CaSO4沉淀产生,有BaSO4沉淀产生。
9. (1) 3.8×10−4 mol·dm−3(2) 不相等。
因为F-离子的存在,大大减少了Sr2+的存在,增加了CO32-的存在。
10. 平衡时无PbBr2固体存在。
11. 7.3×10−412. 无ZnS沉淀,有CuS沉淀。
[H+]=0.32 mol·dm−3[Zn2+]=0.01 mol·dm−3[Cu2+]=3.74×10−15 mol·dm−313. (1) 52.7 mg/100 cm3(2) 7.0×10−4 mol·dm−314. (1) 无CdS沉淀,(2) 有CdS沉淀。
15. (1) pH=1.08(2) 有CaC2O4沉淀,第一种沉淀后不会有BaC2O4沉淀。
16. (1) 有Mg(OH)2沉淀。
(2) 加入12.8 g NH4Cl(s)。
17. (1) 1.84×10−14 mol·dm−3(2) 5.8×10−11 mol·dm−318. [Ag+]=2.4×10−5 mol·dm−3[MoO42−]=4.6×10−2 mol·dm−319. 111 mL20. (1) [SO42−]=1.8×10−5 mol·dm−3(2) 18%(3) 2.16×10−3 mol 21. [Sr2+]=8.7×10−4 mol·dm−3[Ba2+]=1.7×10−6 mol·dm−3[SO42−]=8.7×10−4 mol·dm−322. (1) AgCl先沉淀(2) [Cl−]=4.03×10−5 mol·dm−3(3) 7.15×10−4 g23. 95.6 %24. (1) 3.67 (2) 6.3925. 无BaF2沉淀产生26. 无AgAc沉淀产生27.28. −1.37 < pH ≤ 1.3329. 1.06 g30. [Br−]=3.0×10−5 mol·dm−3[I−]=4.8×10−9 mol·dm−331. 1.0×10−5 mol·dm−332. 3.0×10−1033. 1.7 g34. [Ag+]=1.0×10−8 mol·dm−3[Cl−]=0.017 mol·dm−3[Br−]=5.0×10−5 mol·dm−3[Na+]=0.067 mol·dm−3[NO3−]=0.05 mol·dm−335. [Ag+]=0.0053 mol·dm−3[Cl−]=3.2×10−8 mol·dm−3[Ba2+]=5.6×10−7 mol·dm−3[SO42−]=0.0027 mol·dm−336. 有ZnS和NiS沉淀37. 0.35 g·dm−338. 无FeS沉淀产生39. [Ba2+]=1.4×10−8 mol·dm−3[SO42−]=1.3×10−4 mol·dm−3[Sr2+]=6.0×10−3 mol·dm−3[CrO42−]=6.0×10−3 mol·dm−340. [Ag+]=1.3×10−11 mol·dm−3[Cl−]=1.4×10−2 mol·dm−3[I−]=6.4×10−6 mol·dm−3[Tl+]=1.4×10−2 mol·dm−341. [I−]=1.0×10−8 mol·dm−342. [Ag+]=4.3×10−10 mol·dm−3[NO2−]=1.1×10−4 mol·dm−343. (1) K=5.88×10−3(2) K=1.18×104对于同种类型的难溶电解质,在某种离子浓度相近时,K sp大的沉淀可以转化成K sp小的沉淀。
无机化学第五版习题答案

无机化学第五版习题答案第一章:化学元素、化合物和物质的分子结构1. 对Boron的五种常见同素异形体进行了描述,分别是?答:Boron的五种同素异形体分别是α-Rhombohedral、β-Rhombohedral、β-Tetragonal、γ-Orthorhombic和δ-Tetragonal。
2. 银属于哪一族元素,其原子序数是多少?答:银属于IB族元素,其原子序数为47。
第二章:价键理论3. 请解释共价键的性质和特点。
答:共价键是由两个非金属原子的外层电子轨道中的电子对共享而形成的。
共价键的性质和特点包括:a. 共价键的共用电子对能够保持原子之间的引力。
b. 共价键的长度取决于电负度差异。
c. 共价键的极性取决于原子间的电负差异。
d. 共价键的性质可通过价键角度和长度表示。
第三章:离子键和金属键4. 铁的晶体结构是什么?答:铁的晶体结构为面心立方结构。
5. 碳酸根离子的化学式是什么?答:碳酸根离子的化学式是CO3^2-。
第四章:配位化合物及配位化学6. 请说明涉及电子对的转移过程中存在的条件。
答:涉及电子对的转移过程中存在的条件包括价电子数、配体的电荷和配合物的稳定性等因素。
7. 请介绍一下Fe(H2O)6Cl3的晶体结构。
答:Fe(H2O)6Cl3的晶体结构是八面体结构。
第五章:反应动力学8. 简述活化能及其在反应动力学中的作用。
答:活化能是指在化学反应中分子需要克服的能量障碍。
在反应动力学中,活化能决定了反应速率的快慢,活化能越高,则反应速率越慢。
第六章:电化学9. 电解质溶液中的电导率表示什么?答:电解质溶液中的电导率表示电流通过单位横截面积的溶液所需要的电压。
10. 请问在锌电池中,锌的作用是什么?答:在锌电池中,锌的作用是作为阳极溶解释放电子,从而导致电化学反应的进行。
以上是无机化学第五版习题的部分答案,仅供参考。
更多内容建议阅读原书内容进行学习和理解。
中山大学无机化学(上册)第5章习题答案汇总

第5章 溶液与电离平衡习题答案原子量取四位有效数字,计算过程采用“四舍六入五成双”取舍,热力学数据除题目给出外均引用自书后附录以及兰氏手册。
1. 实验室某些常用的试剂百分浓度及密度分别是:(1)浓盐酸:含HCl 37.0%,密度1.19 g ⋅cm -3;加至3位有效数字 (2)浓硫酸:含H 2SO 4 98.0%,密度1.98 g ⋅cm -3; (3)浓硝酸:含HNO 3 70.0%,密度1.42 g ⋅cm -3; (4)浓氨水:含NH 3 28.0%,密度0.900 g ⋅cm -3。
试分别计算它们的物质的量浓度。
解:(1) -33-3-131.19g cm 1000cm 37.0%12.0mol dm 36.5g mol 1.0dmn c V ⋅⨯⨯===⋅⋅⨯ (2)19.8 mol·dm -3(3)15.8 mol·dm -3 (4)14.8 mol·dm -3 2. 是非题(1) 0.10 mol .dm -3 HAc 溶液中c (H +) = 1.3⨯10-3 mol .dm -3,故0.050 mol .dm -3 HAc 溶液中c (H +) = 0.65⨯10-3 mol .dm -3;(2)向浓度均为0.10 mol .dm -3的NH 3⋅ H 2O- NH 4Cl 的缓冲溶液中,加入HCl 使c (HCl) = 0.099 mol .dm -3,则由于溶液的缓冲作用,pH 不变;(3)Na 2CO 3溶液中通入适量CO 2气体,便可得到一种缓冲溶液; (4)多元弱酸盐的水解(如Na 3PO 4),以第一步水解为主;(5)将浓度均为0.10 mol .dm -3的HAc 和NaAc 混合溶液冲稀至浓度均为0.05 mol .dm -3,则由于HAc 电离度增大,混合溶液的酸度降低; (6)在一定的温度下,改变溶液的pH ,水的离子积不变; (7)弱电解质的电离度随弱电解质浓度降低而增大;(8)NH 4Ac 为一元弱酸碱盐,水解程度很大,故其水溶液的酸碱性很大。
无机化学各章节第五章答案(新)

第五章 习题5-2用质子理论判断下列物质哪些是酸?并写出它的共轭碱。
哪些是碱?也写出它的共轭酸。
其中哪些既是酸又是碱?H 2PO 4-,CO 32-,NH 3,NO 3-,H 2O ,HSO 4-,HS -,HCl解:酸HCl ,HSO 4- 碱CO 32-,NO 3-, 既是酸又是碱NH 3,H 2PO 4-,H 2O ,HS -, 5-3氨水是一弱碱,当氨水浓度为0.200 mol .L -1时,NH 3H 2O 的离解度α为0.946%,问当浓度为0.100 mol .L -1时NH 3H 2O 时电离度α为多少?解:222211ααθc c K a == %423.010.0%)946.0(02.0222112=⨯==c c αα 5-4 0.01 mol ⋅L -1 HAc 溶液的解离度为4.2%,求同一温度下,HAc 的解离常数和溶液的pH值。
解:5221076.1%)2.4(01.0-⨯=⨯==αθc K a∵{θc c /}﹒)(HAc K a θ=0.01×1.76×10-5>61.1210-,{θc c /}/)(HAc K a θ=0.01/1.76×10-5>81.210∴θc H c /)(+=θθc c K a /=01.01076.15⨯⨯-=4.2×10-3 pH=2.385-5水溶液中,强酸与强碱反应的离子反应式为 H + + OH -= H 2O , 反应的标准平衡常数Kθ=θwK 1; 强酸与弱一元碱反应的离子反应式为 B -+ H + = HB , 反应的标准平衡常数K θ=θ)(1HB a K , 弱一元酸与强碱反应的离子反应式为 HB +OH -= B -+ H 2O , 反应的标准平衡常数K θ=θθwHB a K K )( ; 弱一元酸与弱一元碱反应的离子反应式为HA + B - = A -+HB , 反应的标准平衡常数K θ=θθ)()(HB a HA a K K 。
无机化学第五章习题参考答案
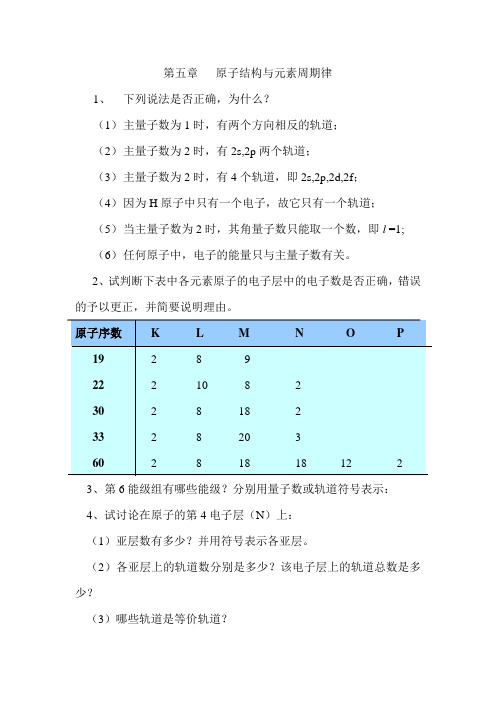
第五章原子结构与元素周期律1、下列说法是否正确,为什么?(1)主量子数为1时,有两个方向相反的轨道;(2)主量子数为2时,有2s,2p两个轨道;(3)主量子数为2时,有4个轨道,即2s,2p,2d,2f;(4)因为H原子中只有一个电子,故它只有一个轨道;(5)当主量子数为2时,其角量子数只能取一个数,即l =1;(6)任何原子中,电子的能量只与主量子数有关。
2、试判断下表中各元素原子的电子层中的电子数是否正确,错误的予以更正,并简要说明理由。
3、第6能级组有哪些能级?分别用量子数或轨道符号表示:4、试讨论在原子的第4电子层(N)上:(1)亚层数有多少?并用符号表示各亚层。
(2)各亚层上的轨道数分别是多少?该电子层上的轨道总数是多少?(3)哪些轨道是等价轨道?5、写出与下列量子数相应的各类轨道符号,并写出其在近似能级图中的前后能级所对应的符号:(1)n=2, l=1(2) n=3, l =2(3) n=4, l =0(4) n=4, l =36、在下列各项中,填入合适的量子数:(1)n=?, l=2, m=0, m s=±1/2(2)n=2, l=?, m=-1, m s=±1/2(3)n=4, l=?, m=+2, m s=±1/2(4)n=3, l=0, m=?, m s=±1/27、指出下列假设的电子运动状态(依次为n,l,m, m s),哪几种不可能存在?为什么?(1)3,2,+2,+1/2 (2)2, 2, -2, +1/2(3)2, 0, +1, -1/2 (4) 2, -1, 0, +1/2(5) 4, 3, -1, 18、原子吸收能量由基态变成激发态时,通常是最外层电子向更高的能级跃迁。
试指出下列原子的电子排布中,哪些属于基态或激发态,哪些是错误的。
(1)1s2 2s2 2p1(2)1s2 2s2 2p62d1(3) 1s22s22p43s1(4) 1s2 2s4 2p29、写出原子序数为45,52,79各元素的原子核外电子排布式及其价层电子构型。
高等无机化学课后习题答案第5章

第五章1.解释过渡金属的有机金属化合物的结构与金属d电子组态的关系:d6组态的有机金属化合物常采取六配位八面体结构;d8组态的采取五配位四方锥或三角双锥结构;d10组态的采取四配位四面体结构,并举出一些实例。
(提示:根据18电子规则)(P191)答:过渡金属有机金属化合物满足有效原子序数规则,即金属的全部电子数与所有配体提供的σ 电子的总和恰好等于金属所在周期中稀有气体的原子序数。
如果只考虑价层电子,那么金属价电子数加上配体σ 电子数的总和等于18 的分子是稳定的,即18 电子规则。
这一规则反映了过渡金属原子用它的5 个nd 轨道,一个(n+1)s 轨道和3个(n+1)p 轨道总共9个价轨道最大程度地成键,在每个价轨道中可容纳一对自旋相反的电子,共计18个电子形成稳定结构。
对于d6组态,其配位数为(18-6)/2 = 6 ,所以多采取六配位八面体结构,如[V(CO)6]-和Cr(CO)6等;对于d8组态,其配位数为(18-8)/2 = 5 ,所以采取五配位四方锥或三角双锥结构,如Fe(CO)5等;对于d10组态,其配位数为(18-10)/2= 4 ,所以采取四配位四面体结构,如Ni(CO)4等。
2.解释以下羰基伸缩振动频率的变化:[V(CO)6]-Cr(CO)5[Mn(CO)6]+cm-l1860 2000 2090答:配位化合物离子所带的电荷对νCO有影响,如上边的等电子系列中,负电荷增加,反馈作用增强,C≡O键削弱,使νCO 下降;反之正电荷阻止电173子从金属移向CO 的空轨道,反馈作用减弱,造成νCO 增加。
4.根据下列红外光谱图判断羰基的类型。
答:CO的不同配位方式可以通过红外光谱鉴定,已知中性分子中M-CO端基的CO伸缩振动频率在1900~2150cm-1范围内,而与正常双键性质相应的“酮式”CO,即μ2-桥基CO 的伸缩振动频率降低到1750~1850cm -1范围内,叁桥的μ3-CO 具有更低的伸缩振动频率。
《无机化学习题》及答案5

第五章答案1. (1) 3.8×10−17 mol·dm−3(2) 3.58×10−2 mol·dm−3(3) 3.3×10−3 mol·dm−32. 2.90×10−703. (1) 1.34×10−4 mol·dm−3(2) 1.8×10−7 mol·dm−3(3) 1.8×10−5 mol·dm−34. FeS能溶于1.00 mol·dm−3的盐酸中,HgS则不溶。
5. 1.19×10−46. [Ag+]=[Cl−]=1.3×10−5 mol·dm−3[Ba2+]=[SO42−]=1.3×10−5 mol·dm−37. 4.9×10−108. 无CaSO4沉淀产生,有BaSO4沉淀产生。
9. (1) 3.8×10−4 mol·dm−3(2) 不相等。
因为F-离子的存在,大大减少了Sr2+的存在,增加了CO32-的存在。
10. 平衡时无PbBr2固体存在。
11. 7.3×10−412. 无ZnS沉淀,有CuS沉淀。
[H+]=0.32 mol·dm−3[Zn2+]=0.01 mol·dm−3[Cu2+]=3.74×10−15 mol·dm−313. (1) 52.7 mg/100 cm3(2) 7.0×10−4 mol·dm−314. (1) 无CdS沉淀,(2) 有CdS沉淀。
15. (1) pH=1.08(2) 有CaC2O4沉淀,第一种沉淀后不会有BaC2O4沉淀。
16. (1) 有Mg(OH)2沉淀。
(2) 加入12.8 g NH4Cl(s)。
17. (1) 1.84×10−14 mol·dm−3(2) 5.8×10−11 mol·dm−318. [Ag+]=2.4×10−5 mol·dm−3[MoO42−]=4.6×10−2 mol·dm−319. 111 mL20. (1) [SO42−]=1.8×10−5 mol·dm−3(2) 18%(3) 2.16×10−3 mol 21. [Sr2+]=8.7×10−4 mol·dm−3[Ba2+]=1.7×10−6 mol·dm−3[SO42−]=8.7×10−4 mol·dm−322. (1) AgCl先沉淀(2) [Cl−]=4.03×10−5 mol·dm−3(3) 7.15×10−4 g23. 95.6 %24. (1) 3.67 (2) 6.3925. 无BaF2沉淀产生26. 无AgAc沉淀产生27.28. −1.37 < pH ≤ 1.3329. 1.06 g30. [Br−]=3.0×10−5 mol·dm−3[I−]=4.8×10−9 mol·dm−331. 1.0×10−5 mol·dm−332. 3.0×10−1033. 1.7 g34. [Ag+]=1.0×10−8 mol·dm−3[Cl−]=0.017 mol·dm−3[Br−]=5.0×10−5 mol·dm−3[Na+]=0.067 mol·dm−3[NO3−]=0.05 mol·dm−335. [Ag+]=0.0053 mol·dm−3[Cl−]=3.2×10−8 mol·dm−3[Ba2+]=5.6×10−7 mol·dm−3[SO42−]=0.0027 mol·dm−336. 有ZnS和NiS沉淀37. 0.35 g·dm−338. 无FeS沉淀产生39. [Ba2+]=1.4×10−8 mol·dm−3[SO42−]=1.3×10−4 mol·dm−3[Sr2+]=6.0×10−3 mol·dm−3[CrO42−]=6.0×10−3 mol·dm−340. [Ag+]=1.3×10−11 mol·dm−3[Cl−]=1.4×10−2 mol·dm−3[I−]=6.4×10−6 mol·dm−3[Tl+]=1.4×10−2 mol·dm−341. [I−]=1.0×10−8 mol·dm−342. [Ag+]=4.3×10−10 mol·dm−3[NO2−]=1.1×10−4 mol·dm−343. (1) K=5.88×10−3(2) K=1.18×104对于同种类型的难溶电解质,在某种离子浓度相近时,K sp大的沉淀可以转化成K sp小的沉淀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机化学习题解答(5)思虑题1.什么是氧化数?怎样计算分子或离子中元素的氧化数?氧化数是某一原子真实或模拟的带电数。
若某一原子其实不是真实获取若失去电子而带电荷,可以认为获取与之键合的电负性小于它的原子的电子或恩赐与之键合的电负性大于它的原子电子,尔后计算出来的带电情况叫氧化数。
已知其他原子的氧化数,求某一原子的氧化数时可用代数和的方法,中性分子总带电数为零;离子总带电数为离子的电荷。
2.指出以下分子、化学式或离子中划线元素的氧化数:As2 O3KO 2 NH +Cr2-Na 2S2O3Na 2O2 CrO 5 Na 2PtCl 6 N 2H2Na 2S5 42O7As O+2-2.+1,NH4-3 ,Cr2O7+3,Na2S2O3 +2,Na2O2 -1 ,CrO5+10,Na2PtCl 6+4,2 3 +3,KO2N2H2-1 ,Na2S5-2/5 ,3.举例说明以下看法的差异和联系:⑴氧化和氧化产物⑵还原和还原产物⑶电极反应和原电池反应⑷电极电势和电动势3.⑴氧化是失去电子氧化数高升,所得氧化态较高产物即为氧化产物。
⑵还原是获取电子氧化数降低,所得氧化态较较产物即为还原产物。
⑶在某个电极上发生的反应为电极反应,分为正极的还原反应和负极的氧化反应,总反应为原电池反应。
⑷固体电极资料与所接触的溶液间的电势差即为该原电池的电极电势。
两电极组成原电池时两电极间的电势差为该原电池的电动势。
4.指出以下反应中何者为氧化剂,它的还原产物是什么?何者为还原剂,它的氧化产物是什么?⑴2FeCl 3+Cu→FeCl 2+CuCl2⑵C u+CuCl2+4HCl→ 2H2[CuCl 3]⑶C u2O+H2SO4→ Cu+CuSO4+H2O4.⑴氧化剂:FeCl 3,还原产物: FeCl 2,还原剂: Cu,氧化产物:CuCl2。
⑵氧化剂: CuCl2,还原产物: 2H2[CuCl 3] ,还原剂: Cu,氧化产物: 2H2[CuCl 3] 。
⑶氧化剂: Cu2O,还原产物: Cu,还原剂: Cu2O,氧化产物: CuSO4。
5.离子 - 电子法配平氧化- 还原方程式的原则是什么?判断以下配平的氧化还原方程式可否正确,并把错误的予以改正。
⑴2FeCl 2+3Br2→2FeBr 3+4Cl -2+-+3+⑵Fe +NO +4H→ Fe +NO↑ +2H O325.原则是: (1) 依照质量守恒定律,反应前后各种元素的原子总数各自相等;(2)依照电荷平衡,反应前后各物种所带电荷总数之和相等。
⑴6FeCl 2+3Br2→2FeBr 3+4FeCl32+-+3+⑵3Fe +NO3 +4H → 3Fe +NO↑+2H2O 6.以下说法可否正确?⑴电池正极所发生的反应是氧化反应;⑵E 值越大则电对中氧化型物质的氧化能力越强;⑶E 值越小则电对中还原型物质的还原能力越弱;⑷电对中氧化型物质的氧化能力越强则还原型物质的还原能力越强。
6.⑴错。
电池正极所发生的反应是还原反应;⑵错。
氧化能力强弱还与该物质浓度有关;⑶错。
还原能力强弱还与该物质浓度有关;⑷错。
电对中氧化型物质的氧化能力越强则还原型物质的还原能力越弱。
5.书写电池符号应依照哪些规定?5.负极写在左边,正极写作右边,以双垂线( ‖) 表示盐桥,以单垂线( ︱ ) 表示两个相之间的界面。
盐桥的两边应该是半电池组成中的溶液。
若电对物质自己不能够导电,需引进辅助电极。
6.简述电池的种类,并举例说明。
6.除金属及其对应的金属盐溶液以外,还有金属极其难溶盐电极,如AgCl/Ag , Hg2Cl 2/Hg等。
还有非金属单质及其对应的非金属离子2+2-2-) 、同一种金属不( 如 H和 H,O和 OH,Cl和 Cl同价的离子 ( 如 Fe3+和 Fe2+,Sn4+和 Sn2+) 等。
7.怎样利用电极电势来确定原电池的正、负极,计算原电池的电动势?7.⑴计算,若已知电极物质的浓度,查出其表示电极电势,经过能斯特方程计算出电极电势,电极电势高的电极为正极,电极电势低的为负极。
⑵实验,把两电对物质连接起来,溶液间用盐桥,固体电极间用平衡电桥测出电动势,从电动势可知正、负极。
8.举例说明电极电势与有关物质浓度(气体压力)之间的关系。
8.电极电势与有关物质浓度(气体压力)之间的关系由能斯特方程确定。
氧化态(或电极半反应中在氧化态一边)物质浓度越高,其电极电势也越高。
如227227+ K Cr O溶液, K Cr O和 H浓度越大,其电极电势越高,氧化能力越强;还原态浓度越高,其还原能力越强。
如S2-溶2-浓度越低,其还原能力越弱,32-,但在 HgS积淀平衡中,液, S HNO能氧化 CuS积淀平衡中SO2-浓度很小,还原能力很弱, HNO3就不能够氧化 HgS积淀平衡中2-。
由于 HgS的K SP很小, S S 9.正极的电极电势总是正当,负极的电极电势总是负值,这种说法可否正确?9.这种说法是错误的。
两电对间的正、负极是电极电势的相对高低不相同,电极电势高的一端为正极,电极电势低的一端为负极。
与电极电势自己是正、负值没关。
电极电势正、负本身也是相对与标准氢电极人为规定的。
10.标准氢电极,其电极电势规定为零,那么为什么作为参比电极常采用甘汞电极而不用标准氢电极?10.标准氢电极的条件比较苛刻,要求H+浓度 ( 严格的说应为活度) 为?L-1,氢气的分压为100kPa,电极资料为海绵状铂黑。
在实质应用中,随着电极反应的进行,H+浓度马上变化,不再是标准态了,海绵状铂黑吸附了痕量杂质,电极电势也会改变,故实质使用标准氢电极作标准电极来测其他电极的电极电势的情况很少。
从甘汞电极的半反应可知[Hg 2Cl 2(s)+2e -2Hg(l)+2Cl-(aq)],在反应过程,仅有Cl -浓度有变化(固体、液体不计入能斯特方程),在溶液中自己有大量Cl -的情况下,在电极反应中,其电极电势是不变的。
11.同种金属及其盐溶液可否组成原电池?若能组成,盐溶液的浓度必定具备什么条件?11.只要电极电势不相同,就能组成原电池。
同种金属及其盐溶液只要金属离子浓度不相同,电极电势就不相同,就能组成原电池,这种原电池叫浓差原电池。
12.判断氧化还原反应进行方向的原则是什么?什么情况下必定用E值?什么情况下能够用E值?12.两电对的 E 值不相同,两电对间即可发生氧化还原反应, E 值大的氧化态物质作氧化剂,E值小的还原态物质作还原剂。
若两电对的 E 值相差较大(大于,一般直接用 E 值就可以判断正、负极;若两电对的 E 值相差较小(小于,就必定把各自浓度代入能斯特方程,计算出 E 值,再判断氧化还原反应可否进行。
若有积淀剂或配位体使金属离子浓度急剧减小,则无论两电对 E 值相差多大,都要把各自浓度代入能斯特方程,计算出 E 值,再判断氧化还原反应可否进行。
13.由标准锌半电池和标准铜半电池组成原电池:4-14-1)∣Cu( + )( - )Zn ∣ ZnSO(1mol ?L) ‖ CuSO(1mol ?L⑴改变以下条件时电池电动势有何影响?①增加 ZnSO4溶液的浓度;②增加 CuSO4溶液的浓度;③在 CuSO4溶液中通入H2S。
⑵当电池工作10min?后,其电动势可否发生变化?为什么?⑶在电池的工作过程中,锌的溶解与铜的析出,质量上有什么关系?13.⑴①电池电动势减小。
②电池电动势增大。
③电池电动势减小。
⑵当电池工作10min?后,由于Cu2+浓度减小, Zn2+浓度增大,电动势也减小。
⑶锌的溶解与铜的析出,摩尔数相同,质量上等于其摩尔质量比,: 。
14.试述原电池与电解槽的结构和原理,并从电极名称、电极反应和电子流动方向等方面进行比较。
14.原电池是由于两电对的电极电势不相同而发生的氧化还原反应,由于电子传达要经过外电路,两电对不直接接触,一般在两个容器中进行,中间用盐桥连接。
电极电势高的一极为正极,电极电势低的一端为负极。
电子从负极流向正极。
电解槽是在外加电源作用下强迫进行的氧化还原反应。
与外电源正极相连的为阴极,溶液中电活性物质或电极物质自己在此得电子,与外电源负极相连的为阳极,溶液中电活性物质或电极物质自己在此失去电子。
电子从阴极到阳极。
15.影响电解产物的主要因素是什么?当电解不相同金属的卤化物和含氧酸盐水溶液时,所得的电解产物一般规律怎样?15.影响电解产物的主要因素是电对物质的 E 值。
E 值越大其氧化态越易德电子而被还原。
16.金属发生电化学腐化的实质是什么?为什么电化学腐化是常有的而且危害又很大的腐蚀?16.金属发生电化学腐化的实质是金属失去电子、变成离子的过程。
裸露的金属与周边的介质常会发生析氢或吸氧腐化,使金属大量腐化,破坏了资料的力学结构或产品其他性质,产生了大量的危害或潜藏危害。
17.平时金属在大气中的腐化是析氢腐化还是吸氧腐化?分别写出这两种腐化的化学反应式。
17.18.镀层破裂后,为什么镀锌铁(白铁)比镀锡铁(马口铁)耐腐化?19.为什么铁制的工具在沾有泥土处很简单生锈?19.沾有泥土处有很多的溶有O2或 CO2的水,易组成原电池发生析氢腐化或吸氧腐化。
20 .用标准电极电势讲解:⑴将铁钉投入 CuSO 4溶液时, Fe 被氧化为 Fe 2+ 而不是 Fe 3+;⑵铁与过分的氯气反应生成FeCl 3 而不是 FeCl 2。
20 .⑴由于 E O (Fe 2+/Fe)= , E O (Fe 3+/Fe 2+)= ,而 E O (Cu 2+/Cu)= ,O 2+ O 2+ O 3+ 2+ 2+ 3+ E (Fe /Fe) < E (Cu /Cu) < E (Fe /Fe ) ,故 Fe 被氧化为 Fe 而不是 Fe ;21.一电对中氧化型或还原型物质发生以下变化时,电极电势将发生怎样的变化?⑴还原型物质生成积淀;⑶氧化型物质生成弱电解质;⑷氧化型物质生成积淀。
21.⑴还原型物质生成积淀时,电极电势将增大; ⑵氧化型物质生成配离子,电极电势将减小;⑶氧化型物质生成弱电解质,电极电势将减小;⑷氧化型物质生成积淀,电极电势将减小。
习题1.用离子 - 电子法配平以下反应式(酸性介质)--2+⑴MnO +Cl→ Mn +Cl242+-+Bi 3+⑵Mn +NaBiO 3→ MnO 4⑶Cr 3+2-2++PbO 2 → Cr 2O 7 +Pb-2+⑷C H O+MnO → C H O+Mn38 43 62⑸ H ClO 3+P 4→ Cl - +H 3PO 4⑹ I - +H 2O 2→ I 2+H 2O- ⑺MnO 4+H 2O 2→ 2+Mn +O 2+H 2O⑻ C u 2S+HNO 3→ Cu(NO 3) 2+S+NO+H 2O-+-2+×22Cl-- 2e -→ Cl 2 ×51.⑴ MnO 4 +8H +5e → Mn +4H 2O--+2+2MnO +10Cl+16H ==2Mn +5Cl +8H O422⑵Mn 2++4H 2O - 5e - → MnO 4- +8H +×2 NaBiO 3+6H ++2e - → Bi 3++3H 2O × 52++-3+2Mn +5NaBiO +14H==2MnO +5Bi+7HO3423+-2-+×1 PbO +-2+⑶2Cr +7H 2O - 6e →Cr 2O 7 +14H2+4H +2e → Pb +2H 2O × 32Cr 3+O 2- 2+ + +2PbO+HO=== 2Cr2 +2Pb +2H27-+-2+× 4 C3H 8O - 4e -+2H 2O → C 3H 6O 2 +× 5⑷MnO 4 +8H +5e → Mn +4H 2O +6H- + 2+4MnO +5C 3H 8O+2H===4Mn +5C 3H 8O+6H 2O⑸ H ClO 3+5H ++6e - → Cl - + 3H 2O ×10 P 4+16H 2O - 20e - → 4H 3PO 4+20H + × 310HClO 3+ 3P 4+18H 2O=== 10Cl - +12H 3PO 4+10H +2 2+-2× 12I - - 2e - → I 2× 1⑹H O+2H +2e → 2H OH 2O 2+2H ++2I - ===2HO+ I 2- +-2+×2HO - 2e -+×5⑺MnO +8H +5e→ Mn +4H O2→ O+2H4222-+ 5H 2O 2 +2+2MnO 4 +6H ===2Mn +5O 2+8H 2O3+-→NO+2HO× 4 Cu2S - 4e -2+×3⑻HNO+3H +3e→2Cu +S+2+4HNO 3+12H +3Cu 2S===4NO+6Cu+3S +8H 2O16HNO 3+3Cu 2S===4NO+6Cu(NO 3)2+3S +8H 2O2.用离子电子法配平以下反应式(碱性介质)。
