高二化学选修4第四章 单元测试试题及答案
新课标人教版高中化学选修4第四章测试题
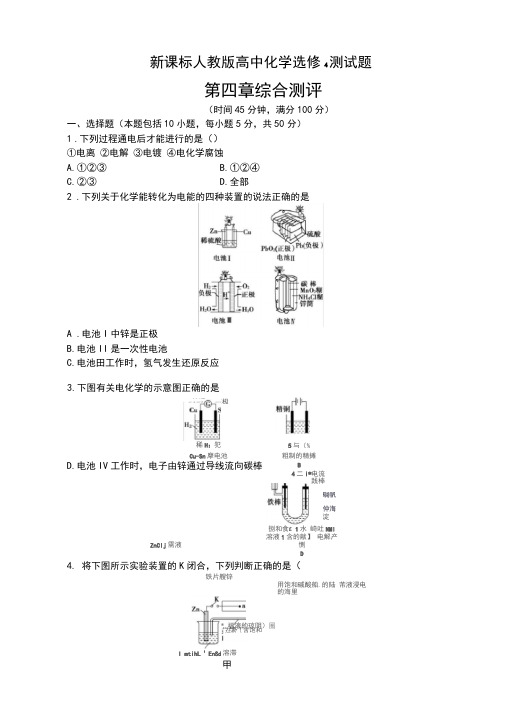
新课标人教版高中化学选修4测试题第四章综合测评(时间45分钟,满分100分)一、选择题(本题包括10小题,每小题5分,共50分)1 .下列过程通电后才能进行的是()①电离 ②电解 ③电镀 ④电化学腐蚀A.①②③B.①②④C.②③D.全部2 .下列关于化学能转化为电能的四种装置的说法正确的是A .电池I 中锌是正极B.电池II 是一次性电池C.电池田工作时,氢气发生还原反应D.电池IV 工作时,电子由锌通过导线流向碳棒ZnClj 需液铁片艘锌用饱和碱酸船.的陆 芾液浸电的海里I mtihL 1 EnSd 溶滞®福液的琼阴)圈 拄新{含饱和3.下图有关电化学的示意图正确的是蛇援 正极4. 将下图所示实验装置的K 闭合,下列判断正确的是(稀H :犯Cu-Sn 摩电池 5与(% 碉帆仲海淀粗制的精摊B捌和食£1水 崎吐NMI溶液1含的献】 电解产恻D 4二i*电流 践棒A . Cu电极上发生还原反应B.电子沿Zn一a一b一Cu路径流动C.片刻后甲池中c(so4一)增大D.片刻后可观察到滤纸b点变红色5.铁锲蓄电池放电时的总反应式为Fe+ Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2,下列有关该电池的说法正确的是()A.电池的负极为Ni2O3,正极为FeB.电池的电解液可能是碱性溶液,也可能是酸性溶液C.电池放电时,正极反应式为Ni2O3+3H2O + 2e ===2Ni(OH)2+2OHD.电池充电时,阳极附近溶液的pH升高6.X、Y、Z、W四块金属板分别用导线两两相连浸入稀硫酸中构成原电池。
X、Y相连时,X 为负极;Z、W相连时,外电路电流方向是W-Z; X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。
据此判断四种金属的活动性顺序是()A. X>Z>W>YB. Z>X>Y>WC. X>Y>Z>WD. Y>W>Z>X7.下列与金属腐蚀有关的说法,正确的是()舞触化的3%WCI溶淞图1 图2 图3A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重8.图2中,发生吸氧腐蚀C.图3中,燃烧灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁相当于原电池的正极8.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。
(完整)人教版高中化学选修4第四章《电化学基础》单元测试试题(含答案),推荐文档

人教版高中化学选修4 第四章《电化学基础》单元测试试题(含答案)第四章《电化学基础》单元测试题一、单选题(每小题只有一个正确答案)1.利用反应 Zn+Cu2+= Zn2++ Cu 设计成原电池。
则该电池的负极、正极和电解质溶液选择合理的是()A.Zn、Cu、ZnSO4B.Cu、Zn、 ZnCl2C.Cu、Zn、CuCl2D.Zn、Cu、CuSO42.控制适合的条件,将反应 2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池。
下列判断不正确的是()A.为证明反应的发生,可取甲中溶液加入铁氰化钾溶液B.反应开始时,甲中石墨电极上 Fe3+被还原,乙中石墨电极上发生氧化反应C.电流计读数为零时,在甲中溶入FeCl2固体时,甲中的石墨电极为正极D.此反应正反应方向若为放热,电流计读数为零时,降低温度后乙中石墨电极为负极3.某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu,电解质溶液都是CuSO4溶液,则下列说法正确的是()A.电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极ⅡB.电极Ⅰ发生还原反应C.电极Ⅳ逐渐溶解D.电极Ⅲ的电极反应:Cu-2e-=Cu2+4.已知海水中含有的离子主要有 Na+、Mg2+、Cl-、Br-,利用下图装置进行实验探究,下列说法正确的是()A.X 为锌棒,K 置于 M,可减缓铁的腐蚀,铁电极上发生的反应为 2H++2e-=H2↑1 / 14B.X 为锌棒,K 置于 M,外电路电流方向是从 X 到铁C.X 为碳棒,K 置于 N,可减缓铁的腐蚀,利用的是外加电流的阴极保护法D.X 为碳棒,K 置于 N,在 X 电极周围首先失电子的是Cl- 5.下列解释事实的反应方程式不正确的是()A.热的纯碱溶液可去除油污:CO 3 2-+2H2 O H2 CO3 +2OH-B.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-2e-=Fe2+C.以Na2S 为沉淀剂,除去溶液中的Cu2+:Cu2++S2-=CuS↓D.向电解饱和食盐水的两极溶液中滴加酚酞,阴极变红:2H2O+2e-==H2↑+2OH-6.化学与科学、技术、社会、环境密切相关。
(完整版)人教版高中化学选修4第四章《电化学基础》单元测试题(解析版)

第四章《电化学基础》单元测试题一、单选题(每小题只有一个正确答案)1.下列叙述中,正确的是()①电解池是将化学能转变成电能的装置①原电池是将电能转变成化学能的装置①金属和石墨导电均为物理变化,电解质溶液导电是化学变化①不能自发进行的氧化还原反应,通过电解的原理有可能实现①Cu+2Ag+===Cu2++2Ag,反应既可以在原电池中实现,也可以在电解池中实现,其他条件相同时,二种装置中反应速率相同A.①①①①B.①①C.①①①D.①2.铅蓄电池的工作原理为Pb+PbO2+2H2SO42PbSO4+2H2O,研读下图,下列判断不正确的是()A. K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO42-B.当电路中转移0.2 mol电子时,①中消耗的H2SO4为0.2 molC. K闭合时,①中SO42-向c电极迁移D. K闭合一段时间后断开,①可单独作为原电池,d电极为正极3.一定条件下,碳钢腐蚀与溶液pH的关系如下:下列说法不正确的是()A.在pH<4溶液中,碳钢主要发生析氢腐蚀B.在pH>6溶液中,碳钢主要发生吸氧腐蚀C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-===2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓4.锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。
下列说法不正确的是()A.充电时电极a连接电源的负极B.放电时负极的电极反应式为Zn—2e-===Zn2+C.放电时左侧电解质储罐中的离子总浓度增大D.阳离子交换膜可阻止Br2与Zn直接发生反应5.下图为铜锌原电池示意图,下列说法正确的是()A.锌片逐渐溶解B.烧杯中溶液逐渐呈蓝色C.电子由铜片通过导线流向锌片D.锌为正极,铜为负极6.下列关于金属的防护方法的说法不正确的是()A.我们使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用B.给铁件通入直流电,把铁件与电池负极相连接C.轮船在船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法D.钢铁制造的暖气管管道外常涂有一层较厚的沥青7.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是()A.铜电极上发生氧化反应B.电池工作一段时间后,甲池的c(SO42-)减小C.电池工作一段时间后,乙池溶液的总质量增加D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡8.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解)。
高中化学高二化学选修4配套试题及参考答案第4章第1节

第四章第一节一、选择题1.某同学根据离子反应方程式2Fe3++Fe===3Fe2+来设计原电池。
下列设计方案中可行的是()A.电极材料为Fe和Zn,电解质溶液为FeCl3溶液B.电极材料为Fe和Cu,电解质溶液为Fe(NO3)3溶液C.电极材料为Fe和石墨,电解质溶液为FeCl2溶液D.电极材料为石墨,电解质溶液为FeCl3溶液【参考答案解析】:据反应2Fe3++Fe===3Fe2+知,负极发生氧化反应的是Fe-2e-===Fe2+,因此Fe作负极,正极应是活泼性比Fe弱的金属或碳棒,电解质溶液应是可溶性铁盐酸,B合适。
【参考答案】:B2.下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:卡片:No.28时间:2014.03.20实验后的记录:①Zn为正极,Cu为负极②H+向负极移动③电子流动方向为Zn―→Cu④Cu极有H2产生⑤若有1 mol电子流过导线,则产生的H2为0.5 mol⑥正极反应式:Zn-2e-===Zn2+卡片上的描述合理的是()A.①②③B.③④⑤C.①⑤⑥D.②③④【参考答案解析】:构成原电池的正极是Cu,负极是Zn,故①错误;电子从负极Zn流出,流向正极Cu,H+向正极移动,在Cu上得电子:2H++2e-===H2↑,故②错误,③、④正确;此原电池负极上发生的反应是Zn-2e-===Zn2+,⑥错误;总反应方程式:Zn+2H +===Zn2++H2↑,当有1 mol电子通过时,产生H2为0.5 mol。
故⑤正确。
【参考答案】:B3.有a 、b 、c 、d 四个金属电极,有关的实验装置及部分实验现象如下:实验装置部分实验现象a 极质量减小,b 极质量增加b 极有气体产生,c 极无变化d 极溶解,c 极有气体产生电流从a 极流向d 极A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c【参考答案解析】:由第一个装置可知a 极溶解,故a 极是负极,可知金属活动性a>b ;第二个装置依据氧化性,还原性的规律可知金属活动性b>c ;由第三个装置得金属活动性d>c ;第四个装置电子从d →a ;故金属活动性d>a 。
人教版高中化学选修四单元测试题及答案全套.doc

最新人教版高中化学选修四单元测试题及答案全套第一章过关检测(时间:45分钟满分:100分)一、选择题(本题共8小题,每小题7分,共56分。
每小题只有一个选项符合题意)1•能源是当今社会发展的三大支柱Z—,有专家指出:如果对燃料燃烧产物如CO?、H20. N2等利用太阳能让它们重新组合,使之能够实现下图所示循环,那么不仅可以消除燃烧产物对大气的汚染,还可以节约燃料,缓解能源危机。
在此构想的物质循坏中太阳能最终转化为()CH4、NH)、CHjOH 兄0、CO2、N2太阳能A.化学能B.热能C.生物质能D.电能解析:从题图中可看岀:太阳能一>化学能一>热能。
答案:B2.下列与化学反应中能量变化相关的叙述正确的是()A.生成物总能量一定低于反应物总能量B.放热反应的反应速率总是大于吸热反应的反应速率C.根据盖斯定律,可计算某些难以直接测量的反应焰变D.同温同压下,H2(g)+Cl2(g)^2HCl(g)在光照和点燃条件的不同解析:生成物的总能量低于反应物的总能量的反应,是放热反应,若相反则是吸热反应,故A项错;反应速率与反应是吸热还是放热没有必然的联系,故B项错;C项是盖斯定律的重要应用,正确;根据△//=生成物的恰■反应物的焙,可知,焙变与反应条件无关,故D项错。
答案:C3.下列关于反应能量的说法正确的是()A.Zn(s)+CuSO4(aq)==ZnSO4(aq)+Cu(s) A//=-216 kJ-mof1,则反应物总能量〉生成物总能量B.相同条件下,如果1 mol氢原子所具有的能量为&,1 mol氢分子所具有的能量为则2£,=£2C」01 kPa 时,2H2(g)+O2(g) ----- 2H2O(1) A//=-571.6 kJ-mof1,则H2的燃烧热为571.6 kJ mol"D.氧化还原反应一定是放热反应解析:A项正确,因为该反应为放热反应;B项错误,因为分子变成原子要破坏化学键,吸收能量,2&>E2;C项错高温误,出的燃烧热是1 mol氢气充分燃烧,生成液态水时放出的热量;D项错误,如C+CO2==2CO,此反应是氧化还原反应,但是属于吸热反应。
华师一附中高二电解池单元测试

选修4第四章 电化学基础2电解池和金属的电化学腐蚀与防护单元测试题班级_________ 姓名__________ 分数_______________一、选择题(每题有1-2个正确答案。
每题3分,共计54分)1. Cu 2O 是一种半导体材料,基于绿色化学理念设计的制取.Cu 2O 的电解池示意图如下,电解总反应:2Cu+H 2O==Cu 2O+H 2↑,下列说法正确( ) A.石墨电极上产生氢气 B.铜电极发生还原反应C.铜电极接直流电源的负极D.当有0.1mol 电子转移时,有0.1molCu 2O 生成2.常温时,将500 ml pH=5的CuSO 4 溶液用石墨电极电解一段时间,测得溶液的pH 变为2,若使溶液的浓度、pH 与电解前相同,可采用的方法( )A .向溶液中加入0.245g Cu (OH)2B .向溶液中加0.31g CuSO 4C .向溶液中加0.0025 mol H 2 SO 4并加热D .向溶液中加0.2g CuO3.近年来,加“碘”食盐较多使用了碘酸钾(KIO 3)。
KIO 3在工业上可用电解法制取,以石墨和铁为电极,以KI 溶液为电解液在一定条件下电解。
反应方程式为KI+H 2O →KIO 3+H 2↑。
下列有关说法中正确的是 ( ) A.电解时,石墨作阳极,铁作阴极 B.电解时,在阳极上产生氢气C.电解后得到KIO 3产品的步骤有:过滤→浓缩→结晶→灼烧D.电解中,每转移0.6 mol 电子,理论上可得到0.1 mol 无水KIO 3晶体 4.关于铅蓄电池的说法正确的是 ( )A.在放电时,正极发生的反应是Pb(s)+SO 42-(aq)-2e-=PbSO 4(s)B.在放电时,该电池的负极材料是铅板C.在充电时,电池中硫酸的浓度不断变小D.在充电时,阳极发生的反应是PbSO 4(s)+2e-=Pb(s)+SO 42-5. 三氧化二镍(Ni 2O 3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl 2溶液pH 至7.5,加放适量硫酸钠后进行电解。
2015-2016学年高二人教版化学选修四练习:4章测评A、B Word版含答案

第四章测评A(基础过关卷)(时间:45分钟满分:100分)第Ⅰ卷(选择题共48分)一、选择题(本题包括12小题,每小题4分,共48分。
每小题只有一个选项符合题意)1.下列事实不能用电化学原理解释的是()A.铝片不用特殊方法保护B.轮船水线下的船体上装一定数量的锌块C.纯锌与稀硫酸反应时,滴入少量CuSO4溶液后速率增大D.镀锌铁比较耐用解析:铝能与空气中的O2化合生成致密的氧化膜,保护铝不受腐蚀;B项是牺牲阳极的阴极保护法;C项锌与置换出的铜构成原电池,加快反应速率;镀锌铁一旦破损,锌比铁活泼,仍能起保护作用,比较耐用。
答案:A2.下列叙述正确的是()A.电解饱和食盐水制烧碱时,Fe作阳极,石墨作阴极B.电解氯化铜溶液时,阳极上产生的气体质量和阴极上析出的铜的质量相等C.钢铁在空气中发生电化学腐蚀时,铁作负极D.原电池工作时,阳离子移向电池的负极解析:电解饱和食盐水制烧碱时,阳极必须是惰性电极,A错误;电解氯化铜时,实质是电解氯化铜本身,阳极上产生的气体质量和阴极上析出的铜的质量不相等,B错误;钢铁在空气中发生电化学腐蚀,不论是析氢腐蚀还是吸氧腐蚀,均是铁作负极,C正确;原电池工作时,阳离子移向电池的正极,D错误。
答案:C3.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-Li2S+Fe,有关该电池的下列说法中,正确的是()A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价B.该电池的电池反应式为2Li+FeS Li2S+FeC.负极的电极反应式为Al-3e-Al3+D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-2Li++FeS解析:在该电池中Li是负极材料,材料中Li为0价,负极反应式为2Li-2e-2Li+,结合题给正极反应式可得出电池反应为2Li+FeS Li2S+Fe,选项A、C不正确,选项B正确;充电时阴极发生得电子的还原反应,选项D不正确。
人教版选修四化学单元测试题(四)及答案.doc

高二化学单元测试题(四)姓名:班级:座号:成绩:本试卷分第一部分(选择题)和第二部分(非选择题),满分100 分,考试时间45 分钟。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cu 64 Cl 35.5第一部分选择题(共42 分)一、选择题(每小题只有 1 个选项符合题意,每小题 4 分,共 24 分。
)....1.下列关于强弱电解质的叙述错误的是( )A .弱电解质在溶液中部分电离,存在电离平衡B.在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同D.纯净的强电解质在液态时,有的导电,有的不导电2.下列叙述正确的是( )A .无论是纯水,还是酸性、碱性或中性的稀溶液,在常温下,其+) ·c(OH-- 14 c(H )= 1× 10+- 7mol/L 的溶液一定是中性溶液B.c(H )等于 1× 10+3COOH溶液中的c(H +C.0.2 mol/L CH 3COOH 溶液中的 c(H )是 0.1 mol/L CH )的 2倍D.任何浓度的溶液都可以用pH 来表示其酸性的强弱3.水的电离过程为H2 ++OH-,在不同温度下其平衡常数为K W (25℃ )=1.0×-14 , K(35℃ )=2.1×10 - 14( )10 。
下列叙述正确的是+A . c(H )随着温度的升高而降低+-)B.35℃时纯水中 c(H )> c(OHC.向水中加入 NaHSO4溶液会抑制水的电离D.向水中加入 NaHCO 3溶液会抑制水的电离4.用标准的 KOH 溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( ) A .配制标准溶液的固体KOH 中混有 NaOH 杂质B.滴定终点读数时,仰视滴定管的刻度,其他操作正确C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液5.下列离子方程式属于盐的水解,且书写正确的是( )A . NaHCO 3溶液: HCO 3-+H2O CO32-+ H3O+B.NaHS 溶液: HS-+ H 2O H 2S+OH-C.Na 2CO3溶液: CO3 2-+ 2H2O-H 2CO3+ 2OHD. NH 4Cl 溶于 D2O 中: NH 4++ D2O+NH 3·D 2O+H6.牙齿表面由一层硬的成分为Ca5(PO4)3OH 的物质保护着,它在唾液中存在下列平衡:Ca5(PO4)3OH(s)2+ 4 3- -Ca5 (PO4)3 F(s)的溶解度比5Ca (aq)+ 3PO (aq)+ OH (aq) ,已知Ca5(PO4)3OH 更小,为了保护牙齿,世界各地均采用了不同的措施。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高二化学选修4第四章单元测试试题及答案第四章单元测试姓名班别学号成绩一、选择题(共18小题,每小题3分,共54分,每小题只有一个选项符合题意)1. 下列各变化中属于原电池反应的是( )A(在空气中金属铝表面迅速氧化形成保护层B(镀锌铁表面有划损时,也能阻止铁被氧化C(红热的铁丝与冷水接触,表面形成蓝黑色保护层D(浓硝酸比稀硝酸更能氧化金属铜-12. 铁棒与石墨棒用导线连接后浸入0.01mol•L的食盐溶液中,可能出现的现象是( )-A. 铁棒附近产生OH B. 铁棒逐渐被腐蚀C. 石墨棒上放出ClD. 石墨棒上放出O 223. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( ) ((- -A(电解饱和食盐水时,阳极的电极反应式为:2Cl,2e==Cl ? 2- -B(氢氧燃料电池的负极反应式:O+ 2HO+ 4e== 4OH 2 2C(粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu- 2+,2e== Cu- 2+D(钢铁发生电化学腐蚀的正极反应式:Fe,2e== Fe4. 用惰性电极电解100mL饱和食盐水,一段时间后,在阴极得到112mL H(标准状况),此时电解质溶液(体积变化忽略不计)的21pH为 ( )A. 13B. 12C. 8D.15. 用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,该电池放电时的总反应为:CH+2KOH+2O==KCO+3HO,下列说法错误的是( ) 42232A. 通甲烷的一极为负极,通氧气的一极为正极B. 放电时通入氧气的一极附近溶液的pH升高C. 放电一段时间后,KOH的物质的量不发生变化--2-D. 通甲烷的电极反应式是:CH+10OH,8e==CO+7HO 2436. 用两支惰性电极插入500mL AgNO溶液中,通电电解。
当电解3液的pH从6.0变为3.0时(电解时阴极没有氢气放出,且电解液在前后体积变化可以忽略),电极上析出的质量大约是( )A. 27mgB. 54 mgC. 108 mgD. 216mg7. 下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( ) (((A(该能量转化系统中的水也是可能循环的B(燃料电池系统产生的能量实际上来自于水-- C(水电解系统中的阳极反应:4OH2HO+O?+4e 222- -D(燃料电池放电时的负极反应:H+2OH2HO+2e 228. 对外加电流的保护中,下列叙述正确的是( )A. 被保护的金属与电源的正极相连B. 被保护的金属与电源的负极相连C. 在被保护的金属表面上发生氧化反应D. 被保护的金属表面上不发生氧化反应,也不发生还原反应9. 如下图所示,下列叙述正确的是( )A. Y为阴极,发生还原反应B. X为正极,发生氧化反应C. Y与滤纸接触处有氧气生成D. X为滤纸接触处变红10. 下面有关电化学的图示,完全正确的是( )11. 将等物质的量的KSO、NaCl、Ba(NO)、AgNO混合均匀后,24323置于指定容器中,加入足量的水,搅拌、静置、过滤。
取滤液,用铂电极电解一段时间。
则两极区析出的氧化产物与还原产物的质量比约3为( )A. 35.5:108B. 108:35.5C. 8:1D. 1:212. 用惰性电极电解饱和NaCO溶液,若保持温度不变,则一段23时间后( )+2- A(溶液的pH变大 B(c(Na)与c (CO)的3比值变大C(溶液浓度变大,有晶体析出 D(溶液浓度不变,有晶体析出13. 电解含下列离子的水溶液,若阴极析出相等质量的金属,则消耗的电量最多的是 ( )+2++A(Ag B(Cu C(Na2+D(Mg14. (2008江苏,5)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。
已知某镍镉电池的电解质溶液为KOH溶液,其充、放电放电按下式进行:Cd + 2NiOOH + 2HOCd(OH) + 2Ni(OH) 有关222充电该电池的说法正确的是( )--A(充电时阳极反应:Ni(OH),e + OH == NiOOH + HO 22B(充电过程是化学能转化为电能的过程C(放电时负极附近溶液的碱性不变-D(放电时电解质溶液中的OH向正极移动15. 已知蓄电池在充电时作电解池,放电时作原电池。
铅蓄电池4上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。
关于标有“+”的接线柱,下列说法中正确的是( ) ((A(充电时作阳极,放电时作负极 B(充电时作阳极,放电时作正极C(充电时作阴极,放电时作负极 D(充电时作阴极,放电时作正极-12-16. 在1LKSO和CuSO的混合溶液中,c(SO)=2.0 mol?L,2444用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L+(标准状况)气体,则原溶液中K的物质的量浓度为( )-1-1-1A. 2.0 mol?L B. 1.5 mol?L C. 1.0 mol?L D.-10.5 mol?L17. 在某电解质溶液里,用M和N作电极,通电一段时间后,发现M极质量减小,N极质量增大,符合这一情况的是( B )A. 电解质溶液是稀硫酸B. 金属M是阳极,金属N是阴极C. M和N都是石墨电极D. M是阴极,N是阳极18.(2008宁夏理综,10)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。
该电池负极发生的反应是( )+ - A. CHOH(g)+O(g) ==HO(1)+CO(g)+2H(aq)+2e 3222+- B. O(g)+4H(aq)+4e ==2HO(1) 22+ - C. CHOH(g) (1) ==CO(g)+6H(aq)+6 e 325--D. O(g)+2HO(1)+4 e==4OH 22二、填空(本题包括5个小题,共46分)19.(8分)右图为以惰性电极进行电解: (1)写出B、C、D各电极上的电极反应式和总反应方程式:A:________________________________,B:________________________________,总反应方程式:________________________;C:________________________________,D:________________________________,总反应方程式:___________________________; (2)在A、B、C、D各电极上析出生成物的物质的量比为__________________。
20.(10分)氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空:6(1)在电解过程中,与电源正极相连的电极上电极反应为__________________,与电源负极相连的电极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
2+2+(2)工业食盐含Ca、Mg等杂质,精制过程发生反应的离子方程式为________________________________________________________________________。
2-2-(3)如果粗盐中SO含量较高,必须添加钡试剂除去SO,该钡44试剂可以是_________。
a. Ba(OH)b. Ba(NO)c. 232BaCl22+2+2-(4)为了有效除去Ca、Mg、SO,加入试剂的合理顺序为4_________(选填a、b、c)a. 先加NaOH,后加NaCO,再加钡试剂 23b. 先加NaOH,后加钡试剂,再加NaCO 23c. 先加钡试剂,后加NaOH,再加NaCO 23(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过_________、冷却、_________(填写操作名称)除去NaCl。
21. (8分)如图A 直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:7(1)电源A上的a为________极;(2)滤纸B上发生的总化学方程式为___________________; (3)欲在电槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为________________,电极f上发生的反应为______________________________,槽中放的镀液可以是________或________(只要求填两种电解质溶液)。
22.(8分)电解原理在化学工业中有广泛应用。
右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为___________________________,在X极附近观察到的现象是 :__________________。
(2)Y电极上的电极反应式是_________,检验该电极反应产物的方法是 :____________________________________。
(3)如果用电解方法精炼粗铜,电解液a选用CuSO溶液,则X电48极的材料是_________,电极反应式是__________________,Y电极的材料是_________,电极反应式是__________________。
23.(12分)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:放电 + 2-Pb+PbO+4H+2SO2PbSO+2HO 2442 充电请回答下列问题(不考虑氢、氧的氧化还原):(1)放电时:正极的电极反应式是________________;电解液中HSO24的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO和Pb时,若按图连接,电解一段时间后,2则在A电极上生成________、B电极上生成________,此时铅蓄电池的正负极的极性将________。
第四章单元测试参考答案1. B2. B3. A4. A5. C6. B7. B8. B9. A 10.D 11. C 12. D 13. B 14. A 15. B 16. A 17. B 18. C电解 2+-- 19.(1)Cu+2e== Cu 2Cl-2e,Cl? CuCl Cu+ Cl? 222+---4Ag+4e== 4Ag 4OH-4e== 2HO+O? 4AgNO+2HO== 4Ag+O?22322+4HNO 3(2)2:2:4:19--2+2-20.(1)2Cl-2e== Cl? 升高 (2)Ca+CO== CaCO ?2332+-Mg+2OH== Mg(OH)? 2(3)ac(4)bc(5)加热蒸发过滤电解 1)正 (2)2NaCl+2HOH?+Cl?+2NaOH 21.(222-2+2+-(3)Zn—2e===Zn Zn+2e===Zn ZnSO溶液或ZnCl溶液 42+-22.(1)2H+2e==H? 有气泡,溶液变红 2--(2)2Cl—2e==Cl? 把湿润的淀粉KI试纸放在Y极附近,试纸22+-变蓝,说明Y极产物为Cl(3)纯铜 Cu+2e==Cu 粗铜 2-2+Cu-2e==Cu,+2-23.(1)PbO +2e+ 4H +2SO== PbSO + 2HO ;小;48 (2)2442Pb; PbO ;对换210。
