第一类医疗器械备案信息表041119093103
第一类医疗器械生产备案表
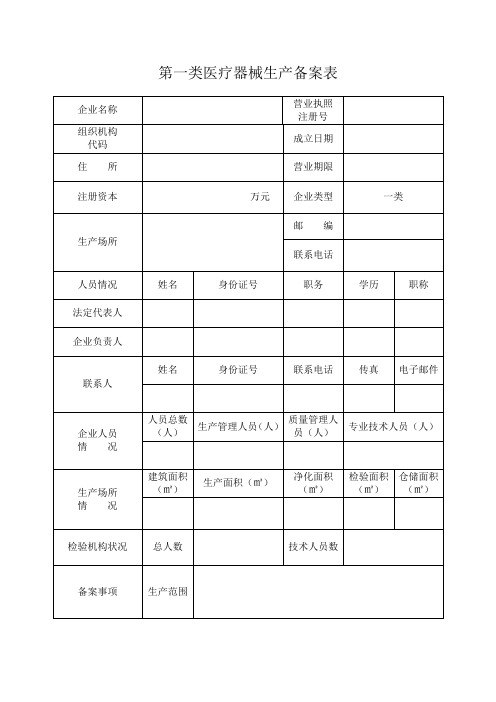
第一类医疗器械生产备案表
填表说明:
一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表生产范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表应使用A4纸双面打印,不得手写。
第一类医疗器械生产备案材料要求
1.第一类医疗器械生产备案表;
2.所生产产品的医疗器械备案凭证复印件;
3.经备案的产品技术要求复印件;
4.营业执照和组织机构代码证复印件;
5.法定代表人、企业负责人身份证明复印件;
6.生产、质量和技术负责人的身份、学历职称证明复印件;
7.生产管理、质量检验岗位从业人员、学历职称一览表;
8.生产场地的证明文件(有特殊生产环境要求的,还应提交设施、环境的证明文件)复印件;
9.主要生产设备和检验设备目录;
10.质量手册和程序文件;
11.工艺流程图;
12.经办人授权证明;
13.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
第一类医疗器械生产备案凭证
备案号:XX食药监械生产备XXXXXXXX号
备案部门(公章)
备案日期:年月日。
第一类医疗器械备案信息表

备案号:闽榕械备20170016号
备案人名称
福州市昕妍秀牛角制品有限公司
备案人组织机构代码
399840158
备案人注册地址
福州市闽侯县南屿镇中溪村溪坂自然村7号
生产地址
福州市闽侯县南屿镇中溪村溪坂自然村7号
代理人
------------------
代理人注册地址
------------------
HB-006
14*3.8*0.6
HC-012
14*6.1*0.6
HB-007
13.5*4*0.6
HC-013
12.6*5.5*0.6
HB-008
11.5*3*0.6
HC-014
14*7*0.6
HB-009
11.5*3.8*0.6
HC-015
15*3*1.0
HB-010
11*3*0.6
HD-001
12*3*0.9
HB-001
14*6*0.6
HC-007
9.8*5*0.6
HB-002
12.5*6*0.6
HC-008
9.5*5.4*0.6
HB-003
14*4*0.6
HC-009
9.8*5.8*0.6
HB-004
14*4.5*0.6
HC-010
9.5*5.2*0.6
HB-005
10*6*0.6
HC-011
9.6*5.2*0.6
产品名称
刮痧板
型号/规格
见附录一
产品描述
采用天然水牛角、黄牛角、羊角等材料加工磨光制成。
预期用途
用于刮痧。
备注
-------------------
第一类医疗器械备案信息表【模板】

手动病床主要采用碳钢、不锈钢、塑钢材料等设计、制造,主要由床头(尾)板、床架、床面、操作系统、侧护栏、档板和脚轮组成。
预期用途
手动病床主要用于在医疗监护下的成年患者的诊断、治疗或监护时使用,用以支撑患者身体,形成临床所需体位。
备注
备案单位
和日期
XX市XX区市场监督管理局
备案日期:2020年04月16日
第一类医疗器械备案凭证
XX市XXX医疗器械有限公司:
根据相关法规要求,对你单位第一类医疗器械:手动病床予以备案,备案号:粤顺械备********号。
XX市XX区市场监督管理局
日期:2020年04月16日
第一类医疗器械备案信息表
备案号:粤顺械备********号
备案人名称
XX市XXX医疗器械有限公司
备案人统一社会信用代码
变更情况
********MA54BMCH53
备案人注册地址
XX市XX区勒流街道黄连坝咀二路2号之五(住所申报)
生产地址
XX市XX区勒流街道黄连坝咀二路2号之五(住所申报)
代理人
/
代理人注册地址
/
产品名称
手动病床
型号/规格
KS101、KS102、KS103、KS201、KS202、KS301、KS302、KS303、KS401、KS402、KS403、KM101、KM102、KM103、KM201、KM202、KM203、KM301、KM302、KM303、KM401、KM402、KM403、KF001、KF002、KF003、KC101、KC102、KC103、KC201、KC202、KC203、KB001、KB002、KB003、KB004、KSK001、KSK002、KSK003、KSK004
第一类医疗器械备案资料

第一类医疗器械备案资料品名: **************有限公司目录备案号:一、第一类医疗器械备案表产品名称(产品分类名称):备案人 :南平市食品药品监督管理局制填表说明1.本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2.要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“∕”。
因备案表格式所限而无法填写完整时,请另附附件。
3.备案时应一并提交含有备案表内容(含附件)的电子文档(形式)。
4.境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5.如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6.境内医疗器械备案人应填写组织机构代码。
7.进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10.备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11.备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
注:填表前,请详细阅读填表说明中文******产品名称/原文(产品分类名称)/英文分类编码******结构特征有源□无源■体外诊断试剂□型号/ 规格******(包装规格)******产品描述(主要组成成分)******预期用途产品有效期(体外诊断试剂适用)备案人生产地址代理人/中文**********名称原文/英文/中文************注册地址原文/英文/联系人******电话************传真******电子邮箱******邮编******备案人******所在地组织机构******代码中******文原/文英/文名称/注册地址/邮编/联系人/电话/传真/电子信箱/代理人/所在地应附资料1.产品风险分析资料■2.产品技术要求■3.产品检验报告■4.临床评价资料■5.生产制造信息■6.产品说明书及最小销售单元标签设计样稿■7.证明性文件■8.符合性声明■其他需要说明的问题备案人: *****************有限公司(签章)日期:年月日二、产品风险分析报告品名: ****************有限公司提示:医疗器械应按照0316 《医疗器械风险管理对医疗器械的应用》的有关要求编制。
第一类医疗器械备案信息表

第一类医疗器械备案信息表
备案编号:
备案人名称
备案人统一社会信用ห้องสมุดไป่ตู้码
(境内医疗器械适用)
备案人住所
生产地址
代理人
(进口医疗器械适用)
代理人住所
(进口医疗器械适用)
产品名称
型号/规格
产品描述
预期用途
备注
备案部门
备案日期
***
(备案部门名称)
备案日期:年月日
变更情况
****年**月**日,**变更为**。
(进口体外诊断试剂适用)
产品分类名称(产品名称)
包装规格
产品有效期
主要组成成分
预期用途
备注
备案部门
备案日期
***
(备案部门名称)
备案日期:年月日
变更情况
****年**月**日,**变更为**。
……
境内备案人委托生产的,备注栏应当标注受托企业名称。
备案人应当确保提交的资料合法、真实、准确、完整和可追溯。
备案人实际生产产品应当与备案信息一致。
……
境内备案人委托生产的,备注栏应当标注受托企业名称。
备案人应当确保提交的资料合法、真实、准确、完整和可追溯。
备案人实际生产产品应当与备案信息一致。
第一类体外诊断试剂备案信息表
备案编号:
备案人名称
备案人统一社会信用代码
(境内体外诊断试剂适用)
备案人住所
生产地址
代理人
(进口体外诊断试剂适用)
代理人住所
第一类医疗器械备案表(隔离衣)

第一类医疗器械备案表产品名称(产品分类名称): 隔离衣备案人: 沈阳XX有限责任公司沈阳市市场监督管理局制填表说明1.本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2.要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“∕”。
因备案表格式所限而无法填写完整时,请另附附件。
3.备案时应一并提交含有备案表内容(含附件)的电子文档(E×cel形式)。
4.境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5.如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6.境内医疗器械备案人应填写组织机构代码。
7.进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10.备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11.备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
注:填表前,请详细阅读填表说明。
备案号沪械备号第一类医疗器械备案表

备案号:沪械备号第一类医疗器械备案表
产品名称(产品分类名称):
备案人:
以下由备案单位填写
申请类型:第一类医疗器械备案
资料号:沪备案- (例:2014沪浦备案-001)
备案日期:年月日
上海市药品监督管理局制
授权委托书
:
现委托以下人员作为我方(单位名称)行政许可申请一事的代理人,代理我(单位)办理(许可事项):
1、姓名:性别:身份证号码:
工作单位:
职务:电话:
委托权限:
□代为提出、变更、放弃行政许可申请;
□接收询问,行使陈述申辩权利;
□要求和参加听证;
□提交和接收法律文书。
代理期限:□自许可提出申请日起至年月日
□自许可提出申请日起至此次许可决定作出之日止
2、姓名:性别:身份证号码:
工作单位:
职务:电话:
委托权限:
□代为提出、变更、放弃行政许可申请;
□接收询问,行使陈述申辩权利;
□要求和参加听证;
□提交和接收法律文书。
代理期限:□自许可提出申请日起至年月日
□自许可提出申请日起至此次许可决定作出之日止
委托人:
法定代表人:
年月日
第一类医疗器械产品备案资料核对要点(首次备案)
上述1-6项,任意一项标注“×”或“否”则不予备案。
上述7-8项,标注“×”或“否”则表明提交资料不齐全,或不符合规定形式。
第一类医疗器械生产备案表

第一类医疗器械生产备案表
填表说明:
一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表生产范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表应使用A4纸双面打印,不得手写。
第一类医疗器械生产备案材料要求
1.第一类医疗器械生产备案表;
2.所生产产品的医疗器械备案凭证复印件;
3.经备案的产品技术要求复印件;
4.营业执照和组织机构代码证复印件;
5.法定代表人、企业负责人身份证明复印件;
6.生产、质量和技术负责人的身份、学历职称证明复印件;
7.生产管理、质量检验岗位从业人员、学历职称一览表;
8.生产场地的证明文件(有特殊生产环境要求的,还应提交设施、环境的证明文件)复印件;
9.主要生产设备和检验设备目录;
10.质量手册和程序文件;
11.工艺流程图;
12.经办人授权证明;
13.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
第一类医疗器械生产备案凭证
备案号:XX食药监械生产备XXXXXXXX号
备案部门(公章)
备案日期:年月日。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
备案号:鲁菏械备 20190005 号 棉签 14 注输、护理 产品结 有源□ 无源 体外诊断试剂□ 和防护器械 构特征
备案ห้องสมุดไป่ตู้名称
山东和福臣药业科技发展有限公司
备案人 统一社会信用代码 (组织机构代码)
91371702MA3C5UQF08
备案人注册地址 菏泽市经济开发区岳程办事处东北隅社区对过黄河东路路南
防护器械
构特征
备案人名称
山东贞泰医疗用品有限公司
备案人 统一社会信用代码 (组织机构代码)
91371700MA3NLY4KXB
备案人注册地址 菏泽市开发区岳程办事处东北隅社区黄河东路南侧
生产地址
菏泽市开发区岳程办事处东北隅社区黄河东路南侧
型号/规格 (包装规格)
型号/规格:5g、10g、20g、25g、30g、50g、100g、150g、200g、
生产地址
菏泽市牡丹区庞王中学西邻
型号/规格 (包装规格)
型号/规格:7cm、8cm、10cm、12cm、15cm、18cm、20cm、 25cm、30cm、35cm。
产品描述
包括吸水性材料。为了方便使用,部分产品有供手持的组件。
(主要组成成分)
不含消毒剂。非无菌提供,一次性使用。
预期用途
产品有效期 备注
第一类医疗器械备案信息表
产品名称 (产品分类名称)
产品分类编码
备案号:鲁菏械备 20190003 号
创口贴
14 注输、护理和 防护器械
产品结 构特征
有源□ 无源 体外诊断试剂□
备案人名称
山东贞泰医疗用品有限公司
备案人 统一社会信用代码 (组织机构代码)
91371700MA3NLY4KXB
备案人注册地址 菏泽市开发区岳程办事处东北隅社区黄河东路南侧
(主要组成成分)
不含消毒剂。非无菌提供,一次性使用。
预期用途
产品有效期 备注
用于对皮肤、创面进行清洁处理。
/ 产品技术要求编号:鲁菏械备 20190006 号
备案单位
/ 变更情况
菏泽市市场监督管理局 备案日期:2019 年 1 月 23 日
第一类医疗器械备案信息表
产品名称 (产品分类名称)
产品分类编码
备案人 统一社会信用代码 (组织机构代码)
91371700MA3NLY4KXB
备案人注册地址 菏泽市开发区岳程办事处东北隅社区黄河东路南侧
生产地址
菏泽市开发区岳程办事处东北隅社区黄河东路南侧
型号/规格 (包装规格)
型号/规格:21c 型、22c 型、27.5c 型(按照每 100mm 所含经纬纱
线数分类)/宽(40~240)×长(5000~8000)mm
250g、300g、350/450g、500g
产品描述 (主要组成成分)
包括吸水性材料。为了方便使用,部分产品有供手持的组件。不含消 毒剂。非无菌提供,一次性使用。
预期用途
产品有效期 备注
用于对皮肤、创面进行清洁处理。
/ 产品技术要求编号:鲁菏械备 20190011 号
备案单位
/ 变更情况
菏泽市市场监督管理局 备案日期:2019 年 1 月 23 日
生产地址
菏泽市开发区岳程办事处东北隅社区黄河东路南侧
型号/规格 (包装规格)
型号/规格:常规棉球、带尾棉球/小号(0.1g、0.2g、0.25g/粒)、
中号(0.3g、0.4g、0.5g/粒)、大号(0.6g、0.7g、0.8g/粒)
产品描述 (主要组成成分)
包括吸水性材料。为了方便使用,部分产品有供手持的组件。不含消 毒剂。非无菌提供,一次性使用。
产品结 构特征
有源□ 无源 体外诊断试剂□
备案人名称
山东贞泰医疗用品有限公司
备案人 统一社会信用代码 (组织机构代码)
91371700MA3NLY4KXB
备案人注册地址 菏泽市开发区岳程办事处东北隅社区黄河东路南侧
生产地址
菏泽市开发区岳程办事处东北隅社区黄河东路南侧
型号/规格 (包装规格)
型号/规格:7cm、8cm、10cm、12cm、15cm、18cm、20cm、25cm、
第一类医疗器械备案信息表
产品名称 (产品分类名称)
产品分类编码
备案号:鲁菏械备 20190006 号 棉球 14 注输、护理 产品结 有源□ 无源 体外诊断试剂□ 和防护器械 构特征
备案人名称
山东和福臣药业科技发展有限公司
备案人 统一社会信用代码 (组织机构代码)
91371702MA3C5UQF08
预期用途
产品有效期 备注
用于对皮肤、创面进行清洁处理。
/ 产品技术要求编号:鲁菏械备 20190010 号
备案单位
/ 变更情况
菏泽市市场监督管理局 备案日期:2019 年 1 月 23 日
第一类医疗器械备案信息表
产品名称 (产品分类名称)
产品分类编码
备案号:鲁菏械备 20190009 号
棉签
14 注输、护理和 防护器械
产品有效期 备注
/ 产品技术要求编号:鲁菏械备 20190004 号
备案单位
/ 变更情况
菏泽市市场监督管理局 备案日期:2019 年 1 月 23 日
第一类医疗器械备案信息表
产品名称 (产品分类名称)
产品分类编码
备案号:鲁菏械备 20190011 号
脱脂棉
14 注输、护理和 产品结 有源□ 无源 体外诊断试剂□
生产地址
型号/规格 (包装规格)
产品描述 (主要组成成分)
菏泽市开发区岳程办事处东北隅社区黄河东路南侧
型号/规格:无纺布型、PE 膜型、纸胶带型、棉布型、
/26cm×300cm 、26cm×400cm、26cm×500cm、2.5cm×300cm、 2.5cm×350cm、2.5cm×400cm、2.5cm×450cm、2.5cm×500cm、 2.0cm×200cm、2.0cm×300cm、2.0cm×400cm、2.0cm×500cm、 1.5cm×500cm、1.25cm×910cm、1.0cm×1000cm、1.0cm×900cm、 1.0cm×800cm、1.0cm×700cm、1.0cm×600cm、1.0cm×500cm、 1.0cm×400cm 、1.0cm×300cm、0.9 cm ×1000cm、0.9cm×900cm、 0.9cm×800cm、0.9cm×700cm、0.9cm×600cm、0.9cm×500cm、 0.9cm×400cm、0.9cm×300cm。
第一类医疗器械备案信息表
产品名称 (产品分类名称)
产品分类编码
备案号:鲁菏械备 20190008 号
医用压敏胶带
14 注输、护理和 防护器械
产品结 构特征
有源□ 无源 体外诊断试剂□
备案人名称
山东贞泰医疗用品有限公司
备案人 统一社会信用代码 (组织机构代码)
91371700MA3NLY4KXB
备案人注册地址 菏泽市开发区岳程办事处东北隅社区黄河东路南侧
由背材上涂有具有自粘特性的胶粘剂的胶带。部分胶带涂胶面有保护
层。非无菌提供,一次性使用。不与创面直接接触。粘贴部位为完好
皮肤。
预期用途
用于将敷料粘贴固定于创面或将其他医疗器械固定到人体的特定部位。
产品有效期 备注
/ 产品技术要求编号:鲁菏械备 20190007 号
备案单位
/ 变更情况
菏泽市市场监督管理局 备案日期:2019 年 1 月 23 日
产品描述 (主要组成成分)
由纺织加工而成的卷状、管状、三角形的材料。其形状可以通过绑扎 的形式对创面敷料进行固定或限制肢体活动,以对创面愈合起到间接 的辅助作用。部分具有弹力或自粘等特性。非无菌提供,一次性使用。 不与创面直接接触。粘贴部位为完好皮肤。
预期用途
用于对创面敷料或肢体提供束缚力,以起到包扎、固定作用。
生产地址
菏泽市开发区岳程办事处东北隅社区黄河东路南侧
型号/规格 (包装规格)
型号/规格:弹力型、透气型、PE 型、防水型/2cm×1.2cm 、
2cm×1cm、1.5cm×1.2cm、1.2cm×2.2cm、1.3cm×2.3cm、 1.1cm×2.1cm、7.2 cm ×1.9 cm。
产品描述 (主要组成成分)
由为背材上涂有具有自粘特性的胶粘剂的胶带。部分胶带涂胶面有保
护层。非无菌提供,一次性使用。不与创面直接接触。粘贴部位为完
好皮肤。
预期用途
用于对创面敷料、绷带等提供粘贴力,以起到固定作用。
产品有效期 备注
/ 产品技术要求编号:鲁菏械备 20190008 号
备案单位
/ 变更情况
菏泽市市场监督管理局 备案日期:2019 年 1 月 23 日
30cm、35cm
产品描述 (主要组成成分)
包括吸水性材料。为了方便使用,部分产品有供手持的组件。不含消 毒剂。非无菌提供,一次性使用。
预期用途
产品有效期 备注
用于对皮肤、创面进行清洁处理。
/ 产品技术要求编号:鲁菏械备 20190009 号
备案单位
/ 变更情况
菏泽市市场监督管理局 备案日期:2019 年 1 月 23 日
第一类医疗器械备案信息表
产品名称 (产品分类名称)
产品分类编码
备案号:鲁菏械备 20190007 号
医用压敏胶带
14 注输、护理和 防护器械
产品结 构特征
有源□ 无源 体外诊断试剂□
备案人名称
山东和福臣药业科技发展有限公司
备案人 统一社会信用代码 (组织机构代码)
91371702MA3C5UQF08
第一类医疗器械备案信息表
