化学反应工程知识点1~3讲义
(版)化学反应工程基础知识(笔记)

化学反响工程根底知识总结〔笔记〕1、化学反响工程是一门研究涉及化学反响的工程问题的学科。
如何将其在工业规模上实现是化学反响工程的主要任务。
2、理想置换反响器的特点:①由于流体沿同一方向,以相同速度向前推进,在反响器内没有物料的返混,所有物料通过反响器的时间都是相同的②在垂直于流动方向上的同一截面,不同径向位置的流体特性是一致的③在定常态下操作,反响器内状态只随轴向位置改变,不随时间改变。
3、全混流反响器的特性①物料在反响器内充分返混②反响器内各物料参数均一③反响器的出口组成与器内物料组成相同④反响过程中连续进料与出料,是一定常态过程。
4、返混的定义:物料在反响器内不仅有空间上的混合而是有时间上的混合,这种混合过程称返混。
5、非均相催化反响过程步骤①反响组分从流体主体向固体催化剂外外表传递②反响组分从外外表向催化剂内外表传递③反响组分在催化剂外表的活性中心上吸附④在催化剂外表上进行化学反响⑤反响产物在催化剂外表上解吸⑥反响产物从催化剂内外表向外外表传递⑦反响产物从催化剂的外外表向流体主体传递6、兰格缪尓〔Langmuir〕吸附模型条件①催化剂外表上活性中心分布是均匀的②吸附活化能和脱附活化能与外表吸附的程度无关③每个活性中心仅能吸附一个气相分子④被吸附分子间互不影响,也不影响空位对气相分子的吸附。
7、焦姆金〔Temkhh〕吸附模型:一般吸附活化能随覆盖率的增加而增大,脱附活化能那么随覆盖率的增加而减小,因此吸附热必然随覆盖率的增加而减小。
8、催化剂颗粒内气体扩散:多孔催化剂颗粒内的扩散现象是很复杂的。
除扩散路径极不规那么外,孔的大小不同时,气体分子扩散机理亦有所不同。
当孔径较大时,分子的扩散阻力要是由于分子间碰撞所致,这种扩散通常所称的分子扩散或容积扩散。
当微孔的孔径小于分子的平均自由程时,分子与孔壁的碰撞时机超过了分子间的相互碰撞,从而使分子与孔壁的碰撞成为扩散阻力的主要因素,称为克努森〔Knudson〕扩散。
化学反应工程

化学反应工程讲义郭锋第一章绪论1.1化学反应工程学的范畴和任务概念:化学反应工程是一门研究化学反应的工程问题的科学。
既以化学反应作为对象,就必须要掌握这些化学反应的特性;它又以工程问题为其对象,那就必须熟悉装置的特性,并把这两者结合起来形成学科体系。
化学热力学反应工程对这方面的要求,主要是确定物系的各种物性常数(如热容、反应热、压缩因子)等等。
反应动力学动力学是专门阐明化学反应速率(包括主反应及副反应)与各项物理因素(如浓度、温度、压力及催化剂等)之间的定量关系的。
催化剂催化剂的问题一般以为属于化学或工艺的范畴,但实际上牵涉到许多工程上的问题。
如粒内的传热、微孔中的扩散、催化剂中活性组份的有效分布、催化剂扩大制备时各阶段操作条件对催化剂活性结构的影响、催化剂的活化和再生等等。
反应过程的分析、反应技术的开发和反应器的设计化学反应工程学的知识应能用于:(1)改进和强化现有的反应技术和设备,挖掘潜力,降低消耗,提高效率。
(2)开发新的技术和设备。
(3)指导和解决反应过程开发中的放大问题。
(4)实现反应过程的最优化。
(5)不断发展反应工程学的理论和方法。
1.2 化学反应工程的基本方法在化学反应工程中,数学模型主要包括下列一些内容:(1)动力学方程式(2)物科衡算式(3)热量衡算式(4)动量衡算式(5)参数计算式1.3化学反应工程的学科体系和编排化学反应过程按操作方法可以分:1.分批(或称间歇)式操作2.连续式操作3.半分批(或称半连续)式操作表1-3-1 反应器的型式与特性第二章均相反应的动力学基础2.1基本概念与术语均相反应动力学是研究各种因素如温度、催化剂、反应物组成和压力等对反应速率,反应产物分布的影响,并确定表达这些影响伊苏与反应速率之间定量关系的速率方程。
2.1-1 化学计量方程一个由S个组份参与的反应体系,其计量方程可写成:a1A1+ a2A2+……+ asAs=0s或∑aiAi=0i=1式中:Ai表示i组份;ai为组份的计量系数。
化学反应工程全套教学课件

可逆反应 不可逆反应
❖ 按照反应分子数分
单分子反应 双分子反应
多分子反应
❖ 按照反应机理分 单一反应
多重反应
平行反应 同时反应 连串反应 平行连串反应 集总反应
平行反应:一例如:氯苯的再氯化 k1
C6H5Cl + Cl2
k2
对-C6H4Cl2 + HCl 邻-C6H4Cl2 + HCl
❖ 本征动力学:又称化学动力学,是在理想条件下研究化学反 应进行的机理和反应物系组成、温度、压力等参数,不包括 传递过程及反应器结构等参数对反应速率的影响。
❖ 宏观反应动力学与本征动力学的区别:宏观反应动力学除了 研究化学反应本身以外,还要考虑到质量、热量、动量传递 过程对化学反应的交联作用及相互影响,与反应器的结构设 计和操作条件有关。
❖传递工程:涉及到动量传递、热量传递和质量传递。
❖工程控制:反应器的运转正常与否,与自动控制水平 相关。
1.4 化学反应工程学中涉及的定义
❖ 宏观反应过程:在工业规模的化学反应器中,化学反应过程 与质量、热量及动量传递过程同时进行,这种化学反应与物 理变化过程的综合称为宏观反应过程。
❖ 宏观反应动力学:研究宏观反应过程的动力学称为宏观反应 动力学。
❖ 停留时间分布:在非理想流动中,不同的质点在反应器中的停 留时间不同,形成停留时间分布。
寿命分布:指质点从进入到离开反应
停留时间分布有两种
器时的停留时间分布
年龄分布:指仍然停留在反应器中的
质点的停留时间分布。
寿命和年龄的关系:寿命是反应器出口处质点的年龄。
❖ 返混:不同停留时间的质点或粒子的混合称为返混,又称为 逆向混合。是不同年龄质点的混合,逆向是时间的概念上的 逆向,不同于一般的搅拌混合。
化学反应工程知识点梳理
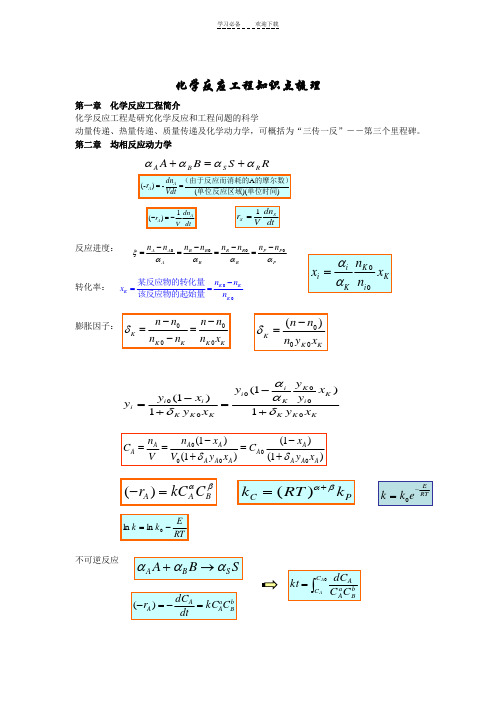
化学反应工程知识点梳理第一章化学反应工程简介化学反应工程是研究化学反应和工程问题的科学动量传递、热量传递、质量传递及化学动力学,可概括为“三传一反”--第三个里程碑。
第二章均相反应动力学反应进度:转化率:膨胀因子:不可逆反应A(-)-()()AAdnrVdt==(由于反应而消耗的的摩尔数)单位反应区域单位时间RSBARSBAαααα+=+1()AAdnrV dt-=-dtdnVr SS1=PPPRRRBBBAAAnnnnnnnnααααξ0-=-=-=-=K KKKn nxn-==某反应物的转化量该反应物的起始量KiKKiixnnxαα=0000KK K K Kn n n nn n n xδ--==-00()KK Kn nn y xδ-=KKKKiKKiiKKKiii xyxyyyxyxyy1)1(1)1(δααδ+-=+-=000(1)(1)(1)(1)A AA AA AA A A A A An xn xC CV V y x y xδδ--===++()A A Br kC Cαβ-=()C Pk RT kαβ+=ERTk k e-=RTEkk-=lnlnSBASBAααα→+bBaAAACkCdtdCr=-=-)(⎰=0AACC bBaAACCdCkt均相催化反应 CC 为催化剂浓度自催化反应A + C → 2C + R …串联反应总收率瞬时收率得率yield总选择性 目的产物P 所生成的摩尔数与副产物S 生成的摩尔数之比,用S0表示:平行反应串联反应()()AA C A dC r kC C dt-=-=CA A A C kCdt dCr =-=-)(A + B P R+S 00PP P A A n n n n -Φ=-/()/p P P A A A r dC dt dC P A r dC dt dC φ====---单位时间内生成的摩尔数单位时间内消耗的摩尔数00/)(A P P P n n n X -=000PP S S n n S n n -=-αA2A αS S (副)αA1A αP P (主),11A A r k C -=(),22A A r k C -=(),1,212()()AA A A A dC r r r k k C dt-=-+-=+=()()A A P A A p P P C k r dt dC r 11,1,1,)(αααα-=--==AA S S S C k dt dC r 22,αα-==tk k A A eC C )(021+-=A P S (均为一级反应)k 1k 2P A P P C k C k dt dC r 21-==PSS C k dt dC r 2==第三章 理想均相反应器 间歇反应器(BSTR)反应时间实际操作时间(operating time)= 反应时间(t) + 辅助时间auxiliary time (t') 反应体积V 是指反应物料在反应器中所占的体积 V = v0 (t + t')为装料系数(the volume charge coefficient),通常在0.4~0.85平推流反应器PFR 空时全混流反应器(CSTR)绝热操作恒容间歇反应器的设计式为:变温平推流反应器⎰⎰--=-=A A A C C A Ax A A A r dC r dx C t 0)()(00等容过程,液相反应 VV ϕ=实际实际的反应器体积为:0V v τ==反应器的容积进料的体积流量0R V dV t v ==⎰反应器中物料反应期的容积的体积流量000()()A A A AA A C C C x V v r r τ-===--0()A A A x V F r =-005000024R R R F v C M ==⨯00000000()(1)A A A A A A x x x A AA A A A E nx x x n n A ART A A dx dx dx t C C C r kC k e C x -===--⎰⎰⎰1001()A A x A A n xA t I x dx k C -=⎰20()()4A A A P A F dx r dV r D dl π=-=-20()4A A A dx D r dl F π-=00000()A x A A A A A dx V V F r v C C τ===-⎰化学反应工程研究的目的是实现工业化学反应过程的优化 全混流平推流多级CSTR 串联的优化对于一级不可逆反应应有PFR: 同间歇釜CSTR:全混流反应器的热衡算方程第四章 非理想流动 停留时间分布()⎰-==A x AAA B A B r dx C t F V 000BR : ()⎰-==Ax A AA P A P r dxCF V 000τPF R: ()000m m A A A A V x F C r τ-==-CST R: 112100010200...(1)(1)(1)Am Am A A A R A A A A A A Am x x x x x V v C kC x kC x kC x -⎛⎫---=+++ ⎪---⎝⎭0121110(1,2,.....1)(1)1Ai RAi Ai Ai v x V i m x k x x -+⎡⎤-∂=-==-⎢⎥∂--⎣⎦11111Ai Ai Ai Ai Ai Ai x xx x x x -++--=--221max 1max 02()k k k P P A C k X C k -==max max 1202211[(/)1]P P A C X C k k ==+1212ln(/)opt k k k k τ=-121opt k k τ=)()1())((0000Pm P P r A c v UAT T c v UA T c v H r V ρρρ+-+=∆--)()1(000P m P r c v UAT T c v UAT Q ρρ+-+= (){}E t P t residence time t t ∆=<<+停留时间分布函数 (){}=<F t P residence time t方差PFRCSTR最大层流流动 轴向扩散模型 0()()d t F t E t t=⎰22222()()()()()()t t t E t dtt t E t dt t E t dt tE t dtσ∞∞∞∞-==-=-⎰⎰⎰⎰0 t t () t t 0 t t E t <⎧⎪=∞=⎨⎪>⎩2220()()()0t t t E t dt t t σ∞=-=-=⎰0 t t () 1 t tF t <⎧=⎨≥⎩()11()t tt tF t e E t et---=-=222 1.0ttθσσ==22()()[2()]r r F t R R =-222/222()2()(1)212()(1)Z t uL E z z Pe tE Ee uL uL e Pe Peθσσ--==--=--。
化学反应工程知识点1~3讲义

知识点1.绪论一、主要讲解内容介绍化学反应工程相关的基本知识,包括化学反应工程的定义、化学反应工程学科的发展、化学反应工程的任务、化学反应工程和其他学科的关系。
二、学习要求本章要求学生能够掌握化学反应工程的定义,明确化学反应工程的任务。
三、视频(已录制完成)四、讲义1.1化学反应工程的定义在工业规模上开发和应用化学反应的工程活动。
1.2化学反应工程学科的发展自然界的物质的运动或变化过程由物理或化学的两类,物理过程不牵涉化学反应,但化学过程却总是与物理因素有着紧密联系。
所以化学反应过程是物理与化学两类因素综合体。
远溯古代,陶瓷制作、酿酒等工艺,但直到本世纪五十年代一直还未形成一门专门研究的独立学科,到1957年举行的第一次欧洲反应工程会议上确立了这一学科的名称。
1.3 化学反应工程的任务化学反应工程学是一门研究化学反应的工程问题的科学,既以化学反应作为研究对象,又以工程问题为研究对象,把二者结合起来的学科体系。
其主要任务包括:分析化学反应的特点、确定合适的反应条件;选择合适的反应器并对其进行最优化设计;对反应器进行最优操作和控制。
1.4 化学反应工程和其他学科的关系a. 数学,微积分、方程的解析求解和数值求解、极值问题等,均是化学反应工程问题求解的基础。
b. 反应动力学:专门阐明学反应速率与各项物理因素(如温度、压力、催化剂等)之间的定量关系。
为实现某一反应,要选定合易的条件及反应器的结构型式、尺寸和处理能力等,这些都依赖于对反应动力学特性的认识。
c. 化工热力学:确定物系的各种物性常数(热容、研所引资、反应热等),看化学反应是否能进行及其反应程度。
为化学反应工程提供反应热、反应平衡常数等基础数据。
d. 催化作用e. 传递工程和流体力学:装置中有动量、热量、质量传递(三传),当规模放大时,出现放大效应。
“三传一反”是三传和反应动力学。
五、小结本章介绍了化学反应工程的定义、学科的发展、任务极其与数学、化工热力学、催化作用及传递工程等学科之间的密切关系。
化学反应工程知识点回顾

化学反应⼯程知识点回顾第⼀章知识点1.化学反应⼯程学的范畴和任务2.化学反应⼯程学的基本⽅法3.化学反应⼯程学的学科系统和编排第⼆章均相反应动⼒学基础知识点 1、概念:①化学计量⽅程:反应物 - ,产物 + ②化学反应速率等温定容反应dtdc r AA -=-反应速率之⽐等于各计量系数的⽐值。
③反应转化率反应程度膨胀因⼦δA 关键组分A 的膨胀因⼦物理意义:每反应掉⼀个摩尔A 所引起反应体系总摩尔数的变化量。
④反应速率⽅程:反应级数 a 、b 由实验确定 k 遵循Arrhenius ⽅程i α1A A dn r V dt-=-00-=K KK K n n x n 0kk k n nξα-=1sii A A αδα==∑a bA AB r kC C -=2、单⼀反应的速率⽅程重点:求取动⼒学参数 1)不可逆反应微分⽅程: 积分⽅程: 2)可逆反应微分⽅程: 反应平衡时: 3)均相催化反应微分⽅程积分⽅程4)⾃催化反应当C A = C M0/2 时,反应速率最⼤ 3、复合反应:平⾏反应串联反应总收率选择性exp[]a E k k RT=-a bA A A BdC r kC C dt-==-0A A C Aa b C ABdC kt C C =?'A A A SdC r kC k C dt-=-=-0A Ae Se r kC k C '-=-=()AA C A dC r kC C dt-=-=A A A C dC r kC C dt-=-=0max 0001ln[]A M M A C t C kC C =-0121()ln ln1A C A A C k k C t C x +==-A B P R +→+A B S +→A B P R S+→→+0000()/()///--Φ==P P P P P A A n n p C C pn a C a 0000()/()/;;()/()/--==--p p p p p p A A A A n n P C C PS S n n a C C a第三章理想反应器1返混的基本定义2⼏个时间的定义反应持续时间t r--在间歇反应器中反应达到⼀定转化率所需时间(不包括辅助时间)。
化学反应工程知识点

化学反应工程知识点1.反应机理和动力学反应机理是指反应的分子层面的步骤和中间产物,它对理解和控制反应过程非常重要。
动力学研究反应速率与反应物浓度的关系,了解反应速率规律,通过动力学模型可以预测反应速率和产物选择性。
2.反应条件的选择反应条件的选择包括温度、压力、反应物浓度、反应物配比和催化剂等。
化学反应的速率和选择性往往受到反应条件的影响,优化反应条件可以提高反应速率和产物质量。
3.反应器的设计和优化反应器是进行化学反应的设备,其设计和优化对反应过程的效率和产品质量具有重要影响。
常见的反应器类型有批式反应器、连续式反应器和循环式反应器等。
反应器的选择和设计要考虑反应物性质、反应过程的控制方式、热传导和质量传递等因素。
4.反应工艺的控制反应工艺的控制包括对反应过程的监测和调节,以维持所需的反应条件和优化产品质量。
常用的控制策略有温度、压力和反应物供给的控制等。
控制系统的设计和优化需要考虑反应机理、反应动力学和工艺实际操作的特点。
5.安全与环保化学反应过程中会产生化学品和能量的变化,单个反应步骤可能会产生副产物和废物。
因此,反应工程也需要关注安全性和环保性。
安全性考虑的因素包括反应物和产物的毒性、易燃性和爆炸性等,以及反应条件的选择和操作的威胁。
环保方面,需要考虑减少废物的生成,回收利用资源,优化反应条件以减少能耗和污染物排放。
6.规模放大与工业化化学反应工程要实现从实验室到工业生产的规模放大和工艺转化。
这涉及到规模放大的技术、成本评估和安全规范,以及将实验室的合成路线或方法转化为适合大规模生产的工艺。
同时,也需要考虑工艺的稳定性和连续运营的可行性。
以上是化学反应工程的一些基本知识点,化学反应工程涵盖了多个学科领域,是化学工程和化学的交叉学科。
化学反应工程的研究和应用有助于解决实际生产中的技术问题,提高反应过程的效率和产品质量,同时也倡导可持续发展和环保意识。
化学反应工程复习提纲

淮海工学院化学反应工程复习参考1 绪论1.化学反应工程研究的内容P12 通常所说的三传一反指什么P13 什么是转化率关键组分的转化率与100%的关系P34 单程转化率与全程转化率的大小关系P45 收率与转化率是针对什么物质而言的,数值能否大于100%P56 收率与转化率,选择性的关系P52 反应动力学基础1.反应速率定义P152 流动系统的反应速率三种表示形式及换算方法P163 基元反应速率方程的写法与级数的分析, 基元反应与非基元反应的关系P17-184温度对三种反应速率的影响,对反应速率常数的影响,不可逆.可逆吸热与放热反应P235 复合反应的类型P26-296 δA的计算方法P317 多相催化反应的步骤P368 物理吸附与化学吸附及理想吸附的特点分析P373 釜式反应器1.等温间歇釜式反应器的计算有单一反应,平行反应及连串反应最大收率的计算P57-652 空时,空速与生产能力的关系P66-673 连续釜式反应器体积的计算P67-684 什么是正常动力学与反常动力学,连续釜式反应器串并联特点P695 釜式反应器的总收率与总选择性的变化特点P75-766 平行反应分析P767 连串反应分析P79-80 4 管式反应器1.理想反应器模型的特点,与实际反应器对应的是什么反应器P982 等温管式反应器的计算P1003 管式与釜式反应器反应体积比较结果P107-1095 停留时间分布与反应器的流动模型1.停留时间的年龄分布与寿命分布定义P1282 停留时间分布的定量描述E(t)与F(t)的定义P128-1293 停留时间分布的实验测定有几种方法及分别测定什么P130-1324 停留时间统计值有两个参数分别表示什么P1345 理想反应器停留时间分布的计算F(θ) E(θ)的计算6 多相系统中的化学反应与传递现象1.颗粒的三个密度大小比较P1592 气固催化反应过程进行的步骤P1603 外扩散对催化反应的影响分析单一反应,复合反应分析P165-1664 孔扩散的三种方式P1675 内扩散有效因子Φ的分析P1706 内外扩散有效因子分析P1767 内扩散对复合反应选择性的影响分析P1778 消除内外扩散影响的方法P178-1797 多相催化反应器的设计与分析1.固定床内空隙率大小分析P1862 多段固定床绝热反应器的类型P1943 流化床反应器中压降与流速的变化关系P211 8 多相反应器1.气液反应机理P2222 η值大小分析P224-2253 气液固反应器机理P2324 滴流床反应器的四个区域P2339 生化反应工程基础1.酶的组成与类型P2442 生化反应过程的特点P2453 酶催化反应特点P2464 酶催化反应的四种抑制机理P248-2505 影响酶催化反应速率的因素p2516 酶与细胞固定化技术P257-2587 影响固定化酶催化反应动力学的因素p2581一、单项选择题1.下列反应器可视为活塞流的反应器是()反应器A:管式B:釜式C:塔式2.对于基元反应2A+B→2C,则反应速率方程为()反应器A:r=kc A2C B B:r A=kC A C B C:r A=Kc A C B2D: r A=kC A C B C c3.在全混流反应器中,反应器的有效容积V R与进料流体的流速Q0之比为()A:空时τB:反应时间t C:停留时间t D:平均停留时间t4.化学反应速率式为-r A=K C CαA C Bβ,如果用浓度表示的速率常数为K C,用压力表示的速率常数为K P,则K C=()K P A:(RT)-(α+β)B:(RT)(α+β) C:(RT)(α-β)5.对于基元反应:2A+B→2P的反应,对A的反应总级数为()级A:1 B:3 C:2 D:06.在平行反应中,A→P,2A→Q,r P=k1C A,r Q=k2C A2,P为目的产物,k1,k2为常数,浓度对瞬时选择性S的影响是()7.完成同样的任务所需反应器体积在()时,平推流反应器与全混釜一样A:反应级数大于零B:零级反应C、反应级数小于零8.阶跃示踪法测定停留时间分布对应的曲线为()A:E(t)曲线 B:F(t)曲线 C:I(t)曲线 D:y(t)曲线9.对正常动力学,完成同样的任务,所需反应器体积最小的操作是()A:单釜 B:二釜串联 C:三釜串联 D:四釜串联O,已知k=0.01L/s.mol,则反应级数为()10.反应NaOH+HCl→NaCl+H2A:1 B:2 C:3 D:011.对于基元反应A+B→2C,则反应速率方程为()反应器A:r=kc A2C B B:r A=kC A C B C:r A=Kc A C B2D: r A=kC A C B C c12.在连续操作的全混流反应器中,反应物的平均停留时间为()A:大于空时τB:小于空时τC:等于空时τ13.完成同样的任务所需反应器体积在()时,平推流反应器与全混釜一样A:反应级数大于零B:零级反应C、反应级数小于零14. 对正常动力学,瞬时选择性S随转化率增大而降低的情况下,反应器内的目的产物最终收率最大的操作是()A:间歇釜反应器 B:连续单釜 C:二釜串联=()15.气相反应2A+B→3P+S,进料时为惰性气体,A与B的摩尔比为2:1进料,则膨胀因子δAA:-1 B:-0.5 C:0.5 D:116.反应产物的质量收率,其最大值为()A:100% B:大于100% C:小于100%117.催化剂颗粒上的反应速率大小与三个有效因子有关,分别是外扩散ηx 、内扩散η、内外扩散总有效因子η,忽略内扩散影响时,它们之间的关系是( )A:ηX >η B:ηX=η C:ηX=ηD:η=η18. 对于()的反应器,在恒容反应过程的平均停留时间、反应时间、空时是一致的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
知识点1.绪论一、主要讲解内容介绍化学反应工程相关的基本知识,包括化学反应工程的定义、化学反应工程学科的发展、化学反应工程的任务、化学反应工程和其他学科的关系。
二、学习要求本章要求学生能够掌握化学反应工程的定义,明确化学反应工程的任务。
三、视频(已录制完成)四、讲义1.1化学反应工程的定义在工业规模上开发和应用化学反应的工程活动。
1.2化学反应工程学科的发展自然界的物质的运动或变化过程由物理或化学的两类,物理过程不牵涉化学反应,但化学过程却总是与物理因素有着紧密联系。
所以化学反应过程是物理与化学两类因素综合体。
远溯古代,陶瓷制作、酿酒等工艺,但直到本世纪五十年代一直还未形成一门专门研究的独立学科,到1957年举行的第一次欧洲反应工程会议上确立了这一学科的名称。
1.3 化学反应工程的任务化学反应工程学是一门研究化学反应的工程问题的科学,既以化学反应作为研究对象,又以工程问题为研究对象,把二者结合起来的学科体系。
其主要任务包括:分析化学反应的特点、确定合适的反应条件;选择合适的反应器并对其进行最优化设计;对反应器进行最优操作和控制。
1.4 化学反应工程和其他学科的关系a. 数学,微积分、方程的解析求解和数值求解、极值问题等,均是化学反应工程问题求解的基础。
b. 反应动力学:专门阐明学反应速率与各项物理因素(如温度、压力、催化剂等)之间的定量关系。
为实现某一反应,要选定合易的条件及反应器的结构型式、尺寸和处理能力等,这些都依赖于对反应动力学特性的认识。
c. 化工热力学:确定物系的各种物性常数(热容、研所引资、反应热等),看化学反应是否能进行及其反应程度。
为化学反应工程提供反应热、反应平衡常数等基础数据。
d. 催化作用e. 传递工程和流体力学:装置中有动量、热量、质量传递(三传),当规模放大时,出现放大效应。
“三传一反”是三传和反应动力学。
五、小结本章介绍了化学反应工程的定义、学科的发展、任务极其与数学、化工热力学、催化作用及传递工程等学科之间的密切关系。
六、自测题1.三传一反是指动量传递、热量传递、质量传递和反应动力学。
知识点2. 计量方程及反应分类一、主要讲解内容主要介绍计量方程的含义,并对反应从不同的角度进行分类。
二、学习要求掌握计量方程的含义,掌握不同的反应分类方法。
三、视频(已录制完成)四、讲义1. 化学计量方程计量方程是表示各反应物、生成物在反应过程的计量关系的方程。
化学计量方程仅是表示由于反应而引起的各个参与反应的物质之间量的变化关系,计量方程本身与反应的实际历程无关。
计量方程两侧同乘以一非零的系数后,可得一个计量系数不同的新的计量方程。
2. 反应分类反应可依据不同的方式进行分类:a. 根据参与反应的相数分类可分成均相反应和非均相反应。
均相反应:参与反应的相数为1,例如在均一的液相或气相中进行的反应。
非非均相反应:反应的进行需要至少两相或两相以上存在(不一定各相都参与反应)。
b. 依据催化作用分类可分成催化反应和非催化反应。
例:煤球的燃烧为非催化非均相反应,石油的催化裂化催化反应为非均相反应。
c. 根据计量方程的个数分类可分成单一反应和复合反应。
只用一个计量方程即可唯一的给出各反应组分之间的变化关系的反应体系为单一反应;必须用两个(或多个)计量方程方能确定各反应组分在反应时量的变化关系的反应,称为复合反应,例如:CO+2H2=CH3OHCO+ 3H2=CH4+ H2Od.根据反应中体积的变化分类可分为恒容反应和变容反应,例如恒温、恒压、恒摩尔的气相反应为恒容反应,压力不是很高的情况下的液相反应。
e. 依据反应的热效应分类 可分为吸热反应和放热反应f. 依据反应的可逆性分类 可分为可逆反应与不可逆反应。
g. 依据反应机理分类可分为基元反应与非基元反应。
计量方程能够表示反应机理或实际的反应历程的反应为基元反应。
计量方程不能够表示反应机理的反应为非基元反应,非基元反应可以假定为一系列的基元步骤。
例如222Br H HBr +→可看假定为如下的基元步骤:2222 Br BrBr H HBr H H Br HBr Br⇔+⇔++→+五、小结计量方程是表示各反应物、生成物在反应过程的计量关系的方程,计量方程与反应历程之间无必然联系。
化学反应依据不同的基准可分为不同的类别,掌握各种反应分类的基准。
六、自测题1. 化学计量方程反映的是 A 。
A. 反应中各反应物、产物之间的计量关系; B. 实际的反应历程。
2. 基元反应和非基元反应之间的区别在于 A 。
A. 计量方程是否反映了实际的反应历程; B. 表示反应所需的计量方程数不同; C. 参与反应的相数不同。
知识点3. 反应速率及动力学方程一、主要讲解内容本部分介绍了反应速率的定义方法、反应速率方程的形式、反应级数和基元反应分子数、反应速率对温度的依赖关系。
二、学习要求掌握反应速率的定义式,了解两种反应速率方程的形式,掌握反应级数和基元反应分子数之间的区别和联系,掌握Arrehenius ’定律。
三、视频(已录制完成) 四、讲义1. 反应速率反应速率定义:1()()i i dN moles i formedr V dt volume of fluid time == mol/(m 3.s)其中,i ——关键组分;dNi ——dt 时间内反应生成的i 的摩尔数;V ——反应器的有效体积。
对于气相反应:流体体积=反应器有效体积=反应器体积;对于液相反应:流体体积=反应器有效体积,但不一定等于反应器体积。
对于任意的反应,例如,A →R ,对反应物,A dN dt 为负值,而产物R dNdt是正值。
对于反应物,为了保证速率数值为正,反应速率通常表示为:对于恒容的情况,1ii i dN dC r V dt dt-=-=-。
根据计量方程可得给定反应中各个物质反应速率之间的关系:aA bB rR sS +→+SA B R r r r r a b r s--===即:():()::::: A B R S r r r r a b r s --=其他速率定义方式:对于流固非均相反应,以其中固体的质量为基准:'1ii dN r W dt=mol/(kg 固体.s)其中W —固相质量,kg 。
对于两流体体系或者流固反应体系:''1ii dN r S dt=mol/(m 2.s) 其中S ——界面面积, m 2;针对流固反应体系:'''1ii S dN r V dt=mol/(m 3solid.s) 其中V s ——固相体积,m 3;''''1ii r dN r V dt= mol/(m 3.s) 其中V r ——反应器体积,m 3。
不同基准的速率之间的关系:''''''''''i i i S i r i V r W r S r V r V r ==== 2 速率方程/动力学方程均相反应动力学是研究各种因素如温度、催化剂、反应物组成和压力等对反应速率反应产物分布的影响,并确定表达这些因素与反应速率间定量关系的速率方程。
(,,,....)i r f C T Cat =目前主要考虑温度、浓度的影响;其它影响因素视为恒定:(,)i r f Concentration Temperture =首先考虑单一反应,动力学方程的形式分为双曲函数型与幂函数型。
1)双曲型动力学方程双曲函数型动力学方程由反应机理导得。
例如:2222111Br HBrBrH HBrC C k C C k +=γ按照反应机理可将反应分类为基元反应和非基元反应,对于基元反应,Products aA bB +→动力学方程可直接写出,动力学方程与计量方程之间存在对应关系:a b A A A B r k C C -= a b B B A B r k C C -=其中,a+b ——分子数,只能是1、2 或者3,不可能大于3。
由():():A B r r a b --=得::A B k k a b =。
注意:a. 如下的两个基元反应不等价:A B → 分子数为122A B → 分子数为2b. 分子数只能是整数例如反应12A B R +→,动力学方程为12AA AB r kC C -=,计量方程和动力学方程之间存在对应关系,但是该反应如果是基元反应,就出现了分子数为小数的情况,所以该反应肯定不是基元反应。
对于非基元反应,通常可假定为一系列的基元步骤。
例如222 Br H HBr +→可看假定为如下的基元步骤:2222 Br BrBr H HBr H H Br HBr Br⇔+⇔++→+ 实际上真正的反应历程是不是这样,其中存在很大的不确定性。
这些基元步骤中涉及到了Br ·及H ·等这样的中间物种,实际反应中涉及的中间物种是不是这些?我们并不能肯定,其中的原因有以下几点:a. 中间物种寿命非常短暂, 很难捕捉到其存在的信息。
b. 其浓度非常低,低于一般的仪器设备的检测极限。
c. 中间物种不具有正常化合物的结构和性质,即使有时候我们能够检测到一些信息,也很难确定这些物种究竟是何物。
所以我们所说的反应机理通常具有很大的主观性。
2) 幂函数型动力学方程幂函数型动力学方程通常由经验推出:A B r kC C αβ=其中k ——速率常数;α、β——分别为A 和B 的反应级数;α+β——总反应级数。
注意:幂数型动力学方程中通常未排除传递过程的影响;通常只能在实验范围能使用,外延使用范围需慎重;此类动力学方程和计量方程之间无必然联系。
幂数型动力学方程可视为双曲型的特例,例如对于如下双曲型动力学方程,1`mA nA kC r k C =+当`1nA k C 时,变为幂数型方程"m n A r k C -=,当`1nA k C 时,变为幂数型方程m A r kC =。
可以说该反应可视为一个变级数反应,反应级数在m-n 和m 之间变化。
又例如:1`mA mA kC r k C =+ 当`1mA k C (或C A 很高)时,该反应动力学方程变成0级,这也是零级反应通常存在的范围,即高浓区。
对于如下幂数型动力学方程,n A A r kC -=mol/m 3.s可推得动力学常数k 的单位为[浓度]1-n [时间]-1,例如1级反应,k 的单位应为s -1,2级反应,k 的单位应为m 3.mol -1.s -1,0级反应,k 的单位应为mol.m -3s -1。
其中的反应级数通常≤3 , 可以是正数、负数、零或者小数。
反应速率常数k 通常满足Arrehenius ’定律,/0E RT k k e -=其中k 0——指前因子或频率因子;0, (01)mk T m ∝≤≤E ——活化能,大于零,J/mol 。
